紫外辐射与生物膜同步耦合降解喹啉
2012-12-26张永明上海师范大学生命与环境科学学院上海200234
甘 露,阎 宁,张永明 (上海师范大学生命与环境科学学院,上海 200234)
紫外辐射与生物膜同步耦合降解喹啉
甘 露,阎 宁,张永明*(上海师范大学生命与环境科学学院,上海 200234)
紫外辐射光解与生物降解同步耦合的气升式内循环反应器用于喹啉的降解.实验过程中分别采用单独紫外光解、单独生物降解和紫外光解与生物降解同步耦合的方法对喹啉进行降解.结果表明,喹啉在紫外光解与生物降解同步耦合的作用下,其降解速率明显提高.喹啉降解动力学分析结果表明,喹啉的生物降解可以用有抑制性的 Haldane模型描述.相比生物降解过程,单独紫外光解对喹啉的降解速率可以忽略,但将紫外辐射与生物降解耦合在一起后,可以提高喹啉的最大降解速率近1倍并减小抑制常数36%,同时还可以提高喹啉的矿化程度.
喹啉;生物降解;紫外光解;生物膜;反应器
喹啉是一种重要的精细化工原料,主要用于合成医药、染料、农药和多种化学助剂,因此每年都有大量喹啉进入环境系统中[1-2].喹啉又称氮杂萘,分子式为C9H7N,是吡啶与苯并联的化合物,且有两种方式,分别成为喹啉和异喹啉,存在于煤焦油和骨焦油中.喹啉及其衍生物进入环境后会对动植物生长发育产生不良反应, 有致癌、致畸、致突变性[3-4],且在较高级的生物体中有通过食物积累的可能性,对地表水和地下水环境系统有较大的威胁,所以对喹啉降解的研究日益受到重视[5-6].
大量文献表明喹啉及其衍生物可以被生物降解,并且已经鉴定出了大量的喹啉及其衍生物的降解菌[7-12],通过筛选所得的菌种在喹啉的生物降解效果上得到了强化,但也有文章有提到,单独的生物方法耗时较长,耐冲击负荷的能力也不强[13-14].目前喹啉及其衍生物的生物降解研究有4种类型:好氧降解、厌氧降解、缺氧降解和共基质降解[15].鉴于喹啉对微生物具有抑制作用,通常单独的生物降解其效率较低.国内外的不少学者采用了一些物化及高级氧化方法技术对喹啉及其衍生物进行处理,较为传统的物化及高级氧化方法主要有:混凝法、吸附法等,以及催化氧化、电化降解、湿式氧化、光催化氧化、臭氧氧化、超临界水氧化等高级氧化技术[16-21].其中紫外辐射光解或光催化是相对简单、易于操作的高级氧化方法.但若单独依赖紫外辐射将喹啉完全降解为二氧化碳和水,效率较低,且不经济.将紫外辐射光解与生物降解耦合在一起,通过两者的协同作用,提高喹啉的降解效率.当将紫外辐射与生物降解结合后,喹啉中的C—C、C—N键吸收紫外光的能量而断裂,使有机物逐渐降解,从而有利于生物降解,最后以CO2的形式离开体系[22].以往将紫外辐射光解或光催化与生物降解的耦合处理难降解有机废水方面,大多采用分步耦合的方法进行处理,即将光解或光催化与生物降解分别在2个单元里分步进行[23-29].这存在一个最佳控制的问题,即光解或光催化时间过长,则总的效率下降;而时间过短则不利于后续的生物降解.为此,将光解或光催化与生物降解结合在一个单元里处理难降解有机物,则可以大大提高处理效率[30-31].本研究采用气升式内循环紫外光解与生物降解耦合反应器,通过该反应器将紫外辐射光解与生物降解有效地组合为一体,试图实现高效降解喹啉.分别采用间歇和连续两种方式,考查不同浓度的喹啉在单独紫外光解、单独生物降解以及紫外光结合生物降解过程中的降解规律.
1 材料与方法
1.1 反应器
气升式内循环光/生物一体化反应器由石英玻璃制成,如图1所示.反应器中间设置一块玻璃板,将反应器分隔为紫外辐射光解区和生物降解区.反应器有效容积为 45mL.在距反应器紫外辐射光解区一侧 10cm是一功率为 24W,波长为254nm的紫外光源.实验过程中,在生物降解区内曝气,可以驱动液体在反应器的光解区和生物降解区之间循环流动,使有机物不断的经历光解和生物降解,从而提高其降解效率.
1.2 化学药品及模拟喹啉废水的配制
喹啉和分析用药品:重铬酸钾、硫酸,硫酸银均为分析纯,均购自上海国药集团.模拟喹啉废水是将喹啉直接稀释到自来水中.先配制浓度为5g/L的母液置于冰箱备用,使用时,根据实验设计要求,将浓度稀释为100~1500mg/L.
1.3 喹啉降解菌的驯化培养
污泥取自上海龙华水质净化厂的二沉池的回流污泥.驯化之前,用自来水清洗污泥,方法是将 600mL左右的污泥倒入 2L的量筒内,加入1400mL的自来水,让污泥自由沉淀 30min后将上清液倒掉,重复上述步骤5遍,然后加入浓度为500mg/L的葡萄糖溶液,在 25~30℃条件下进行驯化培养,此时污泥的SV为300mL/L.培养初期每天更换新鲜葡萄糖溶液,在最初30d的培养驯化周期内,逐渐减少葡萄糖用量,直至不再加入葡萄糖,同时逐渐增加喹啉的浓度,从 50mg/L至200mg/L.30d后,待微生物适应环境,逐渐增加喹啉的投加量,使容器内喹啉的浓度从200mg/L逐渐增加到1000mg/L.

1.4 喹啉的降解
1.4.1 空白实验 在反应器中分别装入无生物膜的空白载体、灭活的生物膜对浓度为100mg/L、500mg/L的喹啉进行60min的对比实验以了解载体、生物膜对喹啉的吸附情况.另外单纯对喹啉溶液进行曝气,以了解喹啉在曝气过程中的挥发情况.其中灭活生物膜是将已形成的生物膜置于温度为100℃的恒温箱内1h.
1.4.2 喹啉的间歇降解实验和连续降解实验分别采用单独光解(P)、单独生物降解(B)以及光解与生物降解同步耦合(P&B)的方法对不同浓度的喹啉进行间歇和连续降解实验.间歇实验中,通过曝气驱动溶液在反应器内循环流动,在喹啉光解时,反应器内不装填生物膜,开启紫外灯;在喹啉生物降解时,反应器内装入生物膜,同时关闭紫外灯;在光与生物协同降解喹啉时,反应器内装入生物膜的同时开启紫外灯对喹啉进行降解.在连续降解实验中,分别针对初始浓度为 100, 500,1000mg/L的喹啉进行连续降解,停留时间为5h.连续降解过程中,首先进行单独紫外光解,此时反应器内不加入生物膜,只开启紫外灯.大约150h之后,关闭紫外灯,加入生物膜,进行单独生物降解.300h之后,开启紫外灯,进行紫外光解与生物降解同步耦合降解喹啉.实验中,每间隔一定的时间取样测定喹啉的浓度之外,并测定其COD的去除情况,以了解喹啉的矿化程度.
1.5 动力学方程的建立
由于喹啉属于难降解的含氮杂环化合物,对微生物具有一定的毒性和抑制性[32].通过对喹啉降解的动力学分析可以了解喹啉对生物膜的抑制情况.喹啉降解动力学可以通过喹啉的初始浓度C0与其初始去除速率 V0的关系求得.对于有抑制的降解动力学可以用Haldane模型来描述[33].
1.6 分析方法
用美国产的Agilent 1100的高效液相色谱(配置波长250nm的紫外荧光器、型号为ZORBAX SB-C18反相色谱柱)测试喹啉,流动相为甲醇水溶液,体积比为甲醇:水(含1%醋酸) = 60:40 (V/V),流动速率为1mL/min,检出限在0.1mg/L以上.COD分析采用型号为 KDB—Ⅲ微波消解仪(青岛科迪博电子科技有限公司)进行消解,再用重铬酸钾溶液进行滴定,以求得COD浓度.
2 结果与讨论
2.1 喹啉的吸附和挥发
对初始浓度分别为100mg/L和500mg/L的喹啉进行空白对比实验,以考察空白生物膜载体、灭活的生物膜对喹啉是否有吸附,以及喹啉在曝气过程中的挥发情况,结果如图2所示.结果表明,相比喹啉的生物降解,生物膜载体和灭活的生物膜对喹啉几乎没有吸附,同时喹啉在曝气过程中的挥发也可以忽略.因此,在该体系内,生物膜或生物膜载体对喹啉的吸附作用很小,而后续的实验过程中喹啉的去除可以认为是生物降解或光解的结果.
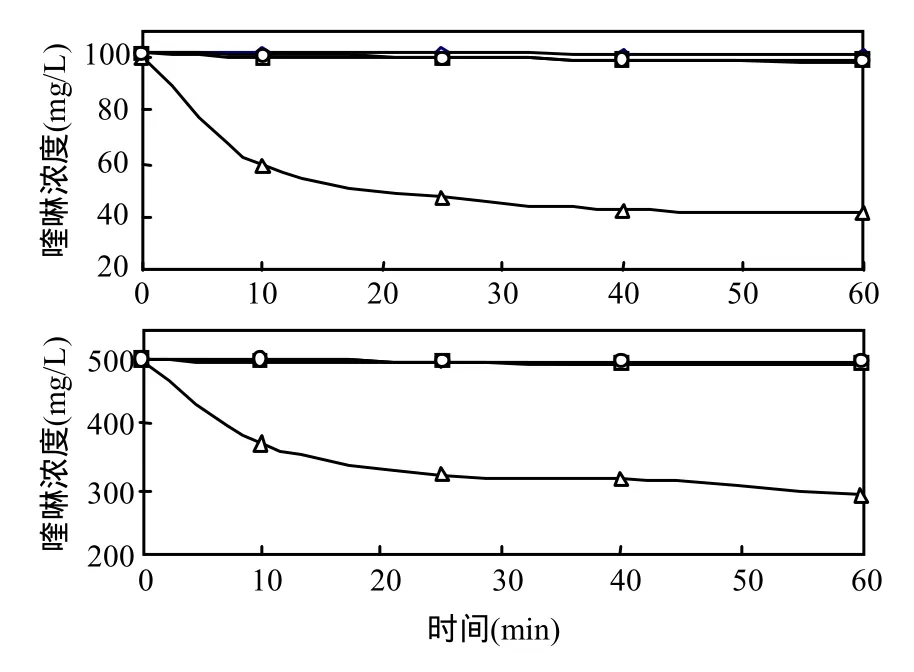
图2 喹啉的吸附、挥发及降解的对比Fig.2 Comparison adsorption and volatile with degradation of quinoline
2.2 喹啉降解动力学分析


图3 分别在生物降解和紫外光解与生物降解协同作用下喹啉的初始去除速率与初始浓度的关系Fig.3 Relationship of initial quinoline concentration and its initial removal rates under photolysis alone, biodegradation alone and intimate coupled photolysis and biodegradation
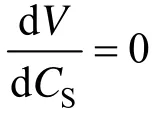
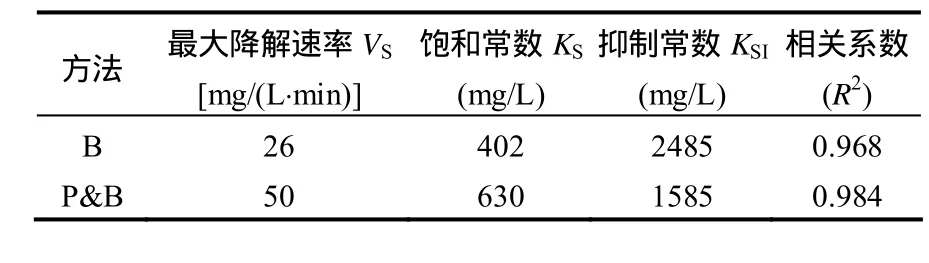
表1 喹啉降解动力学参数Table 1 Parameters of quinoline degradation
因此喹啉在方法B和方法P&B的降解过程中的动力学方程可以分别用下式表示:
单独生物降解(方法B):
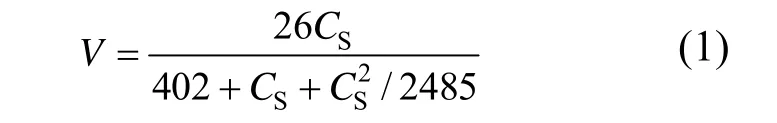
紫外光解与生物降解同步耦合(方法P&B):
从图3也可以看出,它们的拟合程度相当高.从动力学常数的分析可以看出,通过紫外光解与生物膜的协同作用,抑制常数降低了约36%,同时最大降解速率也提高近1倍.这说明虽然单独的紫外光解(P)对喹啉的降解作用相比单独的生物降解(B)可以忽略,但紫外光解与生物膜协同作用后,即通过方法 P&B的作用,可以大大缓解喹啉对生物的抑制,同时也提高了喹啉的降解速率.
2.3 间歇降解喹啉
分别采用方法 P、B和 P&B对浓度为200mg/L的喹啉进行降解,其结果如图4所示.从图4中可以明显地看出,采用方法P&B时,喹啉的降解速率明显地高于其它2种方法.例如当采用方法P&B时,经过8h后,200mg/L的喹啉已经完全去除,而采用方法P和方法B时,8h之后,喹啉的去除率分别为5%和95%.从图4中还可以看出,喹啉在方法P&B和方法B的降解过程中,其降解趋势十分相近,但总是慢一点.根据动力学分析可知,喹啉浓度为200mg/L时,还没有对生物膜产生抑制作用.但由于紫外辐射光解与生物降解的耦合还是提高了喹啉的降解效率.
图4 喹啉分别在方法P、B和P&B作用下的降解规律Fig.4 Quinoline removal regularity under protocol P, B and P&B
2.4 连续降解喹啉
同样采用方法P、B和P&B 3种方法对喹啉进行连续流降解实验.喹啉溶液的浓度分别为100,500,1000mg/L,停留时间均为5h.各浓度的喹啉在连续流降解的情况如图5所示.

图5 喹啉的连续降解Fig.5 Quinoline removal in continuous flow
根据图5的结果可以计算喹啉在3种方法处理过程中的平均体积去除负荷 (VRR).其结果如图6所示.从图6可以看出,采用方法P&B时,喹啉的体积去除负荷明显地高于方法B和P.其中方法B又高于方法P.但各方法中,随着喹啉浓度的增加,体积去除负荷逐渐增大.将图4与图5和图6比较,可以明显看出,在连续流降解喹啉时,喹啉的去除速率高于间歇式去除喹啉的速率.这是因为在连续流过程中,喹啉降解后的中间产物可以及时排除反应器,因而产物的抑制可大大减少.
图6 连续流降解喹啉的体积去除负荷Fig.6 Volume removal rate of quinoline in continuous flow
2.5 喹啉的矿化
对喹啉进行降解是希望能使其得到矿化,COD是衡量喹啉矿化程度的重要指标,为此针对连续流降解喹啉过程中进、出溶液测定其COD.喹啉所对应的COD去除率如图7所示.
图7 连续降解喹啉时的COD去除率Fig.7 COD removal percentage for quinoline in continuous flow
从图7中可以看出,采用方法P&B,对喹啉的矿化效果是最好的,而方法P和B对喹啉的矿化率均明显低于方法 P&B.这一结果说明紫外光的参与降低了喹啉对生物膜的抑制作用.有资料表明,在 185/254nm的紫外光的辐照下,喹啉和异喹啉发生降解的主要途径均有两条[34]:(1)水的裂解产生的羟基与苯环加成,随后开环降解;(2)底物发生光电离后形成的自由基与氧气发生反应形成过氧化物,随后开环降解.喹啉的好氧生物降解途径一般有四种,其共同点为[35-36]:一般情况下,首先是邻近氮原子的羟基化,该反应之后喹啉的苯环部分转化为二羟基衍生物,然后环开裂.而由于反应器的特性,喹啉在降解过程中不断地在光解区和生物降解区之间循环流动,在两种方式的共同作用下,上述单独的紫外辐射光解和生物降解对喹啉的降解途径就发生了一定的变化,两者耦合在一起,喹啉中的C—C、C—N键吸收紫外光的能量而断裂,使有机物逐渐降解,其结构一被破坏便立即会被微生物所利用,最后以 CO2的形式离开体系,从而提高了生物降解的矿化能力.
3 结论
3.1 紫外光解对喹啉的降解作用明显低于生物降解,但将紫外光解与生物降解进行耦合之后,可以明显地提高喹啉的降解速率,即耦合后的降解速率大于单独光解与单独生物降解之和.
3.2 喹啉的生物降解过程符合抑制型的Haldane方程,当紫外光解与生物膜耦合之后,可以降低抑制常数 36%,提高喹啉最大降解速率48%,即提高了生物膜对喹啉的亲和程度,进而提高喹啉的降解速率.
3.3 紫外光解与生物膜耦合之后,喹啉的体积去除负荷明显地高于单独的生物降解和单独的紫外光解,相应的矿化程度也明显提高.
[1] Kaiser J P, Feng Y C, Bollag J M. Microbial metabolism of pyridine, quinoline, acridine, and their derivatives under aerobic and anaerobic conditions [J]. Microbiological Reviews, 1996, 60(3):483-498.
[2] Fetzner S. Bacterial degradation of pyridine, indole, quinoline, and their derivatives under different redox conditions [J]. Applied Microbiology and Biotechnology, 1998,49(3):237-250.
[3] Sideropoulos A S, Secht S M. Evaluation of microbial testing methods for the mutagenicity of quinoline and its derivatives [J]. Current Microbiology, 1984,11(2):59-66.
[4] Minako N, Takio Y, Yuko S, et al. Mutagenicities of quinoline and its derivatives [J]. Mutation Research, 1977,42: 335-342.
[5] Miethling R, Hecht V, Deckwer W D. Microbial degradation of quinoline: kinetic studies with comamonas acidovorans DSM 6426 [J]. Biotechnology and Bioengineering, 1993,42(5):589-595.
[6] Sutton S D, Pfaller S L, Shann J R, et al. Aerobic biodegradation of 4-methylquino-line by a soil bacterium [J]. Applied and Environment Microbiology, 1996,62(8):2910-2914.
[7] Zhang Y, Han L, Wang J, et al. An internal airlift loop bioreactor with Burkholderia pickttii immobilized onto ceramic honeycomb support for degradation of quinoline [J]. Biochemical Engineering Journal, 2002,11(2/3):149-157.
[8] Sun Q, Bai Y, Zhao C, et al. Aerobic biodegradation characteristics and metabolic products of quinoline by a Pseudomonas strain [J]. Bioresource Technology, 2009,100(21): 5030-5036.
[9] Qiao L, Wang J. Biodegradation characteristics of quinoline by Pseudomonas putida [J]. Bioresource Technology, 2010,101(19): 7683-7686.
[10] Wang J, Quan X, Han L, et al. Kinetics of co-metabolism of quinoline and glucose by Burkholderia pickettii [J]. Process Biochemistry, 2002,37(8):831-836.
[11] Wang J, Quan X, Han L, et al. Microbial degradation of quinoline by immobilized cells of Burkholderia pickettii [J]. Water Research, 2002,36(9):2288-2296.
[12] 柏耀辉,孙庆华,赵 翠,等.焦化废水处理系统中喹啉降解菌的种群特征 [J]. 中国环境科学, 2008,28(5):449-455.
[13] Bohlmann U, Bohnet M. Improvement of process stability of microbiological quinoline degradation in a three-phase fluidized bed reactor [J]. Engineering in Life Sciences, 2001,1(2):91-96.
[14] Buchtmann C, Kies U, Deckwer W-D, et al. Performance of three phase fluidized bed reactor for quinoline degradation on various supports at steady state and dynamic conditions [J]. Biotechnology and Bioengineering, 1997,56(3):295-303.
[15] 张翠萍,刘益平,朱丽红.含喹啉废水的处理和生物降解研究进展 [J]. 三峡环境与生态, 2008,1(1):49-51.
[16] Thomas J K, Gunda K, Rehbein P, et al. Flow calorimetry and adsorption study of dibenzothiophene, quinoline and naphthalene over modifieed Y zeolites [J]. Applied Catalysis B: Environmental, 2010,94(3/4):225-233.
[17] Alexei N I, Kiwi J. Transient intermediate species active during the Fenton-mediated degradation of quinoline in oxidative media: pulsed laser spectroscopy [J]. Journal of Photochemistry and Photobiology A: Chemistoy, 1997,110(2):141-148.
[18] An T, Zhang W, Xiao X, et al. Photoelectrocatalytic degradation of quinoline with a novel three-dimensional electrode-packed bed photocatalytic reactor [J]. Journal of Photochemistry and Photobiology A: Chemistry, 2004, 161(2/3):233-242.
[19] Thomsen A B. Degradation of quinoline by wet Oxidation-kinetic aspects and reaction mechanisms [J]. Water Research, 1998, 32(1):136-146.
[20] 王小亻毛 ,黄 霞, 左晨燕,等.喹啉的O3及O3/UV降解规律 [J].中国环境科学, 2003,23(2):134-138.
[21] Ogunsola O M. Decomposition of isoquinoline and quinoline by supercritical water [J]. Journal of Hazardous Materials, 2000, 74(3):187-195.
[22] 方景礼.强螯合物废水的处理方法, 第三部分——紫外光氧化分解法处理螯合物废水 [J]. 电镀与涂饰, 2007,26(11):31-34.
[23] Alinsafi A, Evenou F, Abdulkarim E M, et al. Treatment of textile industry wastewater by supported photocatalysis [J]. Dyes and pigments, 2007,74(2):439-445.
[24] Balcioglu I A, Arslan I. Application of photocatalytic oxidation treatment to pretreated and raw effluents from the kraft bleaching process and textile industry [J]. Environmental Pollution, 1998, 103(2/3):261-268.
[25] Balcioglu I A, Cecen F. Treatability of kraft pulp bleaching wastewater by biochemical and photocatalytic oxidation [J]. Water Science and Technology, 1999,40(1):281-288.
[26] Hu C, Wang Y. Decolorization and biodegradability of photocatalytic treated azo dyes and wool textile wastewater [J]. Chemosphere, 1999,39(12):2107-2115.
[27] Li X Z, Zhao Y G. Advanced treatment of dyeing wastewater for reuse [J]. Water Science and Technology, 1999,39(10/11): 249-255.
[28] Mohanty S, Rao N N, Khare P, et al. A coupled photocatalyticbiological process for degradation of 1-amino-8-naphthol-3, 6-disulfonic acid (H-acid) [J]. Water Research, 2005,39(20): 5064-5070.
[29] Reddy M P, Srinivas B, Kumari V D, et al. An integrated approach of solar photocatalytic and biological treatment of N-containing organic compounds in wastewater [J]. Toxicological and Environmental Chemistry, 2004,86(3):127-140.
[30] Marsolek M D, Torres C I, Hausner M, et al. Intimate coupling of photocatalysis and biodegradation in a photocatalytic circulating-bed bioflm reactor [J]. Biotechnology and Bioengineering, 2008,101(1):83-92.
[31] Zhang Y, Wang L, Rittmann B E. Integrated photocatalyticbiological reactor for accelerated phenol mineralization [J]. Applied Microbiology and Biotechnology, 2010,86(6):1977-1985.
[32] Thomsen A B, Kilen H H. Wet oxidation of quinoline: intermediates and by-product toxicity [J].Water Research, 1998, 32(11):3353-3361.
[33] 戚以政,汪叔雄.生物反应动力学与反应器[M]. 北京:化学工业出版社, 2007.
[34] 朱大章. N-杂环化合物真空紫外降解机理研究 [D]. 上海:同济大学, 2007.
[35] 孙丽娟, 李咏梅, 顾国维.含氮杂环化合物的生物降解研究进展 [J]. 四川环境, 2005,24(1):61-64.
[36] Dlicht S E, Ahring B K. Transformation of in-doleand quinoline by Desulfobacterium indolicum (DSM3383) [J]. Applied Microbiology and Biotechnology, 1997,47(2):167-172.
UV irradiation intimately coupling biofilm for quinoline degradation.
GAN Lu, YAN Ning, ZHANG Yong-ming*(College of Life and Environmental Science, Shanghai Normal University, Shanghai 200234, China). China Environmental Science, 2012,32(4):623~629
Internal loop photolytic biological reactor was used for quinoline degradation by means of three protocols: photolysis alone, biodegradation alone and photo-biodegradation. Experimental results indicated that quinoline removal rate was accelerated clearly under intimately coupled photolysis and biodegradation. Quinoline removal rate could be described with Haldane model as the inhibition to microorganism according to the analysis of quinoline removal kinetics. Compared with quinoline removal rate by biodegradation alone, the photolytic rates might be ignored. But the maximum quinoline removal rate was increased by one times after photolysis was intimately coupled with biodegradation for quinoline degradation, and the inhibition constant was decreased with 36%, at the same time, the quinoline mineralization degree was also increased by intimately coupled UV irradiation and biofilm.
quinoline;biodegradation;UV photolysis;biofilm;reactor
2011-07-14
国家自然科学基金项目(50978164,50678102);上海市基础研究重点项目(11JC1409100);上海市重点学科建设项目(S30406)
* 责任作者, 教授, zhym@shnu.edu.cn
X703
A
1000-6923(2012)04-0623-07
甘 露(1987-),女,江西南昌人,上海师范大学生命与环境科学学院硕士研究生,主要从事难降解有机废水处理技术的研究.
