锁阳提取物对肝纤维化模型大鼠的改善作用及其机制研究Δ
2016-11-18李荣华王航宇林友胜刘漪沦李卉园黄小梅唐琳梅何海林邓峰美成都医学院基础医学院成都60500石河子大学药学院新疆石河子8000成都医学院第一附属医院成都60500
李荣华,王航宇,林友胜,刘漪沦,李卉园,黄小梅,唐琳梅,何海林,崔 浪,邓峰美#(.成都医学院基础医学院,成都 60500;.石河子大学药学院,新疆石河子 8000;.成都医学院第一附属医院,成都60500)
·实验研究·
锁阳提取物对肝纤维化模型大鼠的改善作用及其机制研究Δ
李荣华1*,王航宇2,林友胜1,刘漪沦3,李卉园1,黄小梅1,唐琳梅1,何海林1,崔浪1,邓峰美1#(1.成都医学院基础医学院,成都610500;2.石河子大学药学院,新疆石河子832000;3.成都医学院第一附属医院,成都610500)
目的:考察锁阳提取物对肝纤维化模型大鼠的改善作用及其机制。方法:将90只SD大鼠随机分为正常组、模型组、秋水仙碱组(阳性药物,0.2 mg/kg)和锁阳提取物低、中、高剂量组(50、100、200 mg/kg),每组15只。除正常组外,其余各组大鼠均采用四氯化碳法复制肝纤维化模型。成模后,各给药组大鼠ig相应药物,正常组和模型组大鼠ig生理盐水,每天1次,连续6周。给药结束后,检测大鼠血清肝功能指标[天冬氨酸转氨酶(AST)、丙氨酸转氨酶(ALT)、碱性磷酸酶(ALP)、肌酸激酶(CK)]水平;采用苏木精-伊红和Masson法染色后观察大鼠肝脏病理变化;检测血清和肝组织中转化生长因子β1(TGF-β1)水平并计算大鼠肝脏指数。结果:与正常组比较,模型组大鼠肝脏指数,血清中AST、ALT、CK、ALP水平以及血清和肝组织中TGF-β1水平升高(P<0.05);病理观察结果显示,模型组大鼠肝组织发生明显纤维化病变。与模型组比较,除锁阳提取物中剂量组大鼠血清中ALP、CK外,秋水仙碱组和锁阳提取物中、高剂量组其余各指标均显著改善,锁阳提取物低剂量组仅ALT得到明显改善(P<0.05);各给药组大鼠肝纤维化程度减轻。结论:锁阳提取物对大鼠肝纤维化有一定的改善作用,其机制可能与抑制TGF-β1的表达有关。
肝纤维化;锁阳提取物;转化生长因子β1;肝功能指标;大鼠
肝纤维化(Liver fibrosis,LF)为一种慢性肝脏疾病,是由多种原因引起的肝损害病理改变,其特征是正常的肝组织被再生结节、瘢痕组织所替代,从而使肝脏功能发生障碍,最终发展为肝硬化[1]。LF的发病机制尚不明确,有研究认为与氧化应激[2]、自由基[3]以及转化生长因子β1(Transforming growth factor beta 1,TGF-β1)等多种因素有关,其中TGF-β1在LF形成的过程中起重要的作用[4]。LF的发病率在全球都很高,并无良好的治疗方案。中药在改善症状及减轻肝脏病理改变方面明显优于化学药,且毒副作用较小,已为国内外所共识。
锁阳作为传统中药,对多种疾病均有治疗效果[5]。本课题组前期已从锁阳中分离出了15种单体[6-7],并发现单体Songarin A对肝损伤细胞模型有保护作用[8],为进一步证实锁阳对肝损伤的保护作用,本课题组拟复制LF大鼠模型,以血清中天冬氨酸转氨酶(AST)、丙氨酸转氨酶(ALT)、碱性磷酸酶(ALP)、肌酸激酶(CK)为指标,并结合苏木精-伊红(HE)、Masson法染色后大鼠肝脏病理变化,考察锁阳提取物对模型大鼠LF的改善作用;并以TGF-β1为指标,初步探讨其作用机制,为今后锁阳用于临床治疗LF提供实验依据。
1 材料
1.1仪器
Multiskan FC酶标仪(美国Thermo Fisher公司);Roche Modular D2400全自动生化分析仪(瑞士Roche公司);HC-2518离心机(安徽中科中佳科学仪器有限公司)。
1.2药品与试剂
锁阳提取物[新疆石河子大学药学院提供,批号:20140906,规格:100 mg(提取物)/kg(药材)];秋水仙碱片(云南玉药生物制药有限公司,批号:H53021904,规格:0.5 mg/片);四氯化碳(CCl4,成都科龙化工试剂厂);ALT、AST、ALP、CK测定试剂盒(南京建成试剂公司,批号:20140806、20140601、20140506、20140606);大鼠TGF-β1酶联免疫吸附(ELISA)测定试剂盒(批号:20140901)、兔抗鼠TGF-β1抗体、生物素标记的山羊抗兔免疫球蛋白G(IgG)抗体均购自武汉博士德生物公司;其余试剂均为分析纯。
1.3动物
SD大鼠90只,SPF级,♂,体质量140~160 g,购于成都达硕公司,实验动物生产许可证为SCXK(川)2013-024。将大鼠于温度为(20±2)℃、相对湿度为35%~40%、明暗各12 h(明7:00-19:00,暗19:00-7:00)的环境中适应性饲养1周后用于实验。饲养期间大鼠常规饲料喂养、自由饮水。
2 方法
2.1分组、造模与给药
将大鼠随机分为正常组、模型组、秋水仙碱组(阳性药物,0.2 mg/kg)[9]和锁阳提取物低、中、高剂量组(50、100、200 mg/kg,剂量根据前期预实验结果确定),每组15只。除正常组外,其余各组大鼠于每周三、周日ih CCl4-花生油(4∶6)混合液3 ml/kg(实验首次ih剂量为5 ml/kg),连续6周,复制LF大鼠模型。6周后,各给药组大鼠ig相应药物,正常组和模型组大鼠ig等体积生理盐水,每天1次,持续6周。实验期间各组大鼠正常饮食。
2.2一般情况观察
在喂食大鼠饲料、造模和给药的时候对大鼠的毛色、精神、行为、饮食量、摄水量等一般情况进行观察,记录。
2.3取材及肝脏指数测定
给药结束后,将大鼠固定,ip水合氯醛麻醉,开腹,以5 ml注射器腹主动脉取血,将血液分装到1.5 ml EP管中,静置至血液凝固后离心,取上清,置于-20℃冰箱中保存。取出肝脏,去除系膜,冷生理盐水冲尽残血,用滤纸吸干,观察大鼠肝脏光滑度、颜色、硬度等,称定肝脏质量,计算肝脏指数[肝脏指数=肝脏质量(g)/体质量(100g)]。
2.4肝功能指标检测
取血清,采用全自动生化分析仪检测血清中ALT、AST、 CK、ALP水平,具体操作按试剂盒说明书进行。
2.5肝组织病理变化观察
取肝右叶的相同位置,大小约为5 mm×5 mm×5 mm的肝组织,脱水,透明,石蜡包埋,制备冠状位切片(厚度为4 μm)。参照文献[10]中方法分别进行HE和Masson染色,光镜下观察肝脏组织病理变化。
2.6肝组织中TGF-β1水平检测
参照文献[9],将“2.5”项下制备的切片脱蜡、水化,用3%过氧化氢阻断内源性氧化酶,0.01 mol/L柠檬酸修复液(pH 6.0)微波修复抗原,血清封闭,加入兔抗鼠TGF-β1抗体(1∶100),4℃过夜,滴加生物素标记的羊抗兔IgG抗体,37℃孵育30 min,二氨基联苯胺(DAB)显色,苏木精染色,脱水,透明,封片。组织染色阳性表达主要表现为细胞膜、细胞浆呈黄色或者褐色颗粒。参照文献[10]中方法,以高倍视野观察染色细胞数量、染色颜色深浅等:0分表示不着色,1分表示淡着色(呈浅黄色),2分表示中等着色(呈棕黄色),3分表示重度着色(呈棕褐色)。将所有大鼠肝组织切片的着色程度、范围进行综合分析以评估TGF-β1水平。对免疫组化结果进行半定量分析。
2.7血清中TGF-β1水平测定结果
采用ELISA法测定血清中TGF-β1水平,具体操作按试剂盒说明书进行。
2.8统计学方法
用SPSS 19.0统计软件进行分析。实验数据用x ±s表示,多组间比较采用单因素方差分析,组间两两比较行LSD-t检验。P<0.05表示差异有统计学意义。
3 结果
3.1一般情况及各组大鼠存活情况
正常组大鼠进食正常,体质量自然增长,鼠毛有光泽。模型组大鼠食欲与精神状态差,毛发黄、杂乱,活动量减少;给药后上述症状较模型组有所好转。最终各组大鼠存活情况如下:正常组14只(因打架死亡1只),模型组8只,秋水仙碱组14只,锁阳提取物低剂量组12只,锁阳提取物中剂量组14只,锁阳提取物高剂量组12只。
3.2肝脏观察结果
正常组大鼠肝脏颜色鲜艳,表面光滑、亮如镜、无斑点,质地柔软。模型组大鼠肝脏颜色明显发黄,表面粗糙、呈颗粒状,边缘钝,包膜紧张且极其僵硬。给药各组大鼠肝脏颜色、质感都有不同程度的改善。与锁阳提取物低剂量组比较,秋水仙碱组和锁阳提取物中、高剂量组大鼠肝脏变化更为明显,质地更加松软、表面结节变得极小。与秋水仙碱组比较,锁阳提取物高剂量组大鼠肝脏光泽度较高。各组大鼠肝脏观察结果见图1。

图1 各组大鼠肝脏观察结果Fig 1 Observed results of liverof rats in each group
3.3肝功能指标和肝脏指数测定结果
与正常组比较,模型组大鼠血清中AST、ALT、ALP、CK水平以及肝脏指数显著升高(P<0.05);与模型组比较,各给药组大鼠血清中上述指标水平均有不同程度降低,除锁阳提取物低剂量组大鼠血清中AST、ALP、CK水平以及肝脏指数和锁阳提取物中剂量组大鼠血清中ALP、CK水平降低不显著外(P>0.05),其余各指标水平均显著降低(P<0.05)。各组大鼠肝功能指标和肝脏指数测定结果见表1。
表1 各组大鼠肝功能指标及肝脏指数测定结果(±s)Tab 1 Results of liver function index and liver index of rats in each group(±s)
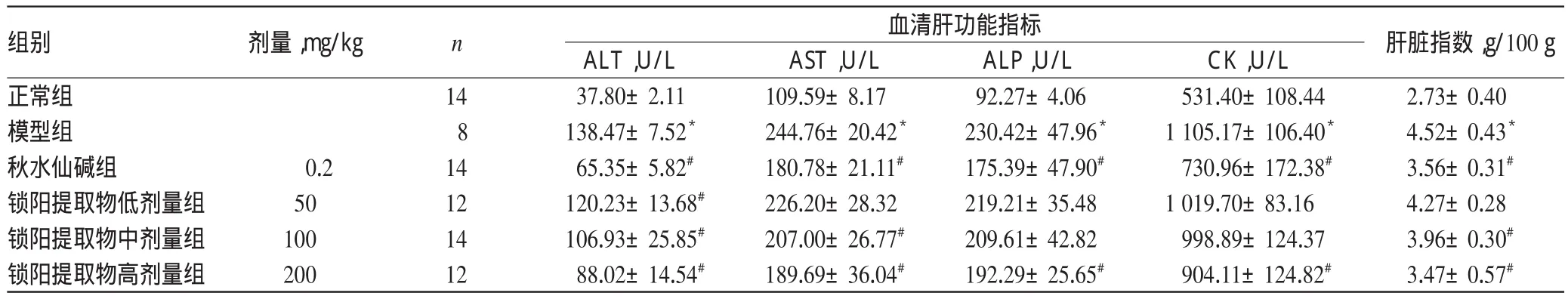
表1 各组大鼠肝功能指标及肝脏指数测定结果(±s)Tab 1 Results of liver function index and liver index of rats in each group(±s)
注:与正常组比较,*P<0.05;与模型组比较,#P<0.05Note:vs.normal group,*P<0.05;vs.model group,#P<0.05
组别正常组模型组秋水仙碱组锁阳提取物低剂量组锁阳提取物中剂量组锁阳提取物高剂量组肝脏指数,g/100 g 2.73±0.40 4.52±0.43*3.56±0.31#4.27±0.28 3.96±0.30#3.47±0.57#剂量,mg/kg n 血清肝功能指标0.2 50 100 200 14 8 14 12 14 12 ALT,U/L 37.80±2.11 138.47±7.52*65.35±5.82#120.23±13.68#106.93±25.85#88.02±14.54#AST,U/L 109.59±8.17 244.76±20.42*180.78±21.11#226.20±28.32 207.00±26.77#189.69±36.04#ALP,U/L 92.27±4.06 230.42±47.96*175.39±47.90#219.21±35.48 209.61±42.82 192.29±25.65#CK,U/L 531.40±108.44 1 105.17±106.40*730.96±172.38#1 019.70±83.16 998.89±124.37 904.11±124.82#
3.4肝组织病理观察结果
3.4.1HE染色正常组大鼠肝小叶结构清晰、肝细胞正常。模型组大鼠肝小叶结构有破坏,肝细胞脂肪沉积,胞质内呈现空泡状、点状坏死,纤维化明显。给药后大鼠肝组织病变减轻,仅有部分细胞脂肪沉淀,且随着锁阳提取物给药剂量增大,改善越明显。各组大鼠肝组织HE染色结果见图2。
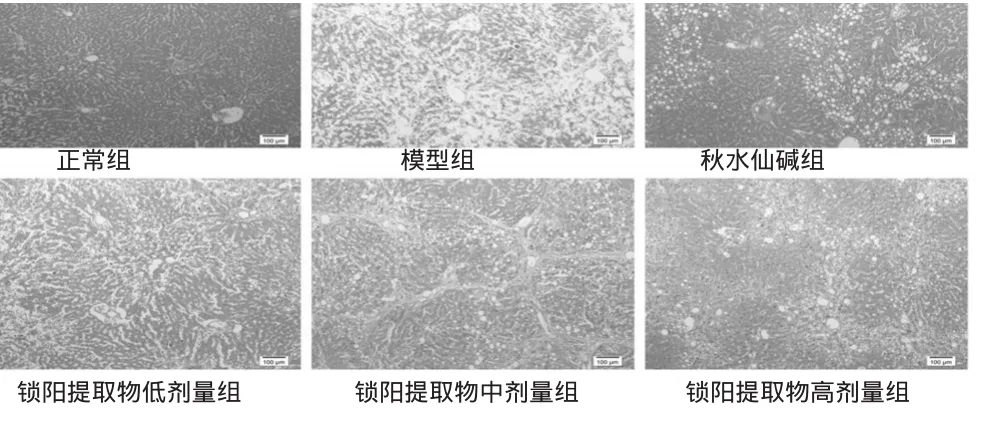
图2 各组大鼠肝组织HE染色结果(×10)Fig 2 HE staining of liver tissue of rats in each group(×10)
3.4.2Masson染色正常组大鼠肝组织只是在汇管区有极少胶原纤维的表达,细胞索排列整齐。模型组大鼠肝组织有假小叶生成,细胞索杂乱,有大量的脂肪空泡,纤维化明显。给药后大鼠肝组织变性细胞和胶原沉积减少,纤维化程度减轻。各组大鼠肝组织Masson染色结果见图3。
3.5血清及肝组织中TGF-β1水平
与正常组比较,模型组大鼠血清及肝组织中TGF-β1水平显著升高(P<0.05)。与模型组比较,各给药组大鼠血清及肝组织中TGF-β1水平均有所降低,且与锁阳提取物呈剂量-效应关系;除锁阳提取物低剂量组大鼠降低不显著外,其余各组差异均有统计学意义(P<0.05)。各组大鼠血清及肝组织中TGF-β1水平测定结果见表2。
表2 各组大鼠血清及肝组织中TGF-β1水平测定结果(±s)Tab 2 Results of the levels of TGF-β1in serum and liver tissue of rats in each group(±s)
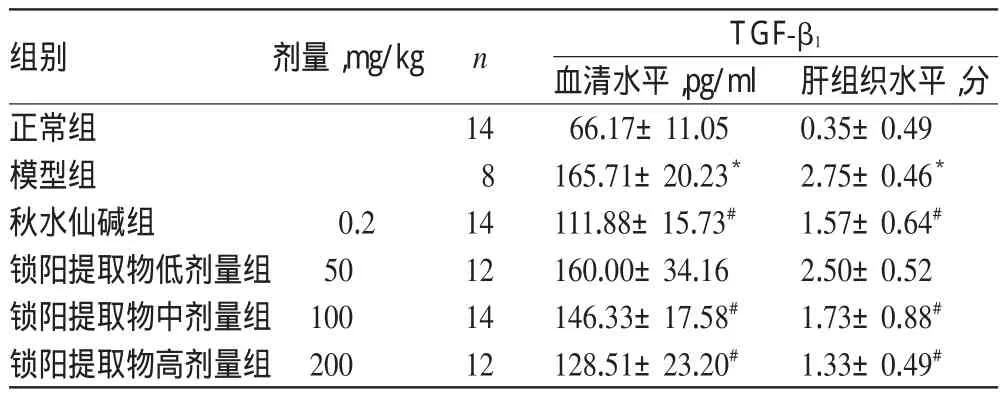
表2 各组大鼠血清及肝组织中TGF-β1水平测定结果(±s)Tab 2 Results of the levels of TGF-β1in serum and liver tissue of rats in each group(±s)
注:与正常组比较,*P<0.05;与模型组比较,#P<0.05Note:vs.normal group,*P<0.05;vs.model group,#P<0.05
组别正常组模型组秋水仙碱组锁阳提取物低剂量组锁阳提取物中剂量组锁阳提取物高剂量组肝组织水平,分0.35±0.49 2.75±0.46*1.57±0.64#2.50±0.52 1.73±0.88#1.33±0.49#剂量,mg/kg n 0.2 50 100 200 14 8 14 12 14 12 TGF-β1血清水平,pg/ml 66.17±11.05 165.71±20.23*111.88±15.73#160.00±34.16 146.33±17.58#128.51±23.20#
4 讨论
LF的产生是由于细胞外基质(Extracellular matrix,ECM)的合成与降解平衡失调,导致肝内纤维结缔组织异常沉积的病理过程。而ECM的来源主要是激活了的肝星状细胞(HSCs)。正常情况下HSCs处于静止状态,当致病因子造成肝细胞损伤时,就会激活血小板、Kupffer细胞以及损伤的肝细胞等分泌多种细胞因子和某些化学介质共同作用于HSCs,使HSCs被激活并转化为肌成纤维细胞(Myofibroblast,MF);激活了的HSCs通过自分泌和旁分泌,促进HSCs增殖,合成大量细胞外基质并在肝内沉积,导致LF的发生[11]。
锁阳最早在1964年被发现对神经系统有一定的影响。近年来被发现有抗肿瘤的功效[12],以及通过增加老年鼠血液和脑组织中端粒的长度来达到抗衰老的作用[13]。而对肝脏疾病方面的影响尚未见报道,直到近期研究发现,在锁阳中被提取出来的一个新的黄烷醇Songarin A可以减轻体外HepG2细胞的损伤[8]。基于这一发现,本研究表明锁阳提取物对大鼠LF也有一定的影响。但是也有研究证明从锁阳中提取的没食子酸和矢车菊3-O-葡萄糖苷具有抗氧化应激的作用[14],且提取物芸香苷、儿茶素和异槲皮苷不仅可以减少自由基的形成,还能清除自由基[15]。结合上述LF的发病原因,锁阳提取物亦可能是通过这几种提取物对LF大鼠发挥作用。
TGF-β1是多效细胞因子,通过自分泌或旁分泌的方式调节细胞的增殖、分化、凋亡,另外还对创伤的修复、细胞外基质的合成、免疫功能等有重要的作用。TGF-β1的过量表达能促进HSCs合成弹性蛋白、黏着蛋白、胶原及蛋白聚糖等细胞外基质,减少降解蛋白酶的合成,从而降低ECM的分解,打破了合成与降解的平衡,使ECM的沉积增多,加速LF的发展[16]。本研究发现,锁阳提取物干预以后,LF大鼠血清中TGF-β1的量和肝组织中TGF-β1的表达均有所降低。锁阳可能是通过作用于此靶点来减少HSCs合成ECM。TGF-β1信号通路主要是通过下游分子受体活化型蛋白Smad2、Smad3,以及抑制型蛋白Smad7来调控表达的[17-18]。另外有文献报道,在与LF有关的Hedgehog通路中,TGF-β1可以刺激其下游转录因子Gli使其累积[19],而Gli可以诱导抗凋亡基因和激活HSCs活化基因的表达,从而使活化的HSCs累积造成LF的发生[20]。因此TGF-β1也可能通过这两条通路来减轻纤维化程度。
综上所述,本研究在用锁阳提取物治疗LF模型大鼠时,在采用秋水仙碱[21]作为阳性对照的基础上,通过计算肝脏指数、观察肝脏外观和病理切片、检测肝功能,发现LF程度明显减轻,提示锁阳提取物对LF确实有一定的改善作用,但具体是否为Songarin A这一成分发挥的效应,需要进一步的验证。而且笔者发现TGF-β1表达有所降低,说明锁阳提取物作用于LF的机制可能与TGF-β1这一靶点有关。
[1]Suk KT,Kim DJ.Staging of liver fibrosis or cirrhosis:the role of hepatic venous pressure gradient measurement [J].World J Hepatol,2015,7(3):607.
[2]Sánchez-Valle V,Chávez-Tapia NC,Uribe M,et al.Role of oxidative stress and molecular changes in liver fibrosis:a review[J].Curr Med Chem,2012,19(28):4850.
[3]Abdel-Moneim AM,Al-Kahtani MA,El-Kersh MA,et al. Free radical-scavenging,anti-inflammatory/anti-fibrotic and hepatoprotective actions of taurine and silymarin against CCl4induced rat liver damage[J].PLoS One,2015,10(12):e0144509.
[4]Hong L,Eric R,Donna H,et al.Transforming growth factor b neutralization ameliorates pre-existing hepatic fibrosis and reduces cholangiocarcinoma in thioacetamidetreated rats[J].PLoS One,2013,8(1):e54499.
[5]Cui Z,Guo Z,Miao J,et al.The genus Cynomorium in China:an ethnopharmacological and phytochemical review[J].J Ethnopharmacol,2013,147(1):1.
[6]谢石安,李国玉,王航宇,等.锁阳化学成分的研究[J].中国药师,2012,15(7):911.
[7]谢石安,李国玉,张珂,等.锁阳化学成分的分离与鉴定[J].沈阳药科大学学报,2012,29(7):525.
[8]Xie SA,Li GY,Huang J,et al.A new flavanol from Cynomorium songaricum[J].J Asian Nat Prod Res,2013,15(4):413.
[9]陈小亮,李俊,邓子煜,等.苦参素对肝纤维化大鼠肝脏TGF-β1的调节作用[J].中国药理学通报,2009,25(6):761.
[10]周学东,刘庆涛.荔枝核总黄酮对肝纤维化模型大鼠肝细胞损伤的改善作用[J].中国药房,2015,26(22):3099.
[11]许珂玉,肖建英.五味子粗多糖提取物对大鼠肝纤维化的防治作用研究[J].中国药房,2011,22(19):1743.
[12]Shi G,Jiang W,Cai L,et al.Molecular characteristics and antitumor capacity of Glycan extracted from Cynomorium songaricum[J].Int J Biol Macromol,2011,48(5):788.
[13]Ma L,Chen G,Nie L,et al.Effect of Cynomorium songaricum polysaccharide on telomere length in blood and brain of D-galactose-induced senescence mice[J].Zhongguo Zhong Yao Za Zhi,2009,34(10):1257.
[14]Zucca P,Rosa A,Tuberoso CI,et al.Evaluation of antioxidant potential of“maltese mushroom”(Cynomorium coccineum)by means of multiple chemical and biological assays[J].Nutrients,2013,5(1):149.
[15]Yu FR,Liu Y,Cui YZ,et al.Effects of a flavonoid extract from Cynomorium songaricum on the swimming endurance of rats[J].Am J Chin Med,2010,38(1):65.
[16]Gressner AM,Weiskirchen R.Modern pathogenetic concepts of liver fibrosis suggest stellate cells and TGF-b as major players and therapeutic targets[J].J Cellular and Molecular Medicine,2006,10(1):76.
[17]Uemura M,Swenson ES,Gaça MDA,et al.Smad2 and Smad3 play different roles in rat hepatic stellate cell function and α-smooth muscle actin organization[J].Mol Biol Cell,2005,16(9):4214.
[18]Dooley S,Hamzavi J,Breitkopf K,et al.Smad7 prevents activation of hepatic stellate cells and liver fibrosis in rats[J].Gastroenterology,2003,125(1):178.
[19]Omenetti A,Choi S,Michelotti G,et al.Hedgehog signaling in the liver[J].J Hepatol,2011,54(2):366.
[20]林春蕾,郭传勇.Hedgehog通路与肝纤维化关系的研究进展[J].胃肠病学和肝病学杂志,2012,21(10):909.
[21]孙嘉临,王先化.秋水仙碱对实验性大鼠肝纤维化的影响[J].中国现代医生,2012,50(14):1.
(编辑:林静)
Effects of Cynomorium songaricum Extract on Liver Fibrosis Model Rats and Its Mechanism Study
LI Ronghua1,WANG Hangyu2,LIN Yousheng1,LIU Yilun3,LI Huiyuan1,HUANG Xiaomei1,TANG Linmei1,HE Hailin1,CUI Lang1,DENG Fengmei1(1.School of Basic Medical Sciences,Chengdu Medical College,Chengdu 610500,China;2.School of Pharmacy,Shihezi University,Xinjiang Shihezi 832000,China;3.The First Affiliated Hospital of Chengdu Medical College,Chengdu 610500,China)
OBJECTIVE:To investigate the effects of Cynomorium songaricum extract on liver fibrosis model rats and its mechanism.METHODS:90 SD rats were randomly divided into normal group,model group,colchicine group(positive drug,0.2 mg/kg),C.songaricum extract low-dose,medium-dose and high-dose groups(50,100,200 mg/kg),with 15 rats in each group.Except for normal group,those groups were given carbon tetrachloride to induce liver fibrosis model.After modeling,treatment groups were given relevant medicine intragastrically,and normal group and model group were given normal saline intragastrically,once a day,for consecutive 6 weeks.After treatment,serum liver function index[AST,ALT,ALP,CK]of rats were detected.The pathological changes in the livers of rats were observed by HE and Masson staining;the expression of TGF-β1in the livers and serum of rats were detected and liver index was calculated.RESULTS:Compared with normal group,liver index,AST,ALT,CK,ALP,the level of TGF-β1in serum and liver were increased in model group,with statistical significance(P<0.05).Pathological results showed that fibrosis lesion was found in liver tissue of rats in model group.Compared with model group,those index of colchicine group,C.songaricum extract medium-dose and high-dose groups were improved significantly and ALT of C.songaricum extract low-dose group was improved obviously,except for serum levels of ALP and CK in C.songaricum extract medium-dose groups. The degree of fibrosis was relieved in treatment groups.CONCLUSIONS:C.songaricum extract can improve liver fibrosis to certain extent,which may be related with inhibiting the expression of TGF-β1.
Liver fibrosis;Cynomorium songaricum extract;TGF-β1;Liver function index;Rats
R285
A
1001-0408(2016)28-3903-04
10.6039/j.issn.1001-0408.2016.28.05
国家自然科学基金资助项目(No.81560566);四川省大学生创新训练计划项目(No.201313705011);成都医学院大学生创新训练计划项目(No.CXXS201303)
*硕士研究生。研究方向:肝纤维化的发病机制。E-mail:lrh_ 1990@126.com
教授,硕士生导师,博士。研究方向:肝纤维化的发病机制。电话:028-62739109。E-mail:dengfm2004@163.com
(2016-01-04
2016-04-16)
