吡喹酮咀嚼片微生物限度检查方法的建立
2016-11-16玛尔江木坎
玛尔江·木坎
(新疆维吾尔自治区兽药饲料监察所,新疆乌鲁木齐 830063)
吡喹酮咀嚼片微生物限度检查方法的建立
玛尔江·木坎
(新疆维吾尔自治区兽药饲料监察所,新疆乌鲁木齐 830063)
目的 吡喹酮咀嚼片为内服给药制剂,制剂中含有适合微生物生长的氮源和碳源,因此在原料采购、储存,以及在制剂制备过程和储存等环节,如处理和控制不当,则有滋生微生物的可能,因此对本制剂需要进行微生物限度检查,由于本制剂含有动物组织(鱼粉),依据按照2010年版《中国兽药典》一部附录143-158微生物限度检查标准,对吡喹酮咀嚼片进行了细菌、霉菌及酵母菌计数方法和控制菌检查方法的验证,旨在为规范药品的微生物限度检查提供依据。
吡喹酮咀嚼片微生物限度方法建立
建立吡喹酮咀嚼片微生物限度检查方法,依据按照2010年版《中国兽药典》附录的要求进行方法学验证,因此对本制剂需要进行微生物限度检查和附录271-272页“微生物限度检查法应用指导原则”,建立了吡喹酮咀嚼片微生物限度检查方法,并将该方法纳入吡喹酮咀嚼片质量标准检查项中。
1 实验材料
1.1菌种
大肠埃希菌〔CMCC(B)44102〕,金黄色葡萄球菌〔CMCC (B)26003〕,枯草芽孢杆菌〔CMCC(B)63501〕,白色念珠菌〔CMCC(F)98001〕,黑曲霉〔CMCC(F)98003〕,以上菌种由乌鲁木齐市食品药品检验所提供。
1.2培养基
营养琼脂培养基、营养肉汤培养基、玫瑰红钠培养基、酵母浸出粉胨葡萄糖琼脂(YPD)、胆盐乳糖培养基(BL)、改良马丁液体培养基、改良马丁琼脂培养基、沙门志贺菌属琼脂培养基(SS)、四硫黄酸钠亮绿培养基(TTB)、麦康凯琼脂培养基(MacC)、4-甲基伞形酮葡萄糖苷酸培养基(MUG),均购自北京奥博星科技有限公司生产。
1.3试剂与试液
氯化钠(分析纯)、磷酸二氢钾(分析纯)、磷酸氢二钾(分析纯)、吐温80、定基质试液,0.9%无菌氯化钠溶液、pH值为7.0的无菌氯化钠-蛋白胨缓冲液。
1.4样品
爱普瑞克(吡喹酮咀嚼片)(规格100mg,批号分别为20131204),是由北京中农华威制药有限公司提供。
2 实验方法
2.1细菌菌悬液的制备
取出冷冻保藏的大肠埃希菌、金黄色葡萄球菌、枯草芽孢杆菌的新鲜培养物1ml接种于50ml营养肉汤培养基中,在36℃培养20h;取结束的培养物用0.9%无菌氯化钠溶液进行10倍等级稀释至50~100cfu/ml。
2.2真菌菌液制备
冷冻保藏的白色念珠菌和黑曲霉培养物各0.2ml,接种到真菌斜面培养基上,均匀涂布,在27℃培养,白色念珠菌培养约30h结束。真菌培养约5d结束。
白色念珠菌培养物表面加入4ml0.9%无菌氯化钠溶液,用接种环刮下菌体,用无菌吸管吸取1ml加9ml无菌氯化钠溶液进行10倍等级稀释至50~100cfu/ml。该菌悬液在室温下放置,应在2h内使用。
黑曲霉培养物表面加入4ml0.05%聚山梨酯80的0.9%无菌氯化钠溶液,用接种环轻轻刮培养物表面,将孢子洗脱,用无菌吸管吸取1ml洗脱液加9ml0.05%聚山梨酯80的0.9%无菌氯化钠溶液进行10倍等级稀释至50~100cfu/ml。孢子悬液在室温下放置,应在10h内使用。
3 吡喹酮咀嚼片供试液的制备
3.1供试液A的制备
在超净工作台中,用灭菌的镊子从经过表面消毒的两板铝箔/ PVC泡罩中取出3片吡喹酮咀嚼片(每片重约1.7g)于灭过菌的研钵中捣碎并研成细粉,然后将细粉装入100mlpH值7.0氯化钠-蛋白胨缓冲液的250ml三角烧瓶中,用灭菌棉塞封口,在磁力搅拌器上搅拌1h,然后用孔径大于100um的玻璃砂芯漏斗G1号过滤,滤液即为供试液A。
3.2供试液B的制备
取3片吡喹酮咀嚼片(每片重约1.7g)于灭过菌的研钵中捣碎并研成细粉,取约1 g细粉分别与以上2.1项制备的10-5菌悬液(金黄色葡萄球菌)10ml和10-4的黑曲霉孢子悬液10ml,充分混匀,用孔径大于100μm的玻璃砂芯漏斗(G1)过滤,取滤液用稀释液按1:10进行稀释,得供试品B。以上操作过程均应在无菌条件下进行,制备好的供试液应无菌存放,并及时使用。
4 采用平皿法细菌、霉菌及酵母菌计数验证试验分为五组
4.1试验组
供试品+菌悬液,取1ml供试液A和1ml相对应的菌悬液分别注入平皿中,之后立即倾注温度为45℃以下的营养琼脂培养基(细菌用)和玫瑰红钠培养基(白色念珠菌和黑曲霉用),细菌培养在36℃培养3天,白色念珠菌和黑曲霉用在27℃培养5d,培养期间每天观察并记录菌落数。
4.2阳性对照组
取2.1项菌悬液或孢子悬液1ml注入平皿中,之后立即倾注以上试验组相同的培养基。
4.3阴性对照组
取氯化钠-蛋白胨缓冲液1 ml注入平皿中,之后立即倾注以上试验组相同的培养基。
4.4供试品A 组
取供试液A组1 ml注入平皿中,之后立即倾注以上试验组相同的培养基。
4.5供试品B 组
取供试液B组1 ml注入平皿中,之后立即倾注以上试验组相同的培养基。爱普瑞克(吡喹酮咀嚼片)规格100mg,批号为20131204。结果见表1.
5 控制菌检查
(1)试验设阳性对照组、阴性对照组和供试品检查组。
(2)试验用培养基:a .检查大肠埃希菌用的乳糖胆盐增菌液和4-甲基伞形酮葡萄糖苷酸培养基;b.检查沙门氏菌用的营养肉汤培养基,四硫黄酸钠亮绿培养基,沙门、志贺菌属琼脂培养基。
(3)供试品检查主要包括以下两步:
a.检查大肠埃希菌
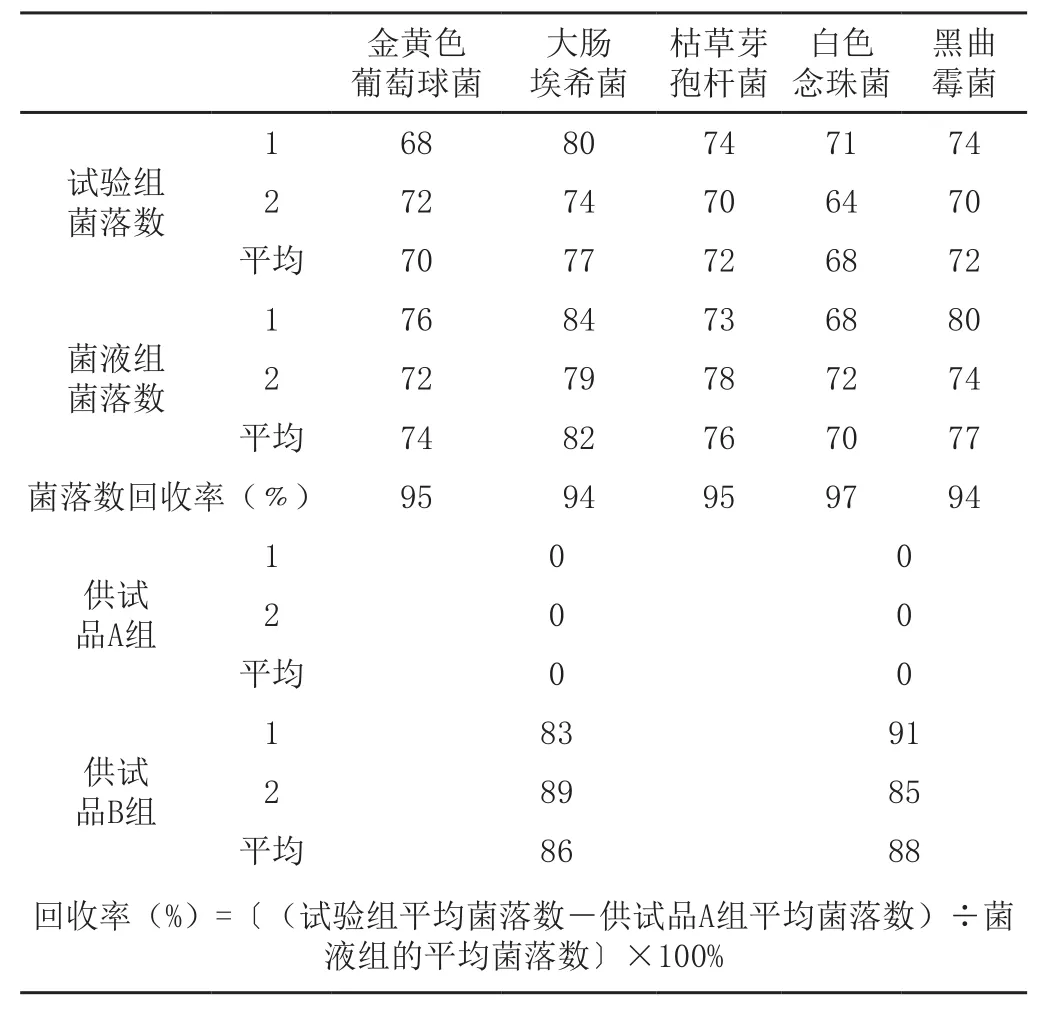
表1 细菌、霉菌及酵母菌计数验证试验
供试液的制备:在超净工作台中,用灭菌的镊子从经过表面消毒的两板铝箔/PVC泡罩中取出3片吡喹酮咀嚼片置灭过菌的研钵中捣碎并研成细粉,全部移入装有100ml氯化钠-蛋白胨缓冲液的200ml三角瓶中,用灭过菌的高速剪切机处理3~5min得混悬液,该混悬液为供试液。
检查过程:取上述供试液10ml加入100ml乳糖胆盐增菌培养基的三角烧瓶中,35±1℃培养24h,培养结束取培养物0.2ml加入到含5mlMUG培养基的试管内培养于5h、24h在360nm紫外光下观察。
b.检查沙门氏菌
供试液的制备:在超净工作台中,用灭菌的镊子从经过表面消毒的两板铝箔/PVC泡罩中取出3片吡喹酮咀嚼片,置灭过菌的研钵中捣碎并研成细粉,即为供试品。
检查过程:取上述供试品约10g加入200ml营养肉汤培养基的三角烧瓶中,用剪切机300~500rpm均质化,于35±1℃培养24h,培养物取1ml接种于10ml四硫黄酸钠亮绿培养基中,培养24h后,用灭菌吸管吸取0.2ml,分别接种于沙门、志贺菌属琼脂培养基的平板上,涂布均匀,48h观察。结果见表2

表2 控制菌检查试验
6 结论
由“试验组”结果与“菌液组”比较可见,供试品对试验菌株无抑菌活性。供试品A组未检出细菌、霉菌和酵母菌,菌落数均为0,这很可能与吡喹酮咀嚼片在加工过程采取了有效的杀菌方法有关。也与本品经过钴-60照射后,没有活的微生物存在。并且采用的包装物密封良好,产品在保存期间被微生物污染的可能性很小。
比较以上试验表明所采用的培养基、培养条件和供试品处理方法符合大肠埃希菌和沙门氏菌的要求,上述检查表明供试品不含有大肠埃希菌和沙门氏菌。通过以上菌落计数和控制菌检查表明,供试品制备方法及具体操作方法适用于本产品的微生物限度检查。
菌落计数试验中,可知该试验组的回收率均高于70%,故可照该供试液制备方法和计数方法测定吡喹酮咀嚼片的细菌和酵母菌数。控制菌检查试验中,可知阴性对照组未检出阳性菌,试验组检出阳性菌,故可用此供试液制备法和控制菌检查法进行吡喹酮咀嚼片的控制菌检查。在试验过程中为了避免污染,应严格遵守操作规范,保证试验结果的准确可靠。
[1]中华人民共和国兽药典委员会.中国兽药典[S].北京:中国农业出版社,2010:附录121.
[2]中国药品生物制品检定所.中国药品检验标准操作规程[S].北京:中国医药科技出版社,2010:351.
[3]马绪荣.药品微生物学检验手册[M]北京:科学出版社,2000:89-90.
玛尔江·木坎(1963-),女,大学本科,高级兽医师,从事抗生素检验、饲料及畜产品安全检测。
