儿童特发性血小板减少性紫癜Th亚群细胞因子测定与骨髓巨核细胞分类的意义
2016-11-16唐玉蓉孙婷婷王际亮伊心浩
唐玉蓉,孙婷婷,王际亮,伊心浩
(山东省胜利油田中心医院1.检验科;2.科教科,山东 东营257034)
*通讯作者
儿童特发性血小板减少性紫癜Th亚群细胞因子测定与骨髓巨核细胞分类的意义
唐玉蓉1,孙婷婷1,王际亮1,伊心浩2*
(山东省胜利油田中心医院1.检验科;2.科教科,山东 东营257034)
据报道儿童免疫性血小板减少性紫癜(ITP)的发病率为1.9-6.4/10万[1],由于病因、发病机理仍不十分明确,推测与多种诱因有关,导致机体出现细胞免疫和体液免疫紊乱。本研究通过判断患儿的Th1/ Th2细胞因子极化状态及Th3细胞因子与骨髓原幼巨核细胞是否有相关性,旨在探讨Th各类型细胞因子与ITP发病的关系。
1 资料和方法
1.1 研究对象
2014年1月至2016年1月在胜利油田中心医院儿科住院且初次确诊为ITP患儿。依据张之楠[2]主编的《血液病诊断及疗效标准》作为诊断标准。急性特发性血小板减少性紫癜(aITP)患儿24例,男性10例,女性14例,年龄在2.7岁到13.4岁之间;慢性特发性血小板减少性紫癜(cITP)患儿20例,男性11例,女性9例,年龄在2.1岁到12.3岁之间。对照组为同期骨髓检查基本正常的住院儿童25例,男10例,女15例,年龄在2.5岁到12.8岁之间。各实验对象需排除感染,且近期无手术及创伤。年龄和性别各组无统计学差异(P>0.05)。
1.2 仪器和试剂
流式细胞仪为Epics XL型(美国Beckman coulter公司),Elx80型酶联免疫仪(美国BioTeic公司),FITC-Cy5-抗人CD3单克隆抗体、PE-抗人CD8单克隆抗体及IgG同型对照、FITC-抗人IFN-γ单克隆抗体、PE-抗人IL-4单克隆抗体均购自美国BD公司,淋巴细胞分层液、伏波酯乙醇(PMA)、离子霉素(ionomycin)和蛋白转运抑制剂莫能霉素(monensin)均为Sigma公司的产品,红细胞裂解液(美国ImmunoProbe公司),Reagent A和Reagent B均为An Der Crub公司的产品。TGF-β1 ELISA检测试剂盒为科华生物公司产品。
1.3 方法
1.3.1 细胞培养 ①无菌采集ITP患儿肝素抗凝的静脉血4 ml,先取100 μl新鲜抗凝血,用RPMI1640[不含小牛血清-磷酸盐缓冲液(PBS)]1∶1等体积稀释。加1 μg/mL PMA12 μl、1 μg/mL离子霉素4 μl及1 mg/mL的莫能霉素3.4 μl混匀;37℃、5%CO2培养箱培养4-6 h。②另取3 ml新鲜抗凝血,用密度梯度离心法分离PBMC,用含10%胎牛血清的RPMI 1640培养液调整PBMC密度为1×109/L;取2 ml细胞悬液加入PMA(终浓度为50 μg/L)和离子霉素(终浓度为1 μmol /L),置37℃温箱中培养过夜,收集上清置-70℃冻存待测细胞因子。
1.3.2 细胞染色 将培养后的外周血细胞平均分为A、B两管,各加入20 μl CD3、CD8单抗混匀,37℃避光孵育15 min;加固定剂A 200 μl 37℃避光孵育15 min,加PBS 3 ml震荡,1200 r/min离心5 min。弃上清后,A管和B管同时加破膜剂B 100 μL,A管加抗IFN-γ、IL-4单抗,B管加入同型对照IgG单抗,37℃避光孵育15 min,PBS洗涤、离心、弃上清液。最后以PBS悬浮细胞,经流式细胞仪检测样本CD3+,CD8-细胞中表达IFN-γ,IL-4的阳性百分比。
所得数据采用Partec软件进行分析,以CD3+,CD8-设门表达CD4+T细胞(Th),分析标本中Th1和Th2细胞占CD4+T细胞的比例。
1.3.3 TGF-β1检测 取上述冻存的PBMC培养上清,ELISA检测其TGF-β1的水平,操作按试剂盒说明进行,酶联仪上测定450 nm波长吸光度(A450)。
1.3.4 骨髓片姬姆萨-瑞氏染色,自然干燥后在低倍镜下查找骨髓巨核细胞,并在油镜下进行分类。
1.4 统计学分析

2 结果
2.1 外周血Th细胞分泌的因子在ITP患儿与正常对照儿童中水平变化
外周血Th1细胞表达的IFN-γ在aITP患儿中的百分比较正常对照组显著增高 (P<0.05);在cITP患儿中较对照组显著降低 (P<0.01);aITP、cITP和对照组三组之间的差异有显著性(P<0.05)。Th2细胞表达的IL-4因子在aITP患儿中的表达较对照组低(P>0.05),两组间无显著性差异;在cITP患儿中的表达高于对照组(P<0.05),有显著性差异。在aITP患儿中Th1/Th2较对照组升高,有统计学意义(P<0.05);在cITP患儿中Th1/Th2较对照组降低,有统计学意义(P<0.05)。在aITP患儿中的外周血单个核细胞Th3细胞表达的因子TGF-β1水平较对照组显著降低(P<0.05),而cITP患儿的TGF-β1水平较aITP组显著降低(P<0.05);aITP、cITP和对照组三组间有显著性差异,结果见表1。
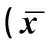
表1 ITP患儿与正常对照儿童外周血中细胞因子水平比较±s)
与对照组比较,△△P<0.01,△P<0.05;与aITP组比较,#P<0.05
2.2 ITP患儿外周血单个核细胞TGF-β1与骨髓原幼巨核细胞百分比分析
实验表明,外周血单个核细胞TGF-β1因子水平在aITP患儿中的表达与骨髓原、幼巨核细胞百分比呈现负相关,外周血单个核细胞TGF-β1因子水平在cITP患儿中与骨髓原、幼巨核细胞正相关,结果见表2和图1。

表2 外周血单个核细胞TGF-β1与骨髓原、幼巨核细胞之间相关性分析
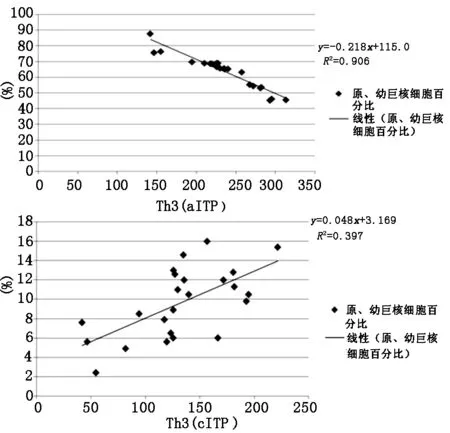
图1 外周血单个核细胞TGF-β1与骨髓原、幼巨核细胞之间相关性分析
3 讨论
免疫性血小板减少症在儿童出血性疾病中最为常见,各年龄段均可以发病,国内文献报道儿童ITP 3岁以下婴幼儿多见[3],且随着年龄的增长,儿童cITP的发病率呈增长趋势。近年来越来越多的研究支持免疫功能紊乱是ITP发病的主要原因。淋巴细胞亚群、细胞因子表达及功能的变化引发了异常的体液免疫和细胞免疫,是ITP发病机制的基础。其中免疫功能异常的T细胞,特别是CD4+T淋巴细胞在ITP的发病过程中免疫功能及其分泌的细胞因子起了非常重要作用。CD4+T淋巴细胞中Th1 亚型细胞因子的功能是通过介导机体细胞免疫来参与巨噬细胞的活化过程,代表因子有IL-2、IFN-γ; Th2亚型细胞因子的功能是通过介导机体体液免疫诱导机体产生抗体,代表因子有IL-4, IL-5, IL-10,但是IL-10可以由如单核细胞等非 T 细胞产生而影响其水平,而IL-4, IL-5主要由Th2 型细胞活化后分泌的。Th3亚型细胞的功能通过分泌免疫调节因子参与机体免疫耐受诱导,以能下调抗原提呈细胞的TGF-β1为代表。
本研究发现,外周血CD4+的IFN-γ因子 在aITP儿童组中高表达,提示aITP急性期时增强了外周血T细胞是从Th0细胞向Th1细胞分化,疾病优势表达Th1;而cITP组中外周血CD4+细胞的IFN-γ因子低表达及IL-4因子的高表达,提示发病时,机体明显减弱了外周血T细胞由Th0细胞向Th1细胞的分化,疾病相对优势表达Th2。TGF-β1的表达在儿童ITP患者中均低表达,提示机体对B细胞的抑制可能随着TGF-β1因子的表达减低而减弱, B细胞增殖可能更活跃,更加容易激活抗血小板抗体对外周血血小板的作用,进一步加剧血小板的破坏;B细胞抑制减弱还会促进其诱导巨噬细胞的激活、加剧补体的形成和增强细胞毒的活性,最终大量破坏巨核细胞和外周血中的血小板而引发疾病。三种细胞因子在外周血中的不同变化,证实了cITP患儿和aITP患儿均存在不同程度机体细胞免疫和机体体液免疫异常,而体液免疫在cITP患儿中表现更明显,提示机体的免疫紊乱则更为严重。
同时,我们也发现aITP和cITP患儿均存Th1/Th2功能极化异常。Dominguez等[4]在研究中发现Th1/Th2细胞间的平衡是影响免疫功能的重要环节。aITP和cITP的患儿细胞因子在本实验中呈相反的极化改变,说明在免疫机制上,两种疾病可能存在本质区别。细胞因子呈Th1优势表达的是aITP组患儿,提示机体的免疫功能亢进是由自身反应性细胞免疫引起的,而在相对优势表达Th2细胞因子的cITP患儿组则提示机体增强的是体液免疫,这与本实验中Th3细胞因子表达TGF-β1结果相一致,均提示cITP体液免疫更明显。
同时,TGF-β1主要是由骨髓幼稚巨核细胞分泌,外周血单个核细胞TGF-β1含量降低,可能反映骨髓幼稚巨核细胞生成TGF-β1障碍。aITP患儿的原幼稚巨核细胞比例明显增多,且TGF-β1含量与之呈负相关,验证了该推测。cITP患儿骨髓中原、幼稚巨核比例正常,其结果与外周血单个核细胞TGF-β1含量正相关,提示TGF-β1在aITP和cITP中的发病机制不同,可能参与了aITP的发病机制。
aITP患儿中TGF-β1浓度低于正常组对照,有观点认为Tr细胞活化后,可通过分泌TGF-β1等抑制性细胞分子调节T细胞功能,由于aITP中的Tr细胞活化受抑制导致TGF-β1含量下降,使T细胞功能混乱,导致抗血小板抗体增多,血小板破坏增多[5]。而TGF-β1主要是由幼稚巨核细胞生成,外周血单个核细胞分泌的TGF-β1降低考虑可能与骨髓巨核细胞分泌TGF-β1障碍相关,提示其可能作为aITP患儿疗效检测的因子,相互之间的作用机制有待遇进一步探讨研究。
在cITP中,外周血单个核细胞分泌的TGF-β1的变化与骨髓原幼巨核细胞比例正相关,提示可能与全身免疫异常有关系,除了骨髓外,其他细胞影响TGF-β1分泌所致[6]。本研究cITP的病例较少,TGF-β1 在cITP中发挥的作用可能更复杂,有待于进一步扩大样本研究。
[1]Terrell DR,Beebe LA,Vesely SK,et al.The incidence of immune thrombocytopenic purpura in children and adults:A critical review of published reports[J].Am J Hematol,2010,85(3):74.
[2]张之楠.血液病诊断及疗效标准[M].第3版.北京:科学出版社,2008:172-175.
[3]刘德新,廖宁.儿童急性特发性血小板减少性紫癜125例临床分析[J].中国小儿血液与肿瘤杂志,2012,17(3):129.
[4]Dominguez garcia MV,Rodriguez Moyado H.Cellular and biochemical mechanisms involved in physiopathgenesis of autoimmune thrombocytopenic purpura[J].Gac Med Mex,2002,15(3):461.
[5]Maloy KJ,Salamn L,Cahill R,et al.CD4+CD25+T(R) cells suppress immune pathology cytokine-dependent mechanisma[J].J Exp Med,2003,197:111.
[6]胡洪玻,胡 群,胡 迎.小儿特发性血小板减少性紫癜骨髓巨核细胞转化生长因子-β1改变及意义[J].中国实用儿科杂志,2008,23(11):812.
1007-4287(2016)10-1746-03
2016-04-07)
