重组干扰质粒对卵巢癌COC1细胞HDAC1表达的影响
2016-11-16邹颖刚许天敏崔满华
贾 妍,邹颖刚,许天敏,崔满华
(吉林大学第二医院 妇产科 , 吉林 长春130041)
重组干扰质粒对卵巢癌COC1细胞HDAC1表达的影响
贾 妍,邹颖刚,许天敏,崔满华*
(吉林大学第二医院 妇产科 , 吉林 长春130041)
目的 构建重组HDAC1 基因的短发夹RNA (shRNA) 慢病毒干扰质粒并研究其对卵巢癌COC1细胞HDAC1表达的影响。方法 针对HDAC1 基因设计特异性siRNA 靶点,构建慢病毒干扰质粒载体,筛选获得的有效shRNA 慢病毒干扰序列,将其转染卵巢癌COC1细胞。采用Real-time PCR 方法检测靶基因在mRNA 水平的沉默效果,Western blot方法检测靶基因在蛋白质水平的沉默效果。结果 构建的慢病毒载体shRNA 的PCR 鉴定和测序正确。 shRNA 慢病毒干扰质粒转染COC1细胞后HDAC1 基因的mRNA 表达量和蛋白质水平较阴性对照质粒转染组均显著下调(P<0.05)。结论 成功构建HDAC1 基因的shRNA慢病毒干扰质粒,该慢病毒干扰质粒能够在细胞水平有效沉默靶基因。
HDAC1;短发夹RNA;慢病毒
(ChinJLabDiagn,2016,20:1615)
卵巢癌在妇科恶性肿瘤中死亡率最高,因为卵巢位于盆腔的深部,病变早期症状隐匿,绝大多数患者在诊断的时候,肿瘤已经发生了广泛的转移。对于晚期的患者,即使手术做的很理想,仍然有一部分患者出现肿瘤的复发。术后一线的化疗方案是紫杉醇+卡铂(TC)的联合化疗,但疗效非常有限,在化疗的初期反应尚可,很快即出现化疗的耐药,这些都是治疗的难点。最近研究发现,组蛋白去乙酰化酶抑制剂可以作为上皮性卵巢癌紫杉醇耐药的一个新的治疗靶点[1]。组蛋白去乙酰化酶1(histone deacetylase 1,HDAC1)由Taunton 首先发现,是第一个哺乳动物的组蛋白去乙酰化酶[2],HDAC1在肿瘤的发生发展中起着重要作用。本研究拟构建针对HDAC1 的3条慢病毒干扰质粒,并筛选最佳的干扰序列,为进一步研究HDAC1与卵巢癌的关系奠定基础。
1 材料与方法
1.1 主要试剂
人卵巢癌细胞株 COC1为人粘液性卵巢癌细胞株,购自武汉大学典型培养物宝藏中心。慢病毒质粒 pRNAT-U6.2/Lenti vector来源于GenScript公司,RPMI-1640、小牛血清购自 Invitrogen公司,shRNA序列和引物由ShineGene公司合成,PCR 试剂盒购自Takara 公司,Lipofecter脂质体转染试剂购自碧云天生物技术研究所,小量质粒抽提试剂盒购自Qiagen公司,感受态大肠杆菌试剂盒购自Bio sciences公司。PCR扩增仪为Roche公司,Universial 32高速冷冻离心机为Hettich公司,二氧化碳培养箱为日本SANYO公司,超净工作台JDJ-203为苏州净化设备厂,倒置显微镜为日本OLYMPUS公司。
1.2 构建 shRNA 慢病毒表达载体
根据 siRNA 引物的设计原则,查找NCBI 数据库提供的人HDAC1基因的 mRNA 序列(NM_004964),设计针对人HDAC1基因的3条RNA干扰靶序列(3条序列分别命名为sh1:AAAGTCTGTTACTACTACGAC,sh2:AACTGCTAAAGTATCACCAGA,sh3:AATACTTTGGACCAGATTTCA)。经 BLAST Search 检索,确认这3条序列与除HDAC1 以外的人类基因无同源序列。根据干扰序列设计shRNA的DNA双链模板,包括正义链、反义链和连接的loop环,并在5’端融合BamH I位点、3’端融合Xho I酶切位点。应用基因重组技术将这3条RNA干扰靶序列,插入真核表达载体的多克隆位点,使之转染真核细胞后,在U6启动子的作用下生成小发卡状RNA,慢病毒 pRNAT-U6.2/Lenti质粒经BamH I和Xho I双酶切后,与合成的双链DNA 模板进行连接反应,连接成功后,质粒转化到大肠杆菌感受态细胞中,12小时后可出现菌落,挑选阳性的重组克隆进行PCR 鉴定,阳性质粒分别含有sh1,sh2,sh3这三种序列,标记后送测序公司测序,见图1。

图1 pRNAT-U6.2/Lenti载体序列图
1.3 pRNAT-U6.2-HDAC1 转染卵巢癌COC1细胞
将测序正确的3种质粒分别命名为pRNAT-U6.2-HDAC1-sh1,pRNAT-U6.2-HDAC1-sh2,pRNAT-U6.2-HDAC1-sh3,将这3种质粒分别转染生长状态良好的COC1细胞,24 h后荧光显微镜下观察,根据质粒自身携带的绿色荧光蛋白计数转染效率,采用Lipofecter脂质体转染试剂盒,转染前一天用COC1细胞铺板,第二天细胞能达到70%-80%,加入转染试剂,继续培养24 h,在荧光显微镜下,观察质粒转染情况。
1.4 Real-time PCR 方法筛选siRNA 有效靶点
将pRNAT-U6.2-HDAC1-sh1,pRNAT-U6.2-HDAC1-sh2,pRNAT-U6.2-HDAC1-sh3三种质粒分别转染卵巢癌COC1细胞,验证各个siRNA靶点的基因沉默效率,转染72 h后,收集 总RNA,应用Real-time PCR 的方法检测 HDAC1 mRNA 的表达情况,从而筛选3个靶点的基因沉默效率,上游引物为5′-AACTGGGGACCTACGG -3′; 下游引物为5′-ACTTGGCGTGTCCTT-3′,扩增片段大小为230 bp 。以Actin 为内参基因,Actin的上游引物为5′-CATGTACGTTGCTATCCAGGC-3′,其下游引物为5′-CTCCTTAATGTCACGCACGAT-3′,扩增片段为229 bp。CT值=2-ΔΔCT。
1.5 Western Blot检测HDAC-1的蛋白质的表达
将pRNAT-U6.2-HDAC1-sh1,pRNAT-U6.2-HDAC1-sh2,pRNAT-U6.2-HDAC1-sh3三种质粒分别转染卵巢癌COC1细胞,72 h后收集细胞,提取细胞的总蛋白,配制SDS-PAGE凝胶,上样、转膜、封闭、杂交、曝光,取出显影、定影。
1.6 统计学分析

2 结果
2.1 针对HDAC1 基因的shRNA干扰质粒载体的构建
设计3个HDAC1 基因shRNA的寡核苷酸序列,其5’端和3’端分别融合BamHⅠ、XhoⅠ酶切位点,而且慢病毒载体pRNAT-U6.2/Lenti的多克隆位点也包含这两个位点,应用基因重组技术,将shRNA序列和载体分别用BamHⅠ 和XhoⅠ双酶切,两者具有相同的粘性末端,用T4DNA连接酶进行连接,得到3种针对HDAC1 基因的shRNA干扰质粒载体,将其转化到大肠杆菌感受态细胞,挑取阳性单克隆,选取载体上的引物进行PCR扩增反应,PCR引物片段大小为250bp,将反应产物进行电泳纯化,组中在250bp处出现光亮条带为阳性克隆(见图2)。选取阳性克隆进行测序鉴定,应用Chromas软件读取测序结果,经分析、比对,证实3个shRNA序列均已成功插入到慢病毒载体中,形成重组的HDAC1shRNA慢病毒表达载体,从测序结果的截图(图3)中可以看到,3个shRNA序列插入完全正确,表明已经成功的构建了HDAC1的3个shRNA慢病毒干扰质粒,测序鉴定结果与设计的3个靶序列相一致。测序结果表明,HDAC1的3个干扰质粒已经构建成功。
2.2shRNA转染卵巢癌COC1细胞
pRNAT-U6.2慢病毒质粒载体为真核表达载体,带有绿色荧光蛋白标记基因cGFP,转染真核细胞后,在CMV启动子的作用下转录生成绿色荧光蛋白,通过荧光显微镜,可以观察到明亮的绿色荧光。实验结果显示:含有HDAC1干扰质粒的载体和不含插入片段的空载体均能有效的转染卵巢癌COC1细胞,转染24小时后,用荧光显微镜观察,COC1为悬浮的细胞,质粒转染后出现了细胞的皱缩,使细胞的体积变小,细胞内均出现了明亮的绿色,说明质粒已经成功地转染到COC1细胞内(见图4)。选取3个高倍视野进行观察,计数含有绿色荧光的细胞所占比例,即为转染效率。结果显示:HDAC1siRNA干扰质粒和不含质粒的空载体,转染效率均在70%-80%,表明这种转染方法具有可行性,符合继续实验的标准。
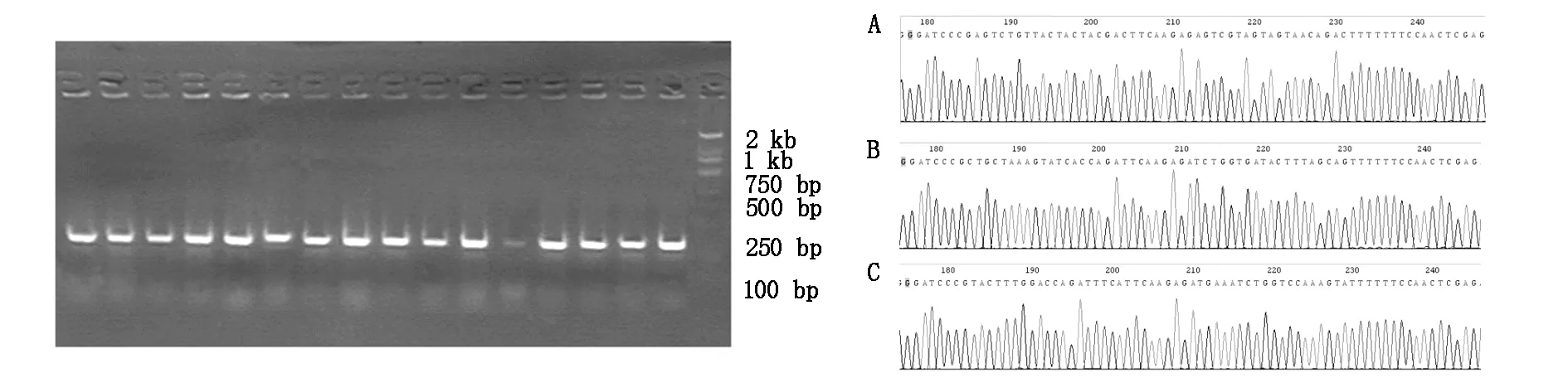
图2 重组shRNA慢病毒载体PCR鉴定电泳图 图3 HDAC1的3个干扰质粒测序的结果

注:A1和A2分别为pRNAT-U6.2/Lenti-HDAC 1质粒在荧光视野和明视野的镜下照片,B1和B2分别为pRNAT-U6.2/Lenti空载体在荧光视野和明视野镜下照片
图4 质粒转染COC1细胞(×100)
2.3 HDAC1 siRNA 有效干扰靶点的筛选
应用Real-time PCR方法,检测上述3 个HDAC1的 shRNA慢病毒干扰质粒与阴性对照质粒,转染 COC1细胞后HDAC1在mRNA水平表达的变化,RT-PCR结果的CT值用2-△△CT来计算,以Actin为内参。 1-3 号干扰质粒的HDAC1 mRNA的表达量分别为0.857±0.080、0.350±0.091和0.830±0.056(见图5A),以2 号靶点的沉默效果最好,表达有显著性差异(P<0.001),2 号靶点为最有效的 siRNA 靶点,选择该靶序列HDAC1-sh2质粒进行后续实验。而阴性对照组和与空白对照组的HDAC1 表达无显著差异,表明该慢病毒质粒转染本身,对HDAC1 基因没有特异性影响。
2.4 Western blot 进一步验证3个靶点的有效性
将3种质粒转染COC1细胞72小时后收集细胞,进行Western blot实验,结果显示1-3号靶点对 HDAC1的表达量分别为0.89±0.082、0.403±0.049、和0.803±0.060(见图5A),2 号靶点的沉默效果最好,表达有显著性差异(P<0.001),2 号靶点为最有效的 siRNA 靶点,对HDAC1的沉默效果最佳。

A:3种siRNA在卵巢癌COC1细胞中HDAC1 mRNA的表达的柱状图B:三组细胞中HDAC1的蛋白印记图
图5 三种siRNA的沉默效果
3 讨论
组蛋白去乙酰化酶 (HDACs) 的家族非常庞大,真核生物HDACs分为4类[3],目前发现的组蛋白去乙酰化酶至少有18个亚型,每个组蛋白去乙酰化酶在调控细胞增殖、凋亡中的特异性作用尚不清楚。HDAC1是第一个被发现的组蛋白去乙酰化酶,包含482个氨基酸,分子质量约为55 KD,位于1p34,其mRNA为2091 bp,是HDACs最具代表性的酶。
肖莉[4]等研究表明HDAC1 在宫颈鳞癌中阳性表达率显著高于宫颈上皮内瘤变和慢性宫颈炎,而且HDAC1 阳性表达率与HPV16/18 感染相关,与宫颈癌的临床分期无关,与组织分化、间质浸润深度
及盆腔淋巴结转移相关,提示在宫颈癌的发生发展中,HPV16/18 感染可能是通过提高组蛋白去乙酰化酶1的水平抑制转录而发挥作用。高道键[5]等研究发现,HDACl的特异性干扰质粒能有效地抑制人胰腺癌PaTu8988 细胞的HDACl 在mRNA和蛋白质的表达,同时抑制细胞增殖、诱导细胞凋亡,其机制可能与上调p21、Bax 表达,下调Bcl-2 表达有关。笔者本人的研究也发现HDAC1 在卵巢组织中的阳性表达随组织异型程度的增加而逐渐增高[6],提示HDAC1 表达增强可能是卵巢癌发生的早期事件。Ran Zhao[7]等发现DNA损伤结合复合体(DDB)是通过募集HDAC1来抑制Bcl-2在上皮性卵巢癌细胞中的转录。大量的研究表明,HDAC1在大肠癌、胃癌、前列腺癌和肺癌等均呈高表达,与肿瘤的发生、发展密切相关,抑制HDAC1 有望成为新的肿瘤治疗手段。本研究构建了针对HDAC1 基因的shRNA 干扰质粒,并筛选出沉默HDAC1 效率最高的shRNA 序列,并将该质粒转染卵巢癌COC1细胞,并验证其对HDAC1 的沉默作用,结果显示该质粒能有效地干扰HDAC1 基因的表达,为进一步鉴定HDAC1 基因在卵巢癌发生发展过程中的作用提供了条件。
[1]Pchejetski D,Alfraidi A,Sacco K.Histone deacetylases as new therapy targets for platinum-resistant epithelial ovarian cancer[J].J Cancer Res Clin Oncol,2016,142(8):1659.
[2]Taunton J,Hassig CA,Schreiber SL.A mamm histone deacetylase related to the yeast transcriptiregulator Rpd3p[J].Science,1996,272(5260):408.
[3]Takai N,Narahara H.Histone deacetylase inhibitor therapy in epithelial ovarian cancer[J].J Oncol,2010:458431.
[4]肖 莉,万义增,王 宝,等.宫颈上皮内瘤变及鳞癌组织中组蛋白去乙酰化酶1的表达及与HPV16/18感染的关系[J].中国医科大学学报,2015,5(44):464.
[5]高道键,徐 岷,张玉琦,等.RNA干扰组蛋白去乙酰化酶1对人胰腺癌细胞增殖、凋亡的调控机制研究[J].解放军医学杂志,2010,4(35):380.
[6]贾 妍,邹颖刚,陈 军,等.组蛋白去乙酰化酶1在人上皮性卵巢癌组织中的表达[J].中国实验诊断学,2011,15(2):256.
[7]Ran Zhao,Chunhua Han,Eric Eisenhauer.DNA damage-binding complex recruits HDAC1 to repress Bcl-2 transcription in human ovarian cancer cells[J].Mol Cancer Res,2014,12(3):370.
Interference recombinant plasmids targeting HDAC1 gene in ovarian cancer cell COC1
JIAYan,ZOUYing-gang,XUTian-min,etal.
(DepartmentofObstetricsandGynecology,SecondHospitalofJilinUniversity,Changchun130041,China)
Objective To construct the shRNA lentiviral plasmid targeting HDAC1 gene and detect its effect of gene silence in COC1 cells.Methods The specific siRNA sequences targeting HDAC1 gene were cloned into pRNAT-U6.2/Lenti lentiviral plasmid.After screening for the valid siRNA ,HDAC1 specific shRNA was transfectted into COC1 cells.Then ,real-time PCR and Western Blot was performed to determine the expression level of HDAC1.Results PCR and sequencing results revealed that shRNA plasmids were correctly constructed.The HDAC1 expressions in COC1 cells were down regulated at mRNA and protein level by plasmid transfection.The expression of HDAC1 was decreased in mRNA levels and protein compared with negative control.Conclusion The recombinant lentiviral shRNA plasmid targeting HDAC1 gene has been successfully constructed.HDAC1 mRNA and protein can be down-regulated availably in COC1 cells.
HDAC1;short hairpin RNA;lentivirus
吉林省科技厅青年科研基金(201201034)
1007-4287(2016)10-1615-04
R737.31
A
2015-10-09)
*通讯作者
