多重荧光定量PCR测定疟原虫方法建立
2016-11-15何晓翔雷永良王晓光傅圣勇刘敏
何晓翔+雷永良+王晓光+傅圣勇++刘敏
[摘要] 目的 建立可同时检测四种疟原虫的多重荧光定量PCR方法。 方法 PCR扩增四种疟原虫目的片段,克隆并构建标准质粒,进行梯度稀释。体系按浓度加入五重引物探针,对临床四种疟原虫阳性血样及单一腺病毒和肺炎支原体阳性血样、人基因组进行特异性检测。将本地区优势虫种恶性疟及间日疟阳性血样混合并检测。每个反应做一式三份验证重复性。检测标准品梯度浓度,获得体系最低检测限。 结果 成功构建四种疟原虫标准质粒。对20份样本进行检测,其中15份恶性疟,3份间日疟,1份三日疟,1份卵形疟,与原有确证结果一致。对单一腺病毒及肺炎支原体阳性血样、人基因组检测结果均为阴性。恶性疟及间日疟阳性血样混合检测显示3条特异性扩增曲线。三个复孔的变异系数在0.17~4.96之间。恶性疟可检测到102 copies/mL,间日疟、三日疟、卵形疟可检测到103 copies/mL。 结论 建立五重荧光定量PCR检测四种疟原虫特异性及重复性均较好,灵敏度高,可用于疟原虫快速筛选及分型鉴定。
[关键词] 多重荧光定量PCR;疟原虫;蚊传染病;疟疾
[中图分类号] R440 [文献标识码] A [文章编号] 1673-9701(2016)23-0004-03
[Abstract] Objective To establish the multiple fluorescence quantitative PCR measure to detect four types of plasmodium at the same time. Methods Target fragments of four types of plasmodium were extended by PCR, the standard plasmid was cloned, constructed and diluted by gradient. Five primers and probes were added into the system according to the concentration and the clinical four plasmodium positive blood sample, single adenovirus and mycoplasma pneumonia positive blood sample as well as human gene was detected specifically. The falciparum malaria and tertian malaria positive blood sample caused by the local superior plasmodium were mixed and detected. Each experiment was performed for three times to validate the repetitiveness. The gradient concentration of the sample was detected and the lowest detection limitation was achieved. Results The standard plasmids of four plasmodiums were successfully constructed and 20 samples were detected. 15 samples were falciparum malaria and 3 samples were tertian malaria, 1 sample was quartan malaria and 1 sample was ovale malaria, which was in accordance with the original validated results. The results of detection of single adnovirus and mycoplasma pneumonia positive blood sample and human gene were negative. 3 specifically extended curves were presented by the mixed detection of falciparum malaria and tertian malaria positive blood sample. The variable coefficients of the three duplication holes were within 0.17-4.96. Falciparum malaria was detected to be 102 copies/mL and tertian malaria, quartan malaria as well as ovale malaria was detected to be 103 copies/mL. Conclusion The established five fluorescence quantitative-PCR in the detection of four types of plasmodium has good specificity and repetitiveness as well as high sensitivity, which can be used in the quick screening and type identification of plasmodium.
[Key words] Multiple fluorescence quantitative-PCR; Plasmodium; Mosquito-borne diseases; Malaria
疟疾是由蚊子传播的一种寄生虫病,由带有疟原虫的雌性按蚊叮咬人体而传染,其已经成为全球热带、亚热带最严重的公共卫生问题之一[1]。疟疾主要有四种致病疟原虫:恶性疟(falciparum)、间日疟(vivax)、卵形疟(ovale)、三日疟(malariae)。随着我国对外开放程度的不断扩大,从疟疾流行区归来后引起疟疾爆发的报道次数逐渐增多,且近年来输入性病例所占比例不断增加[2],各个省份均有报道,故对疟疾的控制计划是巨大的挑战。
临床疟疾诊断和最常规的方法以镜检疟原虫、临床体征观察、抗原检测为主。但其准确性、灵敏度均有待提高。PCR检测外周血寄生虫的敏感性和特异性较好,且PCR方法在分型鉴定中有特殊优势。目前,PCR鉴定疟原虫方法大致有:巢氏PCR[3,4]、一步法单管多重PCR[5]、荧光PCR(SYBR Green)[6]、环介导等温扩增PCR(LAMP)。其中巢氏PCR扩增样本之后需要核酸胶鉴定[7],溶解曲线判断要求不同种疟原虫的溶解温度差异要大。本研究旨在开发操作更简单、单步骤的多重PCR体系,在单管中能同时鉴定几种疟原虫的方法,现报道如下。
1 材料与方法
1.1仪器与试剂
四种疟原虫阳性血样来自临床患者,病例收集时间为2014年3月1日~2016年3月1日,由本地疾控中心经金标、镜检、核酸检测等方式确诊[8];腺病毒、肺炎支原体临床阳性血样,人基因组DNA由本实验室保存。7500荧光定量PCR仪购自ABI公司,QIAamp DNA Blood Mini Kit(德国qiagen)购自杭州怡丹生物技术有限公司,NanoDrop分光光度计购自赛默飞世尔科技。Premix Ex Taq、T载体购自takara。割胶回收试剂盒购自Promega公司。Taq酶购自全式金公司。TG1菌株由本实验室保存。
1.2 方法
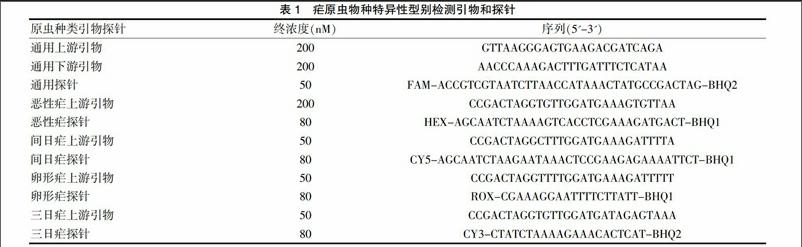
1.2.1 标准质粒构建 四种疟原虫阳性血样提核酸DNA,使用通用上下游引物(表1),Taq酶PCR扩增见试剂说明书,温度:94℃ 2 min。94°C 30 s,61°C 30 s,72℃ 1 min,35个循环,72°C 10 min。使用试剂盒纯化PCR产物,克隆到pMD19-T载体。转化E.coli TG1感受态细胞,在蓝白斑上挑取白斑。提质粒DNA[9],测序验证,使用分光光度计测定浓度并按公式计算拷贝数[10],进行梯度倍比稀释。
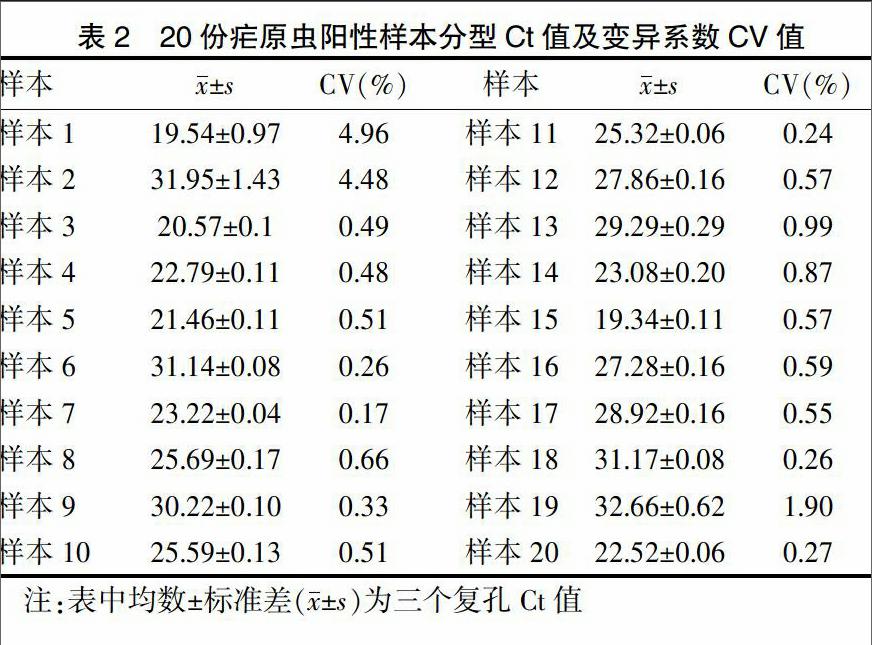
1.2.2 特异性及重复性检测 ①对四种疟原虫阳性血样共20份样本进行多重荧光定量PCR检测,体系引物探针用量见表1。25 μL总体积,10 μL混合液,模板4 μL。95℃ 30 s,1个循环;95℃ 5 s,58℃ 34 s,40个循环;60℃搜集荧光信号。质量控制:加入腺病毒、肺炎支原体阳性血样DNA,人基因组DNA。②将恶性疟与间日疟阳性血样混合在一管中,使用自建体系检测,比较特异性。对同一反应做三个复孔,计算均数、标准差及变异系数,比较重复性。
1.2.3 灵敏度检测 标准品质粒浓度梯度为10、102、103、104、105、106、107 copies/mL,检测最低检测限[11]。
2结果
2.1特异性
PCR结果显示40条特异扩增的S型曲线,通用FAM荧光标记20条典型S型曲线,15份样本HEX荧光基团标记为恶性疟,3份CY5标记为间日疟,1份ROX三日疟,1份CY3卵形疟,腺病毒及肺炎支原体阳性血样、人基因组样本检测均未见特异性扩增。以上所有样本均与预期结果符合。混合血样样本检测显示FAM、HEX、CY5
2.2重复性
2.3 灵敏度
经测序,成功构建四种疟原虫标准质粒,四个标准曲线的R2均>0.993,各稀释度曲线相关性好,恶性疟的为最低检测限为102 copies/mL,间日疟、三日疟、卵形疟均为103 copies/mL。
3讨论
多重荧光定量PCR技术由实时荧光PCR发展而来,通过几种不同的探针荧光报告基团混合,能同时检测基因序列不同的病原体,在国内外蓬勃发展[12-14]。传统PCR技术检测疟原虫需要经过多轮扩增或使用多对引物同时扩增才能鉴别,凝胶电泳费时且难以自动化。本实验旨在单管一步反应获得直观结果,简化实验步骤。
我国疟疾消除计划初显成效,近年来病例多为输入性感染,大量用药导致耐药发生,检测疟原虫隐蔽性及困难程度增加。镜检诊断疟原虫对技术人员专业要求高,且容易漏诊。部分地区实验室镜检技术力量薄弱,一线医技人员对疫情不能及时检验[15],PCR快速检测在出入境关口能克服显微镜的限制,阳性检出率高[16,17],且不受耐药寄生虫影响,应用广泛[18]。我市患者多为恶性疟或间日疟感染,快速准确鉴别虫种对合理治疗有重大意义。
目前国外学者Phuong M等[19]针对地区优势疟原虫种类设计两、三重荧光探针,不能同时鉴定四种疟原虫。国内学者黄雨婷[7]、李美等[20]检测四种疟原虫,巢氏引物扩增后经核酸胶鉴定虫种,曲线的Tm值集中,不易区分和鉴别虫种。
本实验通过对以上方法的综合和优化,调整反应条件、浓度、荧光探针,建立单管中能同时检测四种疟原虫的多重PCR探针系统。本实验方法操作简单,从提取DNA到读出结果在3 h内完成,该系统可对除wallikeri亚种之外的疟原虫进行分型,但疟原虫属保守18S小亚基核糖体基因设计的通用上下游引物可检测出所有疟原虫病原体,以此可应对疟原虫多个基因型差异[21]。本研究的20份样本均已确诊,使用自建方法得出预期结果,通过反应可区分出四种疟原虫。混合血样中加入人基因组,可测得通用、恶性、间日疟特异性扩增,应对混合感染[22]。三个复孔检测曲线呈高度相关性,变异系数<5。对质粒标准品倍比稀释的梯度浓度进行检测,结果显示较好的相关性。四种疟原虫最低检测限均<103 copies/mL,恶性疟可达102 copies/mL,该灵敏度优于其他方法,且有利于混合感染的检测,进一步满足日常检测工作需要。在灵敏度与重复性检测中,梯度浓度相关曲线系数R2>0.98,表明标准品定量可靠。PCR操作过程中需注意污染,且由于本体系引物探针众多,需保证序列质量及保存恰当。为了最大限度获得特异性扩增,本实验优化反应条件及体系浓度,增加特异性及敏感性。上述检测结果显示自建方法高灵敏度、特异性和稳定性,适合在出入境、检验检疫等部门推广应用。
[参考文献]
[1] Lee PC,Chong E T,Anderios F,et al. Molecular detection of human Plasmodium species in Sabah using PlasmoNex multiplex PCR and hydrolysis probes real-time PCR[J]. Malar J,2015,14(11): 28-35.
[2] 王亚丽,王煊,张彦平. 2005~2013年全国本地感染与境外输入疟疾流行病学特征分析[J]. 中国媒介生物学及控制杂志,2015,11(2):120-126.
[3] 孙菲,万向阳,李欢,等. 多重巢式PCR检测恶性疟和间日疟原虫[J]. 临床检验杂志,2014,32(8):565-567.
[4] 王真瑜,张耀光,江莉,等. 上海市1例输血性三日疟病例的实验室检测分析与诊断[J]. 中国血吸虫病防治杂志,2015,17(4):362-366.
[5] 李欢,孙菲,文岚,等. 多重PCR快速检测恶性疟和间日疟的研究[J]. 中国人兽共患病学报,2014,23(3):288-291.
[6] 李欢. SYBR Green实时PCR检测恶性疟原虫与间日疟原虫方法的建立[D]. 中南大学,2014.
[7] 黄雨婷,佘丹娅,卢丽丹,等. 单管单轮多重PCR检测4种疟原虫混合血样[J]. 中国寄生虫学与寄生虫病杂志,2015,33(3):200-205.
[8] 雷永良,陈秀英,叶夏良,等. 经输血传播的1例恶性疟报告[J]. 浙江预防医学,2015,15(2):170-171.
[9] Sheikh IH,Kaushal DC,Chandra D,et al. Immunogenicity of a plasmid DNA vaccine encoding 42kDa fragment of Plasmodium vivax merozoite surface protein-1[J]. Acta Trop,2016,162(13): 66-74.
[10] 戴玉柱,崔大伟,杨先知,等. 五重荧光定量RT-PCR法检测甲型流感病毒[J]. 临床检验杂志,2015,33(9):641-644.
[11] Gupta H,Srivastava S,Chaudhari S,et al. New molecular detection methods of malaria parasites with multiple genes from genomes[J]. Acta Trop,2016,160(14):15-22.
[12] 赵冉,陈琼,孔繁德,等. 4种肠道致病菌的多重荧光定量PCR快速检测方法的建立[J]. 畜牧与兽医,2014,3(8):67-71.
[13] 程鹏飞,唐景峰,程弘夏,等. 淋病奈瑟菌、沙眼衣原体、细小脲原体多重荧光定量PCR检测方法的建立及临床应用[J]. 中国生物制品学杂志,2014,6(1):109-119.
[14] 王原,崔大伟,胡正军,等. 一步法多重荧光定量RT-PCR检测人杯状病毒的建立及应用[J]. 临床检验杂志,2014,32(9):647-651.
[15] 王胜启,李静,郭玉琪,等. 新形势下输入性疟疾疫情防控研究[J]. 中国现代医生,2016,54(4):132-135.
[16] 张宪华. 肠道病毒71型(EV71)的检测[J]. 中国现代医生,2015,53(20):93-95.
[17] 纪衍瑾,孙雯雯,祝喆,等. 应用实时荧光RT-PCR法检测水产品中诺如病毒[J]. 中国现代医生,2015,53(19):130-132.
[18] 万向阳,孙菲,李欢. 荧光定量PCR技术在疟疾诊断中的应用[J]. 实用预防医学,2014,34(1):127-129.
[19] Phuong M,Lau R,Ralevski F,et al. Sequence-based optimization of a quantitative real-time PCR assay for detection of Plasmodium ovale and Plasmodium malariae[J]. J Clin Microbiol,2014,52(4):1068-1073.
[20] 李美,夏志贵,汤林华. 检测4种人体疟原虫多重PCR体系的建立和应用[J]. 中国寄生虫学与寄生虫病杂志,2015,33(2):91-95.
[21] Mahdi AHM,Elamin AF,Albsheer MM,et al. Multiplicity of infection and genetic diversity of Plasmodium falciparum isolates from patients with uncomplicated and severe malaria in Gezira State,Sudan[J]. Parasit Vectors,2016,9(1):362-370.
[22] Nabet C,Doumbo S,Jeddi F,et al. Genetic diversity of Plasmodium falciparum in human malaria cases in Mali[J].Malar J,2016,15(18):353-361.
(收稿日期:2016-04-19)
