胞浆表达绿色荧光蛋白的伯氏疟原虫的构建和筛选
2020-07-15高健史小雨王倩
高健,史小雨,王倩
(天津医科大学基础医学院免疫学系,天津300070)
疟疾(malaria)是一种古老的传染病,主要由受疟原虫(Plasmodium)感染的雌性按蚊叮咬人体所致。根据《2018 年世界卫生组织疟疾报告》显示,2017 年全球共发生2.19 亿例疟疾病例,虽较2010 年减少2 000 万例,但与2016 年的2.17 亿例相比却有所回升,表明近年在减少全球疟疾病例方面进展有限[1]。
反向遗传学技术广泛应用于疟原虫基因功能研究,推动了疟原虫生物学及其与宿主相互作用的研究[2]。基于同源重组原理,可实现特定基因的敲除,从而研究疟原虫基因功能;还可在疟原虫基因组中表达标签蛋白,更直观地探究疟原虫的感染过程。此外,由于目前可用于疟原虫基因组改造的耐药筛选标签数量有限,阻碍了对同一疟原虫基因组的连续改造[3]。为了避免这一问题,可以将荧光蛋白用作筛选标记,有利于快速直观地筛选发生基因改变的疟原虫[4]。为了更直观地探究特定基因在疟原虫发育及侵染过程中的作用,本研究构建并筛选出胞浆中表达绿色荧光蛋白(green fluorescent protein,GFP)的伯氏疟原虫。利用疟原虫敲除载体pL0035,构建pL0035-GFP 重组质粒,在伯氏疟原虫(Plasmodium berghei, P. berghei) 常用基因组改造位点230p(PbANKA_0306000)中,基于双交换(doublecrossover)的同源重组(homologous recombination,HR)原理,将GFP引入到疟原虫基因组中,构建表达GFP 的疟原虫突变体并筛选单克隆突变株,为本实验室后续探究特定基因在疟原虫发育和致病过程中的作用提供了必要工具。
1 材料与方法
1.1 菌株、质粒和疟原虫株 感受态细胞Mach1-T1购自北京博迈德基因技术有限公司,大肠杆菌载体pL0035 于本实验室保存,伯氏疟原虫P. bergheiANKA 由罗格斯大学新泽西医学院Purnima Bhanot教授赠予。
1.2 主要材料和试剂 限制性内切酶SacⅡ、XhoⅠ、EcoRⅠ、EcoRⅤ、ApaⅠ及NEBuilder®HiFi DNA Assembly 试剂盒购自NEB 公司,引物由上海生工生物工程股份有限公司合成。PCR 纯化试剂盒、质粒小提试剂盒和胶回收试剂盒均购自全式金生物技术有限公司。质粒中提试剂盒购自Qiagen 公司。T4 DNA 连接酶购自Thermo Scientific 公司,乙胺嘧啶购自Sigma 公司,细胞核转染试剂盒购自Lonza公司。
1.3 质粒pL0035-GFP 的构建
1.3.1 获取目的片段 以野生型伯氏疟230p基因的编码区(1~6 864 bp)为模板分别合成同源重组上、下游同源臂Up HR arm(1 612~2 165 bp)和Down HR arm(3 315~4 232 bp)。用本实验室保存的含有GFP、eEF1A promoter 和3′yop1/terminal sequence(ts)的质粒扩增GFP(753 bp)、eEF1A(595 bp)和GFP/ts(754 bp),并引入相应酶切位点(表1)。PCR 产物经琼脂糖凝胶电泳鉴定后切胶回收。
1.3.2 载体和目的片段连接 利用In-Fusion 无缝克隆的方法(条件为50°C,30 min)将Down HR arm插入经KpnⅠ和EcoRⅠ酶切的质粒pL0035,得到pL0035-Down HR arm。将连接产物转化至感受态细胞Mach1-T1 中,在含有氨苄的固体培养基上37°C倒置培养12 h,挑取单克隆菌株后,在含氨苄的液体培养液中扩增并提取质粒,酶切鉴定及DNA 测序确认Down HR arm 插入且序列正确。以GFP 和GFP/ts 为模板通过overlap PCR 扩增得到片段GFP-GFP/ts(1 477 bp),再将Up HR arm 和GFPGFP/ts 通过overlap PCR 扩增得到片段Up HR arm-GFP-GFP/ts(2 053 bp)。将经SacⅡ酶切的pL0035-Down HR arm 质粒和片段Up HR arm-GFP-GFP/ts,在T4 DNA 连接酶的作用下16°C 连接16 h,再将产物转化至感受态细胞Mach1-T1 中进行氨苄筛选培养,挑取单克隆菌株并扩增提取质粒,酶切鉴定及测序确认序列正确。XhoⅠ和EcoRⅠ酶切上述得到的质粒和片段eEF1A,利用T4 DNA 连接酶将二者连接,转入感受态细胞,固态培养基倒置培养后扩增单克隆菌株提质粒,测序验证,得到重组质粒pL0035-GFP。大量制备重组质粒,经ApaⅠ和EcoRⅠ线性化后备用。

表1 载体构建引物序列Tab 1 Primer sequences of vector construction
1.4 疟原虫转染 将实验室冻存的伯氏疟原虫(P. bergheiANKA) 感染血液经尾静脉注射感染Wistar 大鼠。尾尖取血制薄血片,Giemsa 染色后油镜下观察计数虫血率。待虫血率增长至3%~5%时,心脏取血(约5 mL),体外同步化培养16~23 h,直至80%左右的疟原虫发育为成熟裂殖体[5]。利用Nycodenz/PBS 密度梯度溶液分离纯化裂殖体,置于冰上备用。取100 μL Nucleofector 溶液、10 μg 线性化重组质粒pL0035-GFP 及30 μL 裂殖体轻柔混匀电击,迅速经尾静脉注入BALB/c 小鼠。
1.5 重组疟原虫筛选与单克隆筛选 电转染次日,如感染小鼠虫血率为阳性,则在小鼠饮用水中加入乙胺嘧啶进行耐药疟原虫筛选。发生重组的疟原虫带有抗乙胺嘧啶的耐药标签,可在给药条件下存活,从而筛选出重组疟原虫,适时停药。待虫血率达5%后,心脏取血并纯化疟原虫,提取疟原虫基因组DNA,PCR 鉴定基因型。采用有限稀释法筛选单克隆虫株。
1.6 表达GFP 的重组疟原虫的红内期成像与流式检测 表达GFP 疟原虫感染小鼠,待虫血率较高时,尾尖取少许血,PBS 清洗1 次,200 g 离心1 min 弃上清,加入20 μL DAPI 工作液避光孵育10 min,再用PBS 清洗1 次,去上清,加少许PBS 重悬,吸取10 μL液体至载玻片,加盖盖玻片,荧光显微镜观察、拍摄。分别取20 μL 感染野生型和表达GFP 的疟原虫小鼠外周血,以5 mL PBS 稀释,300 目滤布过滤后用流式细胞仪检测绿色荧光。
2 结果
2.1 构建胞浆表达GFP 伯氏疟原虫的策略 本研究在伯氏疟原虫基因组230p处插入GFP,以产生表达GFP 的疟原虫突变株。将重组质粒pL0035-GFP 导入疟原虫基因组,转染后发生第1 次同源重组(图1),230p基因部分编码区(2 166~3 314 bp)被质粒上的GFP及耐药标签替换,获得表达GFP 的耐乙胺嘧啶的重组疟原虫(阳性筛选)。为了后续在此疟原虫突变株上进一步进行基因改造,需借助第二次同源重组在上述突变疟原虫中删除耐药标签,同源臂为质粒上的序列3′pbdhfr/ts。在5-氟胞嘧啶(5-fluorocytosine,5-FC)作用下,含有标签蛋白酵母双功能胞嘧啶脱氨酶和尿苷基磷酸核糖基转移酶(yeast enzyme cytosine deaminase and uridyl phosphoribosyl transferase,yFCU)的重组疟原虫可将5-FC 转化为毒性化合物5-氟尿嘧啶(5-fluorouracil,5-FU)而死亡;在5-FC 的压力下发生第2 次同源重组的疟原虫(图1),即耐药标签DHRF-yFCU 被删除的疟原虫可继续存活,从而删除耐药标签(阴性筛选),获得可用于再次基因改造的表达GFP 的疟原虫。
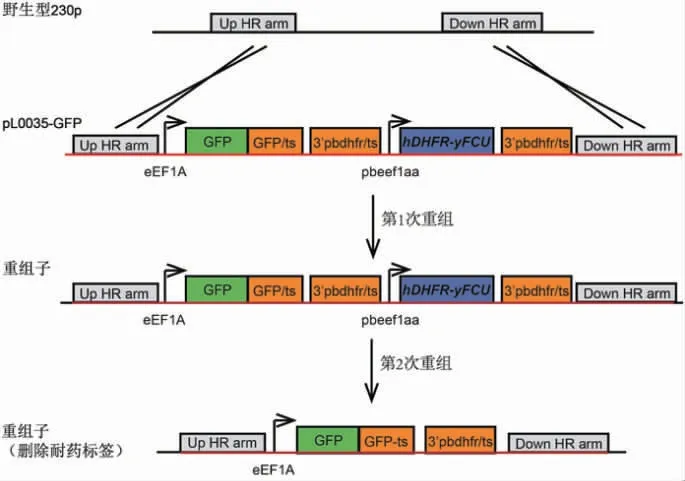
图1 表达GFP 伯氏疟原虫的构建策略Fig 1 Strategy of GFP-expressing P.berghei construction
2.2 重组质粒pL0035-GFP 的构建 重组质粒的构建分为3 个步骤(图2)。第一步,GFP 与GFP/ts片段通过overlap PCR 连接得到GFP-GFP/ts 片段(1 507 bp),并在3′端引入SacⅡ酶切位点,PCR 产物胶回收测序正确(图3A)。第二步,5′端引入SacⅡ酶切位点的Up HR arm 片段与GFP-GFP/ts 片段通过overlap PCR 连接得到Up HR arm-GFP-GFP/ts片段,同时在Up HR arm 与GFP 之间引入XhoⅠ和EcoRⅤ两个酶切位点。片段Up HR arm-GFP-GFP/ts在SacⅡ酶切位点处插入质粒pL0035-Down HR arm,经SacⅡ酶切鉴定显示插入片段大小正确(图3B),质粒测序证明插入片段序列无误。第三步是借助上述引入的酶切位点XhoⅠ和EcoRⅤ将eEF1A promoter 插入Up HR arm 和GFP 之间,最终获得pL0035-GFP 重组质粒,经XhoⅠ和EcoRⅤ酶切鉴定片段大小正确(图3C),测序无误。
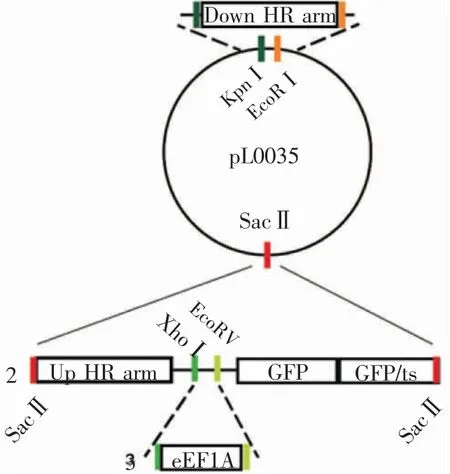
图2 质粒pL0035-GFP 的构建示意图Fig 2 Schematic diagram of pL0035-GFP
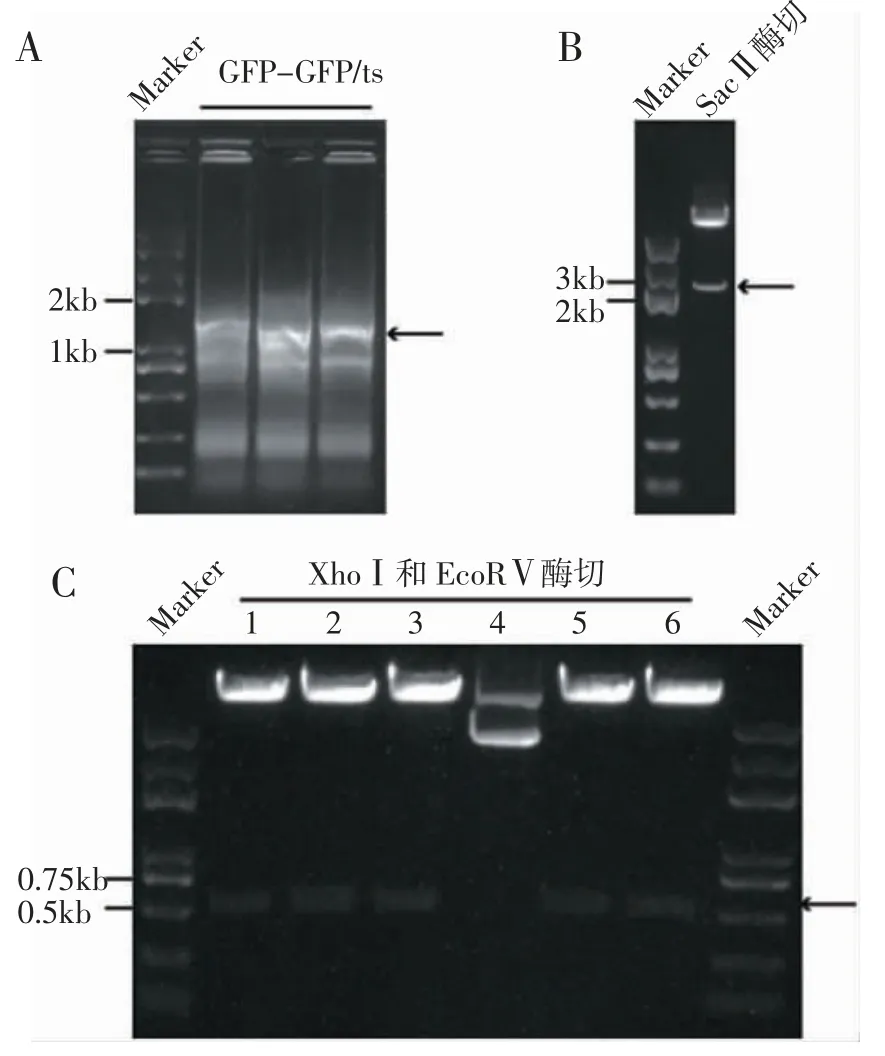
图3 质粒pL0035-GFP 的PCR 鉴定Fig 3 PCR identification of pL0035-GFP
2.3 伯氏疟原虫转染后重组子的鉴定 转染后经乙胺嘧啶药物筛选获得重组疟原虫。经单克隆筛选后共获得4 个虫株A1、B4、C2 和C4,提取疟原虫基因DNA 进行PCR 鉴定基因型,A1、B4、C2 和C4 均有重组条带而无野生型条带(图4),为单克隆的重组子(基因型鉴定引物见表2)。
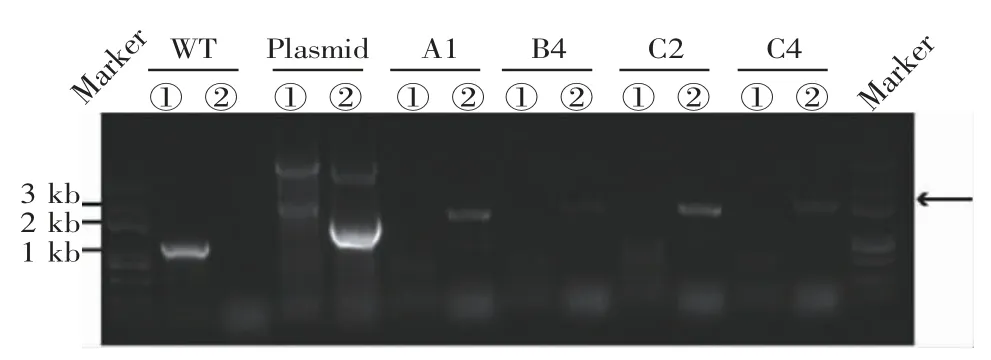
图4 PCR 鉴定疟原虫转染重组子Fig 4 Recombinant Plasmodium verified by PCR
2.4 转染重组质粒pL0035-GFP 的疟原虫在红内期表达GFP 单克隆重组疟原虫DAPI 染核后荧光显微镜观察,可见疟原虫胞浆显示绿色荧光(图5)。流式细胞术也可检测到重组疟原虫的绿色荧光信号(图6)。上述结果均提示表达GFP 的伯氏疟原虫构建成功。
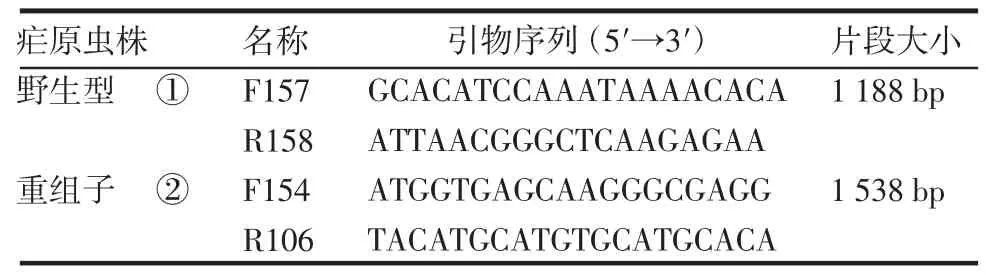
表2 PCR 鉴定疟原虫转染重组子基因型引物序列Tab 2 PCR primers of genotype identification of integrated parasites
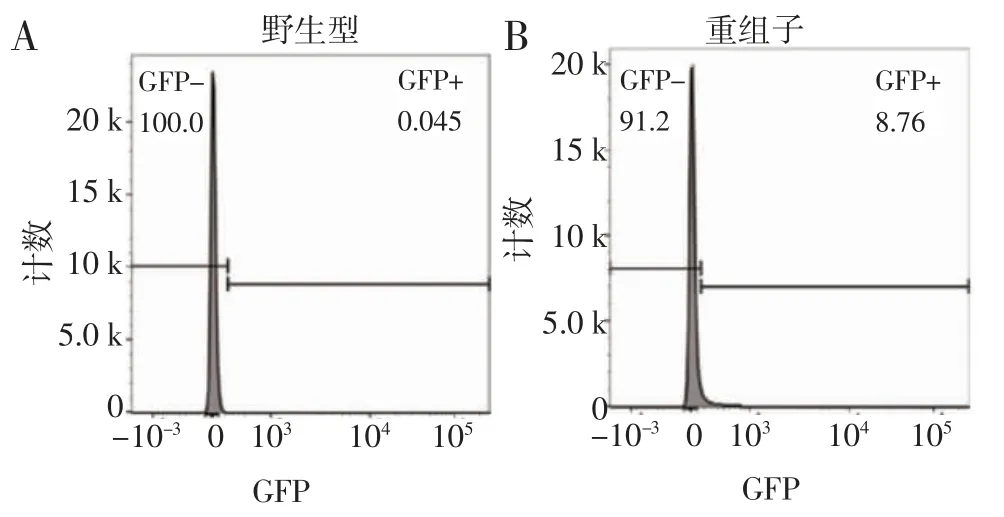
图6 流式细胞术检测重组疟原虫的绿色荧光信号Fig 6 Green fluorescent signal of recombinant Plasmodium detected by flow cytometry
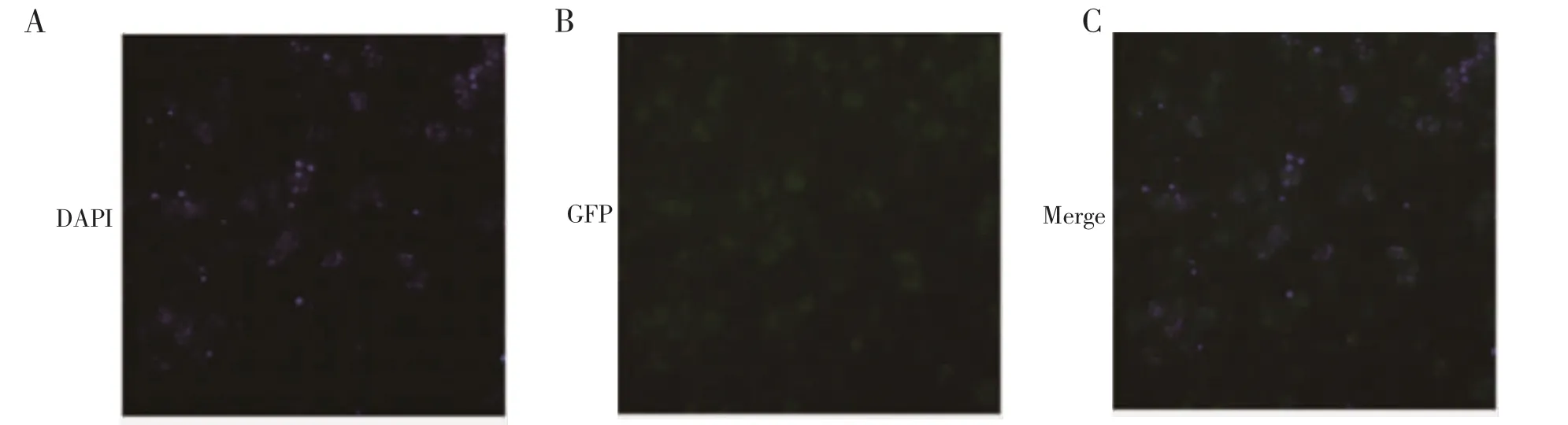
图5 荧光显微镜观察重组疟原虫表达GFPFig 5 Expression of GFP in recombinant Plasmodium observed by fluorescence
3 讨论
疟疾是由疟原虫感染引起的寄生虫病,主要传播媒介是按蚊[6]。疟原虫的生活史复杂,其与宿主之间的相互作用是疟原虫在哺乳动物和按蚊体内寄生的基础[6-8]。为了研究宿主-疟原虫间相互作用,基因修饰技术发挥了巨大的作用,包括对特定基因修改、删除和插入。基于同源重组原理的基因敲除技术在研究疟原虫特定蛋白功能方面发挥了重要的作用。此外,在改造特定基因序列的基础上,还可引入各种标签蛋白,特别是各种荧光蛋白,如将绿色荧光蛋白或生物荧光素酶(Luciferase)引入其基因组中,从而实现体内和体外实时追踪疟原虫及其与宿主之间的相互作用[9-10]。在研究特定蛋白的定位、转运及其与宿主间的相互作用等方面均起重要作用[11]。目前,绿色荧光蛋白应用较为广泛,除了可与特定蛋白融合表达研究该蛋白的定位等功能,还可以在疟原虫体内稳定持续表达,用于追踪疟原虫在各个阶段的寄生情况,例如用GFP 标记环子孢子蛋白可用于研究哺乳动物肝细胞和按蚊体内疟原虫-宿主间相互作用[12];对于胞浆稳定持续表达GFP 的疟原虫,可以直观地观察疟原虫发育和侵染的整个过程[13-15]。
本研究构建胞浆中表达GFP 的伯氏疟原虫。230p(PbANKA_0306000)是疟原虫基因组常用的一个改造位点,破坏疟原虫的230p不会产生任何表型[16]。因此,在230p基因处插入并表达GFP。本研究筛选获得的重组疟原虫可持续表达GFP,且不含耐药标签,可用于后续研究特定蛋白功能时再次进行基因改造,并可直观的观察疟原虫的侵染过程。此外,还可通过流式细胞术等方法检测重组疟原虫感染小鼠的虫血率并进行感染红细胞的分选;还可以根据荧光强度对疟原虫不同发育阶段进行分期,如滋养体、裂殖体和裂殖子等阶段,在模式识别软件的分析下实现自动化计数和分类。综上,本研究获得的胞浆表达GFP 的伯氏疟原虫为后续研究疟原虫特定蛋白功能及其致病机制提供了一个有力的工具。
