薄层色谱法分析苦豆子提取物中生物碱及黄酮类成分
2016-11-15李雪俐杨晓艺李建光
李雪俐,阳 莹,杨晓艺,李建光
(新疆医科大学药学院,乌鲁木齐 830011)
薄层色谱法分析苦豆子提取物中生物碱及黄酮类成分
李雪俐,阳莹,杨晓艺,李建光
(新疆医科大学药学院,乌鲁木齐830011)
目的建立苦豆子提取物薄层质量标准。方法采用硅胶薄层色谱法对苦豆子提取物中的生物碱类活性成分进行鉴别,以甲苯-丙酮-甲醇-氨水(8∶3∶0.2∶0.5)为展开剂,显色剂为改良碘化铋钾试液,白光下检视;采用聚酰胺薄膜层析色谱法对苦豆子提取物中的黄酮类活性成分进行鉴别,以微乳液为展开剂,先喷2-APB,后喷聚乙二醇400进行显色,紫外灯366 nm下检视。结果苦豆子提取物的生物碱供试品色谱图中,在与苦参碱、槐果碱、槐定碱对照品色谱相应的位置上,均显相同的橙色斑点,分离度好;黄酮供试品色谱图中有很多斑点,但没有相对应的对照品。 结论采用薄层色谱定性鉴别苦豆子提取物的主要生物碱成分为苦参碱、槐果碱、槐定碱;由于缺乏对照品,不能确定苦豆子提取物中的黄酮类成分具体是哪些物质。建立的薄层色谱方法简单易行,重现性好,为苦豆子提取物的质量标准提供了依据。
苦豆子;薄层色谱;生物碱;黄酮
苦豆子(Sophora alopecuroides L.)别名苦豆根、苦甘草等,是豆科(Leguminosae)槐属植物苦豆子的干燥全草、根及种子,生长于中亚、西亚一带和我国西北地区荒漠较潮湿的地带[1]。国内外学者已发现苦豆子中含有生物碱、黄酮、有机酸、氨基酸和多糖等成分[2-4],并发现其具有抗炎、免疫调节、抗肿瘤、治疗乙型肝炎的药理活性[5-11]。目前,关于薄层色谱法(TLC法)分析苦豆子成分的研究主要集中在对生物碱类活性成分的鉴别[12-16],为建立苦豆子药材质量控制提供了奠定基础。本研究建立了硅胶薄层色谱法分析苦豆子提取物中的生物碱类活性成分和聚酰胺薄膜层析色谱法分析苦豆子提取物中的黄酮类活性成分的方法,现报道如下。
1 仪器与试药
1.1仪器LINOMAT 5型半自动点样仪(瑞士CAMAG),REPROSTAR 3型薄层色谱数码成像系统(瑞士CAMAG),LINOMAT SYRINGE型 100 μL微量进样针(瑞士CAMAG),T6型紫外可见分光光度计(北京普析通用仪器有限责任公司),KQ3200DE型数控超声波清洗仪(昆山市超声仪器有限公司),BS110S型分析天平(北京赛多利斯天平有限公司),双槽展开缸(20 cm×10 cm),普通硅胶G板(青岛海洋化工有限公司),聚酰胺薄膜 (台州市路桥四甲生化塑料厂)。
1.2试药对照品:苦参碱(南京景竹生物科技有限公司,批号:JZ20141218),槐果碱(南京泽朗医药科技有限公司,批号:ZL20141128H),槐定碱(南京景竹生物科技有限公司,批号:JZ20141022),氧化苦参碱(南京景竹生物科技有限公司,批号:JZ20141108),氧化槐果碱(南京景竹生物科技有限公司,批号:JZ20140508),芦丁(中国药品生物制品检定所,批号:100080-200707),绿原酸(上海源叶生物科技有限公司,批号:B20782)。甲醇、氯仿、氨水、乙酸乙酯、无水乙醇、甲苯、丙酮、碘化钾、次硝酸铋、冰乙酸、盐酸、聚乙二醇400 、2-氨基乙基联苯基硼酸酯、乙酸乙酯、甲酸、正丁醇、十二烷基硫酸钠、正庚烷均为分析纯。苦豆子药材由新疆药物研究所提供,经新疆药物研究所何江副研究员鉴定为Leguminosae槐属植物苦豆子的干燥全草[0]。
2 方法与结果
2.1溶液的配制
2.1.1对照品溶液的制备精密称取苦参碱、槐果碱、槐定碱、氧化苦参碱、氧化槐果碱25 mg,分别置于25 mL容量瓶中,甲醇溶解并定容,制成l mg/mL对照品的溶液。取苦参碱、槐果碱、槐定碱对照品溶液适量,加甲醇制成0.3 mg/mL的生物碱混标溶液。取芦丁、绿原酸对照品各适量,加甲醇溶解,制成0.l mg/mL的混合对照品溶液。
2.1.2供试品溶液的制备苦豆子药材粗粉加入一定比例乙醇,回流提取3 次,每次1 h,合并滤液,65℃下减压回收乙醇,浓缩物经HPD500型大孔吸附树脂进行分离纯化,收集乙醇洗脱液,浓缩干燥,即得苦豆子提取物粉末。称取0.2 g苦豆子提取物粉末,加10 mL甲醇超声溶解,滤过,取滤液作为供试品溶液。称取苦豆子药材粉末0.5 g,加氯仿25 mL、氨水0.3 mL,超声提取30 min,蒸干,加氯仿2 mL溶解,滤过,取滤液作为供试品溶液。
2.1.3显色剂的制备改良碘化铋钾试液Ⅰ:取碘化铋钾试剂2 g,加冰乙酸20 mL,溶解后加50 mL水稀释,即得碘化铋钾试液。取碘化铋钾试液1 mL,加0.6 mol/L盐酸溶液2 mL,加水至10 mL,即得。改良碘化铋钾试液Ⅱ[17]:取次硝酸铋试剂0.85 g,加冰乙酸10 mL与水40 mL溶解后,加碘化钾溶液(4→10)20 mL,摇匀,即得碘化铋钾试液,取碘化铋钾试液1 mL,加0.6 mol/L盐酸溶液2 mL,加水至10 mL,即得。碘化铋钾试液:(1)称取次硝酸铋试剂0.85 g,加冰乙酸10 mL与水40 mL加热溶解。(2)称取碘化钾8 g,加水30 mL溶解。将(1)和(2)等量混合,即为原液。取原液1 mL,加冰醋酸2 mL和10 mL水,即得。鉴别黄酮类成分的显色剂[18]:取聚乙二醇400加乙醇制成每1 mL含50 mg的聚乙二醇400乙醇溶液;取2-氨基乙基联苯基硼酸酯(2-APB)加甲醇制成每1 mL含10 mg的2-氨基乙基联苯基硼酸酯甲醇溶液。显色时先喷2-APB,后喷聚乙二醇400。
2.2苦豆子提取物中生物碱类成分TLC条件的建立
2.2.1显色剂的选择选用改良碘化铋钾试液为显色剂。
2.2.2展开系统的选择将硅胶板放人105℃烘箱活化30 min,分别吸取对照品溶液各2 μL,苦豆子提取物供试品溶液3 μL,点于同一硅胶G薄层板上,以不同的展开系统分别展开,取出,晾干,喷以改良碘化铋钾试液,晾干后白光下检视。苦豆子提取物中未检视到氧化苦参碱和氧化槐果碱,检视出苦参碱、槐果碱和槐定碱。通过图中斑点数目、分离度和拖尾情况确定甲苯-丙酮-甲醇-氨水=8∶3∶0.2∶0.5为最佳展开系统,见图1。
2.2.3不同检视方式的考察分别吸取生物碱混标溶液5 μL和苦豆子提取物供试品溶液3 μL,点于同一薄层板上,以甲苯-丙酮-甲醇-氨水(8∶3∶0.2∶0.5)为展开系统,展开,取出,晾干,喷以显色剂,晾干,分别在白光、紫外光254 nm和366 nm处检视,见图2。
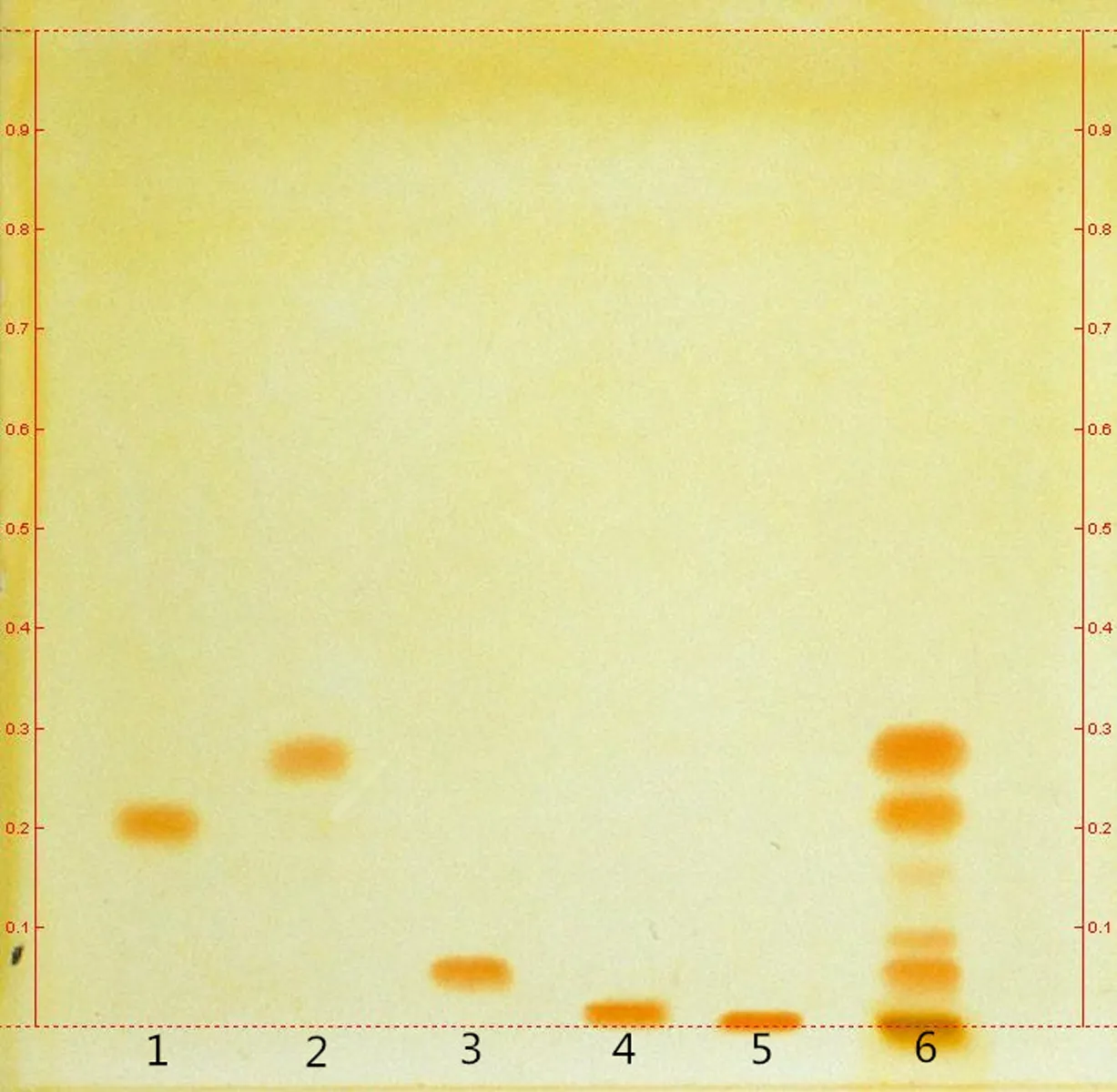
1:苦参碱;2:槐果碱;3:槐定碱;4:氧化苦参碱;5:氧化槐果碱;6:提取物
图1苦豆子提取物的TLC图
2.2.4不同点样量的考察分别吸取生物碱混标溶液和苦豆子提取物供试品溶液2、3、5、6、8、10 μL,点于同一硅胶G薄层板上,以甲苯-丙酮-甲醇-氨水(8∶3∶0.2∶0.5)为展开系统,展开,取出,晾干,喷以显色剂,白光下检视。通过斑点颜色和分离度确定混标溶液(每1 mL各含0.3 mg的混合对照品溶液)和供试品溶液(每1 mL含20 mg的供试品)点样量分别为6 μL 和8 μL,见图3。
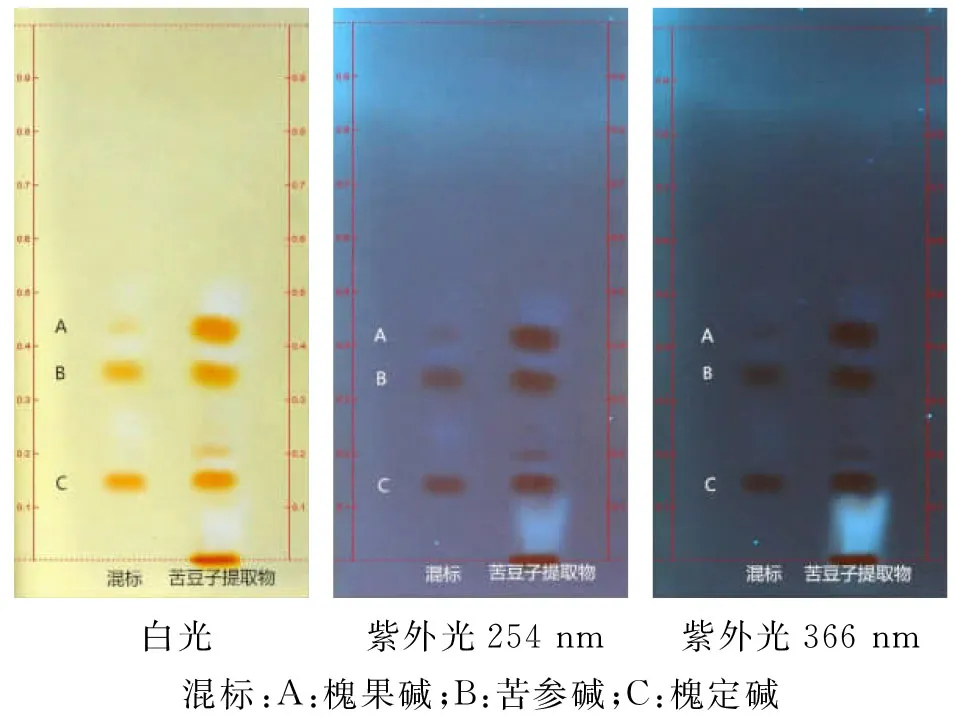
图2 不同检视方式下苦豆子提取物TLC图
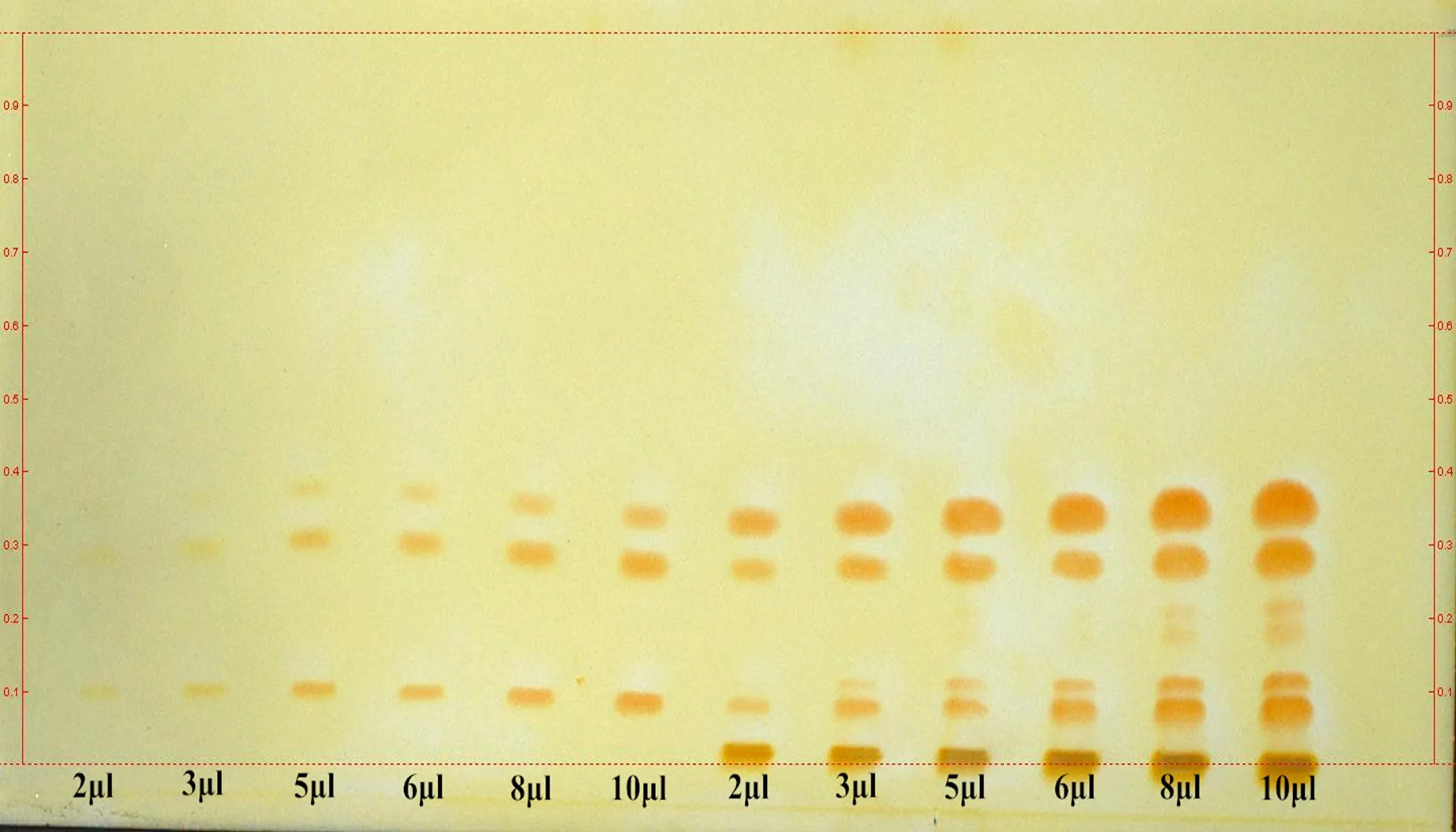
图3 对照品和苦豆子提取物不同点样量TLC图
2.2.5苦豆子提取物与药材中生物碱的指征分别吸取生物碱混标溶液6 μL,苦豆子提取物供试品溶液2 μL,苦豆子药材供试品溶液10 μL,分别点于同一硅胶G薄层板上,以甲苯-丙酮-甲醇-氨水(8∶3∶0.2∶0.5)为展开剂,展开,取出,晾干,喷显色剂,晾干,白光下检视。苦豆子提取物与药材供试品色谱图中,在与苦参碱、槐果碱、槐定碱对照品色谱相应的位置上均显相同的橙色斑点,见图4,Rf值见表1。
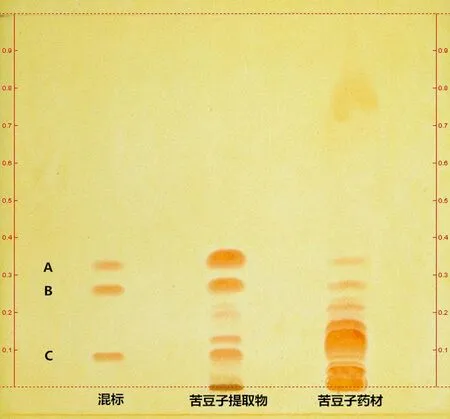
混标:A:槐果碱;B:苦参碱;C:槐定碱

名称混标提取物药材0.330.340.340.260.270.270.24Rf值0.220.220.170.130.120.080.090.08
2.3苦豆子提取物中黄酮类成分的TLC条件建立
2.3.1苦豆子提取物中黄酮类成分的硅胶薄层色谱研究将硅胶板放入105 ℃烘箱活化30 min,吸取生物碱混标溶液和苦豆子提取物供试品溶液各5 μL,分别点于同一硅胶G薄层板上,分别以乙酸乙酯-甲酸-冰醋酸-水=10∶1.1∶1.1∶2.6及甲苯-乙酸乙酯-甲酸=9∶7∶3展开系统展开,取出,晾干,喷以显色剂,在105 ℃加热5 min,在紫外灯366 nm处检视。未找到合适的展开系统,分离效果不好,无法分辨斑点位置,见图5。
2.3.2苦豆子提取物中黄酮类成分的聚酰胺薄膜层析色谱研究SDS-正丁醇-正庚烷质量比为0.27∶0.63∶0.10,搅拌溶解,混匀,放置24 h即得微乳液。吸取生物碱混标溶液和苦豆子提取物供试品溶液各5 μL,分别点于同一5 cm×10 cm聚酰胺薄膜上,以微乳液为展开系统展开,取出,晾干,喷以显色剂,先喷2-APB,后喷聚乙二醇400 ,晾干,置紫外光366 nm处检视。苦豆子提取物中大概有10个斑点,分离效果和硅胶薄层相比,聚酰胺薄膜层析色谱图各斑点分离较好,没有对应于绿原酸的斑点,对应于芦丁位置的斑点颜色不一致,见图6。

图5 不同展开系统下苦豆子提取物的TLC图

混标:A:绿原酸;B:芦丁
3 讨论
本研究用硅胶薄层色谱法对苦豆子提取物中的生物碱类活性成分进行鉴别,在硅胶薄层色谱条件考察过程中,先以文献方法分别以氯仿-甲醇-氨水、乙酸乙酯-乙醇-氨水为展开系统,分离度都较差,后以甲苯-丙酮-甲醇-氨水(8∶3∶0.2∶0.5)为展开系统,所用显色剂为2015版中国药典所述改良碘化铋钾试液,白光下检视,斑点清晰且分离度很好。对青岛海洋化工厂分厂和安徽良臣硅源材料有限公司生产的硅胶板进行比较,安徽良臣生产的硅胶板铺板较均匀,分离效果较好。苦豆子提取物与药材中,除了槐果碱、苦参碱、槐定碱之外,还含有其他未知生物碱成分,提取物中所含生物碱,药材中均有,说明来源正确,苦豆子药材经提取后,苦参碱和槐果碱成分得到浓缩,含量增加。建立硅胶薄层色谱法分析苦豆子提取物中的黄酮类活性成分,分别以乙酸乙酯-甲酸-冰醋酸-水、冰醋酸-水-正丁醇、甲苯-乙酸乙酯-甲酸为展开系统,但斑点模糊,分离度较差,后采用聚酰胺薄膜层析色谱法,微乳液中加入甲酸,供试品斑点模糊,无法分辨斑点位置,最后选择以微乳液(SDS-正丁醇-正庚烷质量比为0.27∶0.63∶0.10)为展开剂进行分离,分离度较好。苦豆子提取物中所含黄酮类成分的种类较多,以芦丁计,测得苦豆子提取物中总黄酮量为9.91%,但由于缺乏对照品,不能确定具体是哪些物质,所以利用绿原酸和芦丁来确定苦豆子提取物中斑点的相对位置。
[1]新疆维吾尔自治区食品药品监督管理局.维吾尔药材标准[M].乌鲁木齐:新疆人民卫生出版社,2010:84-90.
[2]刘静,罗维林.苦豆子生物碱现代药学研究进展[J].海峡药学,2014,26(9):1-4.
[3]Attaur R,Miqbal C,Khalid P,et a1.Quinolizidine alkaloids from sophora alopecuroides[J].J Nat Prod,2000,63(3):190-192.
[4]高兴军,王世华.超临界二氧化碳萃取苦豆子中生物碱的研究[J].中国科技成果,2011,11(1):28-30.
[5]李生虎,李勇,张永康.苦豆子生物碱的抗炎、镇痛活性试验探索[J].黑龙江科技信息,2015,18(11):47-49.
[6]牛彩琴,买文丽,张团笑.苦豆子总碱对家兔离体肺动脉血管作用机制的研究[J].时珍国医国药,2010,20(11):2910-2911.
[7]李圆,周雪华,刘亭彦,等.苦参碱对喉鳞癌细胞株Hep-2侵袭转移的影响[J].中国中西医结合外科杂志,2012,8(3):261-264.
[8]何娜娜,陆明,吕书勤,等.苦豆子提取物对裸鼠肠癌皮下移植瘤的抑制作用[J].新疆中医药,2012,30(6):31-33.
[9]栾迎春,王兵,张秀丽.苦豆子提取物体外抗肿瘤及抗紫外线辐射作用的研究[J].中外健康文摘,2012,9(1):218-220.
[10]刘军锋,丁泽,欧阳艳,等.苦豆子生物碱抗菌活性的测定[J].北京化工大学学报,2011,38(2):84-86.
[11]史伟,陈志国.苦豆子的开发与利用[J].草业与畜牧,2007,27(1):57-59.
[12]周星辰,李鹏,顾沛雯,等.TLC和HPLC法同时测定苦豆子总碱中槐定碱和苦参碱的体系优化[J].北方园艺,2014,37(18):41-43.
[13]毛艳,贺金华,黄华,等.苦豆子片定性定量方法研究[J].中国实验方剂学杂志,2012,18(20):81-83.
[14]辛任升,刘宇,梁剑平,等.苦豆子灌注剂质量的检测[J].动物医学进展,2015,36(5):55-58.
[15]木艾塔尔·努尔麦麦提,李敏,热娜·卡斯木,等.新疆苦豆子药材质量控制研究[J].新疆医科大学学报,2012,35(5):588-593.
[16]武静莲,姜林芬,吴红梅,等.紫归子妇炎康泡腾栓薄层鉴别分析[J].卫生职业教育,2015,33(17):100-101.
[17]国家药典委员会.中华人民共和国药典(四部)[M].北京:中国医药科技出版社,2015:322.
[18]Wagner H,Bladt S.Plant Drug Analysis:A thinlayerchromatography Atlas[D].Springer:University of Munich,1996.
(本文编辑施洋)
Determination of alkaloids and flavonoids in the extract of Sophora alopecuroides by TLC
LI Xueli,YANG Ying,YANG Xiaoyi,LI Jianguang
(College of Pharmacy,Xinjiang Medical University,Urumqi 830011,China)
ObjectiveTo establish the quality standard of the extract of Sophora alopecuroides by TLC.MethodsUsed silica gel thin layer chromatography for the identification of alkaloids in the extract of Sophora alopecuroides,took Toluene-acetone-methanol-ammonia (8∶3∶0.2∶0.5) as the agent,and modified bismuth potassium iodide solution as chromogenic agent,then observed under the white light.And the flavonoids in the extract of Sophora alopecuroides were identified by polyamide thin film chromatography,With microemulsion as the agent,firstly sprayed 2-APB,then sprayed polyethylene glycol 400 for color rendering,and observed under the UV-366nm.ResultsThe Alkaloids of Sophora alopecuroides extract samples in the chromatogram show the same orange spots corresponding to the positions of control samples of matrine,sophocarpine and sophoridine,which indicates better degree of separation for them,however there are many spots in the chromatogram of flavonoids,which are no corresponding controls.ConclusionFrom the above,a thin layer chromatography method was better to use for identifying the alkaloids and flavonoids in the extract of Sophora alopecuroides,and the main alkaloids are matrine,sophocarpine and sophoridine; but due to lack of corresponding controls,the specific substances of the flavonoids of Sophora alopecuroides extract can not be determined.The TLC method is easy to operate with good reproducibility,which provided the basis for the quality standard of the extract of Sophora alopecuroides.
Sophora alopecuroides; TLC; Alkaloids; Flavonoids
新疆维吾尔自治区科技支疆项目(201491187)
李雪俐(1993-),女,在读硕士,研究方向:药物分析。
李建光,男,博士,教授,博士生导师,研究方向:药物分析,E-mail:L77117@163.com。
R914
A
1009-5551(2016)11-1440-04
10.3969/j.issn.1009-5551.2016.11.023
2016-09-18]
