环磷酰胺联合强的松治疗儿童肾病综合征型紫癜性肾炎的疗效观察
2016-11-15阿迪力江喀日扎依旦艾力罗燕飞沙坎阿克纳依
阿迪力江·喀日,扎依旦·艾力,罗燕飞,沙坎·阿克纳依
(新疆医科大学第一附属医院儿科中心,乌鲁木齐 830054)
环磷酰胺联合强的松治疗儿童肾病综合征型紫癜性肾炎的疗效观察
阿迪力江·喀日,扎依旦·艾力,罗燕飞,沙坎·阿克纳依
(新疆医科大学第一附属医院儿科中心,乌鲁木齐830054)
目的探讨大剂量环磷酰胺(CTX)联合强的松治疗肾病综合征型紫癜性肾炎患儿的疗效。方法肾病综合征型HSPN患儿42例,按随机数字表法随机分为治疗组(23例)和对照组(19例),治疗组采用口服强的松片联合大剂量CTX冲击治疗,对照组仅口服强的松片治疗,评价CTX冲击治疗的效果。结果治疗组患儿的完全缓解率为65.2%,总体缓解率为95.7%,对照组患儿的完全缓解率为15.8%,总体缓解率为68.4%,治疗组完全缓解率及总体缓解率高于对照组,差异有统计学意义(P<0.05);通过14 w的治疗,两组的24 h尿蛋白、血尿素氮(BUN)、血肌酐(Scr)、总胆固醇(TC)和甘油三酯(TG)的水平均有不同程度下降,治疗组明显优于对照组(P<0.05);血浆白蛋白(ABL)水平均有不同程度上升,治疗组优于对照组(P<0.05);治疗组患儿的不良反应发生率亦明显低于对照组(P<0.05)。结论环磷酰胺冲击治疗儿童肾病综合征型紫癜性肾炎较单独采用强的松片口服效果好,且不良反应较少。
肾病型;紫癜性肾炎;环磷酰胺;糖皮质激素
过敏性紫癜(Henoch-Schoenlein purpura,HSP)是一类急性的小血管炎,常见的临床表现多为非血小板减少样皮疹、无关节畸形的关节炎、胃肠道受累和肾炎,通常伴有IgA沉积。HSP可发生于各个年龄段,平均发病年龄为6岁,90%发生于10岁以下的儿童[1]。有30%~50%的患者会累及肾脏而出现紫癜性肾炎(Henoch-Schoenlein purpura nephritic,HSPN),临床主要表现为血尿和蛋白尿,重症病例可表现为肾病综合征,同时可伴发有高血压和肾功能不全[1-2]。虽然多数的HSPN患者预后良好,但仍有1%~15%的患者会出现终末期肾病(ESRD)[3]。临床上儿童肾病综合征型的HSPN首选糖皮质激素治疗,但常出现对糖皮质激素不敏感和频复发的情况。对此2012年公布的KDIGO指南指出儿童肾病综合征型的HSPN在治疗过程中出现激素不敏感和频复发者可合并使用免疫抑制剂治疗,但目前诸多的免疫抑制剂治疗儿童HSPN的疗效参差不齐,同时还伴发诸多的毒副作用,使得临床中针对儿童肾病综合征型HSPN的治疗较为棘手。本研究选择新疆医科大学第一附属医院儿科2012年3月-2014年12月收治的肾病综合征型HSPN患儿42例,研究单纯糖皮质激素和糖皮质激素联合环磷酰胺(CTX)冲击治疗儿童肾病综合征型HSPN的疗效,现报道如下。
1 对象和方法
1.1研究对象选取我院儿科2012年3月-2014年12月收治的肾病综合征型HSPN患儿42例,按随机数字表法随机分为治疗组(23例)和对照组(19例)。纳入试验的所有HSPN患儿均符合肾病综合征型HSPN的诊断标准[4],两组患儿性别、年龄、外周血白细胞(WBC)计数、24 h尿蛋白定量、血浆白蛋白(ABL)、肾脏功能和血脂水平差异无统计学意义,见表1。
1.2方法对照组给予足量强的松片2 mg·kg-1·d-1口服,单日最大剂量<60 mg/d,清晨空腹条件下顿服,足量口服4 w后进入巩固维持阶段(尿蛋白缓解欠佳者足量激素口服时间可延长至8 w),改为隔日单次口服1~1.5 mg·kg-1·d-1,并维持口服3个月,同时辅助口服双嘧达莫片1~2 mg·kg-1·d-1,分3次口服。治疗组在对照组治疗的基础上加用CTX静脉点滴冲击治疗,CTX每次10 mg/kg加入0.9%生理盐水250 mL中静脉点滴,连用2 d为一个疗程,每隔3周重复1次,共6个疗程,最大累积量不超过150 mg/kg,自试验开始之日起强的松2 mg·kg-1·d-1,隔日清晨空腹顿服,并根据尿蛋白水平逐渐减量。在CTX治疗当日通过静脉给予水化及碱化疗法(10%葡萄糖注射液2 000 mL/m2,5%碳酸氢钠注射液2~3 mL·mg-1·d-1),同时鼓励患儿多饮水。

表1 治疗组和对照组治疗前相关指标的比较(±s)
1.3疗效评价完全缓解:水肿、紫癜、腹痛、关节痛等肾外症状消失;24 h尿蛋白定量<250 mg/24 h[5],尿红细胞计数<4.0万/mL或镜下血尿消失。部分缓解:肾外临床症状及体征消失或好转,24 h尿蛋白定量较开始治疗之前减少≥50%,同时尿红细胞计数较开始治疗之前减少≥50%。无效:未达到上述治疗目标或上述治疗症状加重。
1.4观察指标观察两组患儿是否出现皮肤紫癜、黑便、腹痛、关节痛、高血压等;同时检测2组患儿外周血白细胞(WBC)计数、24 h尿蛋白定量、ABL、肾脏功能(BUN、Scr)、血脂水平(TC、TG)和尿常规(镜下血尿)。

2 结果
2.1两组患儿缓解率的比较治疗组23例患儿中有15例获得完全缓解,7例部分缓解,1例无缓解,完全缓解率为65.2%,总体缓解率为95.7%;对照组19例患儿中有3例获得完全缓解,10例部分缓解,6例无缓解,完全缓解率为15.8%,总体缓解率为68.4%,治疗组的完全缓解率和总缓解率均高于对照组,差异均有统计学意义(P<0.05),见表2。
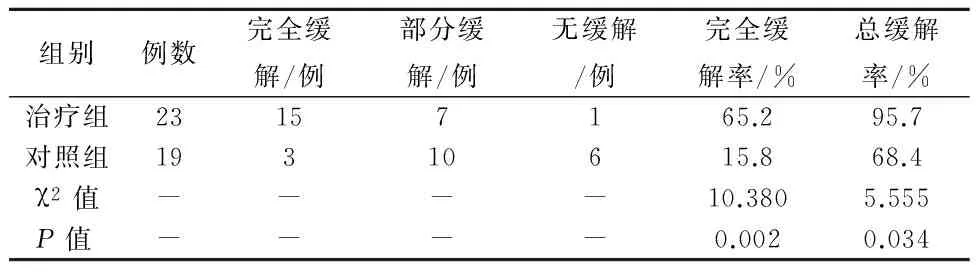
表2 治疗组和对照组患儿缓解率的比较
2.2两组患儿治疗前、后各项参考指标的比较治疗组和对照组治疗后24 h尿蛋白定量、Scr和TG水平均低于治疗前,ABL水平高于治疗前,差异有统计学意义(P<0.05),同时治疗组的效果明显优于对照组。治疗组中BUN和TC水平治疗后均有下降,差异有统计学意义(P<0.05),而对照组BUN、TC比较差异无统计学意义。两组治疗前、后的WBC计数差异均无统计学意义(P<0.05),见表3。

表3 治疗组和对照组患儿治疗前、后各指标的比较(±s)
注:与对照组比较,☆P<0.05;与治疗前比较,△P<0.05。
2.3两组治疗前、后肾外症状及其不良反应的比较治疗组和对照组分别出现5例(21.7%)和11例(57.9%)Cushing综合征(包括满月脸、水牛背、毛发粗重等),两组比较差异有统计学意义(P<0.05),提示使用大剂量CTX冲击治疗不容易发生Cushing综合征;治疗组和对照组中分别出现2例(8.7%)和5例(26.3%)血压增高现象,但两者差异无统计学意义(P>0.05);治疗14 w后治疗组和对照组仍分别有2例(8.7%)和10例(52.6%)镜下血尿,治疗组治疗效果优于对照组,差异有统计学意义(P<0.05);经过14 w的治疗所有患儿紫癜、黑便、腹痛和关节痛症状均未再出现,见表4。

表4 治疗组和对照组在治疗前后肾外症状及不良反应的比较/例
3 讨论
儿童HSP主要的病理改变是全身广泛性血管炎,可引发无痛样全身性皮疹,多发生于毛细血管分布广泛的皮肤、胃肠道及肾脏,其中对肾脏的损害尤为重要。国外一项研究发现HSP肾脏受累的发生率为20%~80%[6],其中有85%和97%的HSP患儿分别在皮疹出现后的4 w内和6个月内出现尿检异常,即血尿和(或)蛋白尿[2,7]。国内的研究称我国HSP患儿在4 w内和6个月内发生尿检异常的患病率分别为73.4%和96.7%,其中约有1/3的患儿有反复发作的皮疹和其他症状[8]。2007年由HSPN进展为ESRD的患儿占HSP患儿总人数的14.8%~21.0%,在所有需行肾脏替代治疗的患儿中由HSPN引起的患者人数占总数的1.5%[9],因此临床上应给予HSP患儿,尤其是HSPN患儿足够重视。
由于缺乏与HSPN治疗相关的长期随访数据,2012年KDIGO指南在HSPN患儿的预防和治疗方案选取上不推荐使用糖皮质激素来预防和控制HSPN,建议参照IgA肾病的治疗策略,而仅有低级别的询证医学证据认为在肾功能恶化的HSPN患儿中应用大剂量糖皮质激素和免疫抑制剂可改善肾功能[10]。对于肾病综合征型HSPN患儿,糖皮质激素已被普遍推广,同时多数临床试验均证实糖皮质激素能显著缩短已有肾脏损害的HSPN患儿的病程,并减轻肾外症状[11-12]。Weiss等[13]对15份前瞻性及回顾性的研究报告进行Meta分析后指出针对HSPN患儿早期使用糖皮质激素能有效降低肾脏受累发生的概率和减轻急性期的症状。近年来的临床试验提出针对临床表现为重度蛋白尿、急性肾炎综合征、肾病综合征、急进性肾炎型及病理呈弥漫性系膜增生伴新月体形成的重度HSPN病例,在给予糖皮质激素联合免疫抑制剂治疗后可获得显著效果[14-17]。基于HSP是由IgA介导的血管炎症,早期针对HSPN患儿使用糖皮质激素可抑制免疫炎症反应,加速血液和组织中免疫复合物的清除,有利于患者各项临床症状的控制。
本研究显示,两组患儿的年龄、性别、外周血WBC计数、24 h尿蛋白定量、肾功能指标和血脂水平比较差异无统计学意义,在进行了14 w的对比治疗后发现患儿在接受口服强的松片的同时接受CTX冲击治疗之后完全缓解率和总缓解率分别为65.2%和95.7%,均明显高于对照组。治疗组在降低尿蛋白含量、提升血浆白蛋白水平、改善血脂和肾功能的效果方面也同样优于对照组。在经过14 w治疗后治疗组镜下血尿的缓解率高于对照组。治疗组和对照组分别出现5例和11例的Cushing综合征,治疗组的发生率低于对照组,治疗组和对照组在治疗14 w后分别有2例和5例患儿出现无症状性血压增高,但差异无统计学意义。治疗组在CTX使用前、后未发现有明显的脱发和外周血WBC下降,未出现皮炎、口腔炎和膀胱炎病例,偶有恶心、呕吐症状,在给予针对消化道治疗后恶心、呕吐症状好转,提示在控制最大累积量和积极水化、碱化治疗后治疗组未出现与病情恶化相关的不良反应,在治疗前、后所有患儿紫癜、黑便、腹痛、关节痛的症状均消退且未在出现。
蛋白尿是一个己被证实的肾脏慢性病变的致病因素,本研究中治疗组尿蛋白的下降水平较对照组更显著,说明大剂量CTX冲击治疗可更有效减少尿蛋白,减轻对肾脏的进一步损害,进而改善肾脏功能。本研究显示,所有病例未发生严重的不良反应,鉴于观察时间短,尚不能有效评估CTX对儿童性腺的影像,但本组使用CTX的最大累积量(<150 mg/kg)未超过CTX对性腺损害的阈值(<300 mg/kg),故推测对性腺造成损害的可能性不大。
Flynn等[18]研究表明,对于肾病综合征型的HSPN患儿使用糖皮质激素联合CTX治疗可取得显著疗效,分析其机制可能与CTX和糖皮质激素分别作用于免疫细胞发育的不同阶段有关,糖皮质激素可直接作用于免疫系统的效应细胞,作用快速、短暂,CTX主要作用于免疫系统的定向干细胞,阻碍细胞的分化、增殖,对免疫细胞无直接作用,作用缓慢、持久,二者合用有“协同”和“驯化”作用,可以更好地发挥免疫调节作用[19]。Kawasaki等[20]报道37例病理Ⅳ级及以上、肾病水平蛋白尿的HSPN患儿,其中20例给予糖皮质激素联合尿激酶治疗,17例给予甲基泼尼松龙、尿激酶和CTX冲击治疗,随访6个月后加用CTX组的患儿的尿蛋白水平明显低于未使用CTX组;37例患儿再次行肾活检,发现加用CTX能有效降低病理Ⅳ级及以上患儿产生新月体和肾小球的硬化比例。根据针对全国40所医院的4 863例HSPN患儿所进行的临床、病例及治疗资料分析显示,不同医院在免疫抑制剂的选取上差异较大,但对于肾病综合征型的HSPN患儿使用激素联合CTX冲击治疗的比例较以往明显增加,取得的治疗效果令人满意[8]。
本研究结果表明糖皮质激素合并大剂量CTX冲击治疗肾病综合征型HSPN患儿疗效显著,近期不良反应少,因此认为此种治疗方案简单、有效。但本研究未结合HSPN患儿的病理分级进行进一步的疗效评估,且选取例数较少,同时治疗随访时间有限,其远期疗效仍需多中心、大样本的临床双盲对照试验进行长期随访的研究来评价。
[1]Saulsbury FT.Clinical update:Henoch-Schönlein purpura[J].The Lancet,2007,369(9566):976-978.
[2]Narchi H.Risk of long term renal impairment and duration of follow up recommended for Henoch-Schönlein purpura with normal or minimal urinary findings:a systematic review[J].Arch Dis Child,2005,90(9):916-920.
[3]Ronkainen J,Ala-Houhala M,Huttunen NP,et al.Outcome of Henoch-Schoenlein nephritis with nephrotic-range proteinuria[J].Clin Nephrol NLM,2003,60(2):80-84.[4]中华医学会儿科学分会肾脏病学组,儿童常见肾脏疾病诊治循证指南(二):紫癜性肾炎的诊治循证指南(试行)[J].中华儿科杂志,2009,47(12):911-913.
[5]胡亚美,江载芳,诸福棠实用儿科学[M].北京:人民卫生出版社,2005:424.
[6]Dillon MJ.Henoch-Schönlein purpura:recent advances[J].Clin Exp Rheumatol,2007,25(1 Suppl 44):S66-S68.
[7]Trnka P.Henoch-Schönlein purpura in children[J].J Paediatr Child H,2013,49(12):995-1003.
[8]全国儿童常见肾脏病诊治现状调研工作组,儿童紫癜性肾炎诊治现状多中心回顾性调查分析[J].中华儿科杂志,2013.51(12):881-887.
[9]Shenoy M,Bradbury MG,Lewis MA,et al.Outcome of Henoch-Schönlein purpura nephritis treated with long-term immunosuppression[J].Pediatric Nephrol,2007,22(10):1717-1722.
[10]Beck L,Bomback AS,Choi MJ,et al.KDOQI US commentary on the 2012 KDIGO clinical practice guideline for glomerulonephritis[J].Am J Infect Control,2013,62(3):403-441.
[11]Den Boer SL,Pasmans S,Wulffraat NM,et al.Bullous lesions in Henoch Schönlein purpura as indication to start systemic prednisone[J].Acta Paediatrica,2010,99(5):781-783.
[12]Ronkainen J,Koskimies O,Ala-Houhala M,et al.Early prednisone therapy in Henoch-Schönlein purpura:a randomized,double-blind,placebo-controlled trial[J].NLM,2006,149(2):241-247.
[13]Weiss PF,Feinstein JA,Luan X,et al.Effects of corticosteroid on Henoch-Schönlein purpura:a systematic review[J].Pediatrics,2007,120(5):1079-1087.
[14]Spasojevic′-Dimitrijeva B,Kosti M,Peco-Anti A,et al.Henoch-Schönlein purpura outcome in children:A ten-year clinical study[J].Srp Arh Celok Lek,2011,139(3-4):174-178.
[15]罗苇,冯仕品,王莉,等.蛋白尿表现的儿童紫癜性肾炎临床与病理分析[J].临床儿科杂志,2014,32(2):156-159.
[16]孙嫱,沈颖.儿童紫癜性肾炎的诊断,治疗与预后[J].临床儿科杂志,2011,29(4):307-310.
[17]朱光华,钮小玲,黄文彦.2012年KDIGO 紫癜性肾炎临床实践指南解读[J].中华实用儿科临床杂志,2013,28(17):1291-1293.
[18]Flynn JT,Smoyer WE,Bunchman TE,et al.Treatment of Henoch-Schönlein Purpura glomerulonephritis in children with high-dose corticosteroids plus oral cyclophosphamide[J].Am J Infect Control,2001,21(2):128-133.
[19]许云鹏,郭艳芳,儿童难治性肾病综合征的治疗进展[J].中华临床医师杂志:电子版,2014(23):4270-4273.
[20]Kawasaki Y,Suzuki J,Suzuki H.Efficacy of methylprednisolone and urokinase pulse therapy combined with or without cyclophosphamide in severe Henoch-Schoenlein nephritis:a clinical and histopathological study[J].Nephrol Dial Transpl,2004,19(4):858-864.
(本文编辑杨晨晨)
Effect of combination therapy of cyclophosphamide and prednisone on children patients with nephritic syndrome purpuric nephritis
Adilijiang Kari,Zhayidan Ali,LUO Yanfei,Shakan Akenayi
(Department of Pediatrics,the First Affiliated Hospital of Xinjiang Medical University,Urumqi 830054,China)
ObjectiveTo investigate the effect of cyclophosphamide (CTX) and prednisone combination therapy on children with nephritic syndrome purpuric nephritis (NSPN).MethodsThe NSPN patients were randomly divided into treatment group and control group.The treatment group was adopted oral prednisone tablets combined with high-dose CTX therapy while the control group was only adopted oral prednisone tablets to further evaluate the effect of CTX on the treatment of shock.ResultsThe complete remission rate of the treatment group and the control group were 65.2% and 15.8% respectively,and the overall response rate of the treatment group and the control group were 95.7% and 68.4% respectively,which there were significant difference between the two groups (P<0.05,P<0.01).After 12 weeks,24 h urinary protein,blood urea nitrogen (BUN),serum creatinine (Scr),total cholesterol (TC) and triglyceride (TG) levels of the two groups were decreased,and albumin (ABL) levels were increased to various degrees,moreover based on those data,the experimental group indicated significantly better than the control group (P<0.05),the adverse reaction in the treatment group was obviously lower than that of the control group (P<0.05).ConclusionCyclophosphamide plus prednisone therapy in treatment of NSPN children is relatively better than prednisone alone therapy,and less adverse reactions occurrence.
Nephritic Syndrome; Henoch-Schonlein Purpura Nephritis; Cyclophosphamide; Prednisone
新疆医科大学第一附属医院青年专项科研基金(20110805-8)
阿迪力江·喀日(1983-),男(维吾尔族),硕士,主治医师,研究方向:小儿危重症疾患、早期肾损伤及血液净化。
沙坎·阿克纳依 ,男(哈萨克族),副主任医师,研究方向:小儿内分泌疾病及儿科危重症,E-mail:shakan112@sina.com.cn。
R726.9
A
1009-5551(2016)11-1416-05
10.3969/j.issn.1009-5551.2016.11.017
2015-12-02]
