胃癌患者术后肠内营养支持时机探讨
2016-11-15姚俊英
李 倩,韩 丁,姚俊英,范 旻
(新疆维吾尔自治区人民医院临床营养研究所,乌鲁木齐 830000)
胃癌患者术后肠内营养支持时机探讨
李倩,韩丁,姚俊英,范旻
(新疆维吾尔自治区人民医院临床营养研究所,乌鲁木齐830000)
目的探讨胃癌患者术后应用早期肠内营养支持的恰当时机。方法选择行胃癌根治手术治疗的患者150例,随机分成 A、B、C组3 组,每组50例,分别于手术后12 h开始肠外营养(PN)支持,术后24、36、48 h给予肠内营养(EN)支持,其中A组、B组为试验组,C 组为对照组。比较3组患者术后的营养恢复状况及肠蠕动恢复、肛门排气、排便时间及并发症的发生情况。结果手术后2 w BMI较术前变化不大,TSF、PA、ALB、HB、TLC有明显改善,与术前1周相比,差异有统计学意义(P<0.05),与C组相比,A组、B组术后肠蠕动恢复时间缩短,肛门排气时间提前(P<0.05),A组和B组腹泻人数明显增加(P<0.05),3组吻合口瘘及切口感染发生率差异无统计学意义(P>0.05)。结论胃癌术后12 h可以行早期肠内肠外营养支持,但是过早肠内营养支持腹痛、腹胀等不良反应发生率高,视病情推后肠内营养支持时间,更利于术后肠道功能的恢复。
胃癌;肠内营养;肠外营养
营养治疗对于胃癌患者术后提供能量、免疫调控、维护胃肠功能和结构、降低炎症反应等一系列的作用得到了医学界广泛认可,20世纪60年代肠外营养(PN)首先应用于临床,其不经过消化系统的营养方式受到外科医生青睐,成为胃癌手术后患者首选的营养治疗方案。20世纪90年代,有研究证明胃癌术后早期开始肠内营养(EN)治疗也是必需的,肠内营养(EN)具有符合生理、减少并发症和降低治疗费用等多种益处[1-2]。但是对于肠内营养治疗的起始时间目前尚未有统一定论[3-4]。恰当地选择肠内营养(EN)的起始时间,已经成为胃癌患者术后的首要解决问题。本研究对新疆维吾尔自治区人民医院2014年1月-2015年4月共150例胃癌术后患者均采用PN、EN联合营养治疗的方式进行分析,探讨联合肠内肠外营养支持时肠内营养应用的恰当起始时间。
1 资料与方法
1.1一般资料选择2014年1月-2015年4月新疆维吾尔自治区人民医院行胃癌根治手术患者150例,其中男性82例,女性68例,年龄20~70岁,平均年龄54.7岁,均行胃大部切除术或胃十二指肠根治术,完成消化道的重建。患者随机分成A、B和C组,每组50例。其中A组男性27例,女性23例; B组男性28例,女性22例;C组男性24例,女性26例; 3组年龄、性别比差异无统计学意义(P>0.05),具有可比性。
1.2营养支持方式150例患者均采用PN、EN联合营养治疗方式,患者术中放置鼻空肠营养管,术后生命体征基本正常、血流动力稳定12 h开始PN支持,EN支持分别在24、36、48 h后给予,EN由新疆维吾尔自治区人民医院临床营养研究所统一配置,选用要素型制剂,蛋白质水解物以短肽型为氮源(百普素,纽迪希亚公司)。EN开始第1天给予剂量200 mL,浓度为1/4(即0.25 Kcal/mL),采用营养输注泵空肠泵入,速度30 mL/h;EN开始后第2天,无腹胀、腹痛等不适的继续给予EN支持,增加液量至300 mL,浓度不变,营养输注泵速度调整为50 mL/h;EN开始后第3天,增加液量至500 mL,浓度调整增加至1/3(即0.3 Kcal/mL),营养输注泵速度调整为50 mL/h;EN开始后第4天,液量暂仍为500 mL,浓度增加至1/2浓度(即0.5 Kcal/mL),营养输注泵速度调整为60 mL/h;EN开始后第5天,增加液量至750 mL,浓度1/2不变(即0.5 Kcal/mL),营养输注泵速度调整为70 mL/h;EN开始后第6天,液量750 mL,浓度调整为正常(即1.0 Kcal/mL),营养输注泵速度调整为80 mL/h;EN开始后第7天,增加液量至1 000 mL,浓度正常(即1.0 Kcal/mL),营养输注泵速度调整为80 mL/h不变;EN开始后第8、9、10天,保证EN支持1 000 mL,浓度正常,调整营养输注泵速80 mL/h逐渐至100 mL/h。
1.3观察指标手术前、后营养状况选用2套指标进行评估:(1)手术前、后测量身高、体质量,计算体质指数(BMI)及皮折厚度(TSF);(2)手术前、后空腹抽取静脉血,监测血清前白蛋白(PA)、血清白蛋白(ALB)、血红蛋白(HB)及淋巴细胞计数(TLC),比较3组患者术后肠蠕动恢复,肛门排气、排便时间及切口愈合、感染以及腹部不适的发生情况。

2 结果
2.13组患者手术、前后营养指标的变化A、B、C3组患者均手术顺利,术后1 w的生命体征稳定,手术后2 w BMI较术前变化不大,TSF、PA、ALB、HB、TLC有明显改善,与术前1 w相比,差异有统计学意义(P<0.05),见表1。

表1 3组患者手术前、后营养指标的变化(n=150,±s)
注:与术前1周比较,*P<0.05。
2.23组患者手术后胃肠道功能恢复情况与C组相比,A和B组胃肠功能恢复加快,肠蠕动恢复时间缩短,首次肛门排气时间提前(P<0.05) 。与A组相比,B组的胃肠功能并没有明显减慢,肠蠕动时间差异无统计学意义(P>0.05) ,首次肛门排气时间差异无统计学意义(P>0.05),见表2。
2.33组患者术后并发症情况和C组相比,A组、B组患者腹泻人数明显增加,差异有统计学意义(P<0.05);3组患者切口愈合基本良好,B、C组切口感染、吻合口瘘均有发生,但3组比较差异无统计学意义(P>0.05),见表3。

表2 3组患者手术后胃肠道功能恢复情况(h,±s)
注:与C组比较,*P<0.05。
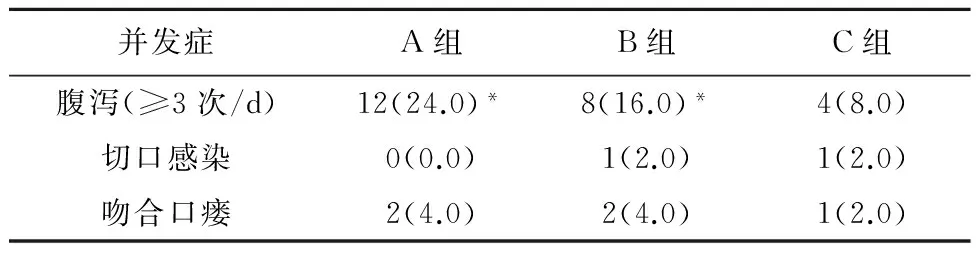
表3 3组患者术后并发症发生率的比较/例(%)
注:与C组比较,*P<0.05。
3 讨论
认识胃癌术后患者代谢与营养状态的改变,掌握恰当的营养支持原则与方法,是实现有效营养治疗的保障。肠外营养支持可以快速达到患者所需能量,但长期使用可加重或导致肿瘤患者的代谢紊乱、器官损害,其中长期的禁食水和胃肠道闲置会导致胃肠道功能的衰退,2009年美国肠内肠外营养学会发表的相关指南建议,在可以进行或者是部分进行肠内营养支持的时候,不建议行完全的肠外营养支持疗法[5-6]。肠内营养在恢复肠道蠕动、保护肠道黏膜屏障、抑制细菌异位中的作用是肠外营养不可比拟的。但肠内营养易引起胃肠道并发症,约10%~20%的患者发生恶心、呕吐、腹泻、腹胀或便秘。恶心、呕吐多由胃排空功能障碍、肠麻痹等疾病相关因素及温度过低、气味难闻、脂肪比例高、乳糖含量高等 EN制剂相关因素,输注速度过快引起;腹泻的发生在使用EN 高渗液中最常见,其次可见于因疾病本身肠道对水份吸收障碍或分泌过多、乳糖不能耐受、EN 液温度过低,也不排除营养液污染,均限制肠内营养的广泛应用。此外,部分患者胃肠道吻合口瘘的存在会限制肠内营养的应用[7-8]。因此需较长时间营养支持者应设法应用EN,而营养需要量较高或期望短期改善营养状况时可联合使用PN。
行消化道手术后,小肠的吸收功能在术后6~12 h即开始恢复[9]。《临床诊疗指南·肠外肠内营养学分册》指出在术后早期即可开始EN支持。本研究认为,EN 可以维护肠黏膜屏障作用,维持肠道免疫功能,促进肠蠕动,使胃肠功能及早恢复。本研究结果显示,A 组患者的肠道蠕动、排气、排便时间均早于B、C组(P<0.05),说明EN早期使用可以缩短患者的排气、排便时间,能更快促进患者消化道功能的恢复,这与陶芝英等[10]的研究结果是一致的。因胃癌患者术前饮食摄入不足等因素影响,均存在营养不良,3组患者术后1 w营养指标较术前比较差异无统计学意义(P>0.05),术后2 w 3组患者的PA、HB、ALB均高于术前水平,说明营养支持促进蛋白合成方面有非常重要的优势,但蛋白质合成是有一定周期的,盲目的认为营养支持无提升蛋白质的作用都是片面的。
本研究结果显示,多数患者可耐受EN,但A组患者发生腹泻、腹胀等不耐受情况较B、C组都要多,作者认为患者对EN的不适反应应作为营养支持策略实施的重要因素,不能盲目按照理论过早、过快增加肠内营养液剂量及速度以期达到过高的能量需要。在临床应用中,进行营养支持治疗应对患者进行监护,发生不耐受情况应及时予以对症治疗,能量过低可增加PN供给,避免通过快速EN支持而加重胃肠道负担。3组患者吻合口瘘、切口感染发生率比较差异无统计学意义(P>0.05),这可能和胃癌患者手术方式、年龄及胃癌分期、肿瘤转移等因素有关。
综上所述,胃癌患者术后联合EN、PN是安全、有效的。早期行EN支持有助于患者肠道功能恢复,对于出现严重腹泻、EN不耐受患者及时调整支持策略,视情推后肠内营养支持时间,更利于术后肠道功能的恢复,使EN更好应用于临床。
[1]黎介寿.胃肠道外瘘[J].中华外科杂志,1978,28(4):214-216.
[2]Ziegler TR.Parenteral nutrition in the critically ill patient[J].N Eng J Med,2009,361(10):1088-1097.
[3]陈娟,王玉珍.肠内营养支持治疗对重症肝硬化患者肝功能的影响[J].河北医药,2009,12(6):202-203.
[4]周伯良.术后早期肠内免疫营养对结肠癌患者的影响[J].中国现代普通外科进展,2013,16(10):828-830.
[5]Kondrup J,Allison SP,Elia M,et al.ESPEN guidelines for nutrition screening 2002[J].Clin Nutr,2003,22(4):415-421.
[6]Kreymann KG,Berger MM,Deutz NE,et al.ESPEN Guidelines on Enteral Nutrition:Intensive care[J].Clin Nutr,2006,25(2):210-223.
[7]曹恒昌,范昭,王永建,等.胃造口双管法治疗食管手术术后吻合口瘘的疗效观察[J].中国临床实用医学,2009,3(12):77-78.
[8]洪书剑,顾国胜,任建安,等.肠内营养对长期禁食肠瘘患者肠粘膜上皮内淋巴细胞及粘液屏障功能的研究[J].中华胃肠外科杂志,2006,9(6):527-529.
[9]Heighes PT,Doig GS,Sweetman EA,et al.An overview of evidence from systematic reviews evaluating early enteral nutrition in critically ill patients:more convincing evidence is needed[J].Anaesth Intensive Care,2010,38(1):167-174.
[10]陶芝英,李刚.胃癌术后早期肠内营养与肠外营养的疗效比较[J].中国医药导报,2013,10(25):28-30.
(本文编辑王艳)
Discussion on timing of enteral nutrition support in postoperative patients with gastric cancer
LI Qian,HAN Ding,YAO Junying,FAN Min
(Institute of Clinical Nutrition,The Xinjiang Uygur Autonomous Region People's Hospital,Urumqi 830000,China)
ObjectiveTo explore the appropriate time of postoperative early enteral nutrition support for gastric cancer patients.Methods150 cases of gastric cancer radical surgery patients were randoely divided into A,B,group C 3 groups,50 cases in each group,respectively.Parenteral nutrition (PN) support was initiated at 12 h postoperatively,then the patients in group A,group B and group C were given the enteral nutrition (EN) support after 24,36 and 48 h postoperatively,respectively.Group A and group B are the experimental groups,while group C was the control group.The nutritional status and recovery of peristalsis,anal exhaust,defecation time and complication were compared among the three groups.ResultsCompared with group C,the recovery time of peristalsis in group A and B was shortened and the duration of anal exhaust was shortened,but the incidence of abdominal pain was increased in group A and B (P <0.05) (P> 0.05).The incidence of anastomotic fistula and wound infection was not statistically significant (P> 0.05).ConclusionThe early enteral parenteral nutrition support can be implemented at 12 h after resection of gastric cancer,,but too early enteral nutrition may raise the incidence of abdominal pain,abdominal distension and other adverse reactions Depending on the condition,postponing the enteral nutrition support time is more conducive to the recovery of postoperative intestinal function.
gastric; enteral nutrition;parenteral nutrition
十二五科技支撑计划(2012BA135B03)
李倩(1984-),女,本科,主治医师,研究方向:临床营养。
姚俊英,女,副主任医师,研究方向:临床营养,E-mail:yaojunyingxj@163.com。
R735.2
A
1009-5551(2016)11-1386-03
10.3969/j.issn.1009-5551.2016.11.008
2016-03-23]
