腹腔镜下射频消融术在肝癌患者中的临床应用价值及其对血清血管内皮生长因子和基质金属蛋白酶-2的影响*
2016-11-15张前进胡伯年裴俊烽李博
张前进,胡伯年,裴俊烽,李博
(1.绍兴文理学院附属医院 肿瘤外科,浙江 绍兴 312000;2.浙江省人民医院 放疗科,浙江 杭州 310014)
腹腔镜下射频消融术在肝癌患者中的临床应用价值及其对血清血管内皮生长因子和基质金属蛋白酶-2的影响*
张前进1,胡伯年1,裴俊烽1,李博2
(1.绍兴文理学院附属医院 肿瘤外科,浙江 绍兴 312000;2.浙江省人民医院 放疗科,浙江 杭州 310014)
目的 探讨腹腔镜下射频消融术(LRFA)在肝癌患者中的临床应用价值及其对血清血管内皮生长因子(VEGF)和基质金属蛋白酶-2(MMP-2)的影响。方法 收集2012年1月-2013年12月该院收治的晚期原发性肝癌患者120例,将患者随机分为LRFA组和对照组。LRFA组患者采用LRFA治疗后,继续采用FOLFOX4方案化疗;对照组仅采用PIAF方案化疗。主要观察指标为健康相关生存质量(HRQL)、实体瘤疗效评价(RECIST)等级、无进展生存期和2年死亡率;次要观察指标为血清VEGF和MMP-2水平。结果 与对照组相比,LRFA组患者病情进展率明显降低(28.33% vs 50.00%,P =0.015);无进展生存期明显延长(500 d vs 380 d,P =0.013);临床干预后6个月时HRQL明显增高[(80.33±5.84) vs (65.87±9.59),P =0.000];临床干预后7、14和28天以及6个月时VEGF明显降低(P值均为0.000);临床干预后14和28天以及6个月时MMP-2明显降低(P值分别为0.003、0.001和0.000)。结论 LRFA明显改善了肝癌患者临床预后,并显著降低患者VEGF、MMP-2水平。
肝癌;血管内皮生长因子;基质金属蛋白酶-2;腹腔镜下射频消融术
原发性肝癌在全世界范围内发病率呈逐年上升趋势,虽然经过国内外学者多年的努力,但死亡率仍高居不下[1]。晚期肝癌患者1年生存率不足50.00%,即使早中期肝癌患者其5年生存率也不足70.00%[2-3]。部分肝癌患者就诊时,已属于肝癌晚期,失去了手术机会[4]。2014年日本肝病学会(Japan Society of Hepatology,JSH)治疗指南建议对于晚期肝癌患者采用化疗为主的综合治疗方案[5]。腹腔镜下射频消融术(laparoscopic radiofrequency ablation,LRFA)是近年来发展的一种新型治疗方案[6]。研究显示:与姑息性切除术相比,LRFA明显降低了患者手术时间和平均住院时间等,但未增加患者死亡率[7-8]。而2015年在一项孤立性肝癌患者中的研究显示与肝切除术相比,射频消融术(radiofrequency ablation,RFA)显著增加了患者术后复发率[9]。另外,研究发现血清血管内皮生长因子(vascular endothelial growth factor,VEGF)和基质金属蛋白酶-2(matrix metalloproteinase-2,MMP-2)与肝癌的发生、发展明显相关[10],但目前尚未有研究探讨LRFA对肝癌患者血清VEGF和MMP-2的影响。本研究旨在探讨LRFA在肝癌患者中的临床应用价值,并同时研究其对血清VEGF和MMP-2的影响。
1 资料与方法
1.1 一般资料
本研究的研究对象为2012年1月-2013年12月我院收治新发现的Ⅳ期原发性肝癌患者。纳入标准:①Ⅳ期(TNM分期)原发性肝癌;②30~65岁;③肝内病灶数目在3个以内;④同意参与本研究。排除标准:①随访期间失访;②继发性肝癌;③原发性脏器功能不全;④预计生存期不足6个月;⑤肝性脑病;⑥肝功能Child-Pugh分级B、C级;⑦入院时于外院接受过手术、肝动脉栓塞或化疗等治疗;⑧凝血功能障碍;⑨大量腹腔积液;⑩白细胞小于3×109/L或血小板小于100×109/L。经严格的纳入标准和排除标准筛选后,共纳入120例,按完全随机数字表原则(1∶1)将患者随机分为LRFA组和对照组,每组60例。其中,LRFA组患者男35例,女25例,年龄为(47.15±9.55)岁,3例直系亲属有肝癌病史,肝内肿块数目为(2.00±0.78)个,肿瘤直径≥5 cm的28例,<5 cm的32例,12例合并门脉癌栓,46例合并腹腔淋巴结额转移,23例合并远处转移,39例合并肝内转移,入院时卡氏评分(Karnofsky,KPS)为(78.65±6.13)分,甲胎蛋白(alpha-fetal protein,AFP)为(446.35±250.88)μg/L;对照组患者男34例,女26例,年龄为(46.15±10.03)岁,2例直系亲属有肝癌病史,肝内肿块数目为(2.03±0.80)个,肿瘤直径≥5 cm的25例,<5 cm的35例,14例合并门脉癌栓,42例合并腹腔淋巴结额转移,21例合并远处转移,42例合并肝内转移,入院时KPS为(80.03±6.17)分,AFP为(418.42±249.26)μg/L;两组患者入院时性别、年龄、家族史、肝内肿块数目、肿瘤直径、转移部位、KPS和AFP水平差异均无统计学意义(P>0.05),具有可比性。所有患者对本研究均知情同意并签署知情同意书,本研究通过我院伦理委员会批准。
1.2 治疗方案
①LRFA组:入院后完善相关检验检查后,采用LRFA治疗,治疗完毕继续采用FOLFOX4方案化疗(亚叶酸钙200 mg/m2静脉滴注2 h,第1和2天;奥沙利铂85 mg/m2静脉滴注2 h,第1天;5-氟尿嘧啶400 mg/m2静脉推注,然后600 mg/m2持续静滴22 h,第1和2天。2周为1疗程,6个疗程);②对照组:入院后完善相关检验检查后,采用PIAF方案化疗(顺铂、干扰素α-2b、多柔比星和氟尿嘧啶)。
1.3 数据收集和疗效评价系统
①基础数据包括入院当天的性别、年龄、家族史、肝内肿瘤数目、肿瘤直径、转移部位、KPS和AFP。主要观察指标为两组患者入院时、临床干预后6个月健康相关生存质量(health related quality oflife,HRQL)、临床干预后6个月时实体瘤疗效评价(response evaluation criteria in solid tumour,RECIST)等级、无进展生存期和2年死亡率。次要观察指标为入院时、临床干预后1、3、7、14和28 d以及6个月时VEGF和MMP-2水平;②RECIST:根据RECIST 1.0系统,于入院后6个月评价临床疗效。完全缓解定义为病灶消失持续4周以上;部分缓解定义为病灶最大直径缩小30.00%达4周以上;疾病稳定定义为介于部分缓解和病情进展之间;病情进展定义为病灶直径增加20.00%以上或发现新的病灶;③无进展生存期:开始接受治疗以后至肿瘤开始进展或者死亡的时间段为无进展生存期;④VEGF和MMP-2检测:取清晨空腹血,离心后取血清采用双抗体夹心酶联免疫吸附测定法(enzyme linked immunosorbent assay,ELISA)检测患者血清VEGF和MMP-2水平。VEGF和MMP-2试剂盒购自美国LIFEKEY生物医学技术公司;酶联免疫检测仪为DG5031,购自南京华东电子集团。
1.4 统计学方法
本研究采用SPSS 22.0软件完成统计分析。符合正态分布的计量资料用均值±标准差(±s)表示,使用t检验进行统计分析;计数资料使用χ2检验进行统计分析并用组内百分比表示。无进展生存期使用生存函数分析,用Wilcoxon检验比较两两之间差异并以中位生存期表示。P <0.05为差异有统计学意义(双侧检验)。
2 结果
2.1 两组患者临床干预后6个月时RECIST等级
经积极治疗临床干预6个月后两组患者无1例获得完全缓解;LRFA组部分缓解率有所增高,但差异无统计学意义(41.67% vs 30.00%,P =0.183);病情稳定率差异无统计学意义(30.00% vs 20.00%,P =0.206);病情进展率明显降低(28.33% vs 50.00%,P =0.015)。见表1。治疗结束后,所有患者病情逐渐开始恶化,无1例患者获得临床痊愈。部分缓解和病情稳定的患者在此期间并未接受其他特殊治疗;对照组有1例病情进展的患者因肝癌破裂小量出血,经保守治疗后稳定。
2.2 两组患者主要临床预后
与对照组相比,LRFA组患者无进展生存期明显延长(500 d vs 380 d,P =0.013)。见图1(采用Wilcoxon检验分析两组患者无进展生存期的差异)。两组患者入院时HRQL差异无统计学意义 [(77.88±5.99)vs(76.67±4.86),P =0.224];LRFA组患者临床干预后6个月时HRQL明显增高[(80.33±5.84)vs(65.87±9.59),P =0.000];2年死亡率有所降低,但差异无统计学意义(30.00% vs 38.33%,P =0.336)。见表2。
2.3 两组患者的VEGF、MMP-2变化趋势
两组患者入院时、临床干预后1和3天时VEGF差异无统计学意义(P值分别为0.707、0.353和0.070)。与对照组相比,LRFA组临床干预后7、14和28天以及6个月时,VEGF明显降低(P值均为0.000)。见图2。两组患者入院时、临床干预后1、3和7天时MMP-2均差异无统计学意义(P >0.05)。与对照组相比,LRFA组患者临床干预后14和28天以及6个月时MMP-2明显降低(P <0.05)。见图3。
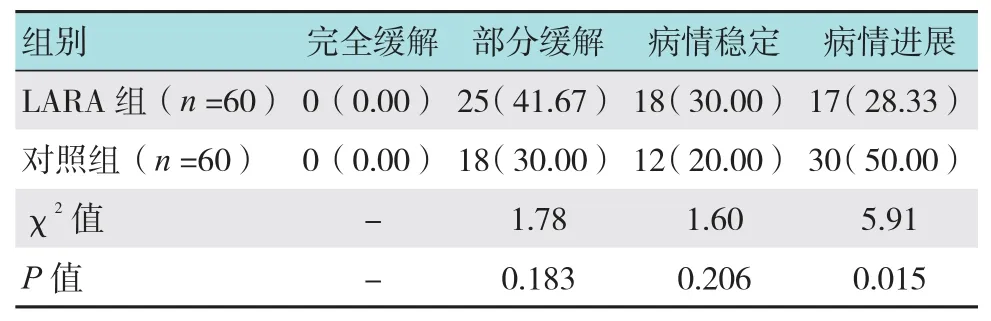
表1 两组患者临床干预后6个月后RECIST等级 例(%)
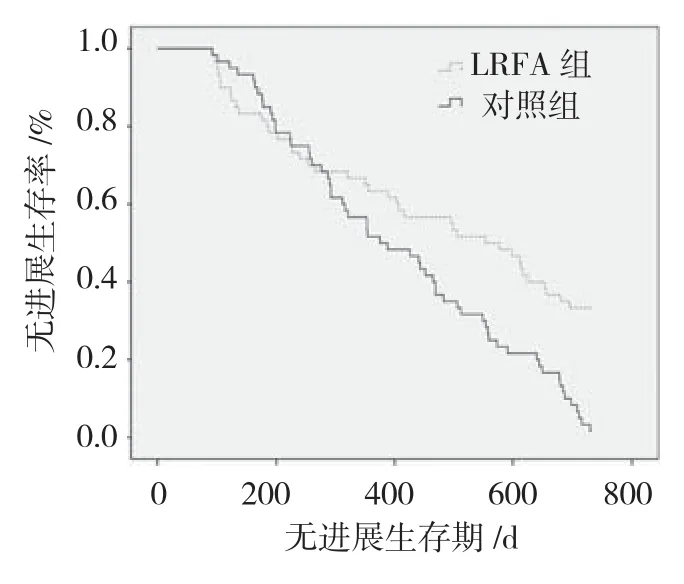
图1 两组患者无进展生存期

表2 两组患者生存质量和2年死亡率比较
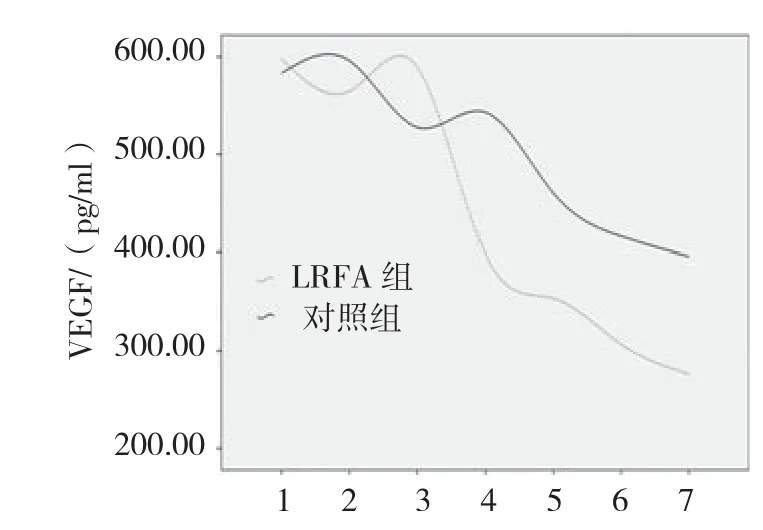
图2 两组患者不同时间点VEGF比较
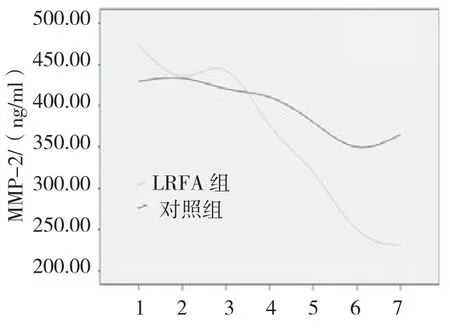
图3 两组患者不同时间点MMP-2比较
3 讨论
对Ⅳ期原发性肝癌患者常用的治疗方法为姑息性肝癌切除术、新辅助化疗、肝动脉栓塞化疗和LRFA等[11],均具有一定的禁忌证和毒性反应[12-13]。为防止患者对治疗方案不耐受而终止治疗,本研究将全身状况较差的患者排除(见排除标准)。本研究主要治疗时间约6个月,将预计生存期不足6个月的患者排除。为排除外院治疗对本研究的影响,将入院时于外院接受过肝癌切除术、肝动脉栓塞或化疗等治疗的患者排除。在此基础上,为探讨LRFA在肝癌患者中的临床应用价值及其对血清VEGF和MMP-2的影响,笔者设计了本研究。结果发现LRFA组患者术后6个月时病情进展率明显降低(28.33% vs 50.00%,P =0.015);无进展生存期明显延长(500 d vs 380 d,P =0.013);6个月时HRQL明显增高[(80.33±5.84)vs(65.87±9.59),P =0.000)];血清VEGF和MMP-2水平明显降低(P <0.05)。目前,关于LRFA在肝癌患者中的研究较多,且不同的研究结果不同。2015年在一项孤立性肝癌患者中的研究显示与肝切除术相比,LRFA显著增加了患者术后复发率[9]。该研究结果与本研究结果明显不同,主要原因是本文纳入的患者TNM分期为Ⅳ期的患者,无法进行根治性治疗,因而无法评估LRFA后患者肝癌复发情况。对于孤立性的可切除性肝癌,手术切除可能更有利。而2013年日本的一项在结直肠肝转移患者中的研究[12]显示:LRFA有助于降低患者术后局部复发风险,肝内直径小于2 cm的患者局部复发率明显低于直径大于2 cm的患者(44.40% vs 5.60%,P =0.030),该研究的作者建议对于肝内肿瘤直径小于2 cm的晚期癌症患者使用LRFA。本研究将肝内肿瘤直径大于5 cm的患者纳入,但依然观察到LRFA具有良好的效果,不过未对患者作亚组分析,这是本研究的一个不足之处。2003年的一项研究在结直肠肝转移患者中的研究同样[14]显示,LRFA联合化疗显著改善了患者术后生活质量和临床结局,该研究病历数仅为7例,整个随访时间为15个月。本研究病例数为120例,为临床对照研究,更具临床意义。2014年的另一项研究显示[15],胃癌肝转移的患者联合使用LRFA融和化疗显著改善了患者术后生存质量,平均总生存期为20.9个月,无进展生存期为9.8个月。不过该研究同时发现对于多发的肝内肿瘤,单纯LRFA治疗效果不佳,需要联合系统性的化学治疗。本研究仅纳入肝内癌肿数目小于等于3个的患者,表明LRFA对肝内癌肿数目小于等于3个的患者是有效的,显著改善了患者术后生存质量和无进展生存期。目前关于LRFA在原发性肝癌患者中应用的有效性尚未有定论,且目前部分研究对象为转移性肝癌患者,LRFA对原发性肝癌和转移性肝癌患者的影响是否相同尚不可知。但是目前多数研究支持在严格把握适应证的情况下,使用LRFA治疗肝癌是有效的。
VEGF和MMP-2是目前关注较多的肿瘤标志物,其表达水平与肿瘤的发生发展密切相关。鉴于目前尚未有相关研究探讨LRFA对VEGF和MMP-2的影响,本研究在探讨LRFA在原发性肝癌患者中临床应用价值的同时,也探讨LRFA对VEGF和MMP-2的影响。结果显示LRFA可以明显降低患者术后血清VEGF和MMP-2水平。表明VEGF和MMP-2水平与肝癌患者临床预后显著相关[16-17]。
本研究的主要优点有以下3个:①本研究是一个随机对照研究,有严格的纳入标准和排除标准;②目前关于LRFA在肝癌患者中的应用是有争议的,不同的研究对象可导致研究结果截然相反,本研究为这方面补充了一定的临床资料;③尚未有研究探讨LRFA对肝癌患者血清VEGF和MMP-2的影响,本研究具有一定的创新性和临床意义。主要缺点是整体随访时间仅为2年,虽然观察到LRFA显著改善了患者无进展生存期,2年死亡率也有降低趋势,但死亡率差异无统计学意义,这可能与本研究随访时间偏短和样本量不够大有关。
综上所述,LRFA显著改善了肝癌患者临床预后,并明显降低患者VEGF和MMP-2水平。
[1] SVIRČEV Z, DROBAC D, TOKODI N, et al. Epidemiology of primary liver cancer in Serbia and possible connection with cyanobacterial blooms[J]. J Environ Sci Health C Environ Carcinog Ecotoxicol Rev, 2013, 31(3): 181-200.
[2] WONG R J, WANTUCK J, VALENZUELA A, et al. Primary surgical resection versus liver transplantation for transplant-eligible hepatocellular carcinoma patients[J]. Dig Dis Sci, 2014, 59(1):183-191.
[3] LADEP N G, KHAN S A, CROSSEY M M, et al. Incidence and mortality of primary liver cancer in England and Wales: changing patterns and ethnic variations[J]. World J Gastroenterol, 2014,20(6): 1544-1553.
[4] BERTUCCIO P, BOSETTI C, LEVI F, et al. A comparison of trends in mortality from primary liver cancer and intrahepatic cholangiocarcinoma in Europe[J]. Ann Oncol, 2013, 24(6): 1667-1674.
[5] KUDO M, MATSUI O, IZUMI N, et al. JSH Consensus-Based Clinical Practice Guidelines for the management of hepatocellular carcinoma: 2014 Update by the Liver Cancer Study Group of Japan[J]. Liver Cancer, 2014, 3(3-4): 458-468.
[6] ITO T, TANAKA S, IWAI S, et al. Outcomes of laparoscopic hepatic resection versus percutaneous radiofrequency ablation for hepatocellular carcinoma located at the liver surface: A casecontrol study with propensity score matching[J]. Hepatol Res,2015, 46(6): 565-574.
[7] SANTAMBROGIO R, OPOCHER E, ZUIN M, et al. Surgical resection versus laparoscopic radiofrequency ablation in patients with hepatocellular carcinoma and Child-Pugh class a liver cirrhosis[J]. Ann Surg Oncol, 2009, 16(12): 3289-3298.
[8] LEE Y H, HSU C Y, CHU C W, et al. Radiofrequency ablation is better than surgical resection in patients with hepatocellular carcinoma within the Milan criteria and preserved liver function:a retrospective study using propensity score analyses[J]. J Clin Gastroenterol, 2015, 49(3): 242-249.
[9] JIANG L, YAN L, WEN T, et al. Comparison of outcomes of hepatic resection and radiofrequency ablation for hepatocellular carcinoma patients with multifocal tumors meeting the Barcelona-Clinic liver cancer stage a classifi cation[J]. J Am Coll Surg, 2015,221(5): 951-961.
[10] MUKOZU T, NAGAI H, MATSUI D, et al. Serum VEGF as a tumor marker in patients with HCV-related liver cirrhosis and hepatocellular carcinoma[J]. Anticancer Res, 2013, 33(3): 1013-1021.
[11] BLACKBURN H, WEST S. Management of postembolization syndrome following hepatic transarterial chemoembolization for primary or metastatic liver cancer[J]. Cancer Nurs, 2016, 39(5):E1-E18.
[12] OWADA Y, MURATA K, MIKAMI K, et al. Radiofrequency ablation for liver metastases from colorectal cancer after systemic chemotherapy[J]. Gan To Kagaku Ryoho, 2013, 40(12): 1984-1986.
[13] SGOUROS J, CAST J, GARADI K K, et al. Chemotherapy plus percutaneous radiofrequency ablation in patients with inoperable colorectal liver metastases[J]. World J Gastrointest Oncol, 2011,3(4): 60-66.
[14] OTSUKA S, INAGAKI M, MIYOSHI K, et al. Radiofrequency ablation therapy combined with intrahepatic arterial infusion chemotherapy for liver metastasis of colorectal cancer[J]. Gan To Kagaku Ryoho, 2003, 30(11): 1598-1601.
[15] HWANG J E, KIM S H, JIN J, et al. Combination of percutaneous radiofrequency ablation and systemic chemotherapy are effective treatment modalities for metachronous liver metastases from gastric cancer[J]. Clin Exp Metastasis, 2014, 31(1): 25-32.
[16] MIN B S, KIM N K, JEONG H C, et al. High levels of serum VEGF and TIMP-1 are correlated with colon cancer liver metastasis and intrahepatic recurrence after liver resection[J]. Oncol Lett, 2012, 4(1): 123-130.
[17] JIA Z Z, JIANG G M, FENG Y L. Serum HIF-1alpha and VEGF levels pre- and post-TACE in patients with primary liver cancer[J]. Chin Med Sci J, 2011, 26(3): 158-162.
(吴静 编辑)
Clinical values of laparoscopic radiofrequency ablation in liver cancer and its impacts on serumal VEGF and MMP-2*
Qian-jin Zhang1, Bo-nian Hu1, Jun-feng Pei1, Bo Li2
(1.Department of Surgical Oncology, the Affi liated Hospital of Shaoxing University, Shaoxing, Zhejiang 312000, China; 2.Department of Radiotherapy, Zhejiang Provincial People's Hospital, Hangzhou,Zhejiang 310014, China)
Objective To investigate the clinical values of laparoscopic radiofrequency ablation in liver cancer and its impacts on serumal VEGF and MMP-2. Method From Jan, 2012 to Dec, 2013, a series of patients with primary liver cancer were studied, patients were randomly signed into LAFA group or control group. During the study period, LRFA group were treated with laparoscopic radiofrequency ablation combined with FOLFOX4 chemotherapy while patients in control group were treated with PIAF chemotherapy only. The primary outcomes were the Health related quality of life score (HRQL), the degree of solid tumors classification, progression-free survival duration and 2-year mortality. The secondly primary outcomes included the level of serumal VEGF and MMP-2. Result When compared with the control group, patients in LRFA group got a signifi cantly lower rate of disease progression(28.33 % vs 50.00 %, P = 0.015); a longer progression-free survival duration (500 vs 380 d, P = 0.013); a higherHRQL (80.33 ± 5.84 vs 65.87 ± 9.59, P = 0.000); a signifi cantly lower level of VEGF at 7 days, 14 days, 28 days and 6 months after the clinical intervention were started (all P values were 0.000); a signifi cantly lower level of MMP-2 at 14 days, 28 days and 6 months after the clinical intervention were started (the P values were 0.003, 0.001 and 0.000). Conclusion Laparoscopic radiofrequency ablation improved the long-term clinical outcomes and decreased the serumal level of VEGF and MMP-2.
liver cancer; vascular endothelial growth factor; matrix metalloproteinases-2; laparoscopic radiofrequency ablation
R735.7
A
10.3969/j.issn.1007-1989.2016.09.003
1007-1989(2016)09-0010-05
2016-03-18
浙江省医药卫生科技计划一般研究项目(No:2014KYA013)
李博,E-mail:lbzj2014@163.com
