卢戈氏液染色与窄带成像放大内镜在早期食管癌术前诊断中的价值比较
2016-11-15王鹏飞陈兆峰王鹏斌魏丽娜王芳贠建尉刘子燕黄晓俊
王鹏飞,陈兆峰,王鹏斌,魏丽娜,王芳,贠建尉,刘子燕,黄晓俊
(1.兰州大学第二医院 消化内科,甘肃 兰州 730030;2.兰州大学第一医院 消化内科,甘肃 兰州730000;3.甘肃省兰州市第二医院 消化内科,甘肃 兰州 730000)
卢戈氏液染色与窄带成像放大内镜在早期食管癌术前诊断中的价值比较
王鹏飞1,陈兆峰2,王鹏斌3,魏丽娜1,王芳1,贠建尉1,刘子燕1,黄晓俊1
(1.兰州大学第二医院 消化内科,甘肃 兰州 730030;2.兰州大学第一医院 消化内科,甘肃 兰州730000;3.甘肃省兰州市第二医院 消化内科,甘肃 兰州 730000)
目的 对比窄带成像放大内镜(NBI-ME)与卢戈氏液染色内镜(LCE)在早期食管癌(EEC)内镜切除术前诊断中的价值,评估LCE能否被NBI-ME取代。方法 收集2014年1月-2015年12月于兰州大学第二医院、兰州大学第一医院、兰州市第二医院拟行内镜下治疗的EEC病例59例,分别用NBI-ME和LCE突显病变黏膜境界、预判病理分型,结合术后的最终病理结果进行统计学分析。结果 经NBI-ME判断病变境界较清晰和非常清晰的比例为64.4%(38/59),低于LCE的91.5%(54/59),Kappa=0.208<0.4,P =0.006<0.01,两种方法一致性较差。NBI-ME预判病理分型与术后病理一致性检验提示McNemar值为5.397,P =0.369>0.05,Kappa=0.429>0.4,P =0.000<0.01,提示两者一致性尚可。LCE预判病理分型与术后病理一致性检验提示McNemar值为4.533,P =0.475>0.05,Kappa=0.286<0.4,P =0.001<0.01,提示两者一致性较差。结论 虽然NBI-ME在预判EEC病理分型方面与术后病理存在一定的一致性,且优于LCE的预判结果,但在清晰显示病变境界方面,LCE仍有明显的优势。NBI-ME尚不能取代LCE。
窄带成像技术;放大内镜;卢戈氏液染色内镜;早期食管癌;取代
内镜下黏膜剥离术(endoscopic submucosal dissection,ESD)可以显著提高早期食管癌(early esophageal cancer,EEC)完整切除率,降低原位复发率,并明显延长患者的无病生存时间[1],是目前治疗EEC的最佳方法。术前准确界定病变范围、预判病理类型对术式选择及术后是否追加化疗或外科手术及随访周期界定有较高的指导意义。使用窄带成像放大内镜(narrow band imaging and magnifying endoscopy,NBI-ME)分辨病变境界,结合黏膜乳头内毛细血管袢(intraepithelial-papillary capillary loop,IPCL)形态预判术后病理分型,之后再用卢戈氏液染色内镜(lugol chromoendoscopy,LCE)显示病变境界,结合染色特点预判病理分型。在内镜切除病变黏膜后结合术后病理结果评价NBI-ME和LCE在内镜术前的诊断价值,为研究EEC诊断中NBI-ME是否可取代LCE提供依据。现报道如下:
1 资料与方法
1.1 一般资料
本研究中EEC病例为2014年1月-2015年12月于兰州大学第二医院、兰州大学第一医院和兰州市第二医院行普通胃镜检出食管黏膜病变并经钳取活检回报为高级别上皮内瘤变(high-grade intraepithelial neoplasia,HGIN),超声内镜评估病变局限于黏膜层且增强CT检查未发现周围淋巴结转移并拟行内镜下切除的59名患者。其中,男女比例为37∶22,年龄48~73岁,平均(52±2)岁。食管早癌的分布为上段(5)∶中段(37)∶下段(17)。病变黏膜面积0.5 cm×0.4 cm~3.6 cm×2.0 cm,平均1.8 cm×1.3 cm。
1.2 设备与试剂
高清放大内镜为日本Olympus GIF-H260Z型,内镜长135.0 cm,外径10.5 mm,可提供高解析度图像及窄带成像模式,光学放大85倍,数码放大1.8倍。高清液晶监视器为日本Olympus OEV261H。1.5%卢戈氏碘液由蒸馏水100 ml中加入碘5 g、碘化钾10 g混匀备用。
1.3 试验方法
1.3.1 NBI-ME观察并预判窄带成像技术可以显著提升食管黏膜图像的对比度及分辨率,结合光学放大,可将NBI模式下呈深褐色的IPCL放大85~150倍后观察其形态变化。患者经全身麻醉后左侧卧位,由具备开展ESD手术资质的内镜医师进行操作。内镜头端带黑色透明帽后进镜,用适量蒸馏水冲洗清除食管黏膜表面的黏液。先用白光观察定位病变黏膜,后切换为NBI模式,结合光学放大辨别病变与正常黏膜界线,1分为看不清(图1A),2分为模糊可见(图1B),3分为较清晰(图1C),4分为非常清晰(图1D)。后逐行扫描观察IPCL变异程度,预判病理分型。采用MIWAKO等[2]对IPCL的分型,参考张勇等[3]的研究结果,诊断标准如下:Ⅰ型:IPCL呈规则的细圆环状,预判为食管炎症(esophagitis,ES)或正常鳞状上皮(图2A);Ⅱ型:IPCL排列尚规则,但出现管径增粗和(或)延长,预判为低级别上皮内瘤变(lowgrade intraepithelial neoplasia,LGIN)(图2B);Ⅲ型:IPCL排列紊乱,管径粗细不一,部分扭曲(图2C),预判为高级别上皮内瘤变(High-grade intraepithelial neoplasia,HGIN),病变位于m1或m2;Ⅳ型:IPCL呈复层及交织分布,新生血管出现且有不规则分支或呈螺旋状(图2D),预判为食管癌(esophagus cancer,EC),病变浸润至m3或更深。
1.3.2 LCE观察并预判NBI-ME观察结束后,将内镜头端置于贲门水平,将胃镜喷洒管经活检孔插入至视野内喷洒管头端出现,直视下缓慢退镜至距门齿20.0~25.0 cm,同时均匀喷洒1.5%卢戈氏液20 ml,2 min后用清水冲洗管腔富余碘液,观察病变境界,1分为看不清(图3A),2分为模糊可见(图3B),3分为较清晰(图3C),4分为非常清晰(图3D)。再根据病变黏膜染色特点预判病理分型[4]。诊断标准如下:Ⅰ类:深染,呈棕褐色,表面光整,与周边界线不清晰,预判为ES(图3A);Ⅱ类:中等染色,呈橙黄色,表明光整,边缘清晰但不锐利,预判为LGIN(图3B);Ⅲ类:淡染,呈浅黄色,黏膜平坦,其间可见岛状深染区,边缘清晰且锐利,预判为HGIN(图3C);Ⅳ类:淡染,呈浅黄色,黏膜粗糙呈颗粒样隆起,边缘清晰似有嵌入感,冲洗褪色后可呈粉肉色[5],或表面附着有胶冻状白色物质,预判为EC(图3D)。
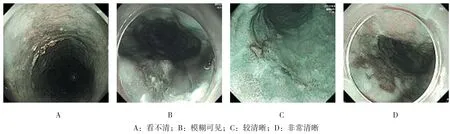
图1 NBI观察食管病变边界标准
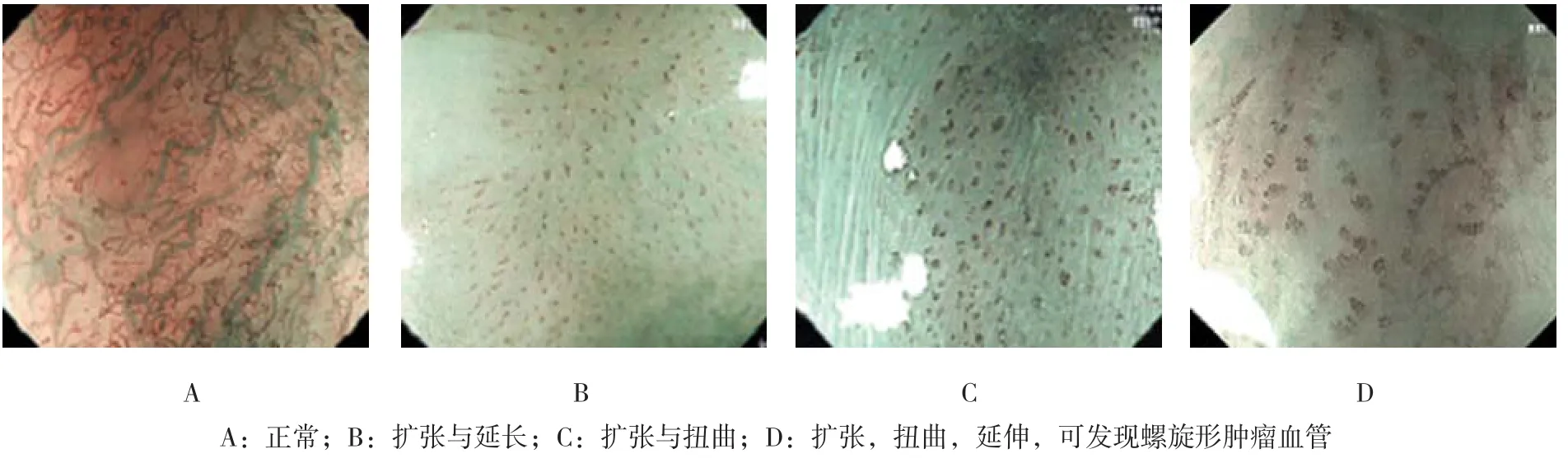
图2 NBI-ME观察食管病变黏膜上皮IPCL改变

图3 LCE观察食管病变
1.4 质量控制
1.4.1 内镜下预判NBI-ME及LCE下病变境界、病理分型的预判由3位事先不了解患者的术前钳取病理结果且熟练掌握染色放大内镜诊断的高年资内镜医师(内镜操作经历≥10年)完成。
1.4.2 病理标准 预判结束后所有病例均实施ESD,术后标本经口完整取出后即刻展平用细针固定,用10%甲醛固定送检。依据维也纳分型[6],以全组织中级别最高者为最终病理结果。
1.5 统计学方法
数据应用SPSS 19.0软件包处理,计数资料一致性应用Kappa检验,P <0.05为差异具有统计学意义。
2 结果
2.1 NBI-ME与LCE判断病变境界一致性比较
通过NBI-ME判断病变境界认为较清晰和非常清晰的比例为64.4%(38/59),而LCE认为病变境界较清晰和非常清晰的比例为91.5%(54/59),见表1。McNemar值为18.091,P =0.006<0.05,Kappa值为0.208<0.4,P =0.006<0.01,差异具有统计学意义,提示两者在判断病变境界方面一致性较差,且存在明确的差别。

表1 NBI-ME与LCE判断病变境界清晰度结果 例
2.2 NBI-ME/LCE预判病理分型与术后病理分型一致性比较
59例患者术后病理提示ES 2例,LGIN 9例,HGIN 26例,EC 22例。通过NBI-ME预判ES 1例,LGIN 11例,HGIN 18例,EC 29例,见表2。与术后病理一致性检验提示McNemar值为5.397,P =0.369>0.05,Kappa=0.429>0.4,P =0.000<0.01,差异具有统计学意义,提示两者一致性尚可。而通过LCE预判ES 1例,LGIN 14例,HGIN 18例,EC 26例,见表3。与术后病理一致性检验提示McNemar值为4.533,P =0.475>0.05,Kappa=0.286<0.4,P =0.001<0.01,差异具有统计学意义,提示两者一致性较差。NBI-ME/ LCE显示病变境界、预判病理分型与术后病理一致性比较的详细结果见表4。
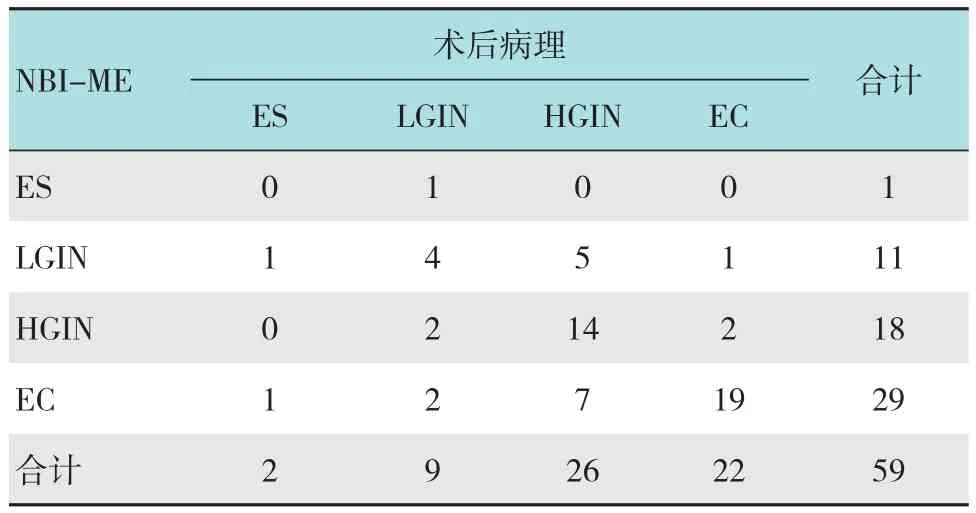
表2 NBI-ME与病理分型结果 例

表3 LCE预判病理分型结果 例

表4 NBI-ME/LCE显示病变境界、预判病理分型与术后病理一致性比较
3 讨论
早期发现病灶并采用ESD治疗是提高食管癌患者预后的最佳策略[7-8]。LCE利用碘与正常鳞状上皮内糖原颗粒结合的原理来提高EEC的发现率或显示其病变范围,是应用最为广泛的EEC检出方法[9-10]。但LCE也有其无法克服的缺点:①需要碘液和喷洒管,延长检查时间;②在非麻醉状态下,食道喷洒碘液后会引起患者胸骨后强烈的烧灼疼痛;③食管黏膜形态由黏膜和黏膜血管图像组成,一旦染色则后者无法被继续观察;④碘液可能会引起过敏反应。NBI-ME采用血红蛋白吸收率最高的波长为415和540 nm的光,结合光学放大技术,能显著提高黏膜血管系统与周围背景组织的分辨率与对比度,是近年来提高上消化道早期病变检出率与诊断准确率的有效手段[11]。NBIME与普通白光模式切换方便,患者胸骨后不适较轻,可明显缩短检查时长,提高患者的耐受性[12]。当然,NBI-ME要求操作者必须有一定的内镜操作基础及对放大图像足够的认知。为了提高患者对内镜检查的耐受性,去除过敏风险,提高内镜检查效率,本研究进行了上述研究来评估NBI-ME替代LCE的可能性。
研究结果显示,NBI-ME与LCE两种方法在显示病变境界试验中,经前者判断病变境界认为较清晰和非常清晰的比例低于LCE(64.4% vs 91.5%),两种方法完全不具备一致性,故可认为LCE在显示病变境界方面仍然存在较为明显的优势,这与SHIMIZU等[13]的研究结果一致。但是,在预判病理分型试验中,经NBI-ME预判的病理分型与术后病理具备一定的一致性,其Kappa值高于LCE,而后者预判病理分型与术后病理分型一致性较差,提示不能单纯依据LCE下黏膜改变特征预判病理分型。另外,本研究中出现了病变境界不清晰、术后最终病理为ES或LGIN,考虑病变面积较小的病例如“一点癌”在初次胃镜检查中活检已钳除肿瘤组织所致。
NAGAMI等[14]对202名食管鳞癌高风险患者进行内镜检查,仅使用NBI模式检出EEC的准确率为77.0%,优于同期进行的碘染色判断(68.0%)。但准确率略低于本研究中经NBI-ME预判的结果(87.5%,42/48),考虑与本研究中兼用放大功能进行微血管及腺体结构观察判断直接相关。另外,本研究中患者前期在常规内镜检查时就已活检证实为EEC且样本量较小均可能是得出上述结果的原因。在后续的研究中,需要通过积累样本数量来进一步提高研究结果的准确性。
综上所述,NBI-ME与传统的LCE均是目前有效的EEC筛查方法,相比NBI-ME,LCE可以更加直观清晰地显示病变境界,便于ESD术前标记剥离范围,又因其对内镜和操作者的要求比较低,易于开展,故更适合于食管癌高发区内镜筛查[15]。而NBI-ME则在预判病理分型、减少患者内镜检查不适及风险方面有LCE无可比拟的优势,更适用于EEC可疑患者的精查。NBI-ME仍无法取代LCE,在实际工作中,应根据实际需要将两种方法结合使用,相互补充,提高EEC内镜诊断、治疗的效率。
[1] TAKAHASHI H, ARIMURA Y, MASAO H, et al. Endoscopic submucosal dissection is superior to conventional endoscopic resection as a curative treatment for early squamous cell carcinoma of the esophagus (with video)[J]. Gastrointestinal Endoscopy,2010, 72(2): 255-264.
[2] MIWAKO A, MASAHLRO T, HIDEAKI A. Evaluation of microvascular patterns of superficial esophageal cancers by magnifying endoscopy[J]. Esophagus, 2005, 2(4): 191-197.
[3] 张勇, 张铭, 张文斌, 等. NBI+放大联合碘染色对早期食管癌及癌前病变的诊断价值探讨[J]. 肿瘤学杂志, 2014, 20(4):320-322.
[4] 王国清, 刘韵源, 郝长青, 等. 食管黏膜碘染色图像和浅表食管癌及癌前病变组织学的关系[J]. 中华肿瘤杂志, 2004, 26(6):342-344.
[5] ISHIHARA R, KANZAKI H, IISHI H, et al. Pink-color sign in esophageal squamous neoplasia, and speculation regarding the underlying mechanism[J]. World J Gastroenterol, 2013, 19(27):4300-4308.
[6] SCHLEMPER R J, RIDDELL R H, KATO Y, et al. The Vienna classifi cation of gastrointestinal epithelial neoplasia[J]. Gut, 2000,47(2): 251-255
[7] 沈陈波, 杨建民, 徐启顺, 等. 内镜黏膜下剥离术和外科手术治疗消化道早癌及癌前病变的比较研究[J]. 中国内镜杂志, 2015,21(6): 571-574.
[8] TANABE S, ISHIDO K, HIGUCHI K, et al. Long-term outcomes of endoscopic submucosal dissection for early gastric cancer: a retrospective comparison with conventional endoscopic resection in a single center[J]. Gastric Cancer, 2014, 17(1): 130-136.
[9] GODA K, DOBASHI A, YOSHIMURA N, et al. Narrow-Band imaging magnifying endoscopy versus lugol chromoendoscopy with pink-color sign assessment in the diagnosis of superficial esophageal squamous neoplasms: a randomised noninferiority trial[J]. Gastroenterol Res Pract, 2015, 2015: 639462.
[10] 芦超, 赵治国, 卢高峰, 等. 22例早期食管癌检诊体会及漏诊原因分析[J]. 中国内镜杂志, 2015, 21(5): 544-547.
[11] GODA K, TAJIRI H, IKEGAMI M, et al. Clinical impact of narrow-band imaging magnifying endoscopy for basal layer type squamous cell carcinoma in the esophagus[J]. Digestive Endoscopy, 2011, 23(1): 75-78.
[12] YAMASAKI Y, TAKENAKA R, HORI K, et al. Tolerability of magnifying narrow band imaging endoscopy for esophageal cancer screening[J]. World J Gastroenterol, 2015, 21(9): 2793-2799.
[13] SHIMIZU Y, TAKAHASHI M, MIZUSHIMA T, et al. Chromoendoscopy with iodine staining, as well as narrowband imaging, is still useful and reliable for screening of early esophageal squamous cell carcinoma[J]. Am J Gastroenterol,2015, 110(1): 193-194.
[14] NAGAMI Y, TOMINAGA K, ARAKAWA T, et al. Usefulness of non-magnifying narrow-band imaging in screening of early esophageal squamous cell carcinoma: a prospective comparative study using propensity score matching[J]. Am J Gastroenterol,2014, 109(6): 845-854.
[15] 中华医学会消化内镜学分会消化系早癌内镜诊断与治疗协作组, 中华医学会消化病学分会消化道肿瘤协作组, 中华医学会消化病学分会消化病理学组, 等. 中国早期食管鳞状细胞癌及癌前病变筛查与诊治共识(2015年·北京)[J]. 中国实用内科杂志, 2016, 36(1): 20-33.
(吴静 编辑)
Comparison of Lugol chromoendoscopy and NBI with magnify endoscopy in preoperative assessment of early esophageal cancer
Peng-fei Wang1, Zhao-feng Chen2, Peng-bin Wang3, Li-na Wei1, Fang Wang1,Jian-wei Yun1, Zi-yan Liu1, Xiao-jun Huang1
(1.Department of Gastroenterology, the Second Hospital of Lanzhou University, Lanzhou, Gansu 730030,China; 2.Department of Gastroenterology, the First Hospital of Lanzhou University, Lanzhou, Gansu 730000, China; 3.Department of Gastroenterology, the Second Hospital of Lanzhou, Lanzhou, Gansu 730000, China)
Objective To compare the value of NBI with magnify endoscopy (NBI-ME) and Lugol chromoendoscopy (LCE) in preoperative assessment of early esophageal cancer, and assess whether the former can replace the latter. Methods 59 patients, sampled in the Second Hospital of Lanzhou University, the First Hospital of Lanzhou University and the Second Hospital of Lanzhou City from January 2014 to December 2015, were examined respectively by NBI-ME and Lugol chromoendoscopy not only to distinguish the lesion boundaries but also predict the pathological types as well for statistical analysis with the combination of the final postoperative pathological results. Results Only 64.4 % (38/59) of lesion boundaries can be well-distinguished by NBI-ME, which is signifi cantly lower than that distinguished by Lugol chromoendoscopy (91.5 %, 54/59), with its kappa value 0.208< 0.4, P < 0.01 (0.006). It indicated that poor concordance existed in these two methods. The McNemar value which refl ects concordance between pathological type predicted by NBI-ME and postoperative pathology was diagnosedto be 5.397, P > 0.05 (0.369), Kappa > 0.4 (0.429), P < 0.01 (0.000), suggesting the concordance can be acceptable. However, the McNemar number diagnosed by Lugol chromoendoscopy was only 4.533, P > 0.05 (0.475), Kappa <0.4 (0.286), P < 0.01 (0.001), showing the poor concordance instead. Conclusions To some extent, pathological type predicted by NBI-ME indeed had an concordance with postoperative pathology, which was also superior to the results examined by Lugol chromoendoscopy, while there was no denying that Lugol chromoendoscopy had an obvious advantage over NBI-ME in terms of distinguishing lesion boundaries, therefore, it can not be completely replaced with NBI-ME at present.
narrow band imaging; magnifying endoscopy; lugol chromoendoscopy; early esophageal cancer;replacement
R604;R735.1
A
10.3969/j.issn.1007-1989.2016.09.005
1007-1989(2016)09-0020-05
2016-04-08
黄晓俊,E-mail:huangxj62@163.com
