MicroRNA-625在食管鳞癌中的表达及临床意义*
2016-11-14刘莎莎岳冬丽陈新峰平玉张毅
刘莎莎岳冬丽陈新峰平玉张毅
·临床研究与应用·
MicroRNA-625在食管鳞癌中的表达及临床意义*
刘莎莎①②岳冬丽①陈新峰①平玉①②张毅①②
目的:探讨microRNA-625(miR-625)在食管鳞癌(esophageal squamous cell carcinoma,ESCC)中的表达及其与临床参数的相关性,探究miR-625对ESCC细胞系KYSE70迁移和增殖的影响。方法:实时荧光定量(real-time polymerase chain reaction,PCR)检测2014年2月至2015年4月郑州大学第一附属医院手术切除的86例ESCC及癌旁正常组织、ESCC细胞系和正常永生化食管上皮细胞系中miR-625的表达,统计学分析其表达水平与ESCC患者临床病理参数及预后的相关性。Transwell实验检测miR-625对细胞迁移能力的影响,细胞计数Kit-8(CCK-8)法检测miR-625对细胞增殖的影响。结果:ESCC组织中miR-625的表达明显低于癌旁正常组织(P<0.05),ESCC细胞系中miR-625表达水平与正常永生化食管上皮细胞相比,显著下调(P<0.05)。miR-625的表达与肿瘤直径、分化程度及淋巴结转移呈负相关(P<0.05)。随访数据提示miR-625低表达组患者预后更差(P<0.05)。miR-625能够抑制ESCC的迁移和增殖(P<0.05)。结论:miR-625作为抑癌基因参与ESCC的发生发展,提示miR-625可能作为一个ESCC治疗靶点和预后判断的分子标志物。
miR-625 食管鳞癌 迁移 增殖 预后
食管癌作为发病率较高的恶性肿瘤之一已越来越被关注。其发病率和死亡率分别占我国各类肿瘤的第5位和第4位。我国食管癌以食管鳞状细胞癌(esophageal squamous cell carcinoma,ESCC)为主,占食管癌90%以上[1-2]。尽管随着ESCC的诊断和治疗手段的进步,但因为癌细胞的无限增殖和转移侵袭特性,ESCC患者术后3年和5年生存率仅为43.7%和26.2%[3]。因此,研究ESCC迁移增殖的机制并寻找新的治疗靶点,对提高ESCC的疗效具有重要的临床意义。
miRNA是一类长度约21~25个核苷酸的非编码RNA,在转录后水平调控靶基因的表达。成熟miRNA通过RNA诱导的沉默复合体结合到靶mRNA上,依赖于序列的互补机制,剪切或阻遏靶mRNA,沉默靶基因的表达[4]。事实上,miRNA调节了约30%的蛋白编码基因,并参与多种生物学功能的调控,包括细胞增殖、凋亡及分化。因此,miRNA的功能异常与人类多种疾病相关。大量的研究发现,多种miRNA与肿瘤的发生及转移等过程相关[5]。因此,miRNA成为治疗原发肿瘤并同时抑制肿瘤转移的有效靶点及治疗工具。研究发现,miR-625能够通过调节ILK基因抑制胃癌的侵袭转移[6];miR-625的低表达与多种肿瘤转移及不良预后有关[7]。但miR-625在ESCC中的报道相对较少,所以本研究从临床方面,研究ESCC组织及ESCC细胞系中miR-625表达情况,以及miR625与ESCC患者生存预后的相关性并探讨miR625与ESCC增殖转移的关系。
1 材料与方法
1.1材料
1.1.1标本收集2014年2月至2015年4月郑州大学第一附属医院手术切除的新鲜ESCC标本及相对应的正常标本86例,所有组织都经病理学确诊,患者在术前均未行放、化疗。标本采集后,采用液氮速冻,然后于-80℃储存以备提取组织总RNA。组织标本的收取均已获得郑州大学第一附属医院伦理委员会批准,并签署知情同意书。所有受试对象均参加每3个月1次的随访计划,随访采用电话随访方式与患者或家属取得联系。
1.1.2细胞正常永生化食管上皮细胞系Het-1α和人ESCC细胞系KYSE70、KYSE450、EC109、EC9706、TE1均由本研究课题组实验室保存。
1.1.3主要试剂RPMI 1640培养液购自美国Hy-Clone公司;胎牛血清(fetal bovine serum,FBS)购自美国Gibco公司;RNAiso plus、cDNA逆转录试剂盒及SYBR®Premix Ex TaqTMⅡ均购自日本TAKARA公司;miR625 mimics和inhibitor由上海吉玛设计;Real time PCR引物由上海生工合成。
Het-1α、KYSE70、KYSE450、EC109、EC9706和TE1均为贴壁细胞,培养于含10%FBS、100 U/mL青霉素和100 U/mL链霉素的RPMI 1640完全培养基中,在37℃、5%CO2培养箱中培养。
1.3实量定量PCR检测miR-625的表达
RNAiso plus法提取Het-1α及ESCC细胞和ESCC组织中总RNA,Nanodrop 2000分光光度计检测RNA纯度及浓度。OD260/280比值在1.80~2.00之间,符合实验要求。按照反转录试剂盒说明书合成cDNA,按SYBR Green试剂说明书于实时荧光定量PCR仪进行扩增。PCR引物为miR625上游引物为5'-AGGGGG AAAGTTCTATAGTCC-3',通用下游引物为5'-TGGT GTCGTGGAGTCG-3'。内参U6上游为5'-CTCGCTT CGGCAGCACA-3',内参U6下游为5'-AACGCTTCA CGAATTTGCGT-3'。
1.4脂质体瞬时转染
转染前24 h铺KYSE70细胞,待细胞融合至70%~80%时,用Lipofectamine 3000转染miR625类似物(mimics)、mimics对照和miR625抑制剂(inhibitor)、inhibitor对照,24 h后收细胞,进行后续实验。
1.5Transwell实验检测细胞迁移能力
取转染过的KYSE70细胞,以每4×104个/mL的密度将细胞接种于8 μm Transwell板的上室,下室加入含10%胎牛血清的完全培养液600 μL,于37℃、5%CO2培养箱培养24 h,再经甲醇固定,0.1%结晶紫染色后,于显微镜下随机选取5个视野(×200)观察并拍照,计数每个视野中穿过滤膜的细胞数。
当短路故障电流流过故障指示器时会上报故障信息,由于配电网呈单电源辐射状运行,因此当故障指示器有故障信息上报时,则可知故障一定在故障指示器下游。若故障指示器没有故障信息上报时,则可知故障一定在故障指示器上游。所以根据故障指示器上报的故障信息,均可提供一种可疑故障区段的证据。
1.6CCK8检测细胞增殖能力
96孔板每孔铺5×103个经转染过的细胞,分别在24、48、72、96 h加入10 μL CCK-8溶液,混匀,细胞培养箱内继续培养1 h后,酶标仪450 nm波长测吸光度值。
1.7统计学分析
应用SPSS 17.0统计学软件分析实验数据。采用student's t检验,配对样本采用配对t检验。生存分析采用Kaplan-Meier法。以P<0.05为差异具有统计学意义。
2 结果
2.1在ESCC组织中及食管癌细胞系中miR-625低表达
通过Real-time PCR检测86对ESCC组织及癌旁正常组织中miR-625的mRNA表达水平。结果显示,miR-625在ESCC组织中的表达明显低于癌旁正常组织(P<0.001,图1A)。同时检测正常永生化食管上皮细胞系Het-1α及6种ESCC细胞系中miR-625的mRNA表达水平,结果同样显示,miR-625在6种ESCC细胞系中的表达明显低于Het-1α,差异具有统计学意义(P<0.05,图1B)。
2.2miR-625表达与肿瘤临床病理参数相关性分析
86例ESCC患者miR-625表达水平与肿瘤病理参数分析结果显示,其表达与肿瘤淋巴结转移情况、分化及肿瘤大小呈负相关,差异具有统计学意义(P<0.05,表1)。
2.3miR-625表达与患者生存预后的关系
miR-625高表达及低表达组的化疗比例分别为45%(19/42),34%(15/44)(P=0.291);miR-625高表达及低表达组的放疗比例分别为31%(13/42),36%(16/ 44)(P=0.596),高表达和低表达组放化疗比例相近,无显著性差异,具有较好的可比性生存分析结果表明miR-625高表达患者中位生存时间为23个月,低表达患者中位生存时间为16.5个月。Kaplan-Meier单因素分析显示miR-625表达与ESCC患者总生存相关。差异具有统计学意义。(P=0.000 9;95%CI:0.124 6~0.586 9;HR=0.270 4)(图2)。
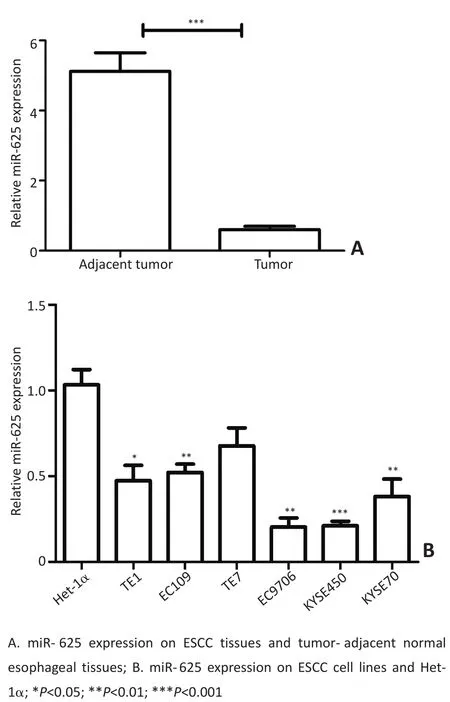
图1 miR-625在ESCC组织中及食管癌细胞系中的表达Figure 1miR-625 expression in ESCC tissues and cell lines

图2 miR-625的表达与ESCC患者生存的关系Figure 2miR-625 expression and prognosis in ESCC patients
2.4miR-625抑制ESCC细胞的迁移能力
将miR-625 miR-625模拟物和抑制剂成功转染到KYSE70细胞系后,Transwell实验结果显示,和对照组相比,miR-625模拟物组的KYSE70细胞迁移能力明显受到抑制(图3A),而miR-625抑制剂组的KYSE70细胞的迁移能力明显增强(图3A),差异具有统计学意义(P<0.05,图3B)。体外Transwell结果表明,miR-625能够抑制ESCC细胞的迁移。
2.5miR625抑制ESCC细胞的增殖能力
为了进一步检测miR-625对ESCC细胞体外增殖能力的影响,本研究采用CCK-8实验分别检测转染过miR-625模拟物组和miR-625抑制剂组KYSE70细胞的体外增殖能力。结果显示,与miR-625模拟物对照组相比,过表达miR-625的KYSE70细胞的增殖能力明显下调(图4A)。与抑制剂对照组相比,敲低miR-625的KYSE70细胞的增殖能力明显升高(图4B),差异具有统计学意义(P<0.05)。体外CCK-8结果表明,miR-625能够抑制ESCC细胞系的增殖。

表1 ESCC患者miR-625表达量与临床病理参数的相关性Table 1Correlation between the clinicopathological characteristics and miR-625 expression in 86 ESCC patients

图3 miR625对ESCC细胞迁移的影响Figure 3Effect of miR-625 on ESCC cell migration

图4 miR-625对ESCC细胞系增殖的影响Figure 4Effect of miR-625 on ESCC cell proliferation
3 讨论
食管癌是最常见的消化道系统恶性肿瘤之一,对人类的生活和健康造成严重的威胁。目前认为,浸润转移是晚期ESCC的重要死因之一[8]。因此进一步研究食管癌侵袭和转移机制,显得尤为重要。
随着科学的发展,曾经被忽视的一类小分子的非编码RNA-miRNA越来越受到关注,甚至成为生命研究的热点。miRNA约占整个基因组的1%,却能调控30%的基因的表达。已有大量研究表明miRNA能够调控肿瘤的侵袭转移。miR-656能够通过抑制BMP-2蛋白受体来抑制脑胶质瘤细胞的增殖、侵袭、转移[9];miR-612能够抑制肝细胞癌的侵袭转移[10];miR-140可以通过靶向TGFBR1和FGF9抑制肝细胞癌的生长和转移[11];miR-300通过靶向Twist蛋白抑制食管癌的上皮间质转化(epithelial mesenchymal transition,EMT)过程,EMT赋予细胞侵袭和转移能力[12-15]。miR-21能够通过下调肿瘤抑制性基因Pdcd4的表达进而促进结直肠癌的侵袭转移特性[16];miR-139能够通过靶向Ⅰ型胰岛素样生长因子受体抑制结直肠癌的侵袭转移[17];miR-331-3p通过靶向PHLPP促进肝癌的增殖及转移[18]。其中,研究发现miR-625的下调能够促进食管癌的增殖和侵袭[19]。这与本研究结果相一致,本研究进一步分析ESCC中miR-625的表达及其与临床预后的关系,将miR-625的表达与临床参数紧密联系,为miR-625作为治疗ESCC的潜在靶点提供更加充实的临床依据。
本研究结果表明miR-625在ESCC组织和ESCC细胞系中表达明显低于癌旁正常组织及正常永生化食管上皮细胞系。miR-625的表达与淋巴结转移、分化程度及肿瘤大小呈负相关,miR-625高表达的患者生存时间明显长于miR-625低表达。这些结果提示miR-625在ESCC的发生发展中发挥重要作用。为了明确miR-625在ESCC增殖转移中发挥的重要作用,进行细胞增殖实验及Transwell实验。当ESCC细胞中miR-625过表达时,能够显著抑制肿瘤细胞的迁移和增殖能力。相反,抑制miR-625的表达可促进细胞增殖及迁移能力。Zhou等[20]在分析乳腺癌组织时发现miR-625较正常对照组显著上调,且发现miR-625能够抑制癌细胞的增殖及迁移。有研究发现miR-625通过调控IGF2BP1/PTEN通路,从而抑制肝癌的转移,在肝癌的发生发展中发挥重要作用[21]。这与本研究结果基本一致。上述研究结果提示miR-625在ESCC的发生发展中发挥着抑癌基因的功能。
综上所述,miR-625在ESCC的发生发展中发挥着抑癌基因的功能,其低表达与淋巴结转移、分化及不良预后相关,且miR-625可抑制ESCC细胞的增殖及迁移能力,提示了miR-625可能是ESCC转移标志物及治疗靶点,为改善ESCC的诊治提供新的实验依据。
[1]Jemal A,Bray F,Center MM,et al.Global cancer statistics[J].CA Cancer J Clin,2011,61(1):33-64.
[2]Hao J,Shao K.Statusofepidemiology,diagnosis and treatment of esophageal cancerandfuturecountermeasure in China[J].Chin J cancer,2011,21(7):501-504.[赫捷,邵康.中国食管癌流行病学现状、诊疗现状及未来对策[J].中国癌症杂志,2011,21(7):501-504.]
[3]Jiang Y,Chen S,Zhu B.Prognostic factors and family history for survival of esophageal squamous cell carcinoma patients after surgery[J].Ann of Thorac Surg,2010,90(3):908-913.
[4]Billeter AT,Barnett RE,Druen D,et al.MicroRNA as a new factor in lung and esophageal cancer[J].Semin Thorac Cardiovasc Surg,2012,24(3):155-165.
[5]Bartel DP.MicroRNAs:target recognition and regulatory functions[J].Cell,2009,136(2):215-233.
[6]Wang M,Li C,Nie H,et al.Down-regulated miR-625 suppresses invasion and metastasis of gastric cancer by targeting ILK[J].FEBS Lett,2012,586(16):2382-2388.
[7]Tili E,Michaille JJ,Croce CM.MicroRNAs play a central role in molecular dysfunctions linking inflammation with cancer[J].Immun Rev,2013,253(1):167-184.
[8]Yue D,Zhang Z,Li J,et al.Transforming growth factor-beta1 promotes the migration and invasion of sphere-forming stem-like cell subpopulations in esophageal cancer[J].Exp Cell Res,2015,336(1):141-149.
[9]Guo M,Jiang Z,Zhang X,et al.MiR-656 inhibits glioma tumorigenesis through repression of BMPR1A[J].Carcinogenesis,2014,35(8):1698-1706.
[10]Tao ZH,Wan JL,Zeng LY,et al.MiR-612 suppresses the invasive-metastatic cascade in hepatocellular carcinoma[J].J Exp Med,2013,210(4):789-803.
[11]Yang H,Fang F,Chang R,et al.MicroRNA-140-5p suppresses tumor growth and metastasis by targeting transforming growth factor beta receptor 1 and fibroblast growth factor 9 in hepatocellular carcinoma[J].Hepatology,2013,58(1):205-217.
[12]Yu J,Xie F,Bao X,et al.miR-300 inhibits epithelial to mesenchymal transition and metastasis by targeting Twist in human epithelial cancer[J].Mol Cancer,2014,13(1):69-74.
[13]Yuan XW,Wang DM,Hu Y,et al.Hepatocyte nuclear factor 6 suppresses the migration and invasive growth of lung cancer cells through p53 and the inhibition of epithelial-mesenchymal transition[J].J Biol Chem,2013,288(43):31206-31216.
[14]Gregory PA,Bracken CP,Bert AG,et al.MicroRNAs as regulators of epithelial-mesenchymal transition[J].Cell Cycle,2008,7(20):3112-3118.
[15]Yao D,Dai C,Peng S.Mechanism of the mesenchymal-epithelial transition and its relationship with metastatic tumor formation[J]. Mol Cancer Res,2011,9(12):1608-1620.
[16]Asangani IA,Rasheed SA,Nikolova DA,et al.MicroRNA-21(miR-21)post-transcriptionally downregulates tumor suppressor Pdcd4 and stimulates invasion,intravasation and metastasis in colorectal cancer[J].Oncogene,2008,27(15):2128-2136.
[17]Shen K,Liang Q,Xu K,et al.MiR-139 inhibits invasion and metastasis of colorectal cancer by targeting the type I insulin-like growth factor receptor[J].Biochem Pharmacol,2012,84(3):320-330.
[18]Chang RM,Yang H,Fang F,et al.MicroRNA-331-3p promotes proliferation and metastasis of hepatocellular carcinoma by targeting PH domain and leucine-rich repeat protein phosphatase[J].Hepatology,2014,60(4):1251-1263.
[19]Wang Z,Qiao Q,Chen M,et al.MiR-625 down-regulation promotes proliferation and invasion in esophageal cancer by targeting Sox2[J].FEBS Lett,2014,588(6):915-921.
[20]Zhou WB,Zhong CN,Luo XP,et al.MiR-625 suppresses cell proliferation and migration by targeting HMGA1 in breast cancer.[J].Biochem Biophys Res Commun,2016,470(4):838-844.
[21]Zhou X,Zhang CZ,Lu SX,et al.miR-625 suppresses tumour migration and invasion by targeting IGF2BP1 in hepatocellular carcinoma[J].Oncogene,2014,34(8):965-977.
(2016-06-06收稿)
(2016-09-13修回)
(编辑:周晓颖校对:孙喜佳)

刘莎莎专业方向为肿瘤免疫、肿瘤微环境的研究。
E-mail:liushasha910729@163.com
Clinical significance of microrna-625 expression in esophageal squamous cell carcinoma
Shasha LIU1,2,Dongli YUE1,Xinfeng CHEN1,Yu PING1,2,Yi ZHANG1,2
Correspondence to:Yi ZHANG;E-mail:yizhang@zzu.edu.cn
1Biotherapy Center,the First Affiliated Hospital of Zhengzhou University,Zhengzhou 450052,China;2School of Life Sciences,Zhengzhou University,Zhengzhou 450000,China
This work was supported by the Foundation for Science and Technology Program of Ministry of Public Health,Henan Province,China(No.201501004)
Objective:To analyze the correlation of miR-625 expression with clinicopathological characteristics in esophageal squamous cell carcinoma(ESCC)and to explore the effect of miR-625 on the migration and proliferation of ESCC cells.Methods:The expression level of miR-625 was determined through real-time PCR in 86 paired human ESCC tissue specimens and tumor-adjacent normal esophageal tissue specimens,ESCC cell lines,and esophageal epithelial cell line.The associations of miR-625 expression with clinicopathological characteristics and survival in ESCC patients were analyzed.Transwell and CCK-8 assays were performed to examine the effect of miR-625 expression on migration and proliferation of ESCC cells.Results:Compared with tumor-adjacent normal specimens,miR-625 was significantly downregulated in ESCC tissue specimens(P<0.05).MiR-625 expression was decreased in ESCC cell lines compared with human esophageal epithelial cell lines(P<0.05).Lower miR-625 expression was associated with poorer prognosis and survival.The migration and proliferation abilities of ESCC cells were inhibited by miR-625 overexpression(P<0.05).Conclusion:MiR-625 acts as a tumor suppressor gene in the development and progression of ESCC,suggesting that miR-625 may serve as an efficient prognosis biomarker and a potential therapeutic target for ESCC.
miR-625,ESCC,migration,proliferation,prognosis
10.3969/j.issn.1000-8179.2016.18.656
①郑州大学第一附属医院生物治疗中心(郑州市450052);②郑州大学生命科学学院
*本文课题受卫生部科技攻关项目(编号:201501004)资助
张毅yizhang@zzu.edu.cn
