DKK1促进非小细胞肺癌线性程序性坏死和血管生成拟态形成*
2016-11-14姚伶俐张丹芳赵秀兰董学易刘芳林贤孙俊英郑旭
姚伶俐张丹芳②赵秀兰董学易刘芳林贤孙俊英郑旭
·临床研究与应用·
DKK1促进非小细胞肺癌线性程序性坏死和血管生成拟态形成*
姚伶俐①张丹芳①②赵秀兰①董学易①刘芳①林贤①孙俊英①郑旭①
目的:探讨非小细胞肺癌(non-small cell lung cancer,NSCLC)中DKK1影响线性程序性坏死(linearly patterned programmed cell necrosis,LPPCN)和血管生成拟态(vasculogenic mimicry,VM)的机制。方法:收集人NSCLC标本173例,H&E染色检测LPPCN,CD31/PAS双染检测VM,免疫组织化学检测DKK1及相关蛋白表达,分析其临床病理意义及相互关系,进而裸鼠H460-DKK1移植瘤体内验证研究假设。结果:NSCLC中14.45%(25/173)存在VM,49.71%(86/173)具有LPPCN,LPPCN(+)组25.6%(22/ 86)形成VM,二者均与分化差、TNM分期晚、易复发转移和预后差相关。VM(+)组和LPPCN(+)组DKK1均高表达,均与VE-cadherin、MMP-2、β-catenin核表达及Twist1正相关。H460-DKK1移植瘤模型证实DKK1促进VM和LPPCN及相关蛋白表达上调。结论:DKK1引起的β-catenin、Twist1表达上调可促进NSCLC中LPPCN和VM形成。
非小细胞肺癌 血管生成拟态 DKK1 上皮间充质转化 线性程序性坏死
肿瘤生长和转移依赖肿瘤血管生成,目前已知的肿瘤微循环模式包括内皮依赖性血管、肿瘤血管生成拟态(vasculogenic mimicry,VM)和马赛克血管[1-2]。VM是肿瘤细胞通过自身变形和与细胞外基质相互作用模仿内皮细胞围成管腔样结构,并与内皮依赖性血管连通,成为肿瘤的功能性血管,在黑色素瘤、肝癌、乳腺癌和肺癌等10余种肿瘤内均发现VM存在[1,3-5],存在VM的肿瘤恶性度明显高于无VM的肿瘤[1],常规的以血管内皮为靶点的抗血管生成药物对存在VM的肿瘤疗效不佳[1,6]。因此,研究VM形成的分子调控机制,寻找有效的治疗靶点是改善具有VM肿瘤患者不良预后的关键。前期研究发现存在VM的肿瘤组织中可见一类特殊类型的坏死细胞,胞体缩小、染色质高度凝集、排列成线状、表达凋亡相关基因。因此课题组将这类细胞死亡形式命名为“线形程序性坏死”(linearly patterned programmedcell necrosis,LPPCN)[7-8]。LPPCN走行与VM一致,提示LPPCN细胞死亡后形成的裂隙状结构可成为VM的空间基础,但具体塑型过程和分子机制尚不清楚。
经典Wnt通路即Wnt/β-catenin通路的异常活化已被证实与胃癌、乳腺癌、结肠癌及肺癌等多种肿瘤的发生发展密切相关[9],前期研究发现Wnt拮抗剂Dickkopf(DKK)分泌蛋白家族成员DDK1通过促进上皮间充质转化(epithelial mesenchymal transition,EMT)促进VM形成[3],且存在VM的非小细胞肺癌(non-small cell lung cancer,NSCLC)中均有LPPCN,因此假说DKK1是调控NSCLC LPPCN和VM形成的关键分子。本研究通过人体标本、细胞转染和动物模型研究DKK1对NSCLC LPPCN和VM形成的调控作用。
1 材料与方法
1.1病例资料
收集1990年10月至2010年11月于天津医科大学肿瘤医院手术治疗的非小细胞肺癌173例,回顾性分析临床病理资料及肿瘤坏死面积等,随访截止至2013年5月1日。根据WHO(2015)肺癌诊断和TNM分期标准,复习切片并将其分为三类:鳞状细胞癌、浸润性腺癌和其它类型癌。
1.2方法
1.2.1免疫组织化学染色及计数本研究兔、羊或小鼠源性多克隆一抗体包括CD31(Zymed,1A10)、DKK1(Santa,SC-25516)、E-cadherin(Santa,SC-7870)、MMP2(Zymed,CA-4001)、MMP9(Santa SC-6840)、Slug(LifespanLS-B3449)、Twist1(Santa,SC-15393)、VE-cadherin(Abcam,Ab33168)、vimentin(Epitomics,EPR3776)、β-catenin(Zymed,CAT-5H10)、MMP-2(Zymed,CA-4001)、MMP-9(Santa,SC-6840)和endomucin(eBioscience,lot:E028994),相应二抗均购自北京中杉金桥生物技术有限公司。按SP两步法操作,石蜡切片脱蜡至水,3%H2O2室温封闭30 min,微波修复抗原,血清封闭,一抗4℃过夜,次日二抗室温孵育60 min,DAB显色。苏木素复染,树胶封片。
人体标本免疫组织化学染色结果按Mattern积分法计数[10]:每例切片选择5个高倍视野(×400),以阳性细胞数占视野中总细胞数的百分比评分:无阳性着色为0分,1%~25%为1分,26%~50%为2分,≥51%为3分;阳性强度:无阳性为0分,浅黄色为1分,深黄色为2分,棕黄色为3分;阳性细胞数和阳性强度乘积为最后得分,>3分视为阳性表达。
1.2.2CD31/PAS双重染色及结果判定采用CD31/ PAS双重染色检测VM,具体步骤如下:常规CD31免疫组织化学染色至DAB显色,滴加1%过碘酸溶液中反应15 min,蒸馏水冲洗,滴加雪夫氏液,37℃避光孵育约20 min,蒸馏水冲洗3次,苏木素复染,树胶封片。
1.2.3细胞培养、质粒构建和细胞转染人NSCLC细胞株H460细胞购自中国医学科学院基础医学院细胞资源中心,采用RPMI 1640培养基加10%胎牛血清(FBS),置于37℃,5%CO2培养箱中培养。pcDNA3.1-DKK1过表达质粒购自上海吉凯基因公司(forward primer:5'-CTAGCTAGCACATGATGGCTCT GG-3',reverse primer:5'-GGAATTCGTGTCTCTGAC AAGTGTG-3')。常规转化感受态大肠杆菌,经氨苄青霉素抗性筛选单克隆后,将质粒进行大量提取,PEI转染6 h,细胞转染48 h后加入G418筛选。
1.2.4裸鼠移植瘤模型选取20只3~4周龄雄性BALB/c裸鼠分为对照组和实验组,每组10只,将稳定转染DKK1质粒的H460细胞及对照细胞制备单细胞悬液,接种至小鼠右侧腋窝皮下,1×107个细胞/只小鼠。每天观察小鼠情况,测量移植瘤体积(体积=长径×短径2/2),21天后处死小鼠,收集肿瘤组织,制备石蜡包埋切片。
1.3统计学分析
数据均用SPSS 18.0软件进行统计分析。各组间的差异采用χ2检验及Spearman相关分析,采用Kaplan-Meier法生存分析,P<0.05为差异具有统计学意义。
2 结果
2.1VM和LPPCN的临床病理意义
CD31/PAS双重染色显示在173例NSCLC组织中14.45%(25/173,图1)存在VM,VM阳性组和VM阴性组肿瘤病理类型、分化程度、TNM分期及复发或转移存在差异。存在VM的肿瘤病理类型多为鳞癌和浸润性腺癌,分化程度低,TNM分期晚,易复发或转移(表1)。173例NSCLC组织中49.71%(86/173,图1)具有LPPCN,LPPCN细胞呈梭形,胞浆浓缩,胞核深染,呈线状、条带状、网络状分布,走行在血管或VM周边。LPPCN阳性组肿瘤多为中央型,分化程度低,TNM分期晚,易复发或转移。Kaplan-Meier生存分析显示VM阳性组较VM阴性组患者生存时间短(χ2= 6.178,P=0.013),LPPCN阳性组较阴性组患者预后生存差(χ2=2.288,P=0.040)。
2.2VM、LPPCN和肿瘤坏死面积之间的相关关系
LPPCN阳性组肿瘤约25.6%(22/86)可形成VM,而不存在LPPCN的肿瘤VM阳性率仅3.4%(3/87)(表1),进一步分析显示LPPCN阳性组内存在VM的肿瘤坏死面积较VM阴性者小(χ2=4.414,P=0.042,图1),而LPPCN阴性组无显著差异(χ2=1.253,P=0.263)。
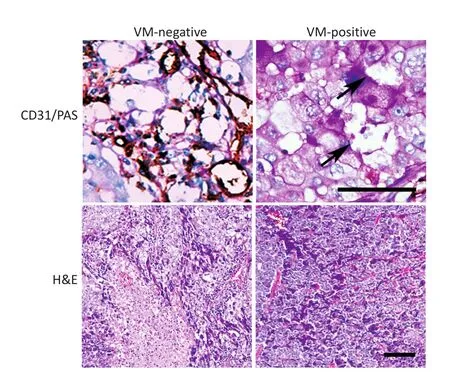
图1 非小细胞肺癌VM阳性组和VM阴性组VM(黑色箭头)和LPPCN比较(Bar=100微米)Figure 1Morphological characteristics of VM(black arrow)and LPPCN of the VM-positive group and VM-negative group(Bar=100 μm)
2.3NSCLC DKK1表达与VM、LPPCN及其相关蛋白之间的相关关系
本研究中173例NSCLC DKK1阳性率为68.21%(118/173),VM阳性组肿瘤DKK1阳性率88.0%,显著高于VM阴性组,LPPCN阳性组约80.2%的肿瘤表达DKK1,LPPCN阴性组DKK1阳性率为56.3%,两组差异具有统计学意义(表2)。Spearman相关分析表明NSCLC VM形成与LPPCN和DKK1呈正相关(r=0.281,0.175,P=0.000,0.022),DKK1高表达与β-catenin核表达、VE-Cadherin、Twist和Slug呈正相关(r=0.207、0.364、0.274、0.235,P= 0.006、0.000、0.000、0.002)。
2.4DKK1高表达促进人NSCLC裸鼠移植瘤VM和LPPCN形成
本研究建立了H460-DKK1裸鼠移植瘤模型,观察DKK1对H460细胞移植瘤生长及VM和LPPCN形成影响。H460-DKK1组较对照组细胞成瘤能力强,移植瘤生长速度快,处死小鼠时H460-DKK1组肿瘤平均体积为(1.74±0.251)cm3,对照组肿瘤体积仅为(0.84±0.16)cm3(t=2.21,P<0.05)。Endomuncin/PAS双染结果发现H460-DKK1组移植瘤VM数目较对照组多,形成VM的能力较强,内皮依赖性血管数目较少(图2)。同时对LPPCN计数显示H460-DKK1组移植瘤LPPCN数目较对照组多,结果与VM形成趋势一致。免疫组织化学染色验证实验组肿瘤显著高表达DKK1(图3)。H460-DKK1组肿瘤中间叶性标记物VE-Cadherin和Vimentin,EMT调控因子Twist和Slug表达显著增高,而且Wnt通路的重要分子β-catenin核表达也显著增多(图3)。
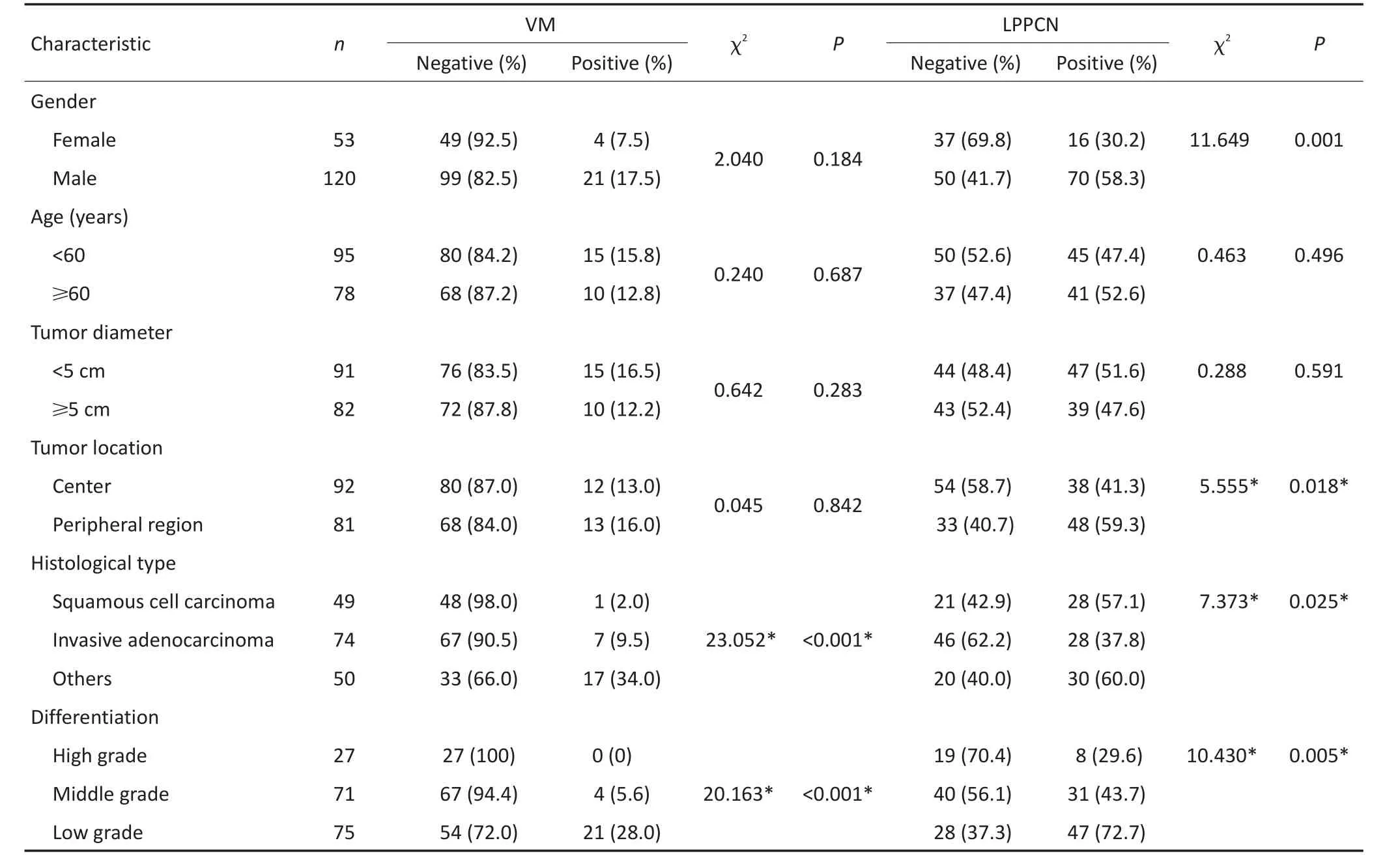
表1 NSCLC中VM和LPPCN与临床病理因素之间的关系Table 1The relationship between VM,LPPCN and clinicopathological parameters in non-small cell lung cancer
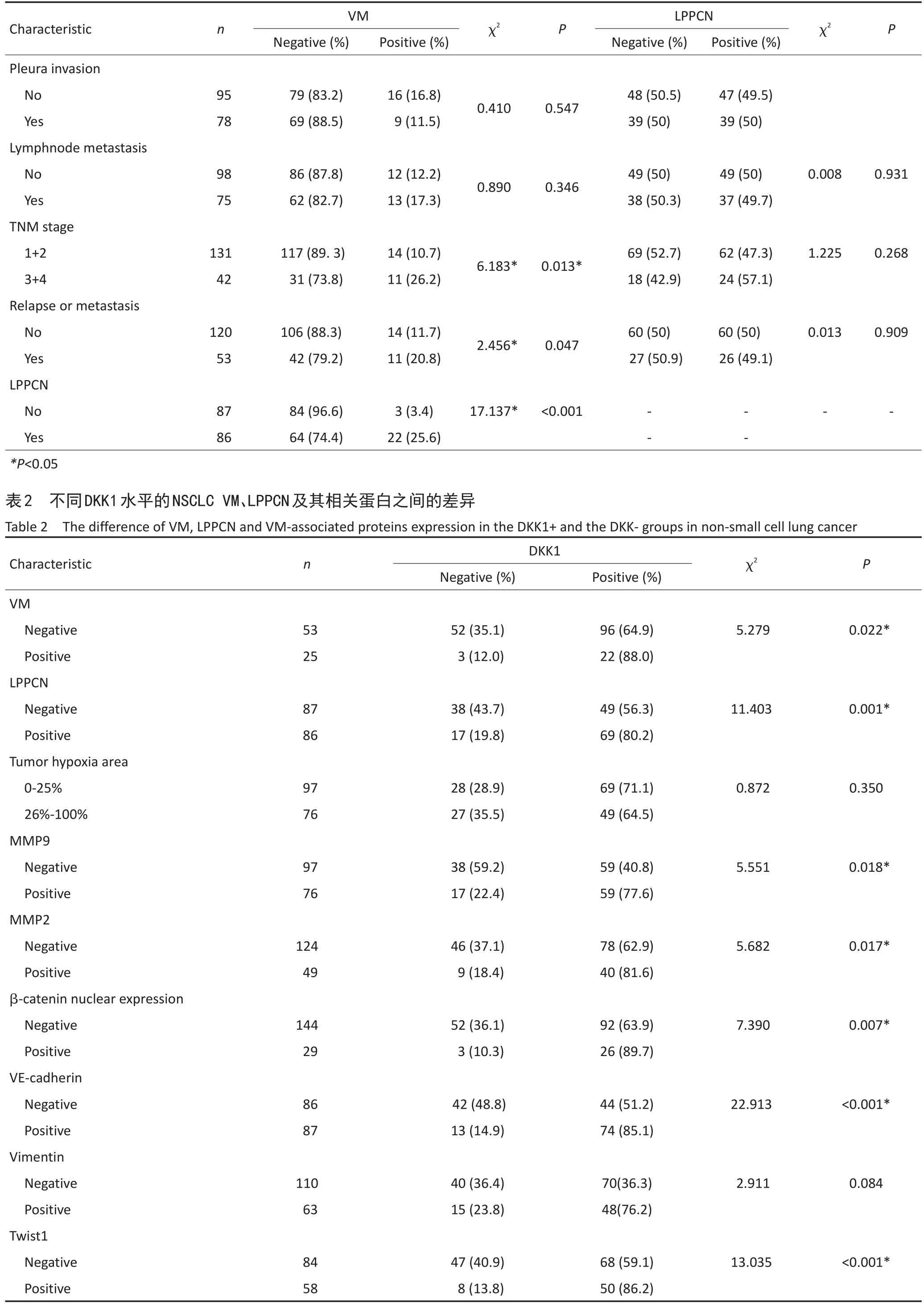
表1 NSCLC中VM和LPPCN与临床病理因素之间的关系(续表1)Table 1The relationship between VM,LPPCN and clinicopathological parameters in non-small cell lung cancer

表2 不同DKK1水平的NSCLC VM、LPPCN及其相关蛋白之间的差异(续表2)Table 2The difference of VM,LPPCN and VM-associated proteins expression in the DKK1+and the DKK-groups in non-small cell lung cancer
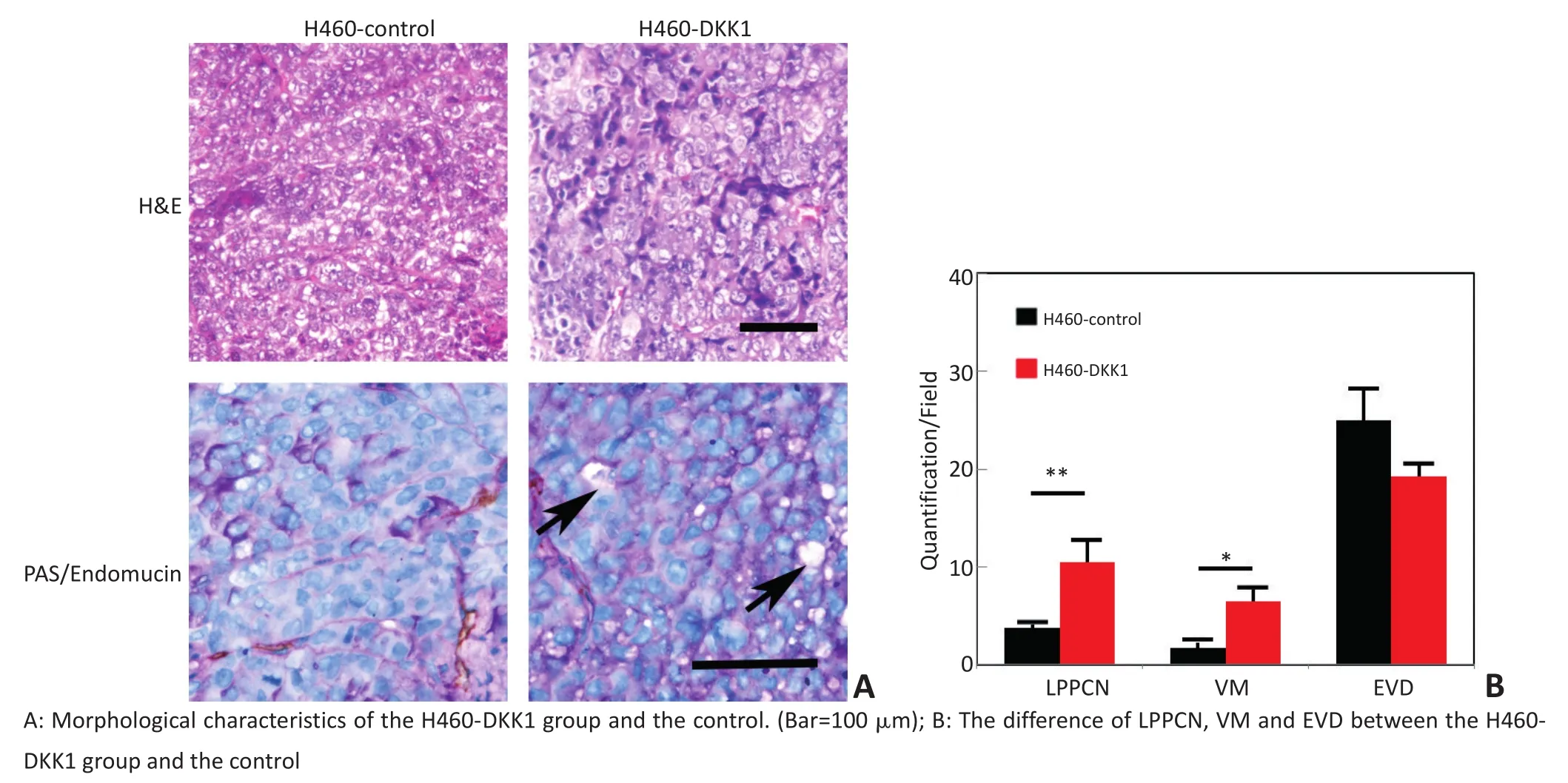
图2 DKK1高表达促进人NSCLC裸鼠移植瘤VM和LPPCN形成P<0.05Figure 2DKK1 overexpression promotes VM and LPPCN formation in non-small cell lung cancer H460 of the nude mice model P<0.05
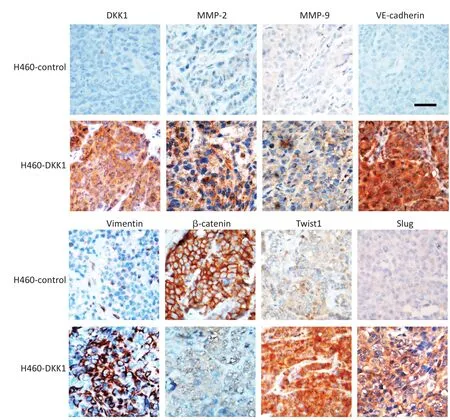
▶图3 H460-DKK1移植瘤与对照组移植瘤DKK1、MMP2、MMP9、VE-cadherin、Vimentin、β-catenin、Twist1和Slug蛋白表达差异(Bar=100微米)Figure 3The different expression of DKK1,MMP2,MMP9,VE-cadherin,Vimentin,β-catenin,Twist1,and Slug between the H460-DKK1 group and the control.(Bar=100 μm)
3 讨论
LPPCN是孙保存教授发现并命名的黑色素瘤中特殊的肿瘤细胞死亡形式,本研究证实在NSCLC中也存在LPPCN现象,它们与内皮依赖性血管或VM走行一致,人体标本分析也显示存在LPPCN的肿瘤VM阳性率更高,LPCCN与VM呈正相关,LPPCN阳性组肿瘤生物学行为与VM阳性组相近,说明存在LPPCN的肿瘤更容易形成VM,再次证实了本课题组的研究假设,线形排布LPPCN细胞被清除降解,局部形成管腔样结构,与血管连通后形成VM[11]。本研究还发现黑色素瘤中LPPCN阳性率与VM阳性率相近[7],而NSCLCLPPCN阳性率为49.71%,VM阳性率仅为14.45%,具有LPPCN的NSCLC约25.59%可形成VM,形成VM者肿瘤坏死面积较小,未形成VM的肿瘤坏死面积较大。上述结果提示VM不是LPPCN的唯一结局,LPPCN形成VM后,血液流入缺氧状态缓解,肿瘤细胞存活;未形成VM者持续缺氧造成肿瘤组织大面积坏死。
肿瘤组织内的高压微环境和缺氧是VM形成的主要驱动因素[12],它们二者可能也是LPPCN的直接诱因[13-14]。为进一步研究调控NSCLC VM和LPPCN形成的分子机制,免疫组织化学染色发现VM阳性组肿瘤和LPPCN阳性组DKK1表达水平均显著增强,上调DKK1的NSCLC移植瘤VM和LPPCN形成能力也显著提高,提示DKK1参与了NSCLC中VM和LPPCN形成过程。EMT和细胞外基质重塑是VM形成过程中的重要环节,Twist1、Slug等多种EMT调控因子均可促进肿瘤细胞发生塑型[15-17],基质金属蛋白酶MMP-2和MMP-9通过诱导细胞外基质重塑促进VM形成。本研究发现NSCLC DKK1与Twist1、Slug及VM相关分子表达呈正相关。因此本研究推测DKK1一方面能够促进部分肿瘤细胞发生LPPCN为VM形成提供空间,另一方面还能够促进肿瘤细胞高表达Twist1、Slug、MMP2等分子,调控细胞外基质重塑、癌细胞EMT等,共同参与调控VM形成。
DKK1是经典Wnt通路的拮抗剂[18],它与Wnt信号的共受体LRP5/6胞外结构域结合,从而阻止β-catenin解离入核,本研究报道DKK1在结肠癌中表达下调,并可抑制结肠癌细胞发生EMT和VM形成[19],而本研究发现DKK1可促进NSCLC VM和LPPCN形成,其经过也与EMT相关,提示DKK1可能在不同肿瘤的发生发展过程中经由不同的分子信号转导通路发挥各异的作用。同时DKK1可抑制Wnt/β-catenin经典通路[20],DKK1还参与Wnt非经典信号途径,DKK1可阻滞Wnt3a介导的C2C12细胞的NF-κB配体减少、可直接抑制NF-κB受体激活因子配体RANKL的表达、可调节β-catenin和RUNX2、可调控p-RB及AKT/NF-kB等[21-22]。DKK1也是β-catenin下游通路的靶点,如食管腺癌中β-catenin入核后与转录调控因子TCF/LEF-1结合可上调DKK1表达[23]。本研究发现DKK1表达与β-catenin的核定位呈正相关,Chen等[24]报道DKK1可以促进肝细胞肝癌β-catenin转录和翻译,促进β-catenin下游基因MMP7的表达从而导致肝癌细胞侵袭和迁移。本研究推测NSCLC中Wnt经典通路被激活后β-catenin由胞浆入核,可促进其靶基因DKK1高表达,DKK1还可反馈性促进β-catenin活性。本研究发现β-catenin下游基因cmyc上调可促进黑色素瘤表达snail/bax促进LPPCN和VM形成[25]。
本研究在NSCLC中观察了VM是LPPCN的结局之一,LPPCN形成VM之后,血液流入缺氧状态缓解,肿瘤细胞存活;未形成VM者导致持续缺氧,造成肿瘤细胞发生大面积坏死。Wnt信号转导通路分子DKK1促进NSCLC LPPCN和VM形成的机制与DKK1表达上调引起的β-catenin、Twist1及VM调控分子表达有关,促进EMT和细胞外基质重塑,进而促进VM形成,但分子之间的调控关系尚待进一步研究。
[1]Sun B,Zhang D,Zhao N,et al.Epithelial-to-endothelial transition and cancer stem cells:two cornerstones of vasculogenic mimicry in malignant tumors[J].Oncotarget,2016.[Epub ahead of print]
[2]Sun BC.New microcirculation pattern of malignant tumor:the current situation and significance of vasculogenic mimicry[J].Chin J Clin Oncol.2013,40(2):63-66.[孙保存.新的肿瘤血供模式-血管生成拟态的研究现状和意义[J].中国肿瘤临床,2013,40(2):63-66.]
[3]Yao L,Zhang D,Zhao X,et al.Dickkopf-1-promoted vasculogenic mimicry in non-small cell lung cancer is associated with EMT and development of a cancer stem-like cell phenotype[J].J Cell Mol Med,2016,20(9):1673-1685.
[4]Lin X,Sun B,Zhu D,et al.Notch4+cancer stem-like cells promote the metastatic and invasive ability of melanoma[J].Cancer Sci,2016,107(8):1079-1091.
[5]Zhao N,Sun H,Sun B,et al.miR-27a-3p suppresses tumor metastasis and VM by down-regulating VE-cadherin expression and inhibiting EMT:an essential role for Twist-1 in HCC[J].Sci Rep,2016,6: 23091.
[6]Zhang D,Sun B,Zhao X,et al.Twist1 expression induced by sunitinib accelerates tumor cell vasculogenic mimicry by increasing the population of CD133+cells in triple-negative breast cancer[J].Mol Cancer,2014,13:207.
[7]Zhang S,Li M,Zhang D,et al.Hypoxia influences linearly patterned programmed cell necrosis and tumor blood supply patterns formation in melanoma[J].Lab Invest,2009,89(5):575-586.
[8]Zhao X,Sun B,Liu Y,et al.Linearly patterned programmed cell necrosis induced by chronic hypoxia plays a role in melanoma angiogenesis[J].J Cancer,2016,7(1):22-31.
[9]Mao J,Fan S,Ma W,et al.Roles of Wnt/beta-catenin signaling in the gastric cancer stem cells proliferation and salinomycin treatment[J].Cell Death Dis,2014,5:e1039.
[10]Bittner M,Meltzer P,Chen Y,et al.Molecular classification of cutaneous malignant melanoma by gene expression profiling[J].Nature,2000,406(6795):536-540.
[11]Han C,Sun BU,Wang W,et al.A pilot study on morphology and the mechanism involved in linearly patterned programmed cell necrosis in melanoma[J].Oncol Lett,2010,1(5):821-826.
[12]Sun B,Zhang S,Zhang D,et al.The influence of different microenvironments on melanoma invasiveness and microcirculation patterns:an animal experiment study in the mouse model[J].J Cancer Res Clin Oncol,2007,133(12):979-985.
[13]Sun B,Zhang D,Zhang S,et al.Hypoxia influences vasculogenic mimicry channel formation and tumor invasion-related protein expression in melanoma[J].Cancer Lett,2007,249(2):188-197.
[14]Zhao N,Sun BC,Sun T,et al.Hypoxia-induced vasculogenic mimicry formation via VE-cadherin regulation by Bcl-2[J].Med Oncol,2012,29(5):3599-3607.
[15]Sun D,Sun B,Liu T,et al.Slug promoted vasculogenic mimicry in hepatocellular carcinoma[J].J Cell Mol Med,2013,17(8):1038-1047.
[16]Ito K,Park SH,Nayak A,et al.PTK6 inhibition suppresses metastases of triple negative breast cancer via Snail-dependent E-cadherin regulation[J].Cancer Res,2016.pii:canres.3445.2015.
[17]Matsusaka S,Zhang W,Cao S,et al.TWIST1 polymorphisms predict survival in patients with metastatic colorectal cancer receiving first-Line bevacizumab plus oxaliplatin-based chemotherapy[J].Mol Cancer Ther,2016,15(6):1405-1411.
[18]Niida A,Hiroko T,Kasai M,et al.DKK1,a negative regulator of Wnt signaling,is a target of the beta-catenin/TCF pathway[J].Oncogene,2004,23(52):8520-8526.
[19]Qi L,Sun B,Liu Z,et al.Dickkopf-1 inhibits epithelial-mesenchymal transition of colon cancer cells and contributes to colon cancer suppression[J].Cancer Sci,2012,103(4):828-835.
[20]Gonzalez-Sancho JM,Aguilera O,Garcia JM,et al.The Wnt antagonist DICKKOPF-1 gene is a downstream target of beta-catenin/TCF and is downregulated in human colon cancer[J].Oncogene,2005,24(6):1098-1103.
[21]Brunetti G,Faienza MF,Piacente L,et al.High dickkopf-1 levels in sera and leukocytes from children with 21-hydroxylase deficiency on chronic glucocorticoid treatment[J].Am J Physiol Endocrinol Metab,2013,304(5):E546-554.
[22]Chu T,Teng J,Jiang L,et al.Lung cancer-derived Dickkopf1 is associated with bone metastasis and the mechanism involves the inhibition of osteoblast differentiation[J].Biochem Biophys Res Commun,2014,443(3):962-968.
[23]Lyros O,Rafiee P,Nie L,et al.Wnt/β-Catenin Signaling Activation beyond Robust Nuclear β-Catenin Accumulation in Nondysplastic Barrett's Esophagus:Regulation via Dickkopf-1[J].Neoplasia,2015,17(7):598-611.
[24]Chen L,Li M,Li Q,et al.DKK1 promotes hepatocellular carcinoma cell migration and invasion through beta-catenin/MMP7 signaling pathway[J].Mol Cancer,2013,12:157.
[25]Lin X,Sun R,Zhao X,et al.C-myc overexpression drives melanoma metastasis by promoting vasculogenic mimicry via c-myc/snail/Bax signaling[J].J Mol Med(Berl).2016 Aug 19.[Epub ahead of print]
(2016-07-10收稿)
(2016-08-27修回)
(编辑:杨红欣校对:武斌)

姚伶俐专业方向为病理学基础研究。
E-mail:ahmuyao@126.com
DKK1 promotes linearly patterned programmed cell necrosis and vasculogenic mimicry in non-small cell lung cancer
Lingli YAO1,Danfang ZHANG1,2,Xiulan ZHAO1,2,Xueyi DONG1,Fang LIU1,Xian LIN1,Junying SUN1,Xu ZHENG1
1Correspondence to:Danfang ZHANG;E-mail:danfangzhang@hotmail.com
Department of Pathology,Tianjin Medical University,Tianjin 300070,China;2Department of Pathology,Tianjin Medical University General Hospital,Tianjin 300052,China
Objective:To investigate the effect of DKK1 on linearly patterned programmed cell necrosis(LPPCN)and vasculogenic mimicry(VM)and the related molecular mechanism in non-small cell lung cancer(NSCLC).Methods:A total of 173 human NSCLC specimens were collected to detect LPPCN by H&E staining,detect VM with CD31/PAS double staining,and investigate DKK1 and related protein expression by immunohistochemistry.The clinical pathological significance of LPPCN,VM,and DKK1 and the correlation of them were analyzed.Human NSCLC H460-DKK1 cells were engrafed in nude mice to evaluate the influence of DKK1 up-regulation on VM and LPPCN in vivo.Results:Approximately,14.45%(25/173)of NSCLC had VM and 49.71%(86/173)had LPPCN.25.6%(22/86)of NSCLC cases in LPPCN-positive group formed VM.Both of VM and LPPCN were all correlated with poor differentiation,late TNM stage,easy recurrence and metastasis and poor prognosis in NSCLC.DKK1 expression in the VM-positive group and the LPPCN-positive group was higher than that in the VM-negative group and the LPPCN-negative group,respectively.DKK1,LPPCN,and VM were positively correlated with VE-cadherin,MMP-2,β-catenin nuclear expression and Twist1.H460-DKK1 transplantation tumor model confirmed that DKK1 promotes the expression of VM and LPPCN and related proteins in NSCLC.Conclusion:The increase of the β-catenin and Twist1 expression induced by DKK1 may promote the formation of LPPCN and VM in NSCLC.
non-small cell lung cancer,vasculogenic mimicry,DKK1,epithelial mesenchymal transition,linearly patterned programmed cell necrosis
10.3969/j.issn.1000-8179.2016.18.807
①天津医科大学病理教研室(天津市300070);②天津医科大学总医院
*本文课题受国家自然科学基金重点项目(编号:81230050)和国家自然科学基金面上项目(编号:81572872)资助
张丹芳danfangzhang@hotmail.com
