凡纳滨对虾肠道上皮细胞微胞子虫PCR检测方法的建立与应用
2016-11-12张会军张文文王雪鹏
雷 燕,肖 洋,张会军,王 娟,张文文,卢 刚,王雪鹏
((1.广州利洋水产科技股份有限公司,广东 广州 510515;2.广州金水动物保健品有限公司,广东 广州 510515;3.山东农业大学动物科技学院,山东 泰安 271018)
凡纳滨对虾肠道上皮细胞微胞子虫PCR检测方法的建立与应用
雷燕1,2,肖洋1,2,张会军1,2,王娟1,2,张文文1,2,卢刚1,2,王雪鹏3
((1.广州利洋水产科技股份有限公司,广东广州510515;2.广州金水动物保健品有限公司,广东广州510515;3.山东农业大学动物科技学院,山东 泰安 271018)
根据GenBank中对虾肠道上皮细胞微胞子虫(Enterocytozoon hepatopenaei,EHP)的基因保守序列,设计一对特异性引物,通过优化 PCR扩增条件,建立快速检测凡纳滨对虾(Litopenaeus vannamei)EHP的PCR方法。用该方法对EHP阳性虾进行PCR扩增,得到与实验设计相符的330 bp特异性扩增条带,而对白斑综合症病毒(WSSV)、桃拉病毒(TSV)、传染性皮下及造血器官坏死病毒(IHHNV)、对虾杆状病毒(BP)、“棉花虾”微孢子虫、黏孢子虫的阳性虾,以及健康虾的扩增结果为阴性。测序比对发现,PCR产物序列与GenBank EHP基因序列的同源性为99.8%,表明该PCR方法检测结果准确。敏感性试验表明,该方法最低可检测出约100 fg的EHP质粒DNA。用该PCR方法检测广东、广西、江苏、山东、海南等地的755份临床样品,共检出阳性样品21份。该PCR方法可用于凡纳滨对虾EHP的快速检测。
凡纳滨对虾;肠道上皮细胞微胞子虫;PCR检测;临床应用
凡纳滨对虾(Litopenaeus vannamei)是当前世界上规模最大、产量最高的养殖对象。近年来,由于养殖环境恶化,其病害也越来越严重,目前,危害凡纳滨对虾的主要病原有白斑症病毒(WSSV)、桃拉病毒(TSV)、传染性皮下及造血器官坏死病毒(IHHNV)、黄头病毒(YHV)、肝胰腺细小病毒(HPV)、对虾杆状病毒(BP)、肝胰腺坏死性细菌(AHPND)、类立克次氏体等,为尽早发现和监测这些病原,均已建立针对性的快速检测技术[1-5]。
肠道上皮细胞微胞子虫(Enterocytozoon hepatopenaei,EHP)简称“虾肝肠胞虫”,体长不到1mm,为凡纳滨对虾的病原体之一[6]。EHP主要感染对虾的肠道表皮及肝胰腺,寄生于肝胰腺小管上皮细胞,致使对虾肠道吸收功能下降,甚至出现肠炎和肝胰腺萎缩现象[7]。EHP最早见于2009年泰国养殖的斑节对虾(Penaeus monodon)[8]。2011年,在越南罹患白斑综合症的斑节对虾中也发现了EHP[9],但Amornrat T等[10]称,EHP不是凡纳滨对虾白斑综合症的诱因。2014年,泰国科学家研究发现,EHP是近年来引起凡纳滨对虾生长缓慢的主要原因之一[11]。2013年我国也发现了EHP,调查结果显示,感染EHP的凡纳滨对虾不会大量死亡,但是肠道吸收功能下降,生长缓慢,造成巨大的经济损失。凡纳滨对虾感染EHP的最明显特征是:生长缓慢,个体差异大;食欲正常,肠、胃充满着食物,肝胰腺略萎缩,发软,但颜色较深。
EHP可经口传播,亦可垂直传播[11],目前尚无较好的治疗方法。为及早发现EHP感染,及时处理,有必要建立一种快速、准确、灵敏的检测方法。本研究拟建立凡纳滨对虾EHP的PCR检测方法,为其临床快速准确诊断检测提供一种快速、敏感、准确的技术手段,以尽早检测肠道上皮细胞微胞子虫,减少损失。
1 材料与方法
1.1材料
EHP阳性材料取自广西北海某凡纳滨对虾养殖场,由利洋公司水产动物疾控分中心实验室(下称“本实验室”)收集、鉴定并保存;健康凡纳滨对虾采自广东省江门市;对虾白斑综合症病毒(WSSV)、传染性皮下及造血器官坏死病毒(IHHNV)、杆状病毒(BP)、桃拉病毒(TSV),“棉花虾”微孢子虫、对虾黏孢子虫阳性材料由本实验室鉴定并保存。pMD19-Enterocytozoon质粒由本实验室构建并保存。临床样品分别采自广东、广西、福建、海南、浙江等地的凡纳滨对虾养殖场。
大肠杆菌 DH5α购自北京天根生化科技有限公司,由本实验室繁殖保存;pMD19-T载体、DNA分子质量标准 DL2000购自大连宝生物工程有限公司;2×Taq PCR MasterMix、高纯度质粒小量抽提试盒、普通琼脂糖凝胶DNA回收试剂盒等购自北京天根生化科技有限公司。其他试剂均为国产分析纯。
1.2引物设计与合成
根据GenBank中发布的肠道上皮细胞微胞子虫核糖体小亚单位RNA基因(登录号:KF135645)的保守序列,设计一对特异性的引物序列。上游引物:5′-TGTGGGAGAAATCTTAGTTTT-3′;下游引物:5′-ATTGCGCTTGCTGCCCAGGAT-3′,预扩增片段长330 bp,引物由华大基因有限公司合成。
1.4DNA的提取
取 EHP阳性凡纳滨对虾的肝胰腺和肠道组织,加500μL TN缓冲液(20 mmol /L Tris /HCl,0.4 mol /L NaCl,pH 7.4),用玻璃匀浆器匀浆,于- 20℃条件下反复冻融 3次,低速离心,取上清液,采用酚-氯仿法提取DNA,保存于- 80℃,备用。待检凡纳滨对虾也按照上述方法取样处理并提取DNA。
1.5PCR检测及其产物测序验证
在PCR反应管中,加入2×Taq PCR MasterMix 10μL,灭菌双蒸水6μL,1 ng/mL DNA模板3μL和上下游引物(浓度为10μmol/L)各0.5μL,共20μL,振荡混匀后置于PCR仪上,按照下列扩增条件进行扩增:95℃下预变性5min;95℃下循环变性30 s,55℃下退火复性35 s,72℃下延伸30 s,共30个循环数;最后72℃下末延伸10min,4℃下保存,用琼脂糖凝胶电泳观察结果。切取阳性目的片段,用普通琼脂糖凝胶DNA回收试剂盒纯化回收,与pMD19-T载体于16℃条件下连接12~16h,产物转化至DH5α感受态细胞,在含氨苄青霉素的LB培养板上,于37℃条件下培养12~ 14h后挑取单个菌落,用LB肉汤培养基扩大培养后,用高纯度质粒小量抽提试盒提取质粒并进行PCR鉴定,筛选出含目的片段的阳性重组质粒,送华大基因公司测序,测序结果提交 NCBI 中的BLAST进行比对,利用生物软件分析序列。
1.6PCR反应条件的优化
1.6.1对PCR反应体系中各组分浓度的优化
1.6.1.1引物浓度采用25μL的PCR反应体系,取8个0.2 mL PCR反应管,分别加入2×反应混合缓冲液12.5μL,5 U/μL Taq DNA聚合酶0.5μL,DNA模板3.0μL,上游引物P1、下游引物P2(浓度为10μmol/L)各分别加0.25、0.50、0.75、1.00μL,每个浓度设一个平行对照,用灭菌超纯水加至总体积,进行PCR扩增。
1.6.2.2Taq DNA聚合酶浓度采用 25μL的PCR反应体系,取8个0.2 mL PCR反应管,分别加入2×反应混合缓冲液12.5μL,上游引物P1、下游引物P2各0.5μL,DNA模板3.0μL,5 U/μL Taq DNA聚合酶分别加0.25、0.50、0.75、1.00μL,每个浓度设一个平行对照,用灭菌超纯水加至总体积,进行PCR扩增。
1.6.2.3DNA模板浓度采用25μL的PCR反应体系,取8个0.2 mL PCR反应管,分别加入2×反应混合缓冲液12.5μL,上游引物P1、下游引物P2各0.5μL,5 U/μL Taq DNA聚合酶0.5μL,DNA模板(浓度为1 ng/mL)分别加1、2、3、4μL,每个浓度设一个平行对照,用灭菌超纯水加至总体积,进行PCR扩增。
1.6.2对PCR反应程序的优化取20个0.2 mL PCR反应管,按照1.6.1的最优组分浓度加样,分别按照如下程序扩增:94℃下预变性5min;94℃下变性30 s,退火温度分别为52.0、52.5、53.0、53.5、54.0、54.5、55.0、55.5、56.0、56.5℃,退火30 s,72℃下延伸30 s,共循环35次;72℃下延伸10min,最后4℃下保存。每个退火温度下设一个平行对照。
反应结束后经琼脂糖凝胶电泳,比较电泳结果,以获得最优的PCR反应条件和反应程序。
1.7PCR特异性试验
分别提取健康虾和EHP阳性、WSSV阳性、IHHNV阳性、BP阳性和TSV阳性虾,以及“棉花虾”微孢子虫及黏孢子虫阳性虾的核酸,作为模板,按照1.6中优化的操作步骤进行PCR反应,观察反应的特异性。
1.8PCR敏感性试验
测定pMD19-Enterocytozoon质粒的含量,按10倍递增稀释成10 ng/mL、1 ng/mL、100 pg/mL、10 pg/mL、1 pg/mL、100 fg/mL、10 fg/mL、1 fg/mL,再以各浓度梯度的质粒作为模板,根据1.6中已获得的最佳反应程序和体系进行PCR,经10g/L琼脂糖凝胶电泳后观察结果,检测模板的最低检测量。
1.9 临床样品检测试验
应用本研究建立的PCR检测方法,对来自广东、广西、福建、海南等地的 755例临床样品进行检测,检验其准确性及临床实用性。
2 结 果
2.1PCR检测方法的建立
利用设计的特异性引物,对EHP阳性凡纳滨对虾样品进行PCR检测,得到与目的条带大小相符的特异性片段(图1)。将PCR阳性产物分别回收、克隆、测序,得到一条长330 bp的序列,与GenBank中发布的肠道上皮细胞微胞子虫基因序列的同源性为99.8%。
2.2PCR反应条件的优化
不同反应条件下下扩增的PCR产物电泳结果比较,确定优化的反应体系为:2×Taq PCR MasterMix 10μL,灭菌双蒸水7μL,DNA模板 2μL,上下游引物各0.5μL;反应条件为:95℃下预变性5min,95℃下循环变性30 s,56℃下退火复性35 s,72℃下延伸30 s,共30个循环,72℃下末延伸10min,4℃条件下保存。
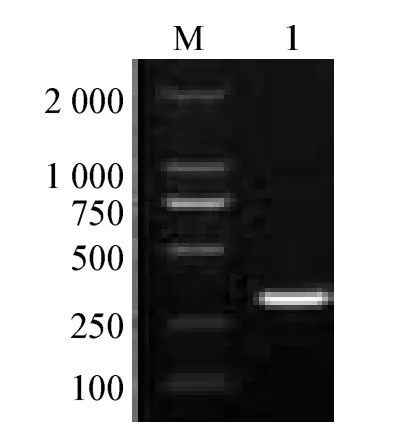
图1 EHP阳性凡纳滨对虾样品PCR检测结果Fig.1 Electrophoresis of PCR detection of microsporida Enterocytozoon hepatopenaei in positive Pacific white leg shrimp Litopenaeus vannamei
2.3PCR特异性扩增结果
按1.7 进行的PCR特异性试验表明,仅EHP阳性虾可扩增出与预期大小相符的目的条带,而健康虾及其他对照组均未扩增出任何条带(图2)。

图2 特异性扩增结果Fig.2 The result of specific amplification by this method
2.4PCR敏感性扩增结果
敏感性测定表明,该PCR检测方法最低能检出100 fg的pMD19- Enterocytozoon质粒模板(图3)。

图3 敏感性试验结果Fig.3 Result of sensitivity detection by this method
2.5临床检测结果
用建立肠道上皮细胞微胞子虫的PCR检测方法,对755份来自广东、广西、江苏、山东、海南等地凡纳滨对虾养殖场的临床样品进行检测,结果发现,共检出阳性样品21份,阳性率2.78%(表1)。
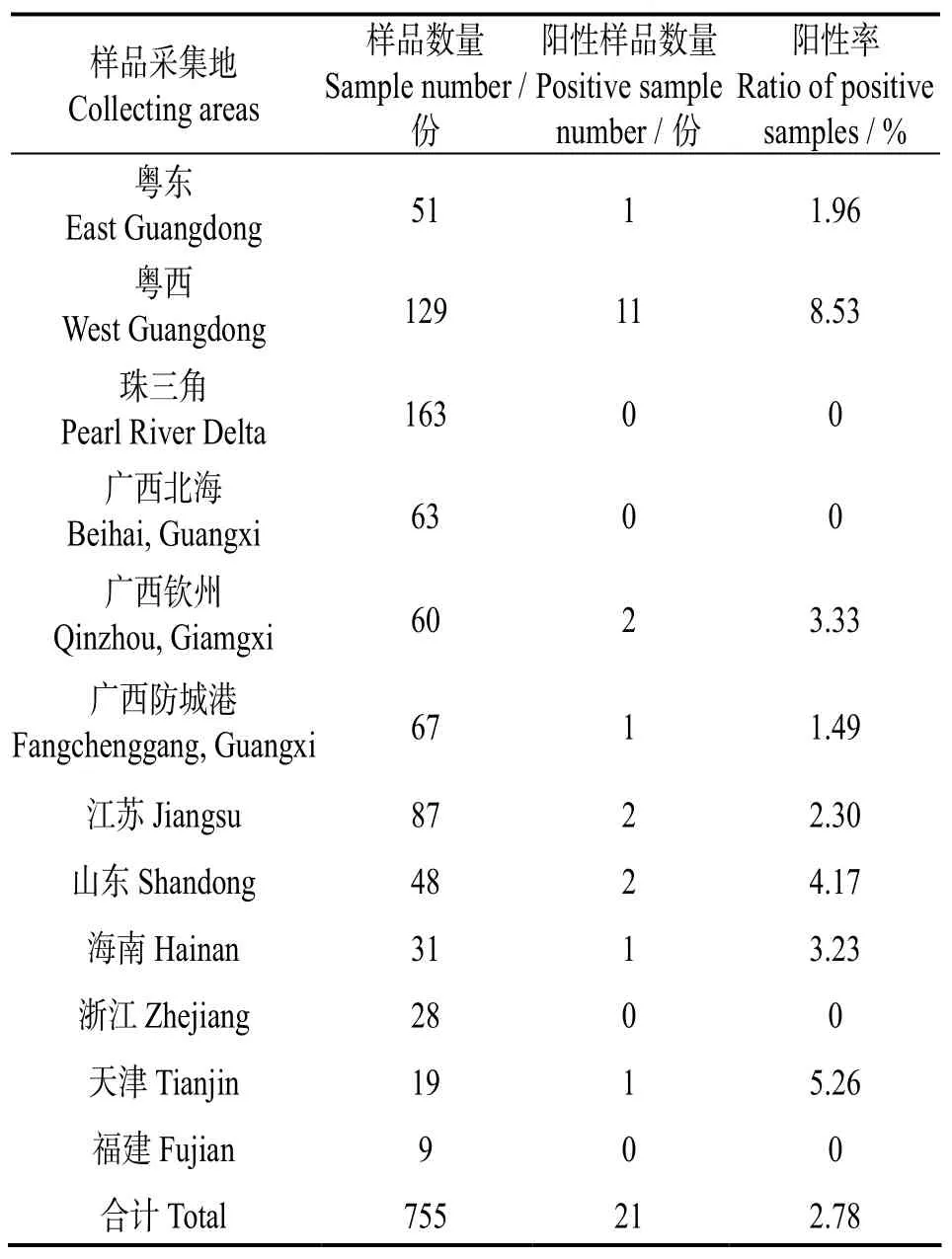
表1 应用建立的PCR检测方法对不同地区临床样品EHP的检测结果Table 1 Detection results of EHP in clinical samples collected from different areas using this method
3 讨 论
在最初发现EHP时,并未发现其与对虾生长缓慢有关。尽管EHP不会引起病虾死亡,但对虾生长极其缓慢[11],目前已在越南、泰国、马来西亚、印度尼西亚和中国等亚洲国家养殖的凡纳滨对虾中发现,被认为是近年来养殖凡纳滨对虾生长缓慢的主要原因之一。我国广东、广西、江苏、山东、海南、天津等地养殖的凡纳滨对虾中已发现肠道上皮细胞微胞子虫。
PCR 检测技术作为一种灵敏的病原检测手段,已应用于许多病原微生物的检测中。本研究根据GenBank中EHP的基因保守序列,设计合成一对特异性引物,建立EHP 的PCR 检测方法。特异性实验表明,该检测方法仅对 EHP 的基因组片段进行特异性 PCR 扩增。敏感性试验表明,最低可检测约100 fg的EHP 基因组DNA。可见,本研究建立的凡纳滨对虾肠道上皮细胞微胞子虫的 PCR检测方法具有特异、敏感、准确检测等优点。利用建立的检测方法,对大量的临床病料进行检测,其检测结果准确,可用于 EHP 感染初期或处于潜伏期的幼虾、亲虾以及池塘底泥、水质的检测。因此,该PCR 方法可为EHP 的流行病学调查、诊断及进出口检疫提供可靠的技术手段。
[1]谢数涛,何建国,杨晓明,等.套式PCR检测斑节对虾白斑症病毒(WSSV)[J].青岛海洋大学学报,2001,31(2):220-224.
[2]徐丽美,吴成林,邱名毅,等.对虾桃拉病毒(TSV)RT-PCR快速诊断技术的研究[J].厦门大学学报(自然科学版),2005,44(2):264-267.
[3]雷燕,肖洋,张会军,等.凡纳滨对虾对虾杆状病毒PCR 检测方法的建立及初步应用[J].广东海洋大学学报,2015,35(4):63-66.
[4]任聪,龚艳清,陈信忠,等.双重PCR同时检测对虾白斑综合征病毒(WSSV)和传染性皮下及造血器官坏死病毒(IHHNV)[J].福建水产,2008(4):38-42.
[5]雷燕,张会军,王娟,等.鱼类类立克次氏体 PCR 检测方法的建立及初步应用[J].广东海洋大学学报,2015,35(6):1-5.
[6]LIGHTNER D V.A handbook of pathology and diagnostic procedures for diseases of penaeid shrimp [M].Baton Rouge,L A:World Aquaculture Society,1996.
[7]TOURTIP S.Histology,ultrastructure and molecular biology of a new microsporidium infecting the black tiger shrimp Penaeus monodon [D].PhD Thesis,Bangkok:Mahidol University,2000.
[8]TOURTIP S,WONGTRIPOP S,STENTIFORD G D,et al.Enterocytozoon hepatopenaei sp.nov.(Microsporida:Enterocytozoonidae),a parasite of the black tiger shrimp Penaeus monodon (Decapoda:Penaeidae):fine structure and phylogenetic relationships [J].Journal of Invertebrate Pathology,2009,102:21-29.
[9]HA N T H,HA D T,THUY N T,et al.Enterocytozoon hepatopenaei parasitizing on tiger shrimp (Penaeus monodon) infected by white feces culture in Vietnam,has been detected (In Vietnamese with English abstract) [J].Agriculture and Rural Development:Science and Technology (translation from Vietnamese),2010,12:45-50.
[10]AMORNRAT T,JIRAPORN S,SAISUNEE C.The microsporidian Enterocytozoon hepatopenaei is not the cause of white feces syndrome in white leg shrimp Penaeus (Litopenaeus) vannamei [J].BMC Veterinary Research,2013,9:139.
[11] SRITUNYALUCKSANA K,SANGUANRUT P,SALACHAN P V,et al.Urgent appeal to control spread of the shrimp microsporidium parasite Enterocytozoon hepatopenaei (EHP).Network of Aquaculture Centre in Asia-Pacific [EB/OL].(2014-11-24).http://www.enaca.org/modules/news/article.php?article_id=2039.
(责任编辑:刘庆颖)
Development and Application of a PCR Detection Assay of Microsporidium Enterocytozoon hepatopenaei in Pacific White Leg Shrimp Litopenaeus vannamei
LEI Yan1,2,XIAO Yang1,2,ZHANG Hui-jun1,2,WANG Juan1,2,ZHANG Wen-wen1,2,LU Gang1,2,WANG Xue-peng3
(1.Guangzhou Liyang Aqua-Technology Co.Ltd,Guangzhou 510515,China; 2.Guangzhou Jinshui Animal Health Products Co.Ltd.,Guangzhou 510515,China; 3.College of Animal Science and Technology,Shandong Agricultural University,Tai'an 271018,China)
A pair of specific primers was designed,and a rapid PCR method was established for detection of microsporidium Enterocytozoon hepatopenaei in Pacific white leg shrimp Litopenaeus vannamei according to the published gene sequences in GenBank by optimization of the reaction parameters.The specific band of 330 bp were amplified from the positive shrimps,but no specific band was found from shrimps with white spot syndrome virus (WSSV),Taura syndrome virus (TSV),infectious hypodermal and hematopoietic necrosis virus (IHHNV),Baculovirus penaei (BP),andPleistophora-like microsporidium,Myxosporea and healthy shrimps.According to the Sequencing analysis,the sequence of PCR product had 99.8% homology with that of EHP gene in GenBank which indicated the high accuracy of this method.The sensitivity test of this method showed that the lowest detectable limit DNA plasmid of the microsporida was 100 fg.755 clinical shrimp samples collected from provinces of Guangdong,Guangxi,Jiangsu,Shandong,and Hainan were detected by this method,and then 21 positive samples were found.The findings indicated that the PCR assay could be used in the detection of Pacific white leg shrimp samples.
Litopenaeus vannamei; Enterocytozoon hepatopenaei; PCR detection; clinical application
S941.51+3
A
1673-9159(2016)04-0050-05
10.3969/j.issn.1673-9159.2016.04.009
2016-03-12
山东省现代农业产业技术体系(SDAⅠT-19);泰安市科技发展计划项目(201440774);浙江省近岸水域生物资源开发与保护重点实验室开放基金项目(J2013006)
雷燕(1983-)男,硕士。E-mail:leikunnuy@163.com
王雪鹏(1980—),男,博士,副教授。Email:xpwang@sdau.edu.cn
