大脑中动脉供血区单发腔梗的病灶位置与其发病机制的关系探讨
2016-11-12温璐璐
温璐璐, 韩 冬, 冯 娟
大脑中动脉供血区单发腔梗的病灶位置与其发病机制的关系探讨
温璐璐,韩冬,冯娟
目的对大脑中动脉供血区单发腔梗(lacunar infarction,LI)的病灶位置及载体动脉硬化情况进行分析,探讨LI发病机制的异质性。方法将2009年10月~2015年10月期间于中国医科大学附属盛京医院神经内科住院的519例经头DWI证实的大脑中动脉供血区的单个新发LI患者纳入研究。根据病灶位置与载体动脉的关系将患者分为两组:近端腔隙性脑梗死组(proximal lacunar infarction,PLI)和远端腔隙性脑梗死组(distal lacunar infarction,DLI);评估每一位患者是否伴有载体动脉病(parent artery disease,PAD)、除载体动脉外的其它大动脉的动脉硬化情况(atherosclerosis of other cerebral artery,AOCA)、脑白质疏松程度、无症状性脑梗死(silent brain infarct,SBI)个数及其他临床资料,比较DLI和PLI两组患者在临床和影像学方面的差异。结果高龄、男性、吸烟、糖尿病、冠心病、AOCA、低密度胆固醇为PAD的危险因素。在PLI及DLI两组患者的临床特点和影像学资料的比较中,糖尿病在PLI组中的患病率高于DLI组,血清叶酸在DLI组中的水平低于PLI组。PLI组患者的病灶大于DLI组。PAD和AOCA为PLI的独立危险因素,脑白质疏松和SBI是PLI的保护性因素。结论不同病灶位置的LI在临床特点和影像学上有显著差异。我们将PAD和AOCA作为动脉硬化的标志,脑白质疏松和SBI作为微血管透明样变的标志,研究结果提示:PLI的发病机制可能与动脉硬化有关;DLI的发病机制可能与微血管透明样变性有关。
腔隙性脑梗死;发病机制;病灶位置;载体动脉病变;脑白质疏松
腔隙性脑梗死(lacunar infarction,LI)是指发生在皮质下深穿支动脉供血区的直径小于20 mm的梗死。据统计,在西方国家LI占脑梗死的1/4,在中国LI的发生率更高。LI被认为是一个相对良性的脑梗死类型,因为其短期预后相对较好(急性期低病死率,较少的神经功能损害,短期内神经功能恢复较快,短期内较低的卒中复发率及短期内对生活质量影响小),然而对LI患者的中、长期的观察发现其病死率、卒中复发率及认知功能障碍均有所增加。
Fisher提出了导致LI的两种深穿支血管的病理改变:小动脉脂质透明样变和微粥样斑块形成。前者累及的是直径在200 μm以下的远端穿支动脉,常常导致多发、小的、无症状的LI和脑白质疏松;后者累及的是直径在200~400 μm的近端穿支动脉,常导致相对较大的、有症状的LI[1]。然而在LI患者中常伴有发出穿支动脉的相应颅内大血管的狭窄甚至是闭塞,这种大血管病变被学者们称为载体动脉病(parent artery disease,PAD),PAD被认为是这类LI的病因。
上世纪70年代,Caplan和Fisher通过尸体解剖描述了基底动脉供血区的LI的病灶位置,发现由动脉硬化致穿支动脉开口狭窄或阻塞引起的LI的病灶常靠近或紧贴基底动脉,而那些由小血管透明样变导致的LI常位于远离基底动脉的脑桥实质内[2]。近年来韩国学者对单发的LI的影像学的研究发现,伴有PAD的单发LI中约有88.6%的病灶位于靠近大动脉的区域;不伴有PAD的LI中仍约有51.6%的病灶靠近大动脉,另外48.4%的病灶远离大动脉[3]。本研究组曾经对203例经DWI证实的大脑中动脉、椎动脉、基底动脉供血区的单发腔梗进行研究,发现病灶位置靠近载体动脉的LI与动脉硬化有关,而病灶位置远离载体动脉的LI与小血管病变有关。在上述研究基础上,本研究进一步分析、比较了519例大脑中动脉(middle cerebral artery,MCA)供血区单个新发LI患者的临床及影像资料,根据病灶位置进行分组,比较患者的影像学及临床特点的差异,试图得出MCA供血区LI发病机制的异质性。
1 临床资料和方法
1.1病例的选择我们回顾研究自2009年10月~2015年10月期间于中国医科大学附属盛京医院神经内科病房4个病区住院的急性脑梗死的患者,查阅分析了患者的病例资料及影像学资料,包括头颅磁共振(magnetic resonance imaging,MRI)扫描,包括弥散加权成像(diffusion-weighted imaging,DWI)和液体衰减翻转恢复成像(fluid-attenuated inversion recovery,FLAIR),磁共振三维时间飞跃法血管成像(MRA),颈部血管超声检查等。入选经DWI证实在MCA供血区的单个、新发、皮质下的梗死,且最大直径<20 mm的病例。排除有房颤、近期心肌梗死、扩张型心肌病、心脏瓣膜病或感染性心内膜炎的患者;排除经颈部血管彩超证实与此次新发梗死相对应的颅外段大动脉狭窄超过50%的患者;排除血液系统疾病,如真性红细胞增多症,血小板增多症等;排除感染性动脉炎;排除自身免疫性疾病所致的炎性动脉改变。
1.2影像特点及分组入选的患者均有完整的MRI序列(1.5-T或3.0-T磁共振仪器),包括:轴位T1、T2、DWI和FLAIR序列,冠位T1和三维时间飞跃法MRA。1.5-T磁共振仪器具有如下指标:DWI,TR/TE为4200 ms/65 ms,视野为230 mm,矩
阵数为256×256,层厚为6.0 mm,层间距1.0 mm;FLAIR,TR/TE为8002 ms/169 ms,视野为230 mm,TI为2200 ms,矩阵数为512 mm×512 mm,层厚为6.0 mm,层间距为1.0 mm;MRA,翻转角为25,TR/TE为21 ms/3 ms。3.0-T磁共振仪器具有如下指标:DWI,TR/TE为2500 ms/67 ms,视野为230 mm,矩阵数为144 mm×144 mm,层厚为6.0 mm,层间距1.0 mm;FLAIR,TR/TE为7000 ms/100 ms,视野为230 mm,TI为2500 ms,矩阵数为512 mm×512 mm,层厚为6.0 mm,层间距为1.0 mm;MRA,翻转角为25,TR/TE为25 ms/3.45 ms。
根据DWI上的病灶与载体动脉的位置关系将所有患者分为两组:近端梗死组(proximal lacunar infarction,PLI)指病灶位于靠近载体动脉的近端区域;远端梗死组(distal lacunar infarction,DLI)指病灶位于穿支动脉供血的远端区域。我们以中脑刚刚消失的层面作为界限,若新发梗死延伸到该层面或其上一层,该梗死被分到PLI组(见图1),若新发梗死未延伸到上述两个层面则被分到DLI组[3](见图2)。
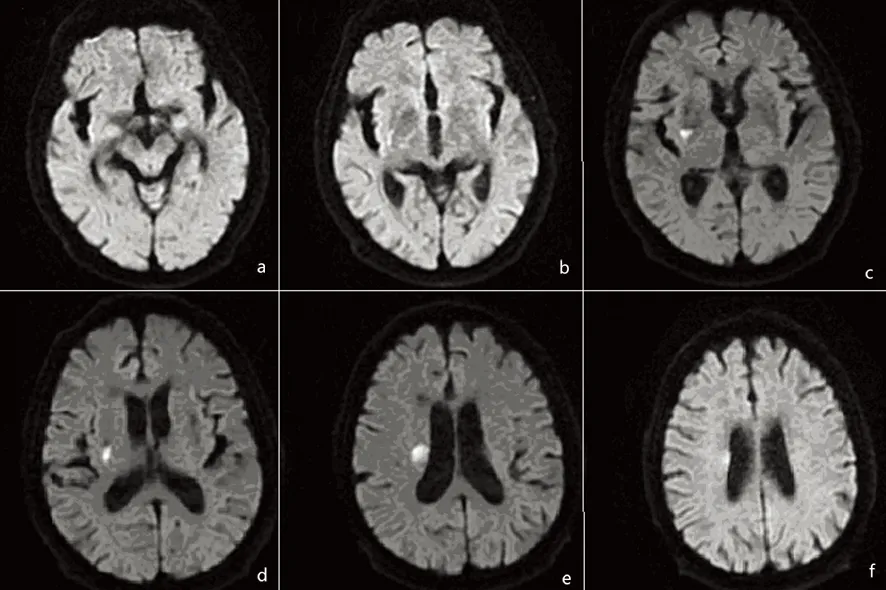
图1大脑中动脉供血区近端梗死PLI的连续轴位DWI图像(b):中脑刚刚消失的层面,为标准层面;该LI病灶延伸到标准层的上一层,属于PLI。
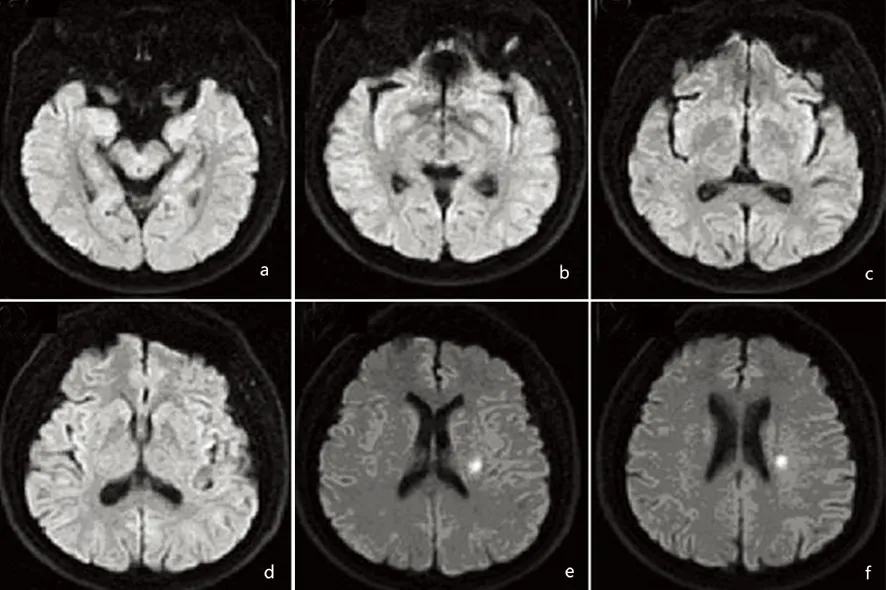
图2大脑中动脉供血区远端梗死DLI的连续轴位DWI图像(b):中脑刚刚消失的层面,为标准层面;该LI病灶未延伸到标准层或其上一层,属于DLI。
评估每位入选患者的PAD情况、除载体动脉外的其它大动脉的动脉硬化情况(atherosclerosis of other cerebral artery,AOCA)。PAD是通过磁共振MRA显示的载体动脉任何程度的狭窄或闭塞[4],由一位神经科医生及一位影像科医生共同评估,若两位医生意见不一致需参考另一位神经科医生的意见。AOCA是MRA显示除载体动脉外其他颅内大血管任何程度的狭窄、闭塞,或颈部血管彩超提示颈动脉内中膜厚度≥1.0 mm或颈动脉内斑块形成[5]。
通过FLAIR序列评估每位患者脑白质疏松程度,采用Wahlund提出的方法,将脑室周围或半卵圆区的双侧对称的、弥漫性高信号病灶予以评分(0~3分),0为无病变;1为局部点状病灶;2为部分融合病灶;3为弥漫融合病灶伴或不伴有U纤维受累[6]。评分≥2被认为较严重的脑白质疏松。
无症状性脑梗死(silent brain infarct,SBI)指MRI上单个或多发的腔梗灶但缺乏相应的脑卒中或短暂性脑缺血发作的病史[7]。我们计数每一位患者SBI的个数。
根据DWI测量每一个新发LI的病灶大小,量取最大层面的最大直径来代表病灶大小。
1.3临床资料及化验检查收集患者病史中一般情况,高血压 (应用降压药物或非同日2次以上测血压≥140/90 mmHg)、糖尿病(应用降糖药物或空腹血糖≥126 mg/dl或餐后2 h血糖≥200 mg/dl)、近期吸烟史(正在吸烟或戒烟时间短于6 m)、既往卒中史、冠心病病史(心肌梗死、心绞痛或冠状动脉造影证明的冠状动脉粥样硬化),入院时的NIHSS评分;记录入院次日清晨空腹后测量的糖化血红白,血清总胆固醇、低密度脂蛋白、叶酸和维生素B12等化验检查结果。
1.4统计学方法对计量资料进行正态分布检验,其中总胆固醇和低密度脂蛋白符合正态分布。单因素分析中总胆固醇和低密度脂蛋白采用t检验;年龄、糖化血红蛋白、叶酸和维生素B12、SBI个数、NIHSS评分、病灶大小采用Mann-Whitney U检验;计数资料采用χ2检验。对于单因素分析中P<0.1的变量纳入多因素Logstic回归分析。数据处理通过SPSS 17.0 for windows 统计软件完成,P<0.05具有显著差异。
2 结 果
2.1一般资料519例患者年龄21~88 岁,平均61.95±11.16岁 ,男性66.7%。PLI组有264例(50.9%),DLI组有255例(49.1%)。所有的患者中伴有PAD的有182例(35.1%),其中病灶位于近端的有156例(85.7%);不伴有PAD的患者中近端梗死有108例(32.0%),远端梗死有229例(68.0%)。所有患者中有393例(75.7%)具有AOCA,有207例 (39.9%)患者具有严重的脑白质疏松,SBI的数量的中位数为4,四分位数 (25%位数2,75%位数6)。最主要的危险因素为高血压65.3%,其次为血脂异常46.8%,吸烟41.2%,糖尿病25.4%,冠心病15.8%。
2.2PAD(+)与PAD(-)两组在临床及影像学特点的比较182例PAD(+)组患者平均年龄高于337例PAD(-)组患者(66.1±10.4 vs 59.9±10.9岁,P<0.001);PAD(-)组中男性患者比例更多(72.4% vs 56.0%,P=0.003);PAD(+)组在糖尿病(33.0% vs 21.4%,P=0.018)、冠心病(22.5% vs 12.2%,P=0.002)的比例上显著高于PAD(-)组;PAD(-) 组吸烟的比例显著高于PAD(+)组(48.4% vs. 28.0%,P<0.001);PAD(+)组患者低密度脂蛋白水平高于PAD(-)组(128.7±35.7 vs. 117.8±35.35 mg/dl,P=0.001),而PAD(-)组患者叶酸水平低于PAD(+)组(4.6±2.5 vs 5.7±3.3 ng/ml,P<0.001)。PAD(+)组患者病灶大于PAD(-)组(13.8±4.1 vs 12.3±4.0 mm,P<0.001)。PAD(+)组中PLI(85.7% vs 32.0%,P<0.001)和AOCA(91.2 % vs 68.1% ,P<0.001)的发生率显著高于PAD(-)组(见表1)。
2.3PLI组和DLI组在临床及影像学特点的比较264例PLI与255例DLI相比,PLI组具有更大的病灶(13.2±3.2 vs. 11.7±2.9mm,P<0.001);具有较高的PAD患病率 (55.7% vs. 13.7%,P<0.001)、AOCA 患病率(87.1% vs. 63.9%,P=0.004)。DLI组较PLI组具有更多的SBI(P=0.001)及更严重的脑白质疏松程度 (Wahlund评分≧2所占的比例为54.6% vs. 28.2%,P<0.001)。危险因素中糖尿病在PLI组中发生率更高(34.8% vs. 15.7%,P<0.001),而血清叶酸在DLI组中水平较低 (4.6±3.6 vs. 5.7±2.1 ng/ml,P=0.042) (见表2)。多因素;Logistic回归分析发现PAD(OR8.870,95%CI4.93~15.95,P<0.001)和AOCA(OR1.81,95%CI1.01~3.20,P=0.043)是PLI的独立危险因素;病灶大小(OR1.18,95%CI1.11~1.25,P<0.001)与PLI也有独立相关性;而脑白质疏松Wahlund 评分≧2(OR0.26,95%CI0.16~0.43,P<0.001)和SBI(OR0.86,95%CI0.80~0.93,P<0.001)是PLI的保护性因素,但结合临床我们考虑二者为DLI的独立危险因素(见表3)。
表1PAD(+)组和PAD(-)组在临床及影像学方面的比较

PAD(+)(n=182)PAD(-)(n=337)P年龄,(岁)男性,n(%)高血压,n(%)糖尿病,n(%)糖化血红蛋白吸烟,n(%)冠心病,n(%)PLI,n(%)AOCA,n(%)脑白质疏松Wahlund评分≧2,n(%)SBI,中位数(IQR)病灶大小,mm低密度脂蛋白,mg/dl叶酸,ng/ml维生素B12,pg/mlNIHSS,中位数(IQR)66.1±10.4102(56.0)118(64.8)60(33.0)7.3±2.251(28.0)41(22.5)156(85.7)156(91.2)69(40.4)4(2to6)13.8±4.1128.7±35.75.7±3.3290.1±121.62(0to4)59.9±10.9244(72.4)221(65.6)72(21.4)6.6±1.5163(48.4)41(12.2)108(32.0)237(68.1)138(39.7)4(3to7)12.3±4.0117.8±35.354.6±2.5294.1±173.52(1to3)<0.0010.0030.8920.0180.001<0.0010.002<0.001<0.0010.8790.014<0.0010.001<0.0010.7970.923
IQR:四分位间距
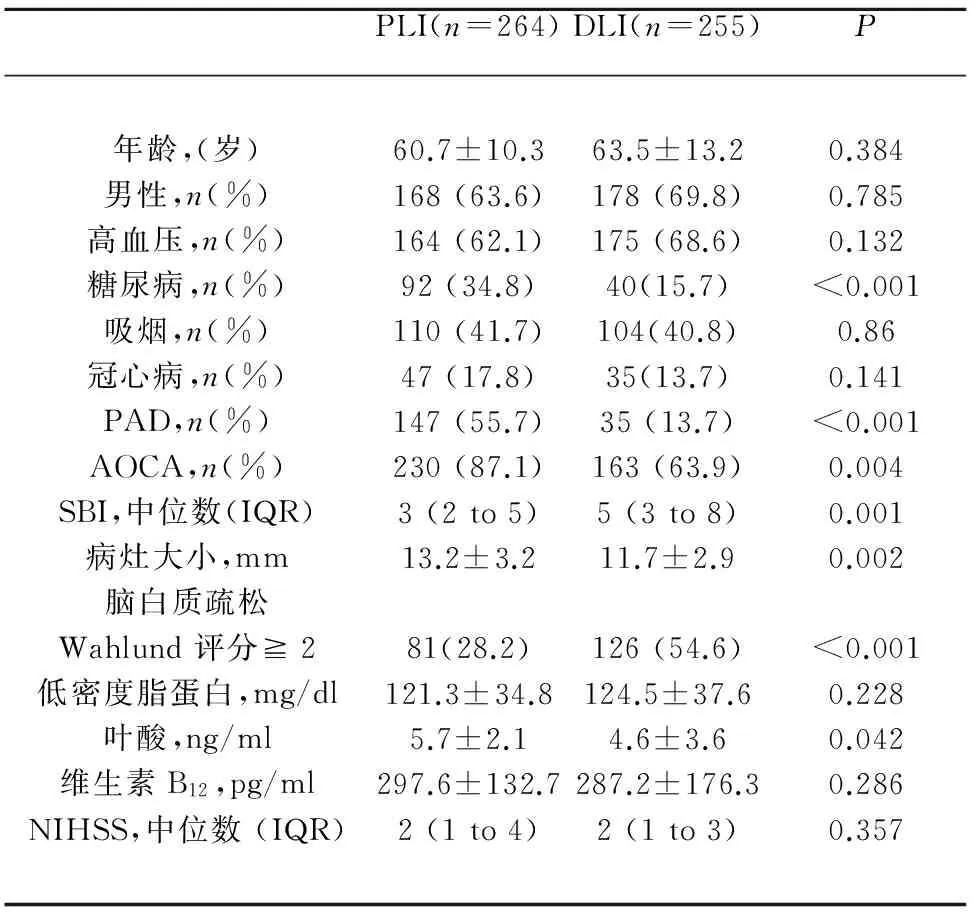
表2 PLI组和DLI组在临床及影像学方面的比较
IQR:四分位间距

表3 PLI组的多因素回归分析
3 讨 论
20世纪70年代,Caplan和Fisher通过尸体解剖对LI的病理改变进行研究。Fisher首先提出导致LI的两种深穿支动脉的病理改变:透明样变性和微粥样斑块[1];前者累及直径小于200 μm的小深穿支动脉,常导致多发、小的、无症状性腔梗;而后者通常累及深穿支动脉近端,管腔直径在200~400 μm,常导致单发的、大的、有症状性腔梗[8]。随后Caplan提出了分支动脉硬化病的概念,是指由于动脉硬化导致分支(穿支)动脉开口的狭窄或阻塞,它可能包括以下几种机制[2,9,10]:(1)载体动脉管腔内的斑块直接阻塞穿支动脉的开口;(2)载体动脉内的斑块扩大延伸到其发出的穿支动脉内导致分支狭窄;(3)穿支动脉内部近开口处形成微粥样瘤;(4)来自近端大动脉的斑块脱落致远端分支开口处的栓塞。由分支动脉病变导致的LI位置往往靠近载体动脉。
临床工作中很难获得LI患者的病理方面研究,那么是否可以通过影像学上病灶的位置来推断LI的发病机制呢?本研究中MCA供血区不同病灶位置的LI在临床及影像学特点方面有着显著差别:梗死灶位置靠近载体动脉的PLI具有较高的PAD及颅内外AOCA的患病率,多因素回归分析提示PAD和AOCA为PLI的独立危险因素;然而病灶位置远离载体动脉的DLI具有较严重的脑白质疏松和SBI,多因素回归分析提示脑白质疏松和SBI为DLI的独立危险因素。脑白质疏松和SBI与小血管(直径<200 μm)的透明样变或纤维素样坏死有关[11,12],因此我们将脑白质疏松和SBI作为小血管病变的标志,而PAD和AOCA可以作为动脉粥样硬化的标志。那么根据我们的研究结果我们可以得出这样的推断:近端LI的发病机制可能与动脉硬化有关,远端LI的发病机制可能与透明样变有关。
对519例患者的临床危险因素的研究发现,高龄、女性、高低密度脂蛋白血症为PAD的危险因素。冠心病增加PAD风险,吸烟增加小血管病变风险。糖尿病在PAD(+)组和PLI组中的发生率均显著增高,提示糖尿病与大血管动脉硬化关系密切[13]。叶酸在PAD(-)组和DLI组中的水平偏低,且有统计学意义,可能与叶酸抑制半胱氨酸的分解[14],导致高同型半胱氨酸血症,而后者被证明与脑白质疏松和SBI有关[15,16],因此低叶酸血症可能加重小血管病变。高血压病被认为是小血管透明样变的传统危险因素,但是在本研究中并未显示出组间的显著差异,这可能与我们的研究所选择的人群为住院患者,具有一定的选择偏倚有关。
本研究通过对LI不同的病灶位置来推断LI的发病机制的差异,具有一定的临床实用价值。首先对LI的临床治疗有一定的指导意义,控制好糖尿病和高脂血症可以延缓动脉粥样硬化的进程,然而避免低叶酸血症有助于预防小血管透明样变的发生和发展。临床治疗上依据不同的发病机制也应采取不同的策略,PLI患者的动脉硬化机制使其对他汀类药物的抗动脉硬化有良好效果[17],该类患者更应该强调抗血小板聚集药物及他汀药物在二级预防中的重要性。DLI患者因为可能存在相对严重的小血管病变而增加颅内出血的风险性[18],因此DLI患者在应用抗血小板聚集药物时要谨慎,尤其是合并严重白质疏松或多发SBI的患者[19,20],双联抗血小板可能增加出血的风险。另外这两类患者在临床预后方面可能有着不同的结局,研究发现MCA供血区近端腔梗患者72 h内神经功能恶化(NIHSS评分恶化大于或等于2分)比例显著高于远端腔梗患者[21]。PLI患者脑卒中复发率较高[22],且患大面积梗死风险较高,同时周身系统性动脉粥样硬化将使冠心病和间歇性跛行的发生率增高[23]。有证据表明远端单发皮质下腔梗患者的1年不良预后发生率较近端腔梗患者显著增高[24],远期预后上小血管病变突出的DLI患者除了具有自发性颅内出血倾向外,在远期死亡率及肢体运动障碍方面不容乐观,尤其是有高血压及严重SBI和白质疏松的患者[25]。另有研究发现伴有严重的脑白质疏松和多发SBI的患者在认知功能损害方面明显增高[26,27]。
我们的研究具有一定的局限性,首先,我们是用临床旁证推断腔梗的不同发病机制,缺乏病理学方面的证实与支持;第二,我们对PAD和AOCA的评估应用的是MRA,其敏感性及特异性不如DSA;第三,我们的研究中未涉及腔梗患者预后,若对两种病灶位置的预后进行分析会使研究更加完整。上述几点仍需未来的研究予以完善。
4 结 论
根据病灶与颅内载体动脉的位置关系我们可以将MCA供血区LI分为近端梗死和远端梗死两类。两类LI在临床特点和影像学表现上的显著差异提示LI发病机制的异质性;病灶位置靠近载体动脉的近端LI的发病机制可能与动脉硬化有关;病灶位置远离载体动脉的远端LI的发病机制可能与微血管透明样变性有关。
[1]Fisher CM. Capsular infarcts:the underlying vascular lesions[J]. Arch Neurol,1979,36:65-73.
[2]Caplan LR. Intracranial branch atheromatous disease:a neglencted,understudied,and underused concept[J]. Neurology,1989,39:1246-1250.
[3]Nah HW,Kang DW,Kwon SU,et al. Diversity of single small subcortical infarctionsaccording to infarct location and parent artery disease analysis of indicators for small vessel disease and atherosclerosis[J]. Stroke,2010,41:2822-2827.
[4]Bogousslavsky J,Regli F,Maeder P. Intracranial large-artery disease and lacunar infarction[J]. Cerebrovasc Dis,1991,1:154-159.
[5]Li GW,Zheng GY,Li JG,et al. Relationship between carotid atherosclerosis and cerebral infarction[J]. Chin Med Sci J,2010,25:32-37.
[6]Wahlund LO,Barkhof F,Fazekas F,et al. A new rating scale for age-related white matter changes applicable to MRI and CT[J]. Stroke,2001,32:1318-1322.
[7]Boiten J,Lodder J,Kessels F. Two clinically distinct lacunar infarct entities a hypothesis[J]. Stroke,1993,24:652-656.
[8]Kim JS. Pure lateral medullary infarction:clinical-radiological correlation of 130 acute,consecutive patients[J]. Brain,2003,126:1864-1872.
[9] Lastilla M. Lacunar infarct[J]. Clin Exp Hyperten,2006,28:205-215.
[10]Kwan MW,Mak W,Cheung RT,et al. Ischemic stroke related to intracranial branch atheromatous disease and comparison with large and small artery diseases[J]. J Neurol Sci,2011,303:80-84.
[11]Vermeer SE,van Dijk EJ,Koudstaal PJ,et al. Homocysteine,silent brain infarcts,and white matter lesions:The Rotterdam scan study[J]. Ann Neurol,2002,51:285-289.
[12]Kim MH,Moon JS,Park SY,et al. Different risk factor profiles between silent brain infarction and symptomatic lacunar infarction[J]. Eur Neurol,2011,65:250-256.
[13]Kim BJ,Lee SH,Kang BS,et al. Diabetes increases large artery diseases,but not small artery diseases in the brain[J]. J Neurol,2008,255:1176-1181.
[14]Malinow MR,Duell PB,Williams MA,et al. Short-term folic acid supplementation induces variable and paradoxical changes in plasma homocyst(e)ine concentrations[J]. Lipids,2001,36:S27-S32.
[15]Khan U,Crossley C,Kalra L,et al. Homocysteine and its relationship to stroke subtypes in a UK black population:the south London ethnicity and stroke study[J]. Stroke,2008,39:2943-2949.
[16]Sasaki T,Watanabe M,Nagai Y,et al. Association of plasma homocysteine concentration with atherosclerotic carotid plaques and lacunar infarction[J]. Stroke,2002,33:1493-1496.
[17]Mok VCT,Lam WWM,Chen XY,et al. Statins for asymptomatic middle cerebral artery stenosis:The Regression of Cerebral Artery Stenosis Study[J]. Cerebrovasc Dis,2009,28:18-25.
[18]Schmal M,Marini C,Carolei A,et al. Different vascular risk factor profiles among cortical infarcts,small deep infarcts,and primary intracerebral haemorrhage point to different types of underlying vasculopathy. A study from the L’Aquila stroke registry[J]. Cerebrovasc Dis,1998,8:14-19.
[19]O’Sullivan M. Leukoaraiosis[J]. Pract Neurol,2008,8:26-38.
[20]王本国,林棉,杨楠,等. 脑微出血在不同脑血管病患者中的患病率及相关危险因素分析[J]. 中风与神经疾病杂志,2010,27(11):984-987.
[21]Duan Z,Fu C,Chen B,et al. Lesion patterns of small subcortical infarct and its association with early neurological deterioration[J]. Neurol Sci,2015,36:1851-1857.
[22]Arboix A,Marti-Vilalta JL. Lacunar stroke [J]. Expert Rev Neurother,2009,9:179-196.
[23]Bang OY,Joo SY,Lee PH,et al. The course of patients with lacunar infarcts and a parent arterial lesion:similarities to large artery vs small artery disease[J]. Arch Neurol,2004,61:514-519.
[24]Yang X,Pu Y,Liu L,et al. The infarct location predicts the outcome of single small subcortical infarction in the territory of the middle cerebral artery[J]. J Stroke Cerebrovasc Dis,2014,23:1678-1681.
[25]de Jong G,Kessels F,Lodder J. Two types of lacunar infarcts:further arguments from a study on prognosis[J]. Stroke,2002,33:2072-2076.
[26]Wen HM,Mok VC,Fan YH,et al. Effect of white matter changes on cognitive impairment in patients with lacunar infarcts[J]. Stroke,2004,35:1826-1830.
[27]Schmidt R,Petrovic K,Ropele S,et al. Progression of leukoaraiosis and cognition[J]. Stroke,2007,38:2619-2625.
Lesion location of lacunar infarction in middle cerebral artery and its association with heterogeneity of pathogenesis
WENLulu,HANDong,FENGJuan.
(DepartmentofNeurology,TheAffiliatedShengjingHospitalofChinaMedicalUniversity,Shenyang110004,China)
ObjectiveWe sought to identify the heterogeneity of the pathogenesis of lacunar infarction (LI) by comparing the clinical characteristics and imaging features of LIs according to lesion location in relation to parent artery. MethodsFive hundred and nineteen patients with acute single lacunar infarction,demonstrated by diffusion-weighted imaging in the perforator territory of middle cerebral artery from October 2009 to October 2015,were involved in our study. We divided the patients into two groups according to the relationship between lesion location and the parent artery:proximal lacunar infarction (PLI) and distal lacunar infarction (DLI). Clinical and imaging characteristics were studied and compared between two groups,including parent artery disease (PAD),atherosclerosis of other cerebral arteries (AOCA),leucoaraiosis,silent brain infarction (SBI),and some vascular risk factors. ResultsAge,male,smoking,diabetes,coronary heart disease,AOCA,and low-density cholesterol were risk factors of PAD. PLI group had larger lesion size,and greater frequency of diabetes mellitus,while the DLI group had lower serum folic acid. PAD and AOCA increased the prevalence of PLI independently. Leucoaraiosis and SBI were protective factors of PLI. ConclusionThere are significant differences of lacunar infarction in clinical characteristics and imaging features according to lesion location. We regard PAD and AOCA as indicators of atherosclerosis and leukoariosis and SBI as indicators of lipohyalinosis of small vessels. The results of our study suggest the heterogeneous pathogenesis of lacunar infarction;proximal infarction seems to be related with atherosclerosis while distal infarction is closely associated with lipohyalinosis.
Lacunar infarction;Pathogenesis;Lesion location;Parent artery disease;Leukoaraiosis
1003-2754(2016)05-0406-05
2016-01-30;
2016-05-03
(中国医科大学附属盛京医院第一神经内科,辽宁 沈阳 110004)
冯娟,E-mail:wenluluwilla@126.com;
韩冬,E-mail:handonghawk@163.com
R743.3
A
