干扰 ATM基因表达增强胃癌细胞 AGS的放射敏感性
2016-11-12刘大伟
郑 旭 刘 丹 刘大伟 刘 帆
(中国医科大学附属第四医院肿瘤放射治疗科 沈阳 110032)
干扰 ATM基因表达增强胃癌细胞 AGS的放射敏感性
郑 旭刘 丹刘大伟刘 帆
(中国医科大学附属第四医院肿瘤放射治疗科沈阳 110032)
为探讨RNA干扰共济失调毛细血管扩张性突变(Ataxia-telangiectasia mutated, ATM)基因表达后对胃癌细胞AGS放射敏感性的影响,通过构建ATM基因RNA干扰质粒转染AGS细胞,获得干扰效率高的克隆细胞AGS-Ri-ATM,并采用RT-PCR和Western blot分别检测mRNA和蛋白表达水平,平板克隆形成实验观察细胞经放射后对细胞生长的影响,流式细胞术检测细胞周期和凋亡情况。检测结果显示其ATM基因表达被干扰下调。经X射线照射至不同吸收剂量,AGS-Ri-ATM平板克隆形成数量/率远低于AGS-Vector的平板克隆形成数量/率,差异显著(p<0.05),具有统计学意义。流式细胞术检测显示当吸收剂量为4 Gy时,AGS-Ri-ATM被阻滞在G1期,同时在12 h后出现明显的凋亡想象。结果表明,ATM基因被干扰后可以诱导细胞周期的阻滞,以及凋亡的增加而增强AGS细胞的放射敏感性。
毛细血管扩张共济失调突变基因,RNA干扰,胃癌,放射敏感性
CLCQ691, TL7
胃癌是我国的常见肿瘤之一,其发病率和死亡率分别位于所有癌症的第二和第三位[1],严重威胁着我国人民的身心健康。目前胃癌的治疗通常首选手术,但大多数国内就诊的患者一经查出胃癌已达中晚期无法进行手术。有很多患者需要通过化疗、放疗或放化疗结合的方式进行治疗,但是胃癌放疗效果不佳的问题一直困扰着医务人员和患者。
大量的研究报道表明,辐照后诱导的DNA损伤修复,尤其是DNA双链断裂修复能力会使肿瘤细胞对放化疗产生耐受抵抗力[2]。其中,共济失调毛细血管扩张性突变(Ataxia-telangiectasia mutated,ATM)基因主要参与细胞周期调控、DNA损伤的识别与修复过程,可以感知辐射诱导的受损DNA双链断裂,通过激活p53和p21等基因来激活G1/S期检测点等的方式,使损伤细胞停止在周期特定节点,并对其DNA进行修复[3-4]。本研究的目的是探讨ATM蛋白对胃癌细胞在放疗过程中的影响。
1 材料与方法
1.1材料
人胃癌细胞系 AGS购自北京协和医学院细胞库;TRizol、LipofectaminTM2000购自Invitrogen (Life science)公司;ATM 干扰表达质粒购自上海吉凯基因设计构建合成,并提供细胞筛选所用的嘌呤霉素;DMEM培养基和胎牛血清购自Gibco公司;细胞周期检测试剂盒购自南京凯基生物公司;ATM、β-actin引物有大连TaKaRa生物公司合成;逆转录和PCR试剂盒购自全式金(Transgen)公司;ATM、β-actin抗体购自ProteinTech公司,山羊抗兔二抗购自中杉金桥生物公司,Western Blot使用的PAGE胶配制试剂均购自Genestar公司。
1.2细胞培养
AGS细胞采用含10% FBS的DMEM培养基培养(Gibco公司),培养液中加入青霉素(100 U/mL)和链霉素(100 μg/mL)。细胞按常规置37 ℃、5% CO2条件下培养,取生长状态良好的细胞用于实验。
1.3脂质体介导的细胞转染
实验使用脂质体Lipofectimine 2000(Invitrogen公司),转染前1 d将细胞接种至35 mm培养皿,调整细胞密度至说明书推荐密度,按照Lipofectimine 2 000使用说明书将10 μL脂质体和4 μg质粒分别加入到250 μL无血清DMEM培养基中孵育5 min,后将两者混合均匀,静置放置20 min后将其加入预先用磷酸缓冲盐溶液(Phosphate buffer saline, PBS)清洗过并加有2 mL无血清DMEM培养基的细胞内,4~6 h后更换 10%胎牛血清的DMEM培养基,48 h后收集细胞提取蛋白,Western Blot检测瞬时转染效果;同时经含2 μg/mL嘌呤霉素培养基筛选,获取稳定干扰ATM表达的克隆。
1.4细胞RNA提取
按照Trizol试剂一步法提取RNA。取对数生长期的细胞,弃除上清,按1 mL/10 cm2培养皿贴壁细胞加入相应量的Trizol试剂,吹打数次使细胞裂解,再经氯仿抽提(每1 mL Trizol加0.2 mL),异丙醇沉淀(每1 mL Trizol加入0.5 mL),75%乙醇(每1 mL Trizol加入1 mL)洗盐,沉淀干燥后以适量DEPC-H2O溶解,1% Argrose胶鉴定,使用Thermo “NanoDrop 2000”微量紫外分光光度计进行浓度测定。
1.5RT-PCR检测
取定量的总RNA 1 μg,按照逆转录试剂盒使用说明书逆转合成cDNA。普通PCR反应体系的总体积为20 μL,包括cDNA模板1 μL,上下游引物各0.5 μL,2×Taq Mix(Transgen公司)10 μL,加双蒸水至20 μL。扩增运行体系:95 ℃变性3 min,94 ℃30 s,60 ℃ 30 s,72 ℃ 30 s,72 ℃延伸10 min。β-actin的表达水平作为内参照,引物序列信息如下:ATM-F:'-CGTGCCAGAATGTGAACACC-3',ATM-R:'-AGCCAATACTGGACTGGTGC-3',扩增产物大小为152bp;β-actin-F:'-TTAGTTGCGTTACACCCTTTC-3',β-actin-R:5'-ACCTTCACCGTTCCAGTTT-3',扩增产物大小为150 bp。取10 μL LPCR反应产物进行1.5%琼脂糖凝胶电泳检测扩增结果。
1.6细胞蛋白免疫印迹实验
待细胞长至80%~90%细胞密度时收集细胞,细胞裂解液裂解细胞,使用 NanoDrop仪器采用260/280 nm UV法测定蛋白浓度。将50 μg样品加入5×SDS凝胶加样缓冲液,进行SDS-PAGE电泳。电泳结束后,采用湿式电转方法350 mA恒流冰浴转膜(PVDF,Pharmacia公司)120 min,5%脱脂牛奶室温封闭1 h,加一抗后放入4 ℃冰箱中孵育过夜,ATM工作浓度为1∶500,β-actin工作浓度为1∶10 000稀释;隔天后0.1% PBST洗膜液水平摇床清洗3次,10 min/次;加入辣根过氧化酶标记二抗(1∶2 000),室温摇床缓慢作用1 h;0.1% PBST洗膜液水平摇床清洗3次,10 min/次,ECL发光液检测,使用凝胶成像分析仪曝光拍照记录。
1.7细胞照射方法
把细胞消化计数接种后,采用本院Varian2100C直线加速器6 MV X线为放射源。源皮距离100 cm照射,剂量率为200 cGy/min。照射时各孔培养液量相同,并根据实验要求照射至不同吸收剂量。
1.8平板克隆形成实验检测细胞放射敏感性
将处于对数生长期的细胞消化成单细胞悬液后,接种500个细胞至60 mm培养皿中,经X线照射至吸收剂量分别为0、2、4、6、8 Gy,每组重复3次。照射后置于恒温37 ℃,5% CO2培养箱培养,每隔3 d更换1次培养基;培养2周左右,待细胞克隆生长到一定大小时,去除培养基,终止培养,用冰甲醇固定30 min,0.5%结晶紫染料染色15 min,PBS冲洗,晾干;使用高像素照相机拍摄细胞克隆形成,计数克隆个数,并按照“平板克隆形成率(%) =(细胞克隆数/接种细胞数)× 100%”计算。
1.9流式细胞术检测细胞周期
将对数生长期的细胞用PBS清洗3次,胰酶消化细胞,接种至60 mm培养皿中。按0、6、12、24 h胰酶消化收集细胞,1 000 r/min离心5 min后,PBS重悬细胞后再次离心,留少量PBS液体,打散细胞,加入2 mL 70%乙醇4 ℃固定过夜;1 000 r/min离心5 min后去除乙醇,用PBS将细胞清洗两次,加入Binding buffer溶液100 μL,再加入碘化丙啶溶液400 μL,混匀,避光反应15 min即可使用流式细胞仪进行检测。
1.10 统计学方法
数据处理采用SPSS 20.0软件,以配对t检验进行统计分析,p<0.05为差异有显著性。
2 结果
2.1干扰ATM基因表达克隆的构建
使用表达ATM基因的AGS细胞采用吉凯基因公司构建的 GV248-Ri-ATM质粒用于稳定转染细胞。转染细胞并经含2 μg/mL嘌呤霉素的培养基进行筛选,约1个月后形成稳定干扰ATM基因表达的单克隆。克隆细胞扩大培养后提取 RNA和蛋白分别经PCR和Western Blot鉴定, 结果见图1。图1(a)显示的mRNA水平的检测结果,相比较空载细胞AGS-Vector,经ATM基因干扰质粒转染得到的克隆AGS-Ri-ATM的mRNA表达明显减少。ATM基因的蛋白表达水平的检测结果(图1(b))与mRNA水平的结果基本一致,说明稳定敲减 ATM基因表达的AGS细胞构建成功,可以用于后续的实验。
2.2平板克隆形成实验检测结果
将空载细胞AGS-Vector和ATM基因干扰细胞AGS-Ri-ATM各500个,分别接种至直径为60 mm的培养皿中,分别经X射线照射至5个不同剂量后,继续培养2周,结果如图2所示。
在吸收剂量为 0 Gy时,AGS-Vector细胞和AGS-Ri-ATM细胞形成的克隆大小和数目基本无差异,但是随着吸收剂量的升高,平板克隆形成的个数也随着下降,但是干扰表达ATM细胞,在2、4、6、8 Gy剂量下形成的克隆个数和克隆形成率均要少于Vector细胞,经统计分析,两者存在明显差异,p<0.05,具体见表1。
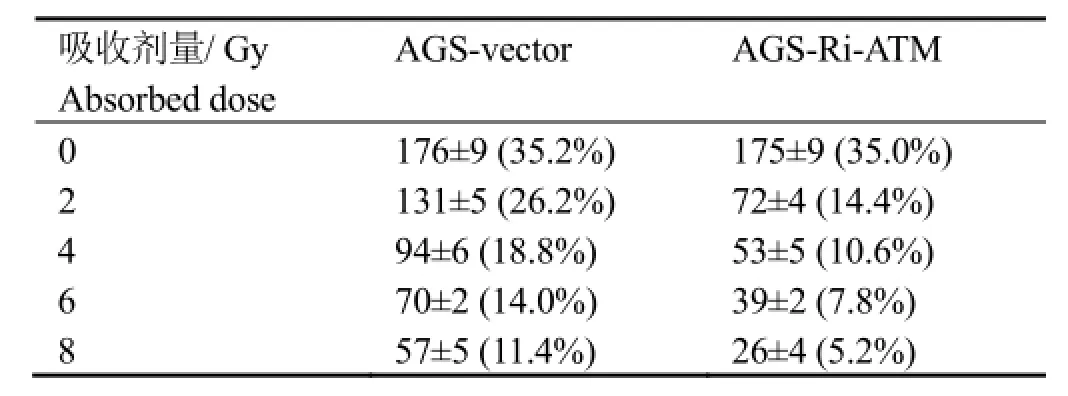
表1 不同吸收剂量下细胞克隆形成数/率Table 1 The colonies formation numbers/ratios of Ri-ATM at different doses of radiation
2.3细胞周期检查结果
用于细胞周期检测的细胞在收集前进行拍照记录,同时进行比较细胞形态学分析。当辐照至吸收剂量4 Gy时,分别收集0、6、12、24 h时的AGS-Ri-ATM细胞。结果如图3和图4所示。其中,图3流式细胞术分析结果显示,在12 h后细胞出现凋亡峰,24 h凋亡峰更为明显,而AGS空载细胞并没有明显的凋亡峰存在,同时细胞被阻滞在G1期。
图4中细胞拍照显示,12 h后AGS-Ri-ATM细胞形态出现了凋亡的细胞碎片,且细胞较AGS-Vector稀疏,细胞不够丰满充实。
3 讨论
肿瘤放化疗的目的是杀伤肿瘤细胞,促进细胞凋亡,或者阻滞细胞周期进展,但是在肿瘤细胞中同时又存在逃避凋亡的机制。正常细胞受到损伤时,尤其是DNA损伤时,细胞可以激活Checkpoint相关蛋白,使细胞停滞前进,以保证DNA修复后再继续下一个进程[5]。有很多报道ATM基因是细胞周期检查点的主要成员之一[6],本研究使用表达ATM基因的AGS细胞为模型,通过干扰ATM基因的表达对放射的应答产生了明显的影响。在平板集落形成上,ATM基因表达被干扰的克隆细胞经过照射后形成的克隆个数明显减少,说明 ATM基因的表达对放疗有抵制力。这与前面有些报道基本一致[7-9]。
王莉等[9]检测了几种胃癌细胞系中 ATM基因的表达情况,并对 ATM基因的功能进行了研究,观察到ATM基因可以保护BGC823细胞抵制DNA损伤剂对其造成凋亡。本研究同样使用了细胞周期流式细胞术实验,发现AGS细胞中干扰ATM基因表达后可以明显增强放射对其造成的凋亡,从实时拍摄的细胞图片上也能清晰地观察到,干扰细胞在照射12 h后已经有凋亡细胞的迹象存在,细胞变得更加稀疏和上漂现象,表明已有细胞死亡。而表达ATM基因的AGS细胞则生长良好,没有明显的凋亡迹象。由此可见,ATM基因突变或者缺失时,会严重影响细胞损伤后的及时修复,导致细胞凋亡,同时也会表现出对放射或电离辐射的敏感性增强特性,因此,研究 ATM基因对肿瘤的影响有着非常重要的意义,同时对那些ATM基因正常表达的肿瘤细胞如何改造影响其对放化疗的敏感性是非常有帮助的。
放射敏感性是放射治疗肿瘤必须重视的一个问题,也是决定放疗效果的关键所在,已有的报道中,甲基黄嘌呤被证实可以抑制 ATM基因路径,从而增强肿瘤细胞的放射敏感性[10]。除此之外,还有另一种较有发展前景的放射增敏剂7-羟基星状孢菌素(UCN-01),它可以抑制Chk1激酶的活性,作用于ATM基因下游的DNA损伤监测点,从而提高肿瘤细胞敏感性[11]。在肿瘤治疗过程中,如果能有更多有效的,毒性小的药物或其他方式将细胞的 ATM基因丧失或阻滞,使其无法行使相应的功能,则会增加肿瘤细胞对放射和辐射的敏感性[12]。对 ATM基因更加深入的研究将为肿瘤的预防、治疗和放化疗药物敏感性问题提供更多的途径和靶点。尤其对那些非手术治疗的胃癌患者提供了治疗的可能性。
1郝捷, 陈万青. 2012中国肿瘤登记年报[M]. 北京: 军事医学科学院出版社, 2012. HAO Jie, CHEN Wanqing. Report of incidence and mortality in China cancer registries, 2012[M]. Beijing:Military Academy of Medical Sciences Press, 2012.
2Martin N M. DNA repair inhibition and cancer therapy[J]. Journal of Photochemistry & Photobiology B Biology,2001, 63(1): 167-170.
3Langerak P, Russell P. Regulatory networks integrating cell cycle control with DNA damage checkpoints and double-strand break repair[J]. Philosophical Transactions of the Royal Society B Biological Sciences, 2011,366(1584): 3562-3571.
4Mckinnon P J. ATM and ataxia telangiectasia[J]. Embo Reports, 2004, 5(8): 772-776.
5Abraham R T. Cell cycle checkpoint signaling through the ATM and ATR kinases[J]. Genes & Development, 2001,15(17): 2177-2196.
6朱虹, 缪泽鸿, 丁健. ATM、ATR和DNA损伤介导的细胞周期阻滞[J]. 生命科学, 2007, 19(2): 139-148. DOI:10.3969/j.issn.1004-0374.2007.02.008. ZHU Hong, MIAO Zehong, DING Jian. ATM, ATR and DNA damage-induced cell cycle arrest[J]. Chinese Bulletin of Life Sciences, 2007, 19(2): 139-148. DOI:10.3969/j.issn.1004-0374.2007.02.008.
7易汉杰, 陈龙华, 李高峰. ATM基因经RNAi表达沉默后对肝癌细胞放射敏感性的影响[J]. 实用医学杂志,2009, 25(10): 1550-1552. DOI: 10.3969/j.issn.1006-5725. 2009.10.006. YI Hanjie, CHEN Longhua, LI Gaofeng. The study of ATM gene to increase radiotherapy sensitivity of hepatocelluar carcinoma[J]. The Journal of Practical Medicine, 2009, 25(10): 1550-1552. DOI: 10.3969/j.issn. 1006-5725.2009.10.006.
8刘小群, 乔田奎. 靶向沉默ATM基因对人肺腺癌A549细胞放射敏感性影响[J]. 中华放射肿瘤学杂志, 2014,23(1): 73-77. DOI: 10.3760/cma.j.issn.1004-4221.2014. 01.021. LIU Xiaoqun, QIAO Tiankui. Effect of silencing of ATM expression by siRNA on radiosensitivity of human lung adenocarcinoma A549cells[J]. Chinese Journal of Radiation Oncology, 2014, 23(1): 73-77. DOI: 10.3760/ cma.j.issn.1004-4221.2014.01.021.
9王莉, 尹芳, 杜昱蕾, 等. ATM在人胃癌细胞系的表达及其在细胞 DNA损伤中的作用[J]. 现代肿瘤医学,2010, 18(3): 433-436. DOI: 10.3969/j.issn.1672-4992. 2010.03.001. WANG Li, YIN Fang, DU Yulei, et al. Expression of ATM gene in human gastric carcinoma cell lines and cellular responses to DNA damage[J]. Journal of Modern Oncology, 2010, 18(3): 433-436. DOI: 10.3969/j.issn. 1672-4992.2010.03.001.
10 Bartolazzi A, Gasbarri A, Papotti M, et al. Application of an immunodiagnostic method for improving preoperative diagnosis of nodular thyroid lesions[J]. Lancet, 2001,357(9269): 1644-1650.
11 Inohara H, Honjo Y, Yoshii T, et al. Expression of galectin-3 in fine-needle aspirates as a diagnostic marker differentiatingbenignfrommalignantthyroid neoplasms[J]. Cancer, 1999, 85(11): 2475-2484.
12 盛方军, 曹建平. ATM参与细胞周期调控分子机制的研究进展[J]. 国外医学遗传学分册, 2005, 28(2): 69-71. DOI: 10.3760/cma.j.issn.1673-4386.2005.02.002. SHENG Fangjun, CAO Jianping. Research progress of ATM molecular mechanisms involved in cell cycle regulation[J]. Section of Genetics Foreign Medical Sciences, 2005, 28(2): 69-71. DOI: 10.3760/cma.j.issn. 1673-4386.2005.02.002
Interference of ATM gene expression increasing the radiosensitivity of AGS cells
ZHENG XuLIU DanLIU DaweiLIU Fan
(Department of Radiation Oncology, the Fourth Affiliated Hospital of China Medical University,Shenyang 110032, China)
To investigate the interference effect of ataxia-telangiectasia mutated (ATM) gene expression on the radiosensitivity of human gastric cancer AGS cells, the plasmid of interfering RNA was used to transfect AGS cells. The mRNA and protein expression levels of ATM gene were measured by RT-PCR and Western blot, respectively. The effect on cell growth after irradiation was analyzed by using the colonies formation assay. Cell cycle and cell apoptosis were analyzed by flow cytometry. The RNA interference plasmid of ATM gene was transfected into AGS cells and AGS-Ri-ATM cells were obtained successfully. The RT-PCR and Western blot results demonstrated that the expression of ATM gene was down-regulated in the AGS-Ri-ATM cells. The colonies formation numbers/ratios of AGS-Ri-ATM cells were less than those of AGS-Vector. The flow cytometry demonstrated that G1 arrest was induced and apoptosis appeared in AGS-Ri-ATM cells after irradiation at 4 Gy for 12 h, which was not observed in AGS-Vector cells. Interference of ATM expression increased the radiosensitivity of human gastric cancer AGS cells.
Ataxia-telangiectasia mutated (ATM) gene, RNA interference, Gastric cancer, Radiosensitivity
ZHENG Xu (male) was born in August 1984, and received his bachelor degree of radiation medicine from Jilin University in 2008. Now he is a physicist in Department of Radiation Oncology, the Fourth Affiliated Hospital of China Medical University. E-mail: zhengxu19840826@163.com
27 April 2016; accepted 3 June 2016
Q691,TL7
10.11889/j.1000-3436.2016.rrj.34.050202
郑旭,男,1984年8月出生,2008年于吉林大学获放射医学学士学位,现为中国医科大学附属第四医院肿瘤放射治疗科物理师,从事肿瘤放射物理工作,E-mail: zhengxu19840826@163.com
初稿2016-04-27;修回2016-06-03
