纤维素酶水解处理提高燕麦全粉中总多酚含量与抗氧化活性
2016-11-11陈东方师俊玲胡新中
陈东方,师俊玲*,胡新中
纤维素酶水解处理提高燕麦全粉中总多酚含量与抗氧化活性
陈东方1,师俊玲2,*,胡新中3
(1.西北农林科技大学食品科学与工程学院,陕西 杨凌 712100;2.西北工业大学生命学院,陕西 西安 710027;3.陕西师范大学食品工程与营养科学学院,陕西 西安 710062)
采用Folin-酚法和高效液相色谱法考察了纤维素酶水解处理对燕麦粉中总多酚及多酚组分含量的影响,并利用2,2’-联氮双-(3-乙基苯并噻唑啉-6-磺酸)二铵盐(2,2’-azinobis (3-ethylbenzothiazoline-6-sulfonic acid) diammonium salt,ABTS)自由基、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除能力、铁离子还原能力(ferric reducing antioxidant power,FRAP)和蛋白损伤修复等方法测定酶解前后提取液的体外抗氧化活性。结果表明:酶解处理以后可显著增加燕麦粉中总多酚含量,尤其是阿魏酸含量提高了11~24 倍;酶解处理后燕麦粉多酚提取物的ABTS+·、DPPH自由基清除能力和FRAP值等体外抗氧化活性和蛋白氧化损伤修复能力得到显著增强。总体而言,纤维素酶水解处理能够有效提高燕麦粉中总多酚含量及其功能活性,主要原因可能是阿魏酸等酚酸物质含量的提高。
燕麦;纤维素酶;多酚;抗氧化活性;蛋白氧化损伤保护
燕麦及其相关产品因为具有预防冠心病[1]、降低胆固醇[2-3]、改善糖尿病[4-6]、抗炎 症[7]等多种功能而成为食品加工的热点,并受到越来越多消费者的青睐。速溶燕麦全粉、燕麦麸皮等冲调性饮料成为近年来新兴产品。然而,这些产品通常会因为含有燕麦麸皮而口感粗糙。纤维素酶处理可以通过水解麸皮中纤维素而有望提高食品的可食性和适口感[8]。该处理对燕麦的功能活性会产生什么影响,尚不清楚。
根据已有研究成果,谷物中纤维素除了作为重要的膳食纤维来源之外,还包含着一些多酚物质。这些多酚物质主要以酯键与纤维素、半纤维素等物质结合在细胞壁中。特别是谷物中最主要的酚酸物质通常是以结合态和游离态存在的,其余部分是以可溶性螯合态存在[9]。谷物籽粒发芽过程中,多酚类物质的含量会有所提高,就是因为种子萌发过程中产生的淀粉酶、蛋白酶、脂肪酶及纤维素酶引发的酶解反应,使得结合态酚类物质释放出来所致[10]。已有报道指出,用纤维素酶水解燕麦麸皮能够有效增加其中的多酚含量[11]。但有关纤维素酶水解处理是否也能提高燕麦粉中多酚含量,尚不得而知。
此外,多酚作为一种重要的生物活性成分,已被证实具有抗自由基[12-13]、预防生物大分子损伤[14-15]、抗炎症[16]、抗癌[17]、抑菌[18-20]等多种药理活性,提高食品中多酚物质含量能够在一定程度上提高食品的功能活性。为此,本实验考察了纤维素酶水解处理对燕麦粉中多酚含量、多酚种类的影响,以及对燕麦粉的体外抗氧化活性和蛋白氧化损伤修复等功能活性的影响,以期为燕麦的实际加工提供一定的理论指导。
1 材料与方法
1.1 材料与试剂
燕麦品种:白燕2号(2012年收获),由山西省农业科学院提供。
F o l i n-酚试剂、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基、2,4,6-三(2-吡啶基)-1,3,5-三嗪(2,4,6-Tri(2-pyridyl)-striazine,TPTZ)、2,2’-联氮双-(3-乙基苯并噻唑啉-6-磺酸二铵盐)(2,2’-azinobis (3-ethylbenzothiazoline-6-sulfonic acid) diammonium salt,ABTS)、水溶性VE(6-hydroxy-2,5,7,8-tetramethylchroman-2-carboxylic acid,Trolox)、2,2’-偶氮二(2-脒基丙烷)二盐酸盐(2,2’-azobis (2-methylpropion amidine) dihydrochloride,AAPH)、考马斯亮蓝R-250、三羟甲基氨基甲烷(tris (hydroxymethyl) aminomethane,Tris)、甘氨酸(glycine)、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、溴酚蓝(bromophenol blue,BPB)、β-巯基乙醇、四甲基乙二胺(tetramethylethylenediamine,TEMED)均为分析纯;没食子酸、对羟基苯甲醛、咖啡酸、香草醛、对香豆酸、阿魏酸均为色谱纯 美国Sigma公司;纤维素酶(>16 000 U/g) 美国MP Biomedicals公司。
1.2 仪器与设备
UV mini-1240型紫外-可见分光光度计、LC-20A高效液相色谱-二极管阵列检测器 日本岛津公司;精密pH计 上海精密科学仪器有限公司;R-200旋转蒸发仪瑞士Büchi公司。
1.3 方法
1.3.1 燕麦粉的纤维素酶酶解处理
将燕麦籽粒清洗、干燥、粉碎过筛(40 目)后于-20 ℃保存。取(4.0±0.05) g燕麦粉(水分含量10%)与pH 4.8的柠檬酸盐缓冲溶液(0.1 mol/L)按照1∶5(m/V)的料液比混合均匀,50 ℃水浴预热5 min后,酶解组中加入0.4 mL纤维素酶酶液(10 mg/mL,用0.1 mol/L pH 4.8的柠檬酸盐缓冲液溶解),未加酶组中加入0.4 mL柠檬酸盐缓冲液。然后将酶解组和未加酶组均在50 ℃水浴条件下分别处理20、40、60、80 min。处理结束后,及时取样,提取其中多酚类物质,并分析其抗氧化活性及其对蛋白损伤的修复活性。
1.3.2 多酚的提取
参照Yu Liangli等[21]的方法,取经酶解处理后的样品和对照样品,分别与含有体积分数1%的HCl-甲醇溶液按照1∶25(m/V)混合均匀,在25 ℃条件下静置24 h。于4 000×g离心10 min,收集上清。沉淀继续与含有1% HCl的甲醇溶液按照1∶25混合,25 ℃条件下静置24 h。4 000×g离心10 min,合并提取液并在40 ℃条件下旋蒸至干,然后用3 mL甲醇溶解,得提取液于-20 ℃保存,用于后续指标检测分析。
1.3.3 总多酚含量的测定
采用Folin-Ciocalteau法[22]。吸取0.1 mL适度稀释的样品溶液于5 mL试管中,然后,依次加入0.5 mL 0.2 mol/L Folin-酚试剂、0.8 mL 7.5% Na2CO3试剂,混合均匀,在25 ℃条件下避光静置30 min后测定765 nm波长处的吸光度。结果以每克燕麦粉中总多酚含量相当于没食子的量(gallic acid equivalent,GAE)来表示,单位为μmol GAE/g燕麦粉。
1.3.4 多酚组分的测定
参考Robbins等[23]的方法,采用高效液相色谱法(high performance liquid chromatography,HPLC)并略做改进。色谱柱:反相C18柱(250 mm×4.6 mm,5 μm);A相:超纯水(磷酸调pH 2.6);B相:甲醇;流速:0.8 mL/min;检测波长:280 nm;柱温:30 ℃;进样量:15 μL。实验中采用二元线性梯度洗脱,洗脱梯度:0~15 min,15%~25% B;15~25 min,25% B;25~65 min,25%~75% B;65~70 min,75%~15% B;70~75 min,15% B。
1.3.5 体外抗氧化活性的测定
1.3.5.1 ABTS+·清除能力
参考Chun等[24]报道的方法进行。7 mmol/L ABTS+·工作液的配制:准确称取0.057 6 g ABTS,用蒸馏水定容至15 mL,使用前加0.264 mL 140 mmol/L过硫酸钾水溶液,室温避光放置12~16 h,用无水乙醇将吸光度 调整至0.700±0.005后备用。取4 mL ABTS+·工作液于试管中,加入适度稀释后的多酚提取液400 μL,摇匀后于25 ℃水浴中避光反应30 min,用甲醇调零,测定734 nm波长处的吸光度。配制0~2 000 μmol/L的Trolox溶液代替样品做标准曲线。结果以每克燕麦粉中Trolox当量(Trolox equivalent,TE)表示,单位为μmol TE/g燕麦粉。
1.3.5.2 DPPH自由基清除能力
参考Bratt等[25]的方法进行。取500 μL适度稀释过的多酚提取液与0.3 mL 0.6 mmol/L DPPH-乙醇溶液混合,摇匀后,于25 ℃水浴中避光反应30 min。用甲醇调零,测定517 nm波长处的吸光度。配制0~2 000 μmol/L的Trolox溶液代替样品做标准曲线。结果以每克燕麦粉相当于Trolox的量(μmol TE/g燕麦粉)表示。
1.3.5.3 铁还原能力
参考Corral-Aguayo等[26]的方法,采用铁离子还原法(ferric reducing antioxidant power,FRAP)进行。储备液:300 mmol/L醋酸盐溶液,pH 3.6;用40 mmol/L HCl配制的10 mmol/L TPTZ溶液;20 mmol/L FeCl3溶液。临用前将三者按体积比10∶1∶1混合得到TPTZ工作液。将100 μL适度稀释的多酚提取液加到2.0 mL TPTZ工作液中,混匀,37 ℃条件下反应10 min后测定。配制0~2 000 μmol/L的Trolox溶液代替样品做标准曲线。结果以每克燕麦粉相当于Trolox的量(μmol TE/g燕麦粉)表示。
1.3.6 AA PH诱导的蛋白损伤修复
参考乔燕等[27]的方法并略有改动。向0.5 mL离心管中依次加入50 μL 1.2 mg/mL牛血清白蛋白(bovine serum albumin,BSA)溶液和30 μL适度稀释的多酚提取液,混匀。25 ℃水浴下反应30 min,再加入20 μL AAPH(500 mmol/L)溶液,37 ℃水浴反应6 h;同时以50 μL BSA溶液,30 μL甲醇和20 μL磷酸盐缓冲液(pH 7.0)作为阳性对照(P);以50 μL BSA溶液、30 μL甲醇和20 μL AAPH的混合液作为阴性对照(N)。
取20 μL上述反应液到新的离心管中,加入20 μL 2×Loading buffer,100 ℃沸水浴5 min,使蛋白充分变性。配制SDS电泳胶:分离胶为10%,浓缩胶为5%,上样量:15 μL。电泳条件:S1,80 V,20 min;S2,120 V,60 min。电泳结束后,用0.1%考马斯亮蓝R-250染色30 min。过夜脱色后,使用Chemidoc-XRS伯乐凝胶成像系统扫描胶片,使用Quantity One 4.6.2软件分析剩余蛋白质含量(%),其中设定阳性对照(P)的剩余蛋白质含量为100%,其他处理的蛋白含量则是相对于阳性对照的量。蛋白质损伤保护率的计算见下式。
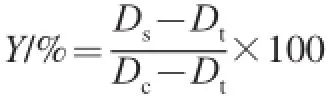
式中:Y为蛋白质损伤保护率/%;Ds为与APPH和样品作用后的剩余蛋白质含量(对照或酶解处理);Dt为与APPH和提取溶剂作用后的剩余蛋白质含量(阴性对照);Dc为与缓冲液和提取溶剂作用后的剩余蛋白质含量(阳性对照)。
2 结果与分析
2.1 酶解处理对总多酚含量的影响

图1 酶解时间对燕麦总多酚含量的影响Fig.1 Polyphenol contents in extracts from heat-treated (control) and cellulase-treated oat samples
由图1可知,经纤维素酶处理的样品中总多酚含量显著高于未加酶处理的样品(P<0.05)。这表明,纤维素酶水解处理能够显著增加燕麦粉中总多酚含量。这与Alrahmany等[11]的结果一致,他们发现:使用碳水化合物酶(戊聚糖复合酶、纤维素酶、淀粉酶、淀粉转葡糖苷酶)处理燕麦麸皮能够显著提高其中的多酚含量。这可能是因为燕麦中的多酚类物质会与多糖、蛋白质及细胞壁成分以结合态的方式螯合在一起,通过相应酶类的水解作用,可以将结合态的多酚释放出来[28]。
值得一提的是,随着加热时间的延长,未加酶组中总多酚含量总体呈现小幅度增加趋势,但在处理的前20 min内会有所降低,随后缓慢回升。这可能是由于处理前期,加热会对原来体系中游离多酚造成损伤;之后缓慢上升可能是因为加热处理促进了结合态多酚的释放,才使其可提取多酚含量增加。而在经纤维素酶处理的样品中,并未见到这种下降过程。这可能是因为酶解处理能够更迅速、更多地释放出结合态多酚,而且这种增加量大于游离态多酚损失而造成的下降幅度,从而才显示出总体上升趋势。同时,加热处理后期多酚的小幅度上升也说明,适当的加热处理可能会有利于燕麦全粉中可提取性多酚物质的增加。
2.2 酶解处理对燕麦粉酚酸组成的影响
目前已发现燕麦中含有多种酚酸物质,如咖啡酸、阿魏酸、对香豆酸、对羟基苯甲酸、对羟基苯甲醛、香草醛、香草酸、芥子酸、原儿茶酸、丁香酸、没食子酸等[28-29]。为了进一步研究酶解处理对这些酚酸组分的影响,本实验对燕麦粉中主要的酚酸阿魏酸、咖啡酸、对香豆酸、没食子酸、对羟基苯甲醛、香草醛的含量进行了高效液相分析,结果如图2所示。高效液相色谱测定结果发现,经纤维素酶酶解处理后,所有检测的酚酸物质含量均比未加酶组显著增加(P<0.05)。其中对羟基苯甲醛、咖啡酸和香草醛的含量增加了17%~35%,没食子酸和对香豆酸的含量增加了1~2 倍,而阿魏酸的增加量最为突出:酶解处理40、80 min时,样品中的阿魏酸含量分别增加了约11、24 倍。同时,未加酶组中阿魏酸的含量并无显著变化(见表1)。这结果说明,纤维素酶酶解处理后增加的总酚含量主要归因于酚酸含量尤其是阿魏酸含量的增加(r=0.97,P<0.05)。据Ishii[30]和Hatfi eld[31]等报道,谷物中酚酸在细胞壁中主要与纤维素、半纤维素等物质以酯键结合。Adom等[9]发现,燕麦麸皮中阿魏酸有98%都是以结合态形式存在的。使用纤维素酶酶解处理燕麦粉,能够有效酶解麸皮中的纤维素、半纤维素,释放出其中结合态酚酸,特别是阿魏酸。
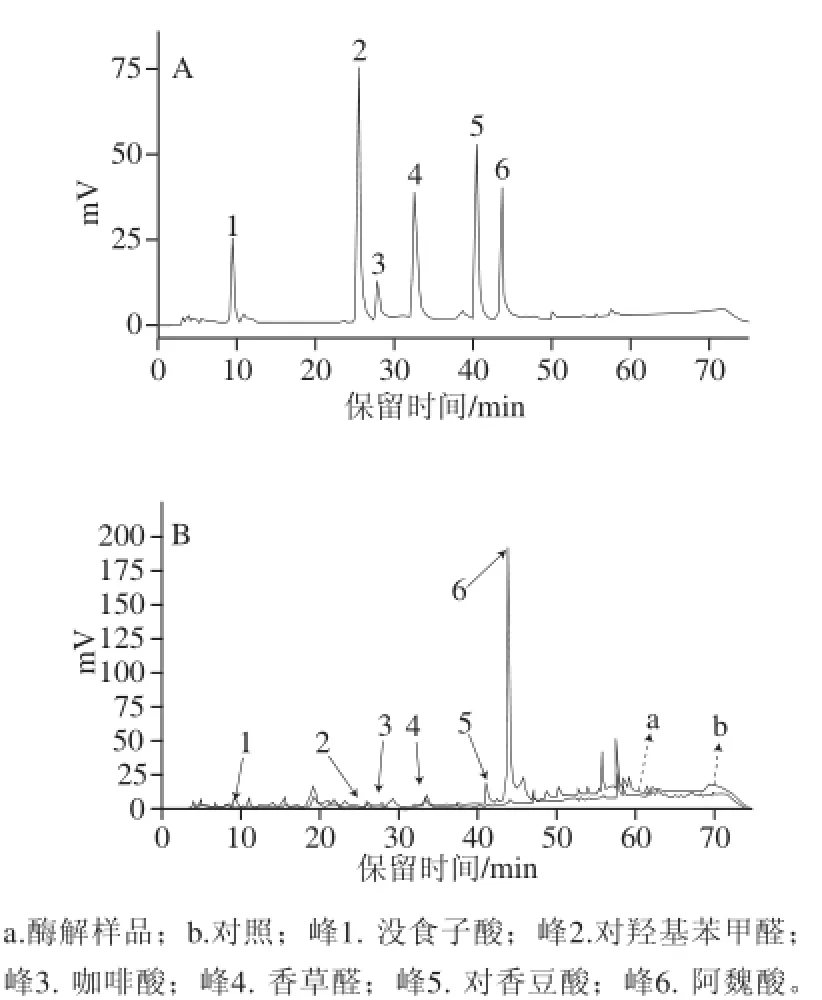
图2 酚酸标准品(A)和燕麦中总多酚(B)的高效液相色谱Fig.2 HPLC chromatograms of phenolic acid standards (A) and phenolic extracts (B) from cellulase-treated (a) and heat-treated oat samples (b)
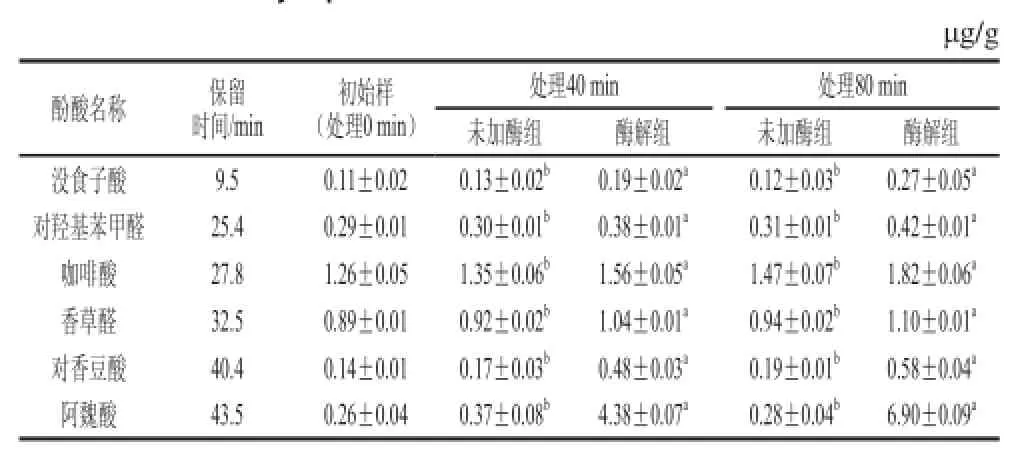
表1 纤维素酶酶解作用对燕麦全粉中主要酚酸含量的影响Table 1 Effect of cellulase and heating treatments on the contents of major phenolic acids in whole oat flour
2.3 酶解处理对燕麦粉抗氧化活性的影响
目前,检测食品抗氧化活性有多种方法,主要包括自由基的清除活性、金属离子的还原能力、脂质抗氧化能力等[32]。每种方法都各有优缺点,且影响因素各有不同,因而不能单独使用某一种方法来评价食品的抗氧化活性[33]。本实验选择了ABTS+·、DPPH自由基清除能力和FRAP 3 种方法检测酶解前后燕麦粉样品的体外抗氧化活性。
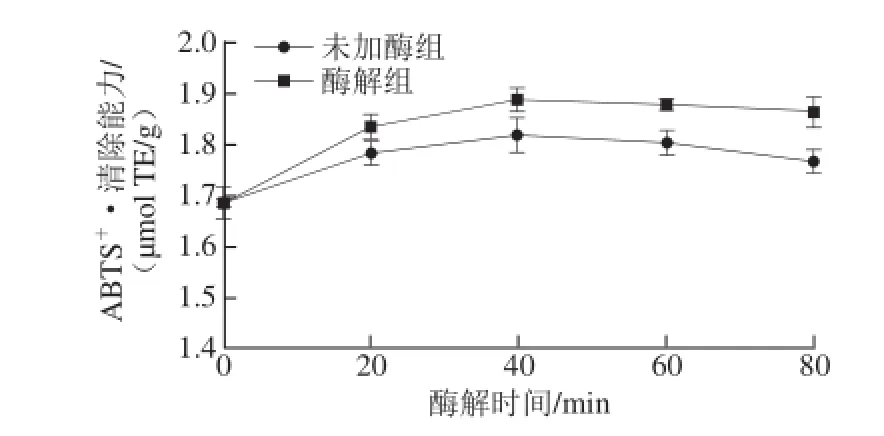
图3 酶解处理不同时间对ABBTTSS+·清除能力的影响Fig.3 ABTS+radical scavenging activities of phenolic extracts from heat-treated (control) and cellulase-treated oat samples at different treatment times
图3 为酶解处理不同时间时燕麦粉多酚提取物清除ABTS+·的能力。与总多酚含量的变化趋势一致,随着处理时间的延长,未加酶组和酶解处理的燕麦粉多酚提取物的ABTS+·清除能力均增强,在40 min后趋于稳定,而且酶解处理后的样品的ABTS+·清除能力显著高于未加酶组(P<0.05)。

图4 酶解处理不同时间对样品DPPH自由基清除能力的影响Fig.4 DPPH radical scavenging activities of phenolic extracts from heat-treated (control) and cellulase-treated oat samples at different treatment times
由图4可知,未加酶组样品清除DPPH自由基的能力随时间延长有轻微的波动,而酶解处理的样品的清除能力随处理时间延长显著增强。而且酶解处理的样品清除DPPH自由基的能力显著高于未加酶组(P<0.05),这表明经纤维素酶酶解后的燕麦粉样品清除DPPH自由基的能力也显著增强。
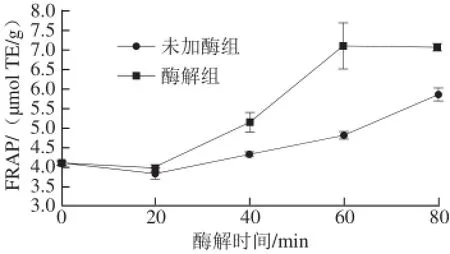
图5 酶解处理不同时间对样品FRAP值的影响Fig.5 FRAP values of phenolic extracts from heat-treated (control) and cellulase-treated oat samples at different treatment times
由图5可知,随着处理时间的延长,未加酶和酶解处理后样品的FRAP值均呈增加的趋势,而且酶解处理后样品的FRAP值显著高于未加酶处理的样品(P<0.05),表明经纤维素酶酶解后的燕麦粉样品的总还原能力显著增强。
2.4 酶解处理对AAPH诱导的BSA氧化损伤的保护作用的影响
蛋白质是生物有机体内一类重要的生物大分子,自由基的诱导通常会改变蛋白质结构并且破坏它们的正常功能。目前流行的假说认为,体内活性氧(reactive oxygen species,ROS)水平的持续增高,会造成大分子氧化损伤,而这一反应是造成衰老及与其相关的功能下降病症的根本原因[34]。因此,降低胞内ROS水平可有效保护神经细胞、神经元,从而进一步保护大脑的正常功能。为了研究酶解处理前后的燕麦样品对蛋白氧化损伤的保护作用,本实验选用AAPH作为一种诱导ROS蛋白损伤的自由基。
图6a显示的是阳性对照(P),阴性对照(N)及处理0、20、40、60、80 min的样品对AAPH诱导的蛋白损伤的保护作用,其中电泳条带越深,表明剩余的蛋白质含量越高,其保护作用越强。由图6a可知,未加酶组和酶解处理组样品的剩余蛋白质含量均高于阴性对照,而且随着处理时间延长,剩余蛋白质含量均会增加。其中,处理时间相同时,加酶处理样品的剩余蛋白质含量高于未加酶(只是加热),说明未加酶和酶解后的样品均可保护AAPH诱导的牛血清白蛋白的氧化损伤,而且随着时间的延长,保护作用也会增加,其中酶解后样品的保护作用更强。由图6b可知,酶解处理后样品的蛋白保护率高于单纯的加热处理,此结果可能与酶解后样品中总多酚含量增加有关。而且,已有报道表明多酚提取液可以有效防止体外蛋白氧化损伤[35]。以上结果说明,用纤维素酶酶解处理燕麦粉,在维持身体健康和预防与氧化应激相关疾病方面有一定的应用潜力。
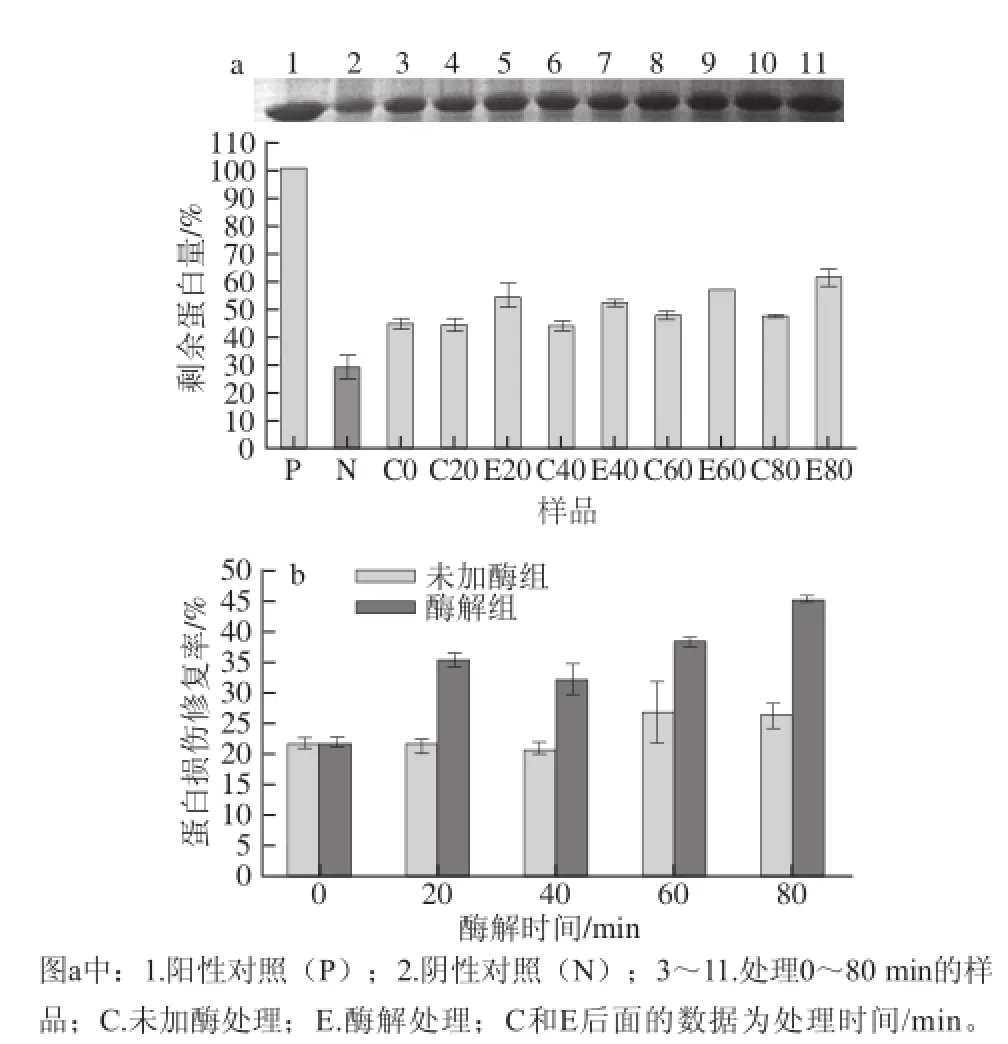
图6 酶解处理对蛋白氧化损伤保护作用的影响Fig.6 Effect of polyphenol extracts from heat-treated (control) and cellulase-treated oat samples on protection against protein oxidative damage
2.5 相关性分析
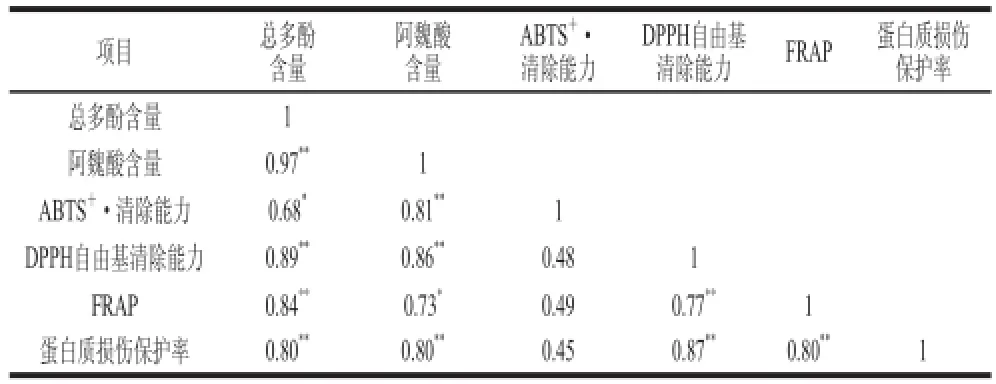
表2 总多酚、阿魏酸含量及ABTS ·清除能力、DPPH自由基清除能力、FRAP值和蛋白损伤修复的相关系数Table 2 Correlation coefficients among total polyphenol content, ferulic acid content, ABTS radical scavenging activity, DPPH radical scavenging activity, FRAP value and protein oxidative damage protection of phenolic extracts from control and cellulase-treated oat samples
通过上述研究,本实验对未加酶和酶解处理后燕麦样品中的总多酚含量、ABTS+·清除能力、DPPH自由基清除能力、FRAP值及蛋白质损伤保护率等各指标间相关系数进行了分析,结果见表2。样品的总多酚含量与抗氧化活性值(ABTS+·清除能力、DPPH自由基清除能力和FRAP值)和蛋白质损伤保护率均呈现显著正相关(P<0.05)。阿魏酸含量与总多酚含量的相关性达0.97,与抗氧化活性值(ABTS+·清除能力、DPPH自由基清除能力和FRAP值)及蛋白质损伤保护率的相关系数分别达0.81、0.86、0.73、0.80。这说明,纤维素酶酶解处理后增加的总多酚含量主要来源于阿魏酸含量的增加。而且,增加的阿魏酸含量在一定程度上增强了样品的抗氧化活性及APPH诱导的蛋白损伤的修复作用。这与之前的文献报道一致,即植物中的酚类物质是其抗氧化活性的主要贡献者[26,36]。
3 结 论
本实验结果说明,纤维素酶酶解处理能够显著提高燕麦粉中总多酚含量,特别是其阿魏酸含量。经40、80 min的纤维素酶酶解处理以后,燕麦粉中的阿魏酸含量分别增加了11 倍和24 倍。酶解处理后燕麦粉醇提取液的抗氧化活性(ABTS+·清除能力、DPPH自由基清除能力和FRAP值)也得到显著提高,对AAPH诱导的蛋白损伤的修复能力也有所增强。综合所有研究结果,可得结论:纤维素酶酶解处理能够有效提高燕麦粉的总多酚含量与功能活性。
[1] BERG A, KÖNIG D, DEIBERT P, et al. Effect of an oat bran enriched diet on the atherogenic lipid profile in patients with an increased coronary heart disease risk[J]. Annals of Nutrition and Metabolism, 2003, 47(6): 306-311. DOI:10.1159/000072404.
[2] CHEN C Y, MILBURY P E, KWAK H K, et al. Avenanthramides and phenolic acids from oats are bioavailable and act synergistically with vitamin C to enhance hamster and human LDL resistance to oxidation[J]. The Journal of Nutrition, 2004, 134(6): 1459-1466.
[3] DAOU C, ZHANG H. Oat beta-glucan: its role in health promotion and prevention of diseases[J]. Comprehensive Reviews in Food Science and Food Safety, 2012, 11(4): 355-365. DOI:10.1111/j.1541-4337.2012.00189.x.
[4] TAPOLA N, KARVONEN H, NISKANEN L, et al. Glycemic responses of oat bran products in type 2 diabetic patients[J]. Nutrition, Metabolism and Cardiovascular Diseases, 2005, 15(4): 255-261. DOI:10.1016/j.numecd.2004.09.003.
[5] DONG J L, CAI F G, SHEN R L, et al. Hypoglycaemic effects and inhibitory effect on intestinal disaccharidases of oat beta-glucan in streptozotocin-induced diabetic mice[J]. Food Chemistry, 2011, 129(3): 1066-1071. DOI:10.1016/j.foodchem.2011.05.076.
[6] BELOBRAJDIC D P, BIRD A R. The potential role of phytochemicals in wholegrain cereals for the prevention of type-2 diabetes[J]. Nutrition Journal, 2013, 12(10): 1917-1922. DOI:10.1186/1475-2891-12-62.
[7] HASNAT M A, PERVIN M, PARK S R, et al. Anti-inflammatory, counteractive, and preventive effects of orally administrated oat extracts on dextran sulfate sodium-induced colitis in mice[J]. Food Science and Biotechnology, 2015, 24(2): 619-628. DOI:10.1007/ s10068-015-0081-4.
[8] 李玉忠, 路宏科, 陈兴叶, 等. 利用生物酶解技术提高小麦麸皮食用性的研究[J]. 价值工程, 2014, 33(11): 301-303. DOI:10.3969/ j.issn.1006-4311.2014.11.165.
[9] ADOM K K., LIU R H. Antioxidant activity of grains[J]. Journal of Agricultural and Food Chemistry, 2002, 50(21): 6182-6187. DOI:10.1021/jf0205099.
[10] KAUKOVIRTA-NORJA A, WILHELMSON A, POUTANEN K. Germination: a means to improve the functionality of oat[J]. Journal of Agricultural and Food Science, 2004, 13(1/2): 100-112. DOI:10.2137/1239099041838049.
[11] ALRAHMANY R, TSOPMO A. Role of carbohydrases on the release of reducing sugar, total phenolics and on antioxidant properties of oat b ran[J]. Food Chemistry, 2012, 132(1): 413-418. DOI:10.1016/ j.foodchem.2011.11.014.
[12] XU J G, TIAN C R, HU Q P, et al. Dynamic changes in phenolic compounds and antioxidant activity in oats (Avena nuda L.) during steeping and germination[J]. Jou rnal of Agricultural and Food Chemistry, 2009, 57(21): 10392-10398. DOI:10.1021/jf902778j.
[13] CAN Z, YILDIZ O, SAHIN H, et al. An investigation of Turkish honeys: their physico-chemical properties, antioxidant capacities and phenolic profiles[J]. Food Chemistry, 2015, 180(1): 133-141. DOI:10.1016/j.foodchem.2015.02.024.
[14] PRAKASH D, SINGH B N, UPADHYAY G. Antioxidant and free radical scavenging activities o f phenols from onion (Allium cepa)[J]. Food Chemistry, 2007, 102(4): 1389-1393. DOI:10.1016/j.foodchem.2006.06.063.
[15] SEVGI K, TEPE B, SARIKURKCU C. Antioxidant and DNA damage protection potentials of selected phenolic acids[J]. Food and Chemical Toxico logy, 2015, 77: 12-21. DOI:10.1016/j.fct.2014.12.006.
[16] BOUDJOU S, OOMAH B D, ZAIDI F, et al. Phenolics content and antioxidant and anti-inflammatory activities of legume fractions[J]. Food Chemistry, 2013, 138(2): 1543-1550. DOI:10.1016/ j.foodchem.2012.11.108.
[17] SUN Y, FANG N, CHEN D D Y, et al. Determination of potentially anti-carcinogenic flavonoids in wines by micellar electrokinetic chromatography[J]. Food Chemistry, 2008, 106(1): 415-420. DOI:10.1016/j.foodchem.2007.05.094.
[18] CUEVA C, MORENO-ARRIBAS M, MARTIN-ALVAREZ P J, et al. Antimicrobial activity of phenolic acids against commensal, probiotic and pathogenic bacteria[J]. Research in Microbiology, 2010, 161(5): 372-382. DOI:10.1016/j.resmic.2010.04.006.
[19] NAQVIA S A R, WASEEMA R, MAHMOODB N, et al. Phenolic acid content, antioxidant properties, and antibacterial p otential of flowers and fruits from selected Pakistani indigenous medicinal plants[J]. Science Asia, 2013, 39(4): 340-345. DOI:10.2306/scienceas ia1513-1874.2013.39.340.
[20] DAS A, DATTA S, MUKHERJEE S, et al. Evaluation of antioxidative, antibacterial and probiotic growth stimulatory activities of sesamum indicum honey containing phenolic compounds and lignans[J]. LWTFood Science and Technology, 2015, 61(1): 244-250. DOI:10.1016/ j.lwt.2014.11.044.
[21] YU L L, HALEY S, PERRET J, et al. Comparison of wheat flours grown at different locations for their antioxidant properties[J]. Food Chemistry, 2004, 86(1): 11-16. DOI:10.1016/j.foodchem.2003.08.037.
[22] PAYET B, SHUM CHEONG SING A, SMADJA J. Comparison of the concentrations of phenolic constituents in cane sugar manufacturing products with their antioxidant activities[J]. Journal of Agricultural and Food Chemistry, 2006, 54(19): 7270-7276. DOI:10.1021/jf060808o.
[23] ROBBINS R J, BEAN S R. Development of a quantitative highperformance liquid chromatography-photodiode array detection measurement system for phenolic acids[J]. Journal of Chromatography A, 2004, 1038(1): 97-105. DOI:10.1016/j.chroma.2004.03.009.
[24] CHUN S S, VATTEM D A, LIN Y T, et al. Phenolic antioxidants from clonal oregano (Origanum vulgare) with antimicrobial activity against Helicobacter pylori[J]. Process Biochemistry, 2005, 40(2): 809-816. DOI:10.1016/j.procbio.2004.02.018.
[25] BRATT K, SUNNERHEIM K, BRYNGELSSON S, et al. Avenanthramides in oats ( Avena sativa L.) and structure-antioxidant activity relationships[J]. Journal of Agricultural and Food Chemistry, 2003, 51(3): 594-600. DOI:10.1021/jf020544f.
[26] CORRAL-AGUAYO R D, YAHIA E M, CARRILLO-LOPEZ A, et al. Correlation between some nutritional components and the total antioxidant capacity measured with six different assays in eight horticultural cro ps[J]. Journal of Agricultural and Food Chemistry, 2008, 56(22): 10498-10504. DOI:10.1021/jf801983r.
[27] 乔燕, 刘学波. 草质素体外清除自由基及抑制蛋白质氧化的作用[J].食品科学, 2013, 34( 17): 106-110. DOI:10.7506/spkx1002-6630-201317024.
[28] PETERSON D M. Oat antioxidants[J]. Journal of Cereal Science, 2001, 33(2): 115-129. DOI:10.1006/jcrs.2000.0349.
[29] DOKUYUCU T, PETERSON D M, AKKAYA A. Contents of antioxidant compounds in Turkish oats: simple phenolics and avenanthramide concentrations[J]. Cereal Chemistry, 2003, 80(5): 542-543. DOI:10.1094/CCHEM.2003.80.5.542.
[30] ISHII T. Structure and functions of feruloylated polysaccharides[J]. Plant Science, 1997, 127(2): 111-127. DOI:10.1016/S0168-9452(97)00130-1.
[31] HATFIELD R D, RALPH J, GRABBER J H. Cell wall cross-linking by ferulates and diferulates in grasses[J]. Journal of the Science of Food and Agriculture, 1999, 79(3): 403-407. DOI:10.1002/(SICI)1097-0010(19990301)79:3%<403::AID-JSFA263>3.0.CO;2-0.
[32] 郭长江, 杨继军, 韦京豫, 等. 两种方法测定坚果类食物抗氧化活性的比较[J]. 中国食品卫生杂志, 2004, 16(2): 135-136. DOI:10.3969/ j.issn.1004-8456.2004.02.010.
[33] PRIOR R L, WU X L, SCHAICH K. Standardized methods for the det ermination of antioxidant capacity and phenolics in foods and dietary supplements[J]. Journal of Agricultural and Food Chemistry, 2005, 53(10): 4290-4302. DOI:10.1021/jf0502698.
[34] CHRISTEN Y. Oxidative stress and Alzheimer disease[J]. American Journal of Clinical Nutrition, 2000, 71(Suppl 2): 621-629.
[35] YANG C S, LANDAU J M, HUANG M T, et al. Inhibition of carcinogenesis by dietary polyphenolic compounds[J]. Annual Review of Nutrition, 2001, 21: 381-406. DOI:10.1146/annurev.nutr.21.1.381.
[36] WONG C C, LI H B, CHENG K W, et al. A systematic survey of antioxidant activity of 30 Chinese medicinal plants using the ferric reducing antioxidant power assay[J]. Food Chemistry, 2006, 97(4): 705-711. DOI:10.1016/j.foodchem.2005.05.049.
Enhancement of Total Polyphenol Content and Antioxidant Activity of Whole Oat (Avena nuda L.) Flour by Cellulase Treatment
CHEN Dongfang1, SHI Junling2,*, HU Xinzhong3
(1. College of Food Science and Engineering, Northwest A&F University, Yangling 712100, China; 2. School of Life Sciences, Northwestern Polytechnical University, Xi’an 710027, China; 3. College of Food Engineering and Nutritional Science, Shaanxi Normal University, Xi’an 710062, China)
In this work, the effect of cellulase treatment on the total phenolic content and composition of whole oat fl our (Avena nuda L.) was measured using Folin-Ciocalteu colorimetric method and high performance liquid chromatography (HPLC). The antioxidant activities of the ph en olic extracts wer e assessed using 2,2’-azinobis (3-ethylbenzothiazoline-6-sulfonic acid) diammonium salt (ABTS), 1,1-diphenyl-2-picrylhydrazyl (DPPH), ferric reducing antioxidant power (FRAP) and protein oxidative damage protection assays. As a result, the cellulase treatment signifi cantly increased total phenolic content and resulted in an increase in ferulic acid content by 11 to 24 folds. Antioxidant activity of the phenolic extract from oat fl our after the enzymatic treatment was also signifi cantly increased in ABTS+radical scavenging activities, DPPH radical scavenging activities, and FRAP assays, and the ability to protect protein oxidation was also enhanced. Overall, the treatment with cellulase could be an effi cient way to produce polyphenol-rich oat products with high antioxidant activity. The results of this study can provide useful information to guide the application of cellulase in oat processing.
oat; cellulase; polyphenols; antioxidant capacity; protein oxidative damage protection
10.7506/spkx1002-6630-201601011
S512.6
A
1002-6630(2016)01-0056-07
陈东方, 师俊玲, 胡新中. 纤维素酶水解处理提高燕麦全粉中总多酚含量与抗氧化活性[J]. 食品科学, 2016, 37(1): 56-62.
DOI:10.7506/spkx1002-6630-201601011. http://www.spkx.net.cn
CHEN Dongfang, SHI Junling, HU Xinzhong. Enhancement of total polyphenol content and antioxidant activity of whole oat (Avena nuda L.) fl our by cellulase treatment[J]. Food Science, 2016, 37(1): 56-62. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201601011. http://www.spkx.net.cn
2015-03-05
国家现代农业(燕麦荞麦)产业技术体系建设专项(CARS-08-D)
陈东方(1989—),女,博士研究生,研究方向为食品生物技术。E-mail:cdfcdf0922@163.com
*通信作者:师俊玲(1972—),女,教授,博士,研究方向为食品生物技术。E-mail:sjlshi2004@aliyun.com
