海带多糖及其纯化组分的胆酸盐吸附能力及抗氧化活性
2016-11-11王智荣林宗毅黄俊伟
王智荣,崔 春*,林宗毅,黄俊伟
海带多糖及其纯化组分的胆酸盐吸附能力及抗氧化活性
王智荣,崔 春*,林宗毅,黄俊伟
(华南理工大学轻工与食品学院,广东 广州 510640)
采用pH 2的柠檬酸溶液提取海带中的多糖,将海带多糖(polysaccharide from Laminaria japonica,LPA-P)通过Sevag法除蛋白、透析除盐处理、离子交换柱处理,分离纯化得到3 种多糖组分LPA-P1、LPA-P2、LPA-P3,探讨了海带多糖的分子质量、硫酸基含量、单糖组成与其抗氧化能力和胆酸盐吸附能力的内在联系。结果表明:LPA-P及其纯化组分均含有硫酸基,且LPA-P3最多为5.36%,LPA-P1最少为1.22%;海带多糖及其纯化组分的单糖组成均以岩藻糖、半乳糖和甘露糖为主,其中LPA-P和LPA-P3主要的单糖为半乳糖,而LPA-P1和LPA-P2主要的单糖为甘露糖,海带多糖LPA-P3中岩藻糖含量最高;海带多糖LPA-P、LPA-P1、LPA-P2和LPA-P3的平均分子质量为20.13、17.55、28.71、17.14 kD。海带多糖的氧自由基吸收能力和2,2’-联氮双(3-乙基苯并噻唑啉-6-磺酸)二铵盐自由基(2,2’-azinobis (3-ethylbenzothi azoline-6-sulfonic acid) ammonium salt radical,ABTS+·)清除能力从大到小依次为LPA-P3>LPA-P>LPA-P2>LPA-P1;LPA-P3具有最强的胆酸盐吸附能力,LPA-P和LPA-P2次之且无显著性差异,LPA-P1基本不具有胆酸盐吸附能力。结合LPA-P及其纯化组分的结构特性,推测高硫酸基含量、主要单糖组成为岩藻糖和半乳糖的海带多糖具有更强的胆酸盐吸附能力及抗氧化活性。
海带;多糖;胆酸盐吸附能力;抗氧化活性
海带属于褐藻门海带目海带科海带属的一种大型海藻,是一种重要的经济海藻[1-2]。我国在很早之前就有食用海带的历史,并将海带作为中药入药。随着药理学、营养学的发展,海带越来越多的生物活性被发现,如:降血糖、抗动脉硬化、抗凝血、抗肿瘤调节免疫等[3-6],研究发现,海带多糖(polysaccharide from Laminaria japonica,LPA-P)是海带具有多种多样的生理活性的物质基础。
LPA-P是存在于海带细胞间和细胞内的一类生物大分子,其生物活性与结构特征密切相关[7]。胆酸盐是一类具有甾核结构的两性大分子,对人体脂肪和胆固醇的消化吸收和脂溶性维生素的代谢起重要作用,它由肝脏的胆固醇形成,并会重吸收进入肝脏形成胆固醇,从而形成胆固醇的胆肝循环。因此,减少肠道内的胆酸盐对降血脂有着重要作用[8-10]。活性物质的活性评价方法多为其对胆酸盐吸附作用的测定,其中胆酸盐多采用胆酸钠、脱氧胆酸钠和牛磺胆酸钠,其中牛磺胆酸钠最为难以被吸附,胆酸盐浓度的测定,一般采用紫外吸收法以及糠醛硫酸法[11]。本课题组卢茳虹等[12-13]前期研究了响应面法优化柠檬酸法从海带渣中提取LPA-P的方法,并研究了其抗氧化活性。Zhao Xue等[14]利用酸水解和快速降解的方法制备LPA-P,并研究了分子质量对抗氧化活性的影响,发现分子质量更小的LPA-P,在清除超氧阴离子自由基(O2-·)的抗氧化能力上有着更好的表现。Saha等[15]发现LPA-P的硫酸基含量越高的组分具有更强的抗病毒活性和抗氧化能力。在此基础上,本实验采用柠檬酸提取海带中的多糖,通过除蛋白、透析除盐、离子交换柱等分离方法得到成分较为均一的LPA-P组分,研究了LPA-P分子质量、硫酸基含量、单糖组成等,并结合其抗氧化能力和胆酸盐吸附能力探究LPA-P生物活性与结构特征的联系,以期为海带的综合利用和深加工提供理论指导。
1 材料与方法
1.1 材料与试剂
海带,采购于山东省烟台,采收于九月,清洗后晒干,粉碎过40 目筛,置于干燥器中贮存备用。
无水乙醇、磷酸二氢钠、磷酸氢二钠、盐酸羟胺、K2S2O8、糠醛、氢氧化钠、氢氧化钾 广州市金华大化学试剂有限公司;盐酸、浓硫酸、二甲基亚砜 江苏强盛功能化学股份有限公司;吡啶、氯仿、碘甲烷、正丁醇、二氯甲烷 天津市大茂化学试剂厂;Trolox、2,2’-联氮双(3-乙基-苯并噻唑-6-磺酸)二铵盐(2,2’-azinobis-(3-ethylbenzthiazoline-6-sulphonate),ABTS)、荧光素钠盐(fluorescein sodium,FL) 美国Sigma公司;二乙氨乙基(diethylaminoethyl,DEAE)美国GE公司;色谱级甲醇 北京迪马科技有限公司;其他试剂均为国产分析纯。
1.2 仪器与设备
酶标仪 美国Thermo公司;7890A气相色谱仪 美国Agilent公司;高效凝胶渗透色谱仪 美国Waters公司;ALPHA1-4冷冻干燥机 德国Christ公司;GL-21M高速冷冻离心机 长沙湘仪离心机仪器有限公司;RE-52AA旋转蒸发仪 上海亚荣生化仪器厂;Unico UV-2000型紫外-可见分光光度计 尤尼柯(上海)仪器有限公司;数显恒温水浴锅 江阴市保利科研器械有限公司。
1.3 方法
1.3.1 粗多糖提取流程
海带干粉→柠檬酸提取(pH 2的柠檬酸溶液(1∶30,m/V),温度120 ℃,时间3 h)→取上清液,用氢氧化钾调pH值至中性→浓缩→醇沉(乙醇最终体积分数为80%)→4 ℃条件下静置8 h→取沉淀物→复溶沉淀物→海带粗多糖
1.3.2 Sevag法除蛋白
参考Navarini等[16]的方法。以5∶1(V/V)配制氯仿-正丁醇溶液(Sevag试剂),保存以备用。取海带粗多糖溶液,加入多糖溶液1/5体积的Sevag试剂,室温条件下振荡反应30 min。充分反应后离心取上清液,重复上述步骤5~6 次直到不再出现沉淀或极少沉淀。除蛋白后的多糖溶液使用乙醇醇沉,使乙醇最终体积分数为80%,在0~4 ℃条件下静置8~12 h,离心取沉淀,并溶于蒸馏水,得除蛋白多糖的溶液。
1.3.3 透析法除盐
选取截留量为800~1 400 D的透析袋,将除蛋白多糖溶液置于透析袋中,用去离子水透析72 h,每隔约4 h换水一次。透析完成后样品溶液用旋转蒸发仪浓缩至适合体积,冷冻干燥得多糖固体。
1.3.4 LPA-P的柱层析分离
采用规格为2.6 cm×20 cm的玻璃柱,用DEAE填料装柱,用0.2 mol/L的NaOH溶液冲洗40 min,1 mol/L的NaCl溶液冲洗60 min,最后用去离子水冲洗填料至中性。分别配制0、0.1、0.2、0.3、0.4、0.5、0.6 mol/L浓度的NaCl溶液保存以备用,取0.8 g LPA-P固体溶于去离子水,并将样品上柱,每个浓度洗脱3~10 个柱体积,洗脱流速为5 mL/min,每试管收集5 mL的洗脱液。根据每管洗脱液的多糖含量,以洗脱管数为横坐标,多糖测定的吸光度为纵坐标,绘制洗脱曲线。收集不同组分样品,把不同浓度NaCl溶液洗脱下来的洗脱液分别收集,浓缩,通过透析除去NaCl,冷冻干燥,获得LPA-P1、LPA-P2和LPA-P3。
1.3.5 LPA-P硫酸基含量的测定
采用硫酸钡比浊法[17]测定。
1.3.6 LPA-P单糖组成的测定
参照文献[18]中的方法测定LPA-P中的单糖组成。
1.3.7 氧自由基吸收能力(oxygen radical absorbance capacity,ORAC)值测定
参照Huang Wuyang等[19]的方法并加以改进。荧光素钠盐(fluorescein sodium,FL)、自由基产生剂2,2’-偶氮二(2-甲基丙基咪)二盐酸盐)(2,2’-azobis(2-methylpropionamidine) dihydrochloride,AAPH)、标准抗氧化物质VE水溶性类似物(Trolox)以及待测样品均用75 mmol/L pH 7.4的磷酸盐缓冲液溶解稀释。在96 孔板各个微孔中依次加入缓冲溶液、样品、70 nmol/L FL各20 μL后,在37 ℃条件下放置15 min,之后迅速在各孔中加入12.8 mmol/L AAPH 140 μL后运行程序,在37 ℃条件下以激发波长485 nm、发射波长538 nm进行连续测定,每2 min测定一次各孔荧光强度,测定120 min,荧光强度分别记为f0、f1、f2f60。将各个微孔不同时间记录下的绝对荧光强度数据fi与初始的荧光强度f0作比,折算成相对荧光强度,并按照下式计算曲线下面积(area under the curve,AUC)值:

再根据公式(2),分别计算不同浓度下(0~100 μmol/L)Trolox和LPA-P的Net AUC值:
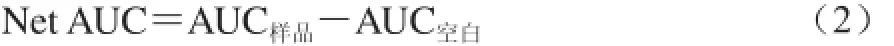
式中:AUC空白为没有抗氧化剂存在时自由基作用对照的AUC值。
以Net AUC值为纵坐标,Trolox浓度为横坐标建立直线回归方程,根据回归方程计算LPA-P的ORAC值。
1.3.8 ABTS+·清除能力的测定[20]
将等量混合的14 mmol/L ABTS水溶液和4.9 mmol/L K2S2O8水溶液,在室温避光条件下静置12~16 h以制备ABTS+·储备液。测定时,用50%乙醇溶液稀释ABTS,使其在734 nm波长处的吸光度在0.70±0.02范围内,形成ABTS+·测定液。将0.1 mL样品用ABTS+·测定液稀释至3 mL,振荡30 s,在30 ℃条件下反应20 min后在734 nm波长处测定吸光度Ai。对照组A0是以0.1 mL水作同样处理。

1.3.9 多糖胆酸盐吸附率的测定
参照周小理等[21]的方法,并做一定修改。配制质量浓度为0、0.4、0.8、1.2、1.6、2.0 mg/mL的胆酸盐标准溶液,移取样液(或各不同质量浓度的胆酸盐标准溶液)1 mL于具塞试管中,加入6 mL体积分数为45%的硫酸,混匀,加入1 mL体积分数为0.3%的糠醛,混匀,置65 ℃恒温水浴中反应30 min,冷却至室温后,于620 nm波长处测定吸光度,绘制标准曲线。
配制4 mg/mL牛磺胆酸钠溶液,加入2 mg/mL的多糖样品,以蒸馏水作为空白对照,于37 ℃恒温下反应1 h后,5 000 r/min离心分离10 min。准确移取1 mL上清液,于620 nm波长处测定吸光度,由标准曲线确定其胆酸盐的质量浓度。再根据添加多糖样品及空白溶液中胆酸盐的浓度差计算多糖对胆酸盐的吸附量。
2 结果与分析
2.1 LPA-P的DEAE柱分离

图1 海带多糖洗脱曲线Fig.1 DEAE-Sepharose fast flow chromatogram of LPA-P
如图1所示,LPA-P经过DEAE柱吸附后,在0.1、0.2、0.3 mol/L NaCl的洗脱浓度下得到3 个明显的峰形,在0、0.4、0.5 mol/L NaCl的洗脱浓度下峰面积较小。分别对0.1、0.2、0.3 mol/L NaCl的洗脱浓度进行收集,经过透析脱盐,冷冻干燥后得到海带多糖LPA-P1、LPA-P2、LPA-P3这3 个组分。
2.2 LPA-P各组分硫酸基含量

表1 LPA-P及其纯化组分硫酸基含量Table 1 Contents of sulfated group in LPA-P and its fractions
由表1可知,随着洗脱液盐浓度的增大,LPA-P1、LPA-P2、LPA-P3这3 个组分的硫酸基含量依次增高,这可能是因为DEAE作为一种阴离子交换填料,可以分离带电荷的多糖[22],因此,随着洗脱液盐浓度的增大,多糖酸性强度也不断增大,所以表现出更高的硫酸基含量。
Wang Jing[23]和Saha[15]等的研究表明,硫酸基含量与多糖抗氧化活性成正比,且与抗病毒等生物活性密切相关,因此可推测LPA-P3组分具有更强抗氧化性和生物活性。3 个分离纯化组分中,存在1 个组分LPA-P1的硫酸基含量低于海带粗多糖,而Saha等[15]从海带粗多糖中分离纯化出的3 个组分,其硫酸基含量均高于海带粗多糖,这可能是因为所采用的提取方法不同。
2.3 LPA-P各组分的单糖组成
LPA-P及其纯化组分各个单糖成分在气相色谱柱中分离效果良好,通过峰面积和内标峰面积的比和标准品实验绘制的标准曲线即可计算出LPA-P及其纯化组分的单糖组成。
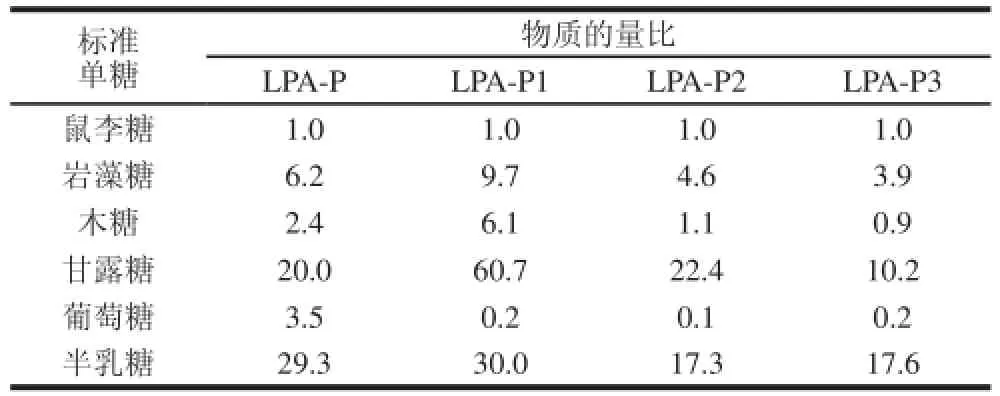
表2 LPA-P及其纯化组分单糖组成Table 2 Monosaccharide composition of LPA-P and its fractions
由表2可知,4 个组分均含有较为常见的6 种单糖,分别为鼠李糖、木糖、岩藻糖、半乳糖、甘露糖和葡萄糖,但鼠李糖、葡萄糖和木糖的含量非常少,而含有大量的半乳糖、甘露糖和岩藻糖,其中LPA-P和LPA-P3的半乳糖含量占最大部分,LPA-P1和LPA-P2则是甘露糖含量最高。
半乳糖和岩藻糖是褐藻多糖中较为常见的单糖,也是岩藻多糖的主要单糖组成,而岩藻糖多糖已被报道具有较强的生物活性,其中包括抗血凝、抗氧化和抗病毒等[24]。Wang Jing等[23]的研究中也发现半乳糖含量更高组分的杀菌及抗氧化能力更强。LPA-P3组分的岩藻糖及半乳糖含量在4 个组分中最高,可推测LPA-P3具有更强的抗氧化性和生物活性。Saha等[15]研究发现狭叶海带粗多糖及其分离纯化出的3 个组分中单糖组成均以岩藻糖为主,且其含量远远高于其他单糖,单糖组成上的差异可能是因为海带的品种不同。
2.4 LPA-P各组分分子质量分布
多糖的分子质量具有相对性,通常所测定的分子质量只是一种统计平均值,代表相似链长的平均值。采用凝胶渗透色谱法对经过分离纯化后的LPA-P、LPA-P1、LPA-P2、LPA-P3的分子质量进行测定,结果如图2所示。可看出LPA-P也是单峰,但峰形较宽且不太对称,LPA-P1、LPA-P2、LPA-P3形成了峰形对称均匀的单峰,说明分离纯化取得了较好的效果。
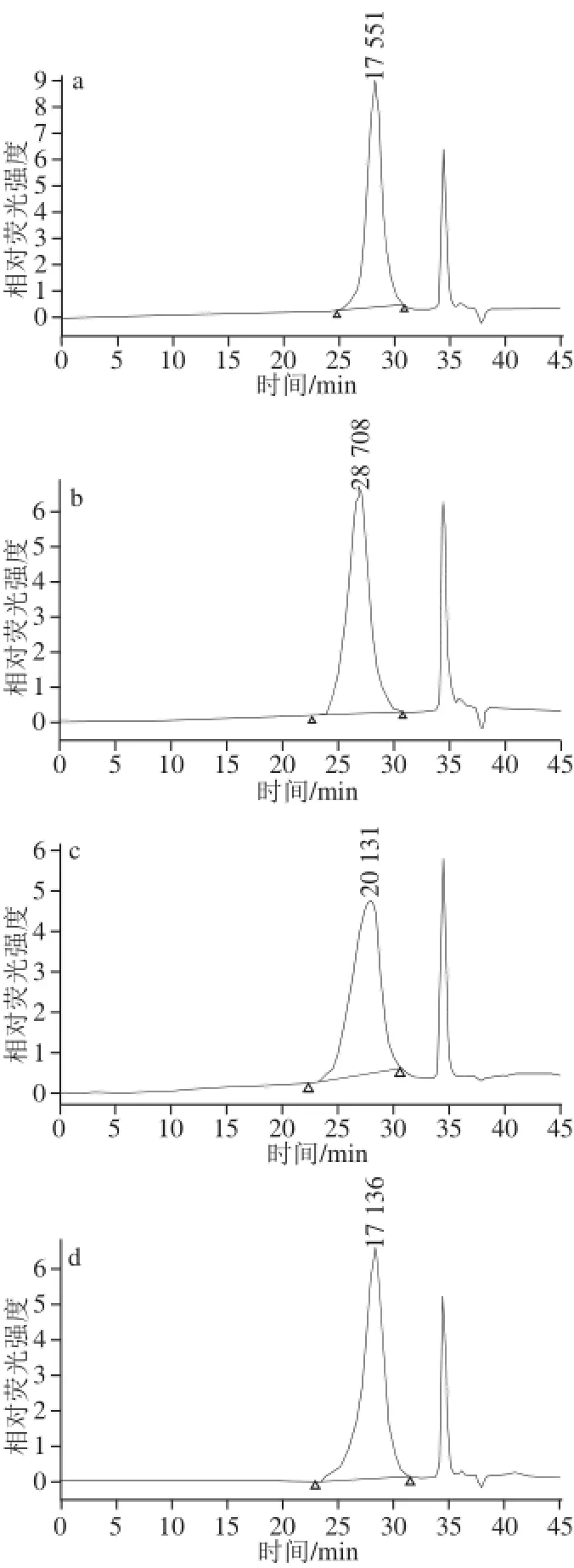
图2 LPA-P(a)、LPA-P1(b)、LPA-P2(c)、LPA-P3(d)的分子质量分布Fig.2 Molecular weights of LPA-P (a), LPA-P1 (b), LPA-P2 (c), and LPA-P3 (d)
由图2a可知,LPA-P的平均分子质量为20.13 kD,与传统水提法得到的多糖平均分子质量有了显著的下降,且各纯化组分与粗多糖的分子质量相差不大,说明柠檬酸法提取海带多糖能有效地把多糖大分子水解成分子质量更小的多糖,其中LPA-P3平均分子质量最小,为17.14 kD。Zhao Xue等[14]利用酸水解和快速降解的方法制备海带多糖,并研究了分子质量对抗氧化活性的影响,其结果表明分子质量更小的LPA-P,在清除超氧阴离子自由基的抗氧化能力上有着更好的表现。一般认为分子质量更小的多糖成分中的有效部分更容易与发生反应的配体相接触,从而使其活性更强;其次分子质量更小的多糖成分更容易透过组织细胞到达产生活性的部位,从而使其活性加强。那么可推测LPA-P3组分会具有更好的抗氧化能力及生物活性。
2.5 LPA-P各组分抗氧化活性研究
2.5.1 LPA-P氧自由基吸收能力

图3 LPA-P及其纯化组分的氧自由基吸收能力Fig.3 Oxygen radical absorbance capacity of LPA-P and its fractions
由图3可知,LPA-P与其分离纯化后组分的氧自由基吸收能力有了显著性差异。其中LPA-P3的ORAC值最高,达到650.93 μmol Trolox/g,比LPA-P组分的341.87 μmol Trolox/g提高了将近1 倍,是LPA-P2的近3 倍。而LPA-P1的氧自由基吸收能力则非常差,只有37.22 μmol Trolox/g。
2.5.2 LPA-P的ABTS+·清除能力

图4 LPA-P及其纯化组分的ABBTTSS+·清除能力Fig.4 ABTS radical scavenging activity of LPA-P and its fractions
由图4可知,LPA-P各组分的ABTS+·清除能力由大到小依次为LPA-P3>LPA-P>LPA-P2>LPA-P1,且均呈量效关系,随多糖质量浓度的上升而增强。在各个质量浓度下,LPA-P3均表现出比LPA-P及其他2个组分更强的ABTS+·清除能力,并且随着质量浓度的上升,LPA-P3的清除能力增大得最快,而LPA-P1最慢。其中LPA-P3的IC50值为1.57 mg/mL,在2 mg/mL时清除率达到60.06%。结合氧自由基吸收能力,两种抗氧化指标能得出比较一致的结论:LPA-P1的ABTS+·及氧自由基吸收能力最弱,LPA-P3最强,LPA-P和LPA-P2次之,但两者间差距较小。
结合硫酸基含量来看,LPA-P3具有最高的硫酸基含量,为5.36%,而LPA-P和LPA-P2的硫酸基含量相差不大,分别为2.23%和2.29%,LPA-P1最少,为1.22%,与各组分的抗氧化指标实验结论十分相似。这与Saha等[15]在研究海带多糖的抗病毒活性时得到的结论相一致:硫酸基含量高的组分具有更强的抗病毒活性和抗氧化能力。
从单糖组成上来看,LPA-P3具有最多的岩藻糖,而LPA-P和LPA-P2的岩藻糖含量相差不大,而LPA-P1的岩藻糖含量最少,并且LPA-P3的半乳糖含量最高,LPA-P也含有大量的半乳糖,而LPA-P2和LPA-P1则主要含有大量的甘露糖,可以看出岩藻糖和半乳糖所占比重越大,多糖的抗氧化能力越好。Wang Jing等[23]的研究中也发现半乳糖含量更高组分的杀菌及抗氧化能力更强。Xue Changhu等[25]在分离海带多糖中也同样得到一个半乳糖含量很高的多糖组分具有最强的抗氧化能力。
从各组分的分子质量来看,LPA-P3和LPA-P1的分子质量最小,为17.13 kD和17.55 kD,但LPA-P3的ABTS+·及氧自由基吸收能力远远高于LPA-P1,而LPA-P和LPA-P2的分子质量也高于LPA-P1,这与Zhao Xue等[14]得出的结论不一致,并没有表现出分子质量越小的组分抗氧化能力越强的特征。
2.6 LPA-P各组分的胆酸盐吸附率

图5 LPA-P及其纯化组分的胆酸盐吸附率Fig.5 Cholate adsorption rate of LPA-P and its fractions
由图5可知,LPA-P及其纯化组分的胆酸盐吸附能力与ABTS+·及氧自由基吸收能力相似。LPA-P3的胆酸盐吸附能力最强,为23.85%;而LPA-P和LPA-P2无显著性差异,分别为13.90%和13.75%。LPA-P1的胆酸盐吸附率几乎为0%,可认为LPA-P1组分不具有胆酸盐吸附能力。
对比抗氧化指标实验结果,可看出多糖的胆酸盐吸附能力与其抗氧化能力有着很高的相关性,具有更强ABTS+·及氧自由基吸收能力的多糖其胆酸盐吸附能力会更高。这可能是由于影响ABTS+·及氧自由基吸收能力的分子基团和结构同样会影响多糖与胆酸盐络合的能力。ABTS+·及氧自由基吸收能力强的多糖,其分子基团和结构更有利于与胆酸盐络合,使胆酸盐排出体外,打断胆肝循环,从而产生降血脂的功效。
结合LPA-P及其纯化组分的结构特性,可推测含有高硫酸基含量、岩藻糖和半乳糖含量的多糖,具有更强的胆酸盐吸附能力及抗氧化活性。
3 结 论
对柠檬酸提取海带多糖进行脱蛋白和透析除盐后得到一种多糖LPA-P,用DEAE离子交换柱分离纯化得到3 种多糖组分LPA-P1、LPA-P2、LPA-P3。LPA-P、LPA-P1、LPA-P2、LPA-P3的平均分子质量分别为20.13、17.55、28.71、17.14 kD,都含有硫酸基,且LPA-P3最多,LPA-P1最少。海带多糖及其纯化组分的单糖组成均以岩藻糖、半乳糖和甘露糖为主,LPA-P和LPA-P3主要的单糖为半乳糖,而LPA-P1和LPA-P2主要的单糖为甘露糖,LPA-P3的岩藻糖含量最高。海带多糖的ABTS+·清除能力从大到小依次为LPA-P3>LPA-P>LPA-P2>LPA-P1,LPA-P3具有最强的胆酸盐吸附能力,LPA-P和LPA-P2次之且无显著性差异,而LPA-P1基本不具有胆酸盐吸附能力。
[1] 黄宗国. 中国海洋生物种类与分布[M]. 北京: 海洋出版社, 1994: 156-157.
[2] 武文洁.海带综合利用研究[J].食品科技, 2006, 31(1): 49-52. DOI:10.3969/j.issn.1005-9989.2006.01.016.
[3] 吴凤娜, 张玲. 海带多糖及其提取方法[J]. 山东食品发酵, 2011(3): 36-38.
[4] KIM K H, KIM Y W, KIM H B, et al. Anti-apoptotic activity of laminarin polysaccharides and their enzymatically hydrolyzed oligosaccharides from Laminaria japonica[J]. Biotechnology Letters, 2006, 28(6): 439-446.
[5] 彭波, 许实波, 许东晖, 等. 褐藻多糖硫酸酯的抗凝和纤溶活性[J]. 中草药, 2001, 32(11): 1015-1018. DOI:10.3321/ j.issn:0253-2670.2001.11.026.
[6] 王庭欣, 王庭祥, 庞佳宏. 海带多糖降血糖,血脂作用的研究[J]. 营养学报, 2007, 29(1): 99-100.
[7] 樊文乐. 海带的综合利用研究[D]. 天津: 天津科技大学, 2006: 34.
[8] 邓雪, 黄惠华. 茶花水溶性蛋白的分离纯化及其体外吸附胆酸盐能力的研究[J]. 现代食品科技, 2013, 29(1): 63-67.
[9] 贺继东, 夏文水, 张家骊. 壳聚糖吸附胆酸盐的研究[J]. 食品工业科技, 2008, 29(2): 80-83.
[10] 吴雁, 王亦农, 马建标. 水溶性壳聚糖降血脂作用的化学机理(Ⅰ):水溶性壳聚糖及其衍生物对胆酸盐的结合能力研究[J]. 高等学校化学学报, 2004, 25(4): 757-761.
[11] 许安邦, 林维宣, 佟邵芳, 等. 食品分析[M]. 北京: 中国轻工业出版社, 1994: 177-180.
[12] 卢茳虹, 林宗毅, 崔春, 等. 响应面优化柠檬酸提取海带抗氧化多糖的研究[J]. 食品工业科技, 2012, 33(15): 224-228.
[13] 卢茳虹, 林宗毅, 崔春, 等. 柠檬酸提取海带渣中多糖及其抗氧化活性与结构的研究[J]. 食品工业科技, 2012, 33(23): 93-96.
[14] ZHAO X, XUE C H, LI Z J, et al. Antioxidant and hepatoprotective activities of low molecular weight sulfate polysaccharide from Laminaria japonica[J]. Journal of Applied Phycology, 2004, 16(2): 111-115.
[15] SAHA S, NAVID M H, BANDYOPADHYAY S S, et al. Sulfated polysaccharides from Laminaria angustata: structural features and in vitro antiviral activities[J]. Carbohydrate Polymers, 2012, 87(1): 123-130. DOI:10.1016/j.carbpol.2011.07.026.
[16] NAVARINI L, GILLI R, GOMBAC V, et al. Polysaccharides from hot water extracts of roasted Coffea arabica beans: isolation and characterization[J]. Carbohydrate Polymers, 1999, 40(1): 71-81. DOI:10.1016/S0144-8617(99)00032-6.
[17] 丛建波, 王长振, 李妍, 等. 褐藻硫酸多糖硫酸基含量测定: 硫酸钡比浊法研究[J]. 解放军药学学报, 2003(3): 181-183.
[18] LIN L Z, ZHUANG M Z, ZOU L W, et al. Structural characteristics of water-soluble polysaccharides from Rabdosia serra (MAXIM.) HARA leaf and stem and their antioxidant capacities[J]. Food Chemistry, 2012, 135(2): 730-737. DOI:10.1016/j.foodchem.2012.05.029.
[19] HUANG W Y, MAJUMDER K, WU J P. Oxygen radical absorbance capacity of peptides from egg white protein ovotransferrin and their interaction with phytochemicals[J]. Food Chemistry, 2010, 123(3): 635-641. DOI:10.1016/j.foodchem.2010.04.083.
[20] ALMAJANO M P, DELGADO M E, GORDON M H. Changes in the antioxidant properties of protein solutions in the presence of epigallocatechin gallate[J]. Food Chemistry, 2007, 101(1): 126-130. DOI:10.1016/j.foodchem.2006.01.009.
[21] 周小理, 黄琳, 周一鸣. 苦荞水溶性蛋白体外吸附胆酸盐能力的研究[J]. 食品科学, 2011, 32(23): 77-81.
[22] YE S H, LIU F, WANG J H, et al. Antioxidant activities of an exopolysaccharide isolated and purified from marine Pseudomonas PF-6[J]. Carbohydrate Polymers, 2012, 87(1): 764-770. DOI:10.1016/ j.carbpol.2011.08.057.
[23] WANG J, ZHANG Q B, ZHANG Z S, et al. Antioxidant activity of sulfated polysaccharide fractions extracted from Laminaria japonica[J]. International Journal of Biological Macromolecules, 2008, 42(2): 127-132. DOI:10.1016/j.ijbiomac.2007.10.003.
[24] PATANKAR M S, OEHNINGER S, BARNETT T, et al. A revised structure for fucoidan may explain some of its biological activities[J]. Journal of Biological Chemistry, 1993, 268(29): 21770-21776.
[25] XUE C H, FANG Y, LIN H, et al. Chemical characters and antioxidative properties of sulfated polysaccharides from Laminaria japonica[J]. Journal of Applied Phycology, 2001, 13(1): 67-70.
Bile Salt Adsorption Capacity and Antioxidant Activity of Polysaccharide Extract from Laminaria japonica and Its Fractions
WANG Zhirong, CUI Chun*, LIN Zongyi, HUANG Junwei
(School of Light Industry and Food Science, South China University of Technology, Guangzhou 510640, China)
Polysaccharide from Laminaria japonica (LPA-P) was isolated by using aqueous citric acid solution. After the removal of protein and salt, LPA-P was purified by DEAE Sepharose fast flow chromatography to obtain LPA-P1, LPA-P2, and LPA-P3. The respective relationships of bile salt adsorption capacity and antioxidant activity with molecular weight, sulfated group content and monosaccharide composition for LPA-P and its fractions were investigated. The results indicated that all LPA-P and its purified fractions contained sulfated group. LPA-P3 had the highest sulfated group content of 5.36%, while LPA-P1 had the lowest of only 1.22%. The major monosaccharide composition consisted of fucose, galactose and mannose. Galactose was the major monosaccharide in both LPA-P and LPA-P3, whereas mannose dominated the monosaccharide composition of both LPA-P1 and LPA-P2. LPA-P3 was the highest in fucose. The average molecular weights of LPA-P, LPA-P1, LPA-P2 and LPA-P3 were estimated to be 20.13, 17.55, 28.71, and 17.14 kD, respectively. LPA-P3 exhibited the strongest antioxidant capacity but LPA-P1 the weakest; the antioxidant capacity of LPA-P was a little stronger than that of LPA-P2. LPA-P3 had the strongest bile salt adsorption capacity, followed by LPA-P and LPA-P2. LPA-P1 had substantially no bile salt adsorption capacity. According to the structure-activity relationship of polysacchrides from Laminaria japonica, it is speculated that the higher the contents of sulfated group as well as fucose and galactose, the stronger bile salt adsorption capacity and antioxidant activity of the polysaccharides.
Laminaria japonica; polysaccharides; bile salt adsorption capacity; antioxidant activity
10.7506/spkx1002-6630-201601005
TS201.1
A
1002-6630(2016)01-0022-06
王智荣, 崔春, 林宗毅, 等. 海带多糖及其纯化组分的胆酸盐吸附能力及抗氧化活性[J]. 食品科学, 2016, 37(1): 22-27.
DOI:10.7506/spkx1002-6630-201601005. http://www.spkx.net.cn
WANG Zhirong, CUI Chun, LIN Zongyi, et al. Bile salt adsorption capacity and antioxidant activity of polysaccharide extract from Laminaria japonica and its fractions[J]. Food Science, 2016, 37(1): 22-27. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201601005. http://www.spkx.net.cn
2015-03-11
国家高技术研究发展计划(863计划)项目(2014AA093602);中央高校基本科研业务费专项资金项目(2014ZZ0053)
王智荣(1990—),男,硕士研究生,研究方向为食品生物技术。E-mail:W-Zhirong520@163.com
*通信作者:崔春(1978—),男,教授,博士,研究方向为食品生物技术。E-mail:cuichun@scut.edu.cn
