丁二酰化对胶原生物活性结构的影响
2016-11-11范浩军
徐 洲,刘 洁,陈 意,范浩军,*
丁二酰化对胶原生物活性结构的影响
徐 洲1,2,刘 洁3,陈 意1,范浩军1,*
(1.四川大学 皮革化学与工程教育部重点实验室,四川 成都 610065;2.宜宾学院生命科学与食品工程学院,四川 宜宾 644000;3.齐鲁工业大学皮革化学与工程学院,山东 济南 250353)
本实验以猪皮胶原为研究对象,通过丁二酸酐改性制备了酰化胶原,采用仪器分析法对酰化胶原三股螺旋结构的保留程度进行检测,在此基础上使用原子力显微镜和成纤维细胞培养实验对酰化胶原的生物活性进行了进一步考察。结果表明:胶原的酰化度为62.4%,酰化胶原的等电点降低到4.1。X射线衍射(X-ray diffraction,XRD)、热变性温度、圆二色谱法检测结果显示,丁二酸酐改性整体上并未破坏胶原的三股螺旋结构;酰化胶原在原子力显微镜下呈现了胶原特有的纤维结构,成纤细胞培养实验结果发现酰化胶原可以兼容成纤细胞,并在一定程度上促进成纤细胞的增殖,丁二酰化不会破坏胶原的生物活性结构。
胶原;丁二酸酐;生物活性
胶原,亦称胶原蛋白,是细胞外基质的主要组成成分,是动物体内含量最多、分布最广的蛋白质,占体内蛋白质总量的20%~30%。目前,胶原已经被广泛应用于保健食品、食品添加剂、美容化妆品和生物医用材料等多个领域。在功能性食品方面,由于骨细胞中的骨胶原是羟基磷灰石的黏合剂,它与羟基磷灰石共同构成了骨骼的主体,摄入足够的胶原蛋白,就能在一定程度上保证人体正常的钙质需要量,因此胶原可用作补钙食品[1];在保健食品方面,食用含胶原蛋白丰富的食品,能有效地增加皮肤组织细胞的储水能力,增强和维持肌肤良好的弹性,强化肌肤的韧性,延缓机体的衰老[2];在食品添加剂方面,胶原蛋白可以影响肉类的嫩度和肉类蒸煮后肌肉的纹理,其含量和存在状态与肉制品的嫩度密切相关[3],添加一定量的胶原,可以使腊肠的感官、质地和口感得到明显改善[4],因此可应用于肉制品改良剂;此外,将胶原蛋白辅以甘油、氯化钙等添加剂,制成可食性蛋白膜用于肉类保鲜效果显著,因而可用作食品保鲜材料[5]。在生物医用材料方面,由于胶原是生物大分子,其相对分子质量达30万,具有3 条多肽链相互缠绕而成的特殊三股螺旋结构,这赋予了胶原良好的生物相容性、促进细胞增殖等生物特性,从而使吸附材料[6-7]、整形和美容护肤材料[8]等胶原基材料得以广泛应用成为了可能。
在将胶原用作生物材料、功能性食品原料之前,往往需要通过修饰改性来赋予胶原更多优良的性能。胶原分子中含有的大量羟基、羧基、氨基等活性基团,使得胶原改性成为了可能。特别指出的是,胶原完整的三股螺旋是胶原应用于功能性食品、保健品的载体,是发挥良好生物相容和组织诱导作用的基础[9],如果胶原被生化降解,三股螺旋结构遭到破坏而形成变性产物明胶,其在模拟生理条件下已经不能激活细胞的生长,基本丧失了生物活性[10]。因此,无论是何种改性方法,要保持胶原的生物活性,都必须以保留胶原自身的三股螺旋结构为前提。
研究表明,在胶原侧链上引入亲水基团羧基,可以使胶原更具吸水性。在保健食品和化妆品上可防止水分散失而具有保湿作用;在吸附材料上,可以增强胶原吸收和结合金属离子的能力[11-12];在生物医用材料上,由于胶原分子的负电荷量大幅度增加,使得改性后的胶原血小板黏附能、血纤维蛋白形成能相对较弱,呈现一定的抗栓性[13]。基于此理,本实验拟采用丁二酸酐对胶原进行酰化改性而引入羧基,通过圆二色谱法(ircular dichroism,CD)、X射线衍射(X-ray diffraction,XRD)和原子力显微镜(atomic force microscopy,AFM)等表征方法,重点考察酰化前后对胶原三股螺旋结构的影响,同时采用成纤细胞培养评价其细胞相容性,以期为丁二酰化胶原在食品保健、生物活性材料方面的应用提供基础数据。
1 材料与方法
1.1 材料与试剂
猪皮块,由皮革化学与工程教育部重点实验室提供。
琥珀酸酐、冰醋酸、氢氧化钠、氯化钠、二甲基亚砜(分析纯) 成都市科龙试剂厂;胃蛋白酶(1∶3 000) 德国Merck-Millipore公司;透析袋(截留分子质量8 kD) 美国Solarbio公司;35 24细胞培养孔板(24、96 孔) 美国Corning公司;DMEM培养基美国Gibcobrl公司。
1.2 仪器与设备
FD-1A-50型冷冻干燥机 北京博医康仪器有限公司;NANO ZS型纳米粒度及ZETA电位分析仪、ZEN3600型纳米粒度及电位分析仪 英国马尔文公司;DX-1000型X射线衍射仪 中国丹东方圆仪器有限公司;Model400型圆二色谱仪 美国Aviv公司;VP-DSC超灵敏差示扫描量热仪(ultrasensitive differential scanning calorimetry,US-DSC) 美国通用电气公司;Model 550型酶标仪 美国Bio-Rad公司。
1.3 方法
1.3.1 纯胶原和丁二酰化胶原的制备
将猪皮剪成小方块后溶于0.5 mol/L醋酸溶液中,加入皮质量3%的胃蛋白酶,磁力搅拌48 h,将胶原溶液在4 ℃条件下9 000 r/min离心10 min后去掉沉淀物质,其上清液用NaCl盐析,离心后将沉淀溶于0.1 mol/L醋酸溶液进行透析72 h,随后将胶原溶液冻干得纯胶原(acidpepsin solubilized collagen,APC),改性备用。
将纯胶原用0.05 mol/L醋酸配制为50 g/L的胶原悬浮液,在4 ℃条件下缓慢滴加一定量的丁二酸酐溶液,将反应体系的pH值保持在9左右,搅拌4 h后于0.1 mol/L醋酸溶液中透析,透析3 d,每8 h换液一次,随后将胶原冻干得丁二酰化胶原(collagen acylated by succinic anhydride,CAS),表征备用。
1.3.2 酰化胶原修饰程度的测定
采用三硝基苯磺酸(trinitrobenzenesulfonic acid sol,TNBS)法[14]测定未改性赖氨酸(ε-氨基)的含量,以确定改性胶原的修饰程度。取11 mg胶原样品于螺纹管中,加入1 mL 4% NaHCO3溶液,1 mL 0.5% TNBS溶液,40 ℃水浴轻微振荡3 h,冷却至室温。加入3 mL 6 mol/L HCl摇匀封管,于60 ℃的水浴中轻微振荡2 h充分水解。用5 mL去离子水稀释后,采用20 mL的无水乙醚溶液分3 次充分萃取水解稀释液以除去过量的TNBS。静置分层,用吸管吸去乙醚层,并在热水浴中加热20 min以蒸发掉残余的乙醚,再加入用15 mL去离子水稀释,于346 nm波长处测定吸光度。酰化度按下式计算。
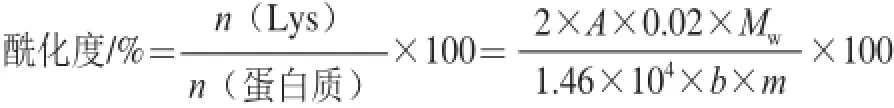
式中:Mw为蛋白质相对分子质量;A为酰化胶原样品溶液在346 nm波长处的吸光度;0.02为酰化胶原样品溶液的体积/L;1.46×104为三硝基苯-赖氨酸(trinitrophenol-Lys,TNP-Lys)摩尔吸光系数/(L/(mol·cm));b为光程/cm;m为样品质量/g。
1.3.3 等电点(pI)的测定
将胶原用0.01 mol/L 乙酸配成质量浓度为0.5 mg/mL的溶液,以0.5为梯度分别测定pH值在2.5~7.5之间胶原溶液的Zeta电位,当Zeta电位值为0时的pH值即为胶原的等电点。
1.3.4 XRD检测
采用X射线衍射仪测定酰化胶原的图谱,使用CuKα射线进行检测,相关参数为管电流30 mA,管电压40 kV,2θ的扫描范围5°~40°,扫描速率为0.15(°)/s。
1.3.5 CD分析
将纯胶原和酰化胶原配制成质量浓度为0.1 mg/mL的溶液,以9 000 r/min离心20 min后,取上清液加入比色皿中,放入圆二色谱仪中在180~260 nm波长范围内以氮气作为载气进行扫描,扫描速率为20 nm/min,从而得到扫描图谱。
1.3.6 热变性温度测定
将酰化胶原配制成质量浓度为0.5 mg/mL的胶原溶液,使用US-DSC对其进行分析。胶原样品溶液和参比溶液(醋酸溶液)在仪器中先脱气30 min,再以1 ℃/min的速率从25 ℃升温到55 ℃进行样品检测。
1.3.7 AFM观察
将胶原样品溶解在0.5 mol/L的醋酸溶液中配成10 μg/mL的胶原溶液,然后将5 μL溶液至新剥离的云母片中,在干燥器中放置2 d干燥成膜。采用原子力显微镜在轻敲模式(soft tapping mode)下观察胶原的表面形貌,扫描速率均为1 Hz,采集的AFM图像用Nano-scope分析软件分析处理。
1.3.8 细胞培养活力比较
参考噻唑蓝(methyl thiazolyl tetrazolium,MTT)比色法对胶原和明胶样品的细胞相容性进行评价[15]。将环氧乙烷灭菌后的明胶、酰化胶原样品溶解在10 mmol/L的磷酸盐缓冲溶液(phosphate buffer saline,PBS)中,此后将成纤维细胞按4×104个/mL 接种于涂覆有明胶或胶原溶液的24 孔细胞培养孔板中,采用DMEM培养基(含有体积分数1%的青霉素和链霉素)在37 ℃培养1、3、5、7 d,隔天换液,同时加入20 μL MTT,在37 ℃条件下培养4 h,以形成蓝紫色甲瓒结晶,去掉上清液,在各孔中加入1.5 mL二甲基亚砜充分溶解甲瓒结晶,室温振荡10 min。随后在492 nm波长处用酶标仪测定各孔的光密度(OD)值,样品各取5 个平行样,取平均值。
2 结果与分析
2.1 改性胶原酰化程度的变化
胶原蛋白中的赖氨酸残基的ε-氨基可与TNBS的磺酸基发生特异性不可逆取代反应,形成TNP复合物,在346 nm波长处有特征光吸收,以此可以测得胶原蛋白中自由氨基的修饰程度。经检测,丁二酸改性后胶原的酰化度(ε-氨基转化率)为62.4%,其酰化效率低于理论计算值,这可能是由于丁二酸酐在碱性水溶液中会发生部分开环水解副反应,生成相应的酸,因此一定程度降低了其酰化效率。
2.2 酰化胶原等电点的变化
胶原蛋白是两性化合物,当外界溶液的pH值为胶原蛋白的等电点时,胶原表面的双电层消失,胶原的动电Zeta电位为零,胶原的溶解度降到最低,此时的pH值即为胶原的等电点。由图1可知,天然胶原的等电点为5.4,而酰化改性胶原的等电点为4.1,由此可知丁二酸酐在与胶原侧链氨基反应过程中引入了羧基,致使丁二酸酐改性后的胶原等电点pH值降低。由等电点的定义可以得出,酰化胶原的等电点越偏离中性溶液,其在中性溶液中的溶解度将更大,因此酰化胶原更加利于在中性溶液中进行二次溶解和应用。
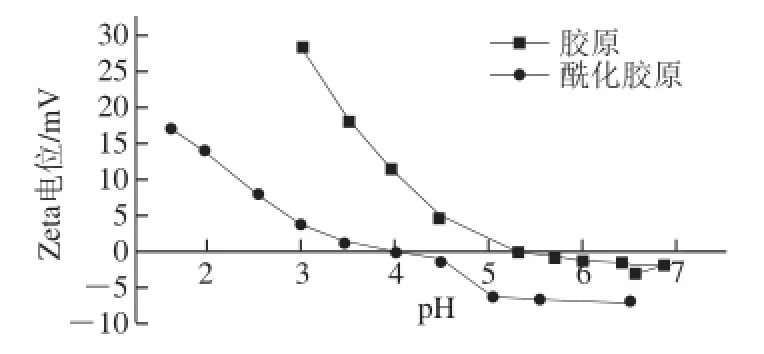
图1 胶原及酰化胶原的等电点Fig.1 pI of APC and CAS
2.3 酰化胶原三股螺旋结构保留度分析
2.3.1 酰化胶原的XRD检测
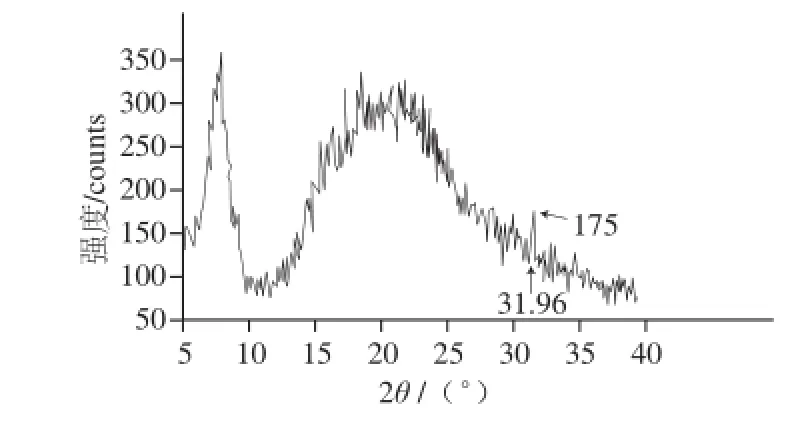
图2 酰化胶原的XRD图谱Fig.2 XRD pattern of CAS
胶原X射线图谱的衍射峰中,在2 θ角为3 1°(0.29 nm波长)附近会出现有一个特征峰值,其反映的是胶原螺旋的一个旋转高度内所对应的轴向周期,即胶原三股螺旋结构[16]。由于X射线衍射是定量测定胶原不同结构层次变化[17],如果胶原的三股螺旋结构遭到破坏,将不会在31°位置出现特征衍射峰。由图2可知,酰化胶原在2θ角为31.96°处出现了特征衍射峰,初步说明丁二酸酐改性没有破坏胶原的三股螺旋结构。
2.3.2 酰化胶原的热稳定性分析
胶原的热变性温度(Ts)是反映其天然螺旋结构的重要指标之一,US-DSC可作为精确的量热手段用于研究稀溶液中胶原蛋白的构象变化。胶原的热变性温度区间为35~40 ℃,在US-DSC图谱中会呈现特定的峰值,而胶原的变性产物明胶由于不存在规整的三股螺旋结构[18],就不会在图谱中出现峰值现象。由图3可知,超灵敏差示扫描量热仪能检测到胶原及酰化胶原中蛋白构象转变而展现出的峰值,纯胶原和酰化胶原的峰值分别为39.6 ℃和38.5 ℃,进一步表明酰化胶原保留了胶原的三股螺旋结构。
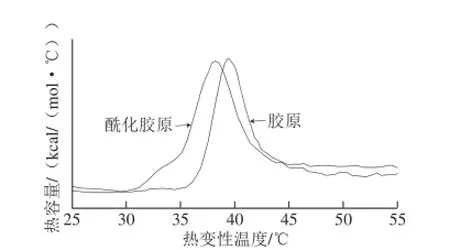
图3 胶原、酰化胶原的US-DSC图谱Fig.3 US-DSC pictures of APC and CAS
2.3.3 酰化胶原的圆二色谱解析
圆二色谱法是测定胶原特殊三股螺旋结构的有效方法,因为胶原是存在特定结构的旋光性生物大分子,具有活性生色基团及折叠结构两方面的典型圆二色性。如果三股螺旋结构没有被破坏,胶原的圆二色谱特征图谱将在210~230 nm波长范围出现一个正吸收峰,在190~200 nm波长范围呈现一个负的吸收峰[19]。同时,正负吸收峰的强度比值(the ratio of positive and negative,Rpn)可以反映三股螺旋结构的完整程度[20-21]。图4圆二色谱图显示,胶原及酰化胶原在223 nm波长处出现了正吸收峰,而在197 nm波长处出现了一个负的吸收峰,再次印证了丁二酸酐改性整体上没有破坏胶原的三股螺旋结构,但酰化改性胶原的Rpn值0.138却小于原胶原的0.142,由此可以看出,由于羧基的引入,使得胶原分子间的化学键有所破坏,因此酰化改性使得三股螺旋结构的整体完整性略有降低。
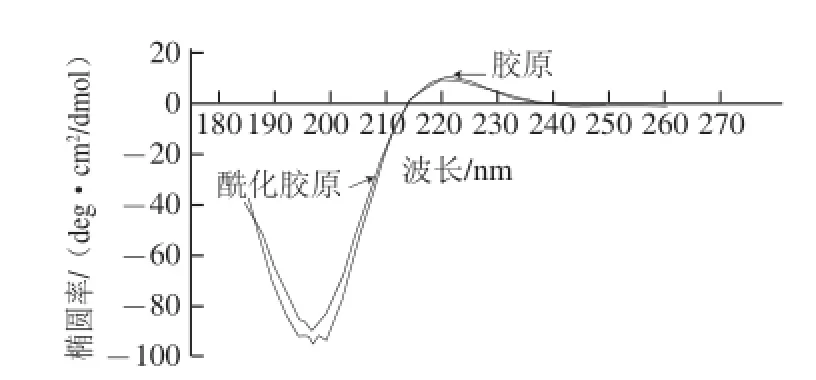
图4 胶原及酰化胶原的圆二色谱图Fig.4 CD spectra of APC and CAS
2.4 胶原的纤维结构
胶原分子的三股螺旋结构是胶原纤维超分子结构的基础。胶原溶液中的溶剂被吸收后,已溶解的胶原分子会通过分子间的相互作用再次自聚成纤维状的结构。如果单个原胶原分子的三股螺旋结构被破坏,那么就不会产生自聚合作用而呈现纤维状结构。图5结果显示,纯胶原、酰化胶原以及明胶的纤维形态呈现出一定的差异,由于明胶的三股螺旋结构已被破坏,通过原子力显微镜并不能观察到纤维结构。但纯胶原和酰化胶原都显示出胶原分子特殊的纤维结构,由此可以看出丁二酰改性并没有破坏胶原的三股螺旋结构。但通过对比发现,酰化胶原纤维间的间隙变得更大,这可能是由于羧基的引入,增大了胶原分子间的静电排斥力,从而使胶原纤维间的距离发生了改变。

图5 纯胶原(a)、酰化胶原(b)、明胶(c)的原子力显微镜图Fig.5 AFM images of APC (a), CAS (b) and gelatin (c)
2.5 酰化胶原的细胞相容性评估
胶原完整的三股螺旋构象是胶原发挥良好生物相容和组织诱导作用的基础[9],通过观察成纤维细胞在涂覆有明胶或胶原溶液的24 孔细胞培养孔板中的生长情况,得出结果如图6所示,成纤维细胞培养不同时段(1、3、5、7 d)的细胞活力呈现一定的差异。成纤维细胞培养之后,胶原和酰化胶原样品均具有促进成纤维细胞增殖的能力,成纤维细胞在胶原和酰化胶原培养基上能激活成纤细胞的生长,随着培养时间的延长,二者整体呈现细胞增殖趋势,在7 d后相应的OD492nm值均在1.5以上。而明胶培养基上的纤维细胞并未呈现明显增殖,其光密度值的变化可能是由于明胶的分解物和死亡成纤细胞的存在造成的,由此可以得知胶原和酰化胶原均具有一定的细胞相容性,具备促进成纤维细胞增殖的活性。
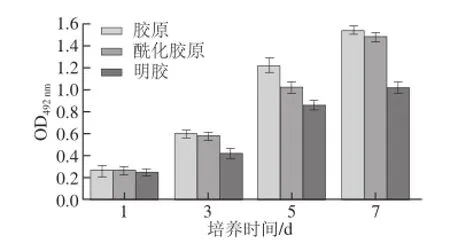
图6 成纤维细胞的活力比较Fig.6 Proliferation of fibroblasts over a period of 7 days
3 结 论
由胶原酰化度值、等电点图谱可知,丁二酸酐改性在胶原分子上成功引入了羧基;从XRD衍射图谱、热变性温度测量、圆二色谱检测结果可以得出,丁二酸酐改性整体上没有破坏胶原的三股螺旋结构,三股螺旋结构的保留使得胶原在原子力显微镜下呈现了胶原特有的纤维结构;通过细胞培养孔板中涂覆胶原溶液进行成纤维细胞培养实验,结果发现酰化胶原可以兼容成纤细胞,并在一定程度上促进成纤细胞的增殖。
在研究方法上,除本研究所采用的检测方法外,还可以使用傅里叶红外光谱法、偏光显微镜观察法、聚丙烯酰胺凝胶电泳法和细胞毒性实验等方法对胶原结构进行更进一步的分析和生物活性评估。本研究采用丁二酸酐对纯胶原进行修饰改性,引入了亲水基团羧基,将更加利于酰化胶原在中性溶液中的二次溶解和应用,酰化胶原在功能性胶原食品、负载材料、生物医用材料的应用上具有一定的应用潜力。
[1] 万春燕, 王英华, 邬元娟, 等. 胶原蛋白在食品中的应用现状及其发展前景[J]. 中国食物与营养, 2008(9): 24-26.
[2] LI X, AGRAWAL C M, WANG Xiaodu. Age dependence of in situ termostability of collagen in human bone[J]. Calcified Tissue International, 2003, 72(4): 513-518. DOI:10.1007/s00223-002-1065-y.
[3] SCHILLING M W, MINK L E, GOCHENOUR P S, et al. Utilization of pork collagen for functionality improvement of boneless cured ham manufactured from pale, soft, and exudative pork[J]. Meat Science, 2003, 65(1): 547-553. DOI:10.1016/S0309-1740(02)00247-4.
[4] MEULLENET J F, CHANG H C, CARPENTER J A, et al. Textural properties of chicken Fankfurters with added collagen fibers[J]. Journal of Food Science, 1994, 59(4): 729-733.
[5] 罗爱平, 朱秋劲, 郑虹, 等. 综合保鲜技术对冷却牛肉的保质研究[J].食品科学, 2004, 25(2): 174-179.
[6] ZENG Y H, LIAO X P, HE Q, et al. Recovery of Th(IV) from aqueous solution by reassembled collagen-tannin fiber adsorbent[J]. Journal of Radioanalytical and Nuclear Chemistry, 2011, 280(1): 91-98. DOI:10.1007/s10967-008-7448-z.
[7] LUO Z Y, ZHANG X L, FAN H J. Modification of collagen fiber for high Cr (III) adsorption[J]. Journal of the American Leather Chemists Association, 2009, 104(4): 149-155.
[8] ZHANG Y, LIU W T, LI G Y, et al. Isolation and partial characterization of pepsin-soluble collagen from the skin of grass carp (Ctenopharyngodon idella)[J]. Food Chemistry, 2007, 103(1): 906-912. DOI:10.1016/j.foodchem.2006.09.053.
[9] LI G Y, FUKUNAGA S, TAKENOUCHI K, et al. Comparative study of the physiological properties of collagen, gelatin and collagen hydrolysate as cosmetic materials[J]. International Journal of Cosmetic Science, 2005, 27(2): 101-106. DOI:10.1111/j.1467-2494.2004.00251.x.
[10] KLAPPER M H, KLOTZ I M. Acylation with dicarboxylic acid anhydrides[J]. Methods in Enzymology, 1972, 25: 531-536. DOI:10.1016/S0076-6879(72)25050-9.
[11] ZHANG L P, ZHU Y J, QIANG X H. Modification of collagen improving high-absorbency of chrome-tanning[J]. China Leather, 2002, 31(15): 10-12.
[12] EVANS A N, MILLIGAN B, MONTGOMERY K C. Collagen crosslinking: new binding sites for mineral tannage[J]. Journal of the American Leather Chemists Association, 1987, 82(4): 86-95.
[13] FRIESS W. Collagen-biomaterial for drug delivery[J]. European Journal of Pharmaceutics and Biopharmaceutics, 1998, 45(2): 113-136.
[14] BUBNIS W A, OFNER III C M. The determination of □-amino groups in soluble and poorly soluble proteinaceous materials by a spectrophotometrie method using trinitrobenzenesulfonic acid[J]. Analytical Biochemistry, 1992, 207(1): 129-133.
[15] HU Y, LIU L, GU Z P, et al. Modification of collagen with a natural derived cross-linker, alginate dialdehyde[J]. Carbohydrate Polymers, 2014, 102: 324-332. DOI:10.1016/j.carbpol.2013.11.050.
[16] GIRAUD-GUILLE M M, BESSEAU L, CHOPIN C, et al. Structural aspects of fish skin collagen which forms ordered arrays via liquid crystalline states[J]. Biomaterials, 2000, 21(9): 899-906. DOI:10.1016/ S0142-9612(99)00244-6.
[17] 张之宝, 王静洁, 陈晖娟, 等. 圆二色谱研究胶原模拟多肽三螺旋结构及其热稳定性[J]. 光谱学与光谱分析, 2014, 34(4): 1050-1055.
[18] LIU J, XU Z, CHEN Y, et al. 1-Butyl-3-methylimidazolium acetate as an alternative solvent for type I collagen[J]. Journal of the American Leather Chemists Association, 2014, 109(7): 189-196.
[19] SREERAMA N, WOODY R W. Poly (Pro) II helixes in globular proteins: identification and circular dichroic analysis[J]. Biochemistry, 1994, 33(33): 10022-10025.
[20] ZHANG Z K, LI G Y, SHI B. Physicochemical properties of collagen, gelatin and collagen hydrolysate derived from bovine limed split wastes[J]. Journal Society of Leather Technologists and Chemists, 2006, 90(1): 23-28.
[21] CONSONNI R, ZETTA L, LONGHI R, et al. Conformational analysis and stability of collagen peptides by CD and by1H and13C NMR spectroscopies[J]. Biopolymers, 2000, 53: 99-111.
Effect of Acetylation on Biological Activity and Structure of Collagen
XU Zhou1,2, LIU Jie3, CHEN Yi1, FAN Haojun1,*
(1. Key Laboratory for Leather Chemistry and Engineering, Ministry of Education, Sichuan University, Chengdu 610065, China; 2. College of Life Science and Food Engineering, Yibin University, Yibin 644000, China; 3. School of Leather Chemistry and Engineering, Qilu University of Technology, Jinan 250353, China)
In this study, acyla ted collagen from pig skin was prepared by succinic anhydride modification. The degree of retention of the collagen triple helix structure was detected by instrumental analysis, and then the biological activity of acylated collagen was further investigated through atomic force microscopy and fibroblast culture. The results showed that the acylation degree of collagen was 62.4%, and the isoelectric point of acylated collagen decreased to 4.1. X-Ray diffraction (XRD) analysis, thermal denaturation temperature determination, and circular dichroism analysis indicated that the triple helix structure of collagen was not destroyed after modification by succinic anhydride. The acetylated collagen presented specific fiber structure under atomic force microscope. Fibroblast culture experiments showed the acetylated collagen could be compatible with fibroblast cells, and partly promote their proliferation. To conclude, acetylation does not destroy the biological activity and structure of collagen.
collagen; succinic anhydride; bioactivity
10.7506/spkx1002-6630-201601003
TS201.3
A
1002-6630(2016)01-0012-05
徐洲, 刘洁, 陈意, 等. 丁二酰化对胶原生物活性结构的影响[J]. 食品科学, 2016, 37(1): 12-16. DOI:10.7506/spkx1002-
6630-201601003. http://www.spkx.net.cn
XU Zhou, LIU Jie, CHEN Yi, et al. Effect of acetylation on biological activity and structure of collagen[J]. Food Science, 2016, 37(1): 12-16. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201601003. http://www.spkx.net.cn
2015-06-30
国家自然科学基金面上项目(51273128;20976110)
徐洲(1984—),男,讲师,博士研究生,研究方向为生物质化学与工程。E-mail:zhxu23@126.com
*通信作者:范浩军(1965—),男,教授,博士,研究方向为高分子材料。E-mail:fanhaojun@scu.edu.cn
