脱脂羊脑蛋白水解多肽的分离纯化及抗氧化活性
2016-11-11杨雪果肖士成蒋鹏飞黄慧娜段旭昌
常 飞,杨雪果,肖士成,蒋鹏飞,黄慧娜,段旭昌,*
脱脂羊脑蛋白水解多肽的分离纯化及抗氧化活性
常 飞1,杨雪果1,肖士成2,蒋鹏飞1,黄慧娜1,段旭昌1,*
(1.西北农林科技大学食品科学与工程学院,陕西 杨凌 712100;2.陕西杨陵华兴羊产业科技发展有限公司,陕西 杨凌 712100)
为制备羊脑蛋白抗氧化肽,本实验对脱脂羊脑蛋白含量及氨基酸组成进行了分析;采用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)对枯草芽孢杆菌中性蛋白酶不同酶解时间的酶解液分子质量进行了分析;采用交联葡聚糖凝胶Sephadex G-25和Sephadex G-15对羊脑酶解产物进行了逐级分离纯化,以羟自由基(·OH)和亚硝酸根离子清除能力为指标对分离组分进行抗氧活性评价,并对纯化后的组分抗氧化活性进行了测定。结果表明,脱脂羊脑粉中蛋白含量为60.55%,在测定的17 种氨基酸中,谷氨酸和天冬氨酸这两种酸性氨基酸含量最高,且含有7 种必需氨基酸;羊脑蛋白经酶解后,分子质量集中在10 kD以下;经Sephadex G-25纯化后,得到了6 个组分,其中组分F4的抗氧化活性最强,组分F4经Sephadex G-15纯化后,得到3 个组分,其中组分F4-2的抗氧化活性最强,组分F4-2对1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基、·OH、超氧阴离子自由基(O2-·)、亚硝酸根离子的半数抑制率IC50分别为1.64、2.47、7.98、5.14 mg/mL。
羊脑蛋白;多肽;分离纯化;抗氧化活性
脑蛋白水解物是指动物脑脱脂后再经蛋白酶降解产生的含有游离氨基酸和分子质量在1 000 D以下的小分子肽等的混合物[1]。目前动物蛋白水解物作为脑血管病的特效药应用于脑血管病的治疗当中,应用最多是以健康猪脑为原料,经酶解而制得的猪脑水解液。脑蛋白水解液有多种功能,Gschanes等[2]研究表明,脑蛋白水解物可显著改善大鼠脑缺血缺氧造成的记忆与运动能力;Gonzalez等[3]研究表明:脑蛋白水解物可显著抑制脑损伤大鼠血清中过氧化氢酶和超氧化物歧化酶活性的降低。钟玉旭等[4]研究表明,小牛脑酶解产物可降低脑损伤引起的脑组织脂质过氧化物(lipid hydroperoxide,LPO),并提高谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)活性。因此把脑蛋白酶解物中的肽段作为保健食品的功能成分具有非常好的应用前景。
羊脑中富含蛋白质,每100 g羊脑中含蛋白质达11 g。西北地区羊产业发达,羊脑资源丰富,利用羊脑蛋白为原料,酶解制备活性肽有很好开发前景。王洪奇等[5]对羊脑水解工艺进行了研究,安玉会等[6]对羊脑多肽的氨基酸组成进行了分析,羊脑多肽含有丰富的谷氨酸、天冬氨酸、亮氨酸和赖氨酸,尤其是谷氨酸和天冬氨酸的含量很高。谷氨酸和天冬氨酸是酸性氨基酸,Ai Saiga等[7]研究发现含有大量酸性氨基酸的肽段呈现更好的抗氧化性。在此理论基础上,本实验利用实验室之前建立的酶解方法制备脱脂羊脑蛋白酶解产物[8],并对酶解产物进行了分离纯化及抗氧化活性研究,旨在为羊脑深加工和功能产品开发,提高羊脑加工利用效益提供理论基础。
1 材料与方法
1.1 材料与试剂
羊脑,由陕西杨陵华兴羊产业科技发展有限公司提供,品种为陕北绒山羊。
枯草芽孢杆菌中性蛋白酶(酶活力为60 000 U/g)北京索莱宝科技有限公司;交联葡聚糖凝胶Sephadex G-25、交联葡聚糖凝胶Sephadex G-15 西安沃尔森生物科技有限公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH) 梯希爱(上海)化成工业发展有限公司;菲洛嗪 上海晶纯生化科技股份有限公司;抗坏血酸 成都市科龙化工试剂厂;石油醚、氢氧化钠、盐酸、95%乙醇、磷酸氢二钠、磷酸二氢钾、磷酸二氢钠、硫酸亚铁、水杨酸、过氧化氢、亚硝酸钠、邻苯三酚等试剂均为国产分析纯;蛋白质Marker(Mw26 616 D)美国Thermo Scientific公司。
1.2 仪器与设备
LGJ-100型冷冻干燥机 北京四环仪器公司;玻璃层析柱(16 mm×100 mm)、HL-2B数显恒流泵、BSZ自动部分收集器 上海沪西分析仪器厂有限公司;FOSS-2300型定氮仪 FOSS瑞典特卡托公司;L-8900全自动氨基酸分析仪 日本日立公司;UV-2550型紫外分光光度计 日本岛津公司;HH-4恒温水浴锅 北京科伟永兴仪器有限公司;HC-3018高速离心机 安徽中科中佳科学仪器有限公司。
1.3 方法
1.3.1 脱脂羊脑粉的制备
将取回的新鲜羊脑用自来水清洗去除表面杂质和鲜血,于-60 ℃条件下冷冻24 h,之后于9.5 Pa、-40 ℃条件下冷冻干燥48 h,冻干后的羊脑经九阳料理机粉碎30 s过100 目筛,用滤纸包裹后放入索氏提取器中用石油醚脱脂12 h,脱脂后的羊脑分散于玻璃纸上于通风橱放置24 h充分挥发残留的石油醚。然后再用九阳料理机粉碎30 s过100 目筛,用自封袋包装后于-60 ℃条件下保存备用,按照GB/T 5009.5—2010《食品中蛋白质的测定》测定脱脂羊脑粉的蛋白质含量[9],按照国家标准GB/T 5009.124—2003《食品中氨基酸的测定》测定氨基酸组成[10]。
1.3.2 羊脑蛋白酶解产物制备
按照实验室之前优化的方法制备酶解产物[8],称取适量的脱脂羊脑粉置于三角瓶中,按固液比为1∶33(m/V)加入蒸馏水混匀,用0.1 mol/L NaOH调pH值至7.0,按5 653.20 U/g底物的酶添加量加入适量的枯草芽孢杆菌中性蛋白酶,在39 ℃条件下酶解3 h,酶解结束后沸水灭酶。酶解液经离心收集上清液,上清液冷冻干燥即得羊脑蛋白酶解产物。
1.3.3 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)
为详细了解羊脑蛋白在加入蛋白水解酶后的蛋白分子质量发生的变化,利用SDS-PAGE跟踪酶解过程,辅助了解蛋白的酶解进程。分别取1 g脱脂羊脑粉于7 个小烧杯中,按实验室之前优化的酶解最佳条件[8]分别酶解1、2、3、4、5、6、7 h,同时做不添加蛋白酶的空白实验,将不同酶解时间的酶解液和空白对照的羊脑蛋白溶液经透析后冻干,将冻干后的样品溶解后进行SDS-PAGE分析,分离胶质量分数为12%,浓缩胶质量分数为4%。考马斯亮蓝R-250染色。蛋白Marker分子质量为26 616 D。
1.3.4 羊脑蛋白酶解产物的分离纯化
1.3.4.1 交联葡聚糖凝胶Sephadex G-25分离纯化[11-13]
将冻干的酶解产物配制成质量浓度25 mg/mL的溶液,在Sephadex G-25凝胶柱上进行分离纯化,上样量为3 mL。以去离子超纯水为洗脱液,洗脱流速为0.3 mL/min,采用自动部分收集器收集洗脱液(3 mL/管),用紫外检测仪在280 nm波长处检测,收集各洗脱峰,真空浓缩,冷冻干燥各级洗脱组分,利用1.3.5.2节和1.3.5.4节的方法和计算公式分别求得羟自由基(·OH)和亚硝酸根离子的清除率,以·OH清除率和亚硝酸根离子清除率为检测指标筛选抗氧化活性最高的组分。
1.3.4.2 交联葡聚糖凝胶Sephadex G-15分离纯化
将上述经过Sephadex G-25凝胶纯化后抗氧化活性最强的组分进行多次收集,冻干。将冻干的组分配制成质量浓度10 mg/mL的溶液,在Sephadex G-15凝胶柱[14]上进行分离纯化,上样量为3 mL。以去离子超纯水为洗脱液,洗脱流速为0.3 mL/min,采用自动部分收集器收集洗脱液(3 mL/管),用紫外检测仪在280 nm波长处检测[15],收集各洗脱峰,真空浓缩,冷冻干燥各级洗脱组分;以·OH清除率和亚硝酸根离子清除率为检测指标筛选抗氧化活性最高的组分。
1.3.5 纯化后活性肽的抗氧化活性测定
1.3.5.1 DPPH自由基清除率测定[16-17]
用95%乙醇将DPPH配制成0.1 mmol/L的溶液,取0.5 mL DPPH溶液置于不同试管中,分别加入0.5 mL酶解脱脂羊脑蛋白多肽测试液和不同浓度VC溶液试样,振荡混匀,于室温下暗反应30 min,在517 nm波长处测定吸光度,分别以蒸馏水代替试样做空白实验,以95%乙醇溶液替代试样做对照实验,按式(1)计算各试样的DPPH自由基清除率,比较纯化后多肽组分与VC和未经纯化的酶解产物对DPPH自由基清除效果。
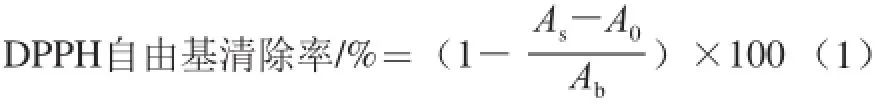
式中:As为试样与DPPH反应的吸光度;A0为95%乙醇代替DPPH对照吸光度;Ab为空白吸光度。
1.3.5.2 ·OH清除率测定[18]
在不同试管中加入0.5 mL 0.15 mol/L的硫酸亚铁溶液和0.5 mL 2 mmol/L水杨酸钠溶液,然后分别加入1 mL酶解脱脂羊脑蛋白多肽测试液或不同浓度VC溶液试样,然后再分别加入0.5 mL 6 mmol/L过氧化氢溶液启动反应,于37 ℃条件下反应1 h后,在510 nm波长处测定吸光度。分别以蒸馏水替代试样和过氧化氢溶液做空白对照,按式(2)计算各样品的·OH清除率,比较纯化后多肽组分与VC和未经纯化的酶解产物对·OH清除效果。

式中:As为试样的吸光度;A0为蒸馏水替代过氧化氢对照吸光度;Ab为蒸馏水替代试样空白吸光度。
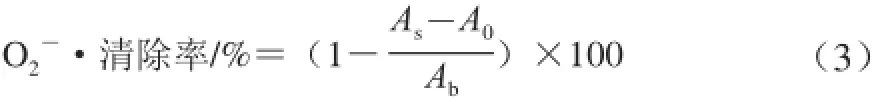
式中:As为试样吸光度;A0为蒸馏水替代邻苯三酚溶液对照吸光度;Ab为蒸馏水替代试样空白吸光度。
1.3.5.4 亚硝酸根离子清除能力测定[20]
取0.5 mL酶解脱脂羊脑蛋白多肽测试液或不同质量浓度VC溶液于不同试管中,分别加入0.5 mL 5 μg/mL亚硝酸钠溶液,于37 ℃反应30 min,再分别加入0.5 mL质量分数为0.4%的对氨基苯磺酸,摇匀静置5 min;再分别加入0.25 mL质量分数为 0.2%的盐酸萘乙二胺显色剂,摇匀,静置反应15 min,于540 nm波长处测定吸光度。分别以蒸馏水替代试样和亚硝酸钠溶液做空白实验,按式(4)计算各实验样的亚硝酸根离子清除率,比较纯化后多肽组分与VC和未经纯化的酶解产物对亚硝酸根离子清除效果。
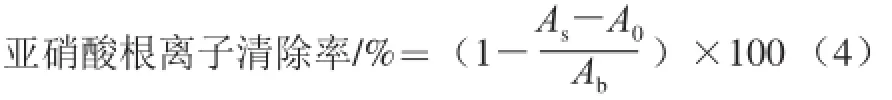
式中:As为试样吸光度;A0为蒸馏水替代亚硝酸钠溶液对照吸光度;Ab为蒸馏水替代试样空白吸光度。
2 结果与分析
2.1 脱脂羊脑粉蛋白含量及氨基酸组成
脱脂羊脑粉的蛋白质含量测定结果为60.55%。氨基酸组成测定结果见表1。

表1 脱脂羊脑蛋白粉氨基酸组成分析结果Table 1 Amino acid composition of defatted goat brain protein
由表1可知,在所测定的17 种氨基酸中,谷氨酸含量最高,其次是天冬氨酸,这与安玉会等[6]对羊脑多肽氨基酸组成分析结果是一致的。Saiga等[7]研究发现含有大量酸性氨基酸的肽段呈现更好的抗氧化性,谷氨酸和天冬氨酸是酸性氨基酸,这两种酸性氨基酸含量高也为下一步抗氧化活性的研究提供了理论支撑。除此之外,可以看到羊脑蛋白中含有丰富的赖氨酸、苯丙氨酸、蛋氨酸、苏氨酸、异亮氨酸、亮氨酸、缬氨酸至少7 种必需氨基酸。
2.2 羊脑蛋白酶解多肽的SDS-PAGE分析

图1 羊脑蛋白不同酶解时间的SDS-PAGGEE图Fig.1 SDS-PAGE of goat brain protein hydrolyzed for different time periods
不同酶解时间羊脑蛋白酶解产物的SDS-PAGE结果如图1所示。未经酶解的羊脑蛋白溶液中蛋白组分比较复杂,含有多种不同分子质量的蛋白质,由于分离胶的浓度较大,因此大分子质量的蛋白的分离效果并不好。但可以看出其分子质量主要集中25~130 kD之间。羊脑蛋 白经枯草芽孢杆菌中性蛋白酶酶解后,除分子质量在55 kD左右的蛋白质只有少量被水解之外,其他蛋白均得到不同程度的水解。从整个电泳图谱来看,高分子质量的蛋白质经枯草芽孢杆菌中性蛋白酶酶解后降解为小分子质量的肽段,这些肽段的分子质量都集中在10 kD以下。SDS-PAGE显示,羊脑蛋白在枯草芽孢杆菌中性蛋白酶的作用下得到了迅速水解。
2.3 羊脑蛋白酶解多肽的Sephadex G-25分离纯化结果

图2 脱脂羊脑蛋白酶解产物的Sephadex G-25层析洗脱结果Fig.2 Elution profile of defatted goat brain hydrolysates on Sephadex G-25 column
脱脂羊脑蛋白的枯草芽孢杆菌中性蛋白酶酶解多肽的Sephadex G-25分离纯化结果如图2所示。羊脑酶解产物经Sephadex G-25纯化后,被分离成F1、F2、F3、F4、F5、F6 共6 个组分。Sephadex G-25的分离范围是1 000~5 000 D,组分F1为穿透峰,即没有进入凝胶颗粒,直接从凝胶的缝隙中被洗脱下来,因此F1组分中以分子质量为5 000 D以上的成分为主;F2、F3、F4、F5、 F6这 5 个组分是进入到凝胶颗粒而被分离开来,因此这5 个组分中以分子质量为5 000 D以下的成分为主。
将这6 个组分分别收集,冷冻干燥,称质量。然后配成质量浓度为1 mg/mL的溶液,测定6 个组分的·OH清除率;配成质量浓度为3 mg/mL的溶液,测定6 个组分的亚硝酸根离子清除率,结果如图3所示。

图3 脱脂羊脑蛋白酶解产物的Sephadex G-25纯化后各组分抗氧化活性比较Fig.3 Antioxidant activity of different fractions purified by Sephadex G-25 column
由图3可知,羊脑蛋白的枯草芽孢杆菌中性蛋白酶酶解多肽经Sephadex G-25纯化后,得到的6 个组分中,F4组分的·OH和亚硝酸根离子的清除率最高,清除能力最强,F4组分质量占6 个组分总质量的(30.43±2.37)%。因此,将组分F4合并收集,冷冻干燥,供进一步的分离纯化研究。
2.4 羊脑蛋白酶解多肽F4的Sephadex G-15分离纯化结果
羊脑蛋白的枯草芽孢杆菌中性蛋白酶酶解多肽的Sephadex G-25分离纯化后的F4组分经Sephadex G-15的进一步分离纯化结果如图4所示。组分F4经Sephadex G-15纯化后,又被分离成F4-1、F4-2、F4-3这3 个组分。Sephadex G-15分离的分子质量范围是<1 500 D,组分F4-1为穿透峰,即没有进入凝胶颗粒,直接从凝胶的缝隙中被洗脱下来,因此F4-1组分中以分子质量为1 500 D以上的成分为主;F4-2、F4-3两个组分是进入到凝胶颗粒而被分离开来,因此这两个组分中以分子质量为1 500 D以下的成分为主。

图4 脱脂羊脑蛋白酶解产物的Sephadex G-15层析洗脱结果Fig.4 Elution profile of F4 on Sephadex G-15 column
将这3 个组分分别收集,冷冻干燥,称质量,然后配成质量浓度为1 mg/mL的溶液,测定3 个组分的·OH清除率;配成质量浓度为2 mg/mL的溶液,测定3 个组分的亚硝酸根离子清除率,结果如图5所示。
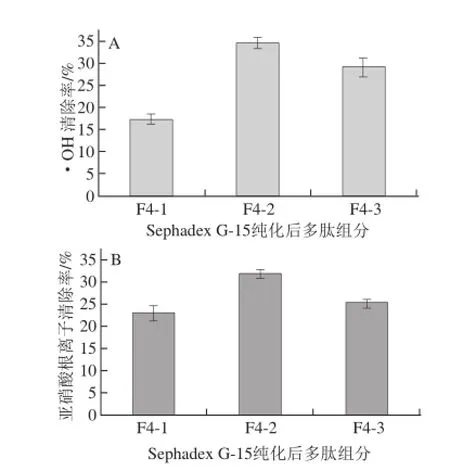
图5 脱脂羊脑蛋白酶解产物的Sephadex G-15纯化后各组分抗氧化活性比较Fig.5 Antioxidant activity of different fractions separated from F4 by Sephadex G-15
由图5可知,羊脑蛋白水解多肽的先经Sephadex G-25分离后的F4组分再进一步经Sephadex G-15分离后,得到3 个组分中的F4-2组分的·OH和亚硝酸根离子清除率最高,即抗氧化活性最强组分,F4-2组分的质量占3 个组分总质量的(26.44±1.62)%。因此,将组分F4-2合并收集,冷冻干燥,供后面的抗氧化活性研究。
2.5 羊脑蛋白水解多肽F4-2组分的抗氧化活性
F4-2组分收集冻干后,配制成不同质量浓度的溶液,测定其对DPPH自由基、·OH、O2-·、亚硝酸根离子的清除能力,然后利用Origin软件对测定结果进行拟合并计算其IC50值。不同质量浓度F4-2组分和对照的抗氧化能力如图6所示。
利用实验室优化后的酶解工艺得到的羊脑蛋白酶解产物相对与一些其他的抗氧化肽表现出了较强的抗氧化性[8]。比如羊脑蛋白酶解产物抗氧化能力强于Klomklao等[21]制得的鲶鱼蛋白酶解产物,Naqash等[22]制得的金线鱼蛋白酶解产物,Hong Zhuang等[16]制得的玉米蛋白酶解产物,Venuste等[23]制得的南瓜蛋白酶解产物,杨璐等[24]制备的马面鱼骨胶原多肽及傅亮等[25]制备的绿豆多肽,因此,羊脑蛋白酶解产物经初步分离纯化后,仅将其与未经分离纯化的羊脑蛋白酶解产物和VC进行抗氧化比较。
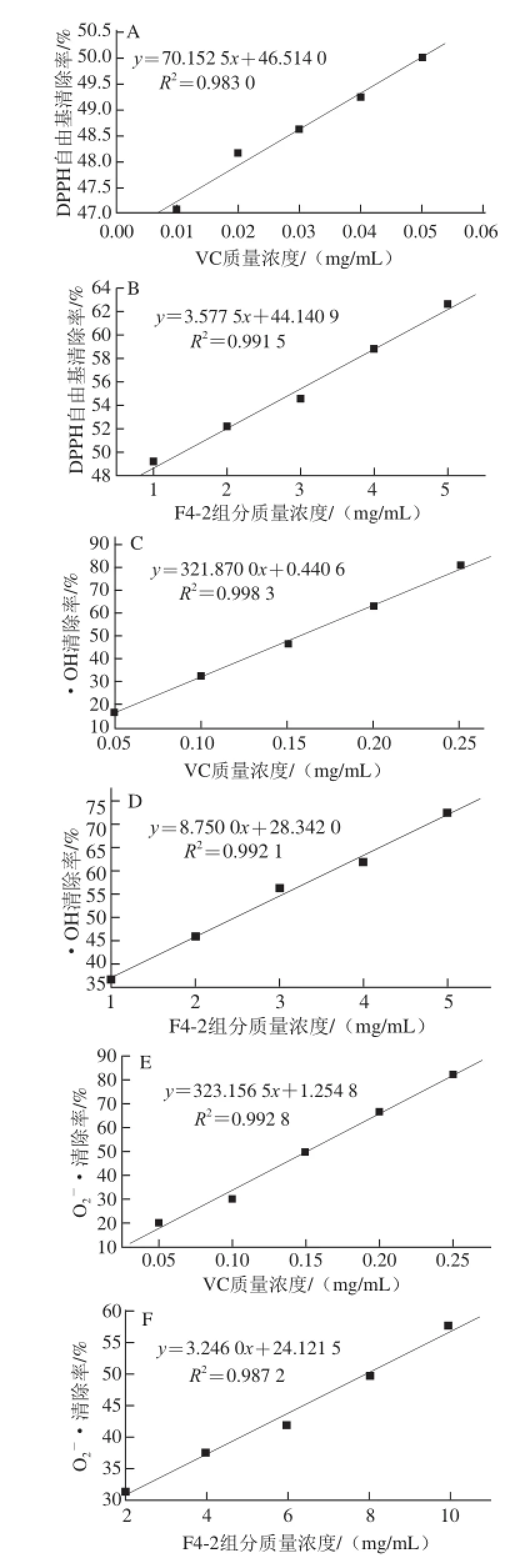

图6 不同质量浓度F4-2组分与VC对照的抗氧化活性Fig.6 Antioxidant activities of fraction F4-2 and control (VC) at different concentrations
由图6A、6B可知,F4-2羊脑蛋白酶解多肽表现出了较强的DPPH自由基清除能力,DPPH自由基清除率与F4-2组分质量浓度呈线性关系,通过 拟合并计算可知,VC和F4-2多肽对DPPH自由基清除的IC50分别为0.049 mg/ mL和1.64 mg/mL。F4-2多肽的IC50值是VC的33.47 倍,清除能力低于VC,但与未经分离前的酶解产物的IC50(2.49 mg/mL)相比有显著提高。
由图6C、6D可知,F4-2多肽对·OH的清除率随着质量浓度的升高而增强,并且呈现出良好的线性关系,经拟合计算,VC和F4-2多肽对·OH的IC50值分别为0.15 mg/mL和2.47 mg/mL。F4-2多肽的IC50值是VC的16.47 倍,清除能力低于VC,但与未经分离前的酶解产物的I C50(3.13 mg/mL)相比得到了提高。
由图6E、6F可知,F4-2多肽对O2-·的清除率随着质量浓度的升高而增强,并且呈现良好线性关系,经拟合计算,VC和F4-2多肽对O2-·清除的IC50分别为0.15 mg/mL和7.98 mg/mL。F4-2多肽的清除能力明显低于VC,但与未经分离前的酶解产物的IC50(10.37 mg/mL)相比得到了明显提高。
由图6G、6H可知,F4-2多肽对亚硝酸根离子的清除率随着质量浓度的升高而增强,当F4-2组分质量浓度小于6 mg/mL时,清除率与F4-2组分质量浓度呈线性关系,当F4-2组分质量浓度大于6 mg/mL时,随着质量浓度的增大,清除率的变化率降低。经拟合计算,VC和F4-2组分对亚硝酸根离子清除的IC50分别为0.03 mg/mL和5.14 mg/mL,F4-2组分的清除能力明显低于VC,但与未经分离前的酶解产物的IC50(10.89 mg/mL)相比有显著提高,其IC50是未经分离前酶解产物IC50的约1/2,即清除亚硝酸根离子的抗氧化能力提高了近2 倍。
经以上分析,羊脑蛋白酶解多肽经Sephadex G-25和Sephadex G-15的分离纯化,提高了分离多肽组分的抗氧化性能,得到的F4-2多肽组分具有最强的抗氧化性能,但其抗氧化性能弱于VC。
3 结 论
脱脂羊脑蛋白粉的蛋白质含量为60.55%,至少含有7 种必需氨基酸,氨基酸中谷氨酸含量最高,天冬氨酸次之。
羊脑蛋白分子质量大部分集中在25~130 kD之间,羊脑中的55 kD蛋白不易被枯草芽孢杆菌中性蛋白酶酶解,其他蛋白的酶解效果较好,酶解后得到的多肽分子质量集中在10 kD以下。
羊脑蛋白枯草芽孢杆菌中性蛋白酶酶解多肽经过Sephadex G-25和Sephadex G-15分离后,得到了抗氧化能力最强的F4-2多肽。F4- 2多肽对DPPH自由基、·OH、O2-·、亚硝酸根离子的半数抑制率IC50分别为1.64、2.47、7.98、5.14 mg/mL,经纯化后的抗氧化肽的抗氧化活性显著高于未经分离纯化的酶解产物。
[1] 孙中武, 王宏伟. 动物脑蛋白水解物研究进展及生产工艺中若干问题的解决初探[J]. 东北林业大学学报, 2004, 32(1): 68-69. DOI:10.3969/j.issn.1000-5382.2004.01.021.
[2] GSCHANES A, WINDISCH M. The influence of Cerebrolysin and E021 on spatial navigation of 24-month-old rats[J]. Journal of Neural Transmission-Supplementa, 1998, 53: 313-321. DOI:10.1007/978-3-7091-6467-9_27.
[3] GONZALEZ M E, FRANCIS L, CASTELLANO O. Antioxidant systemic effect of short-term Cerebrolysin (R) administration[J]. Journal of Neural Transmission-Supplementa, 1998, 53: 333-341. DOI:10.1007/978-3-7091-6467-9_29.
[4] 钟玉旭, 张天民, 邹立家. 动物脑水解物研究[J]. 山东医科大学学报, 1999, 37(3): 257-260.
[5] 王洪奇, 冯健, 修翠娟, 等. 羊脑水解工艺研究[J]. 黑龙江畜牧兽医, 2008(5): 106-107. DOI:10.3969/j.issn.1004-7034.2008.05.053.
[6] 安玉会, 章萍, 郑香梅. 羊脑多肽的氨基酸含量分析[J]. 河南医科大学学报, 2001, 36(1): 36-37. DOI:10.3969/j.issn.1004-7034.2008.05.05.3.
[7] SAIGA A, TANABE S, NISHIMURA T. Antioxidant activity of peptides obtained from porcine myofibrillar proteins by protease treatment[J]. Journal of Ag ricultural and Food Chemistry, 2003, 51(12): 3661-3667. DOI:10.1021/jf021156g.
[8] 常飞, 杨雪果, 肖士成, 等. 脱脂羊脑蛋白酶解条件优化及酶解产物体外抗氧化活性[J]. 食品科学, 2015, 36(3): 114-121. DO I:10.7506/ spkx1002-6630-20150 3022.
[9] 中华人民共和国卫生部. GB 5009.5—2010食品中蛋白质的测定[S].北京: 中国标准出版社, 2010.
[10] 中华人民共和国卫生部. GB 5009.124—2003食品中氨基酸的测定[S].北京: 中国标准出版社, 2003.
[11] CHI Changfeng, WANG Bin, DENG Yueyang, et al. Isolation and characterization of thre e antioxidant pentapeptides from protein hydrolysate of monkfish (Lophius litulon) muscle[J]. Food Research International, 2014, 55: 222-228. DOI:10.1016/j.foodres.2013.11.018.
[12] JIANG Haiping, TONG Tianzhe, SUN Jianhua, et al. Purification and characterizat ion of antioxidative peptides from round scad (Decapterus maruadsi) muscle protein hydrolysate[J]. Food Chemistry, 2014, 154(7): 1 58-163. DOI:10.1016/j.foodchem.2013.12.074.
[13] BARATZADEH M H, ASOODEH A, CHAMANI J. Antioxidant peptides obtained from goose egg whi te proteins by enzymatichydrolysis[J]. International Journal of Food Science & Technology, 2013, 48(8): 1603-1609. DOI:10.1111/ijfs.12130.
[14] KANG N, KO S C, SAMARAKOON K, et al. Purification of antioxidative peptide from peptic hydrolysates of Mideodeok (Styela clava) flesh tissue[J]. Food Science and Biotechnology, 2013, 22(2): 541-547. DOI:10.1007/s10068-013-0112-y.
[15] 贾韶 千, 吴彩娥, 范龚健, 等. 银杏抗氧化肽的分离纯化及活性鉴定[J].农业机械学报, 2011, 42(6): 152-155.
[16] HONG Zhuang, NING Tan g, YUAN Yuan. Purification and identification of antioxidant peptides from corn gluten meal[J]. Jour nal of Functional Foods, 2013, 5(4): 1810-1821. DOI:10.1002/jsfa.6170.
[17] 郭庆启, 张娜, 姜元松, 等. 榛子仁蛋白酶解工艺的优化及酶解物抗氧化能力的研究[J]. 食品科学, 2013, 34(9): 189-193. DOI:10.7506/ spkx1002-6630-201309039.
[18] 侯学敏, 李林霞, 张直峰, 等. 响应面法优化薄荷叶总黄酮提取工艺及抗氧化活性[J]. 食品科学, 2013, 34(6): 124-128. DOI:10.7506/ spkx1002-6630-201306027.
[19] 朴美子, 王懋存, 王晓东. 中华真地鳖酶解短肽的抗氧化作用[J]. 食品科学, 2013, 34(5): 242-245.
[20] 郭德军, 彭春秀, 何享, 等. 云南晒青毛茶提取物抗氧化活性研究[J].中国食品学报, 2013, 13(8): 42-48.
[21] KLOMKLAO S, BENJAKUL S, KISHIMURA H. Functional properties and antioxidative activity of protein hydrolysates from toothed ponyfish muscle treated with viscera extract from hybrid catfish[J]. International Journal of Food Science & Technology, 2013, 48(7): 1483-1489. DOI:10.1111/ijfs.12116.
[22] NAQASH S Y, NAZ EER R A. Antioxidant and functional properties of protein hydrolysates from pink perch (Nemipterus japonicus) muscle[J]. Journal of Food Science and Technology, 2013, 50(5): 972-978. DOI:10.1007/s13197-011-0416-y.
[23] VENUSTE M, ZHANG X, SHOEMAKER C F, et al. Influence of enzymatic hydrolysis and enzyme type on the nutritional and an tioxi dant properties of pumpkin meal hydrolysates[J]. Food & Function, 2013, 4(5): 811-820. DOI:10.1039/c3fo30347k.
[24] 杨露, 丁利君, 蓝德安. 马面鱼骨胶原多肽的理化特性及其抗氧化活性[J]. 食品科学, 2013, 34(7): 234-239. DOI:10.7506/spkx1002-6630-201311024.
[25] 傅亮, 何倩, 陈勇, 等. 绿豆多肽的制备工艺及抗氧化作用[J]. 食品与机械, 2010, 26(6): 79-82. DOI:10.3969/j.issn.1003-5788.2010.06.023.
Purification and Antioxidant Activity of Peptides Derived from Defatted Goat Brain Protein
CHANG Fei1, YANG Xueguo1, XIAO Shicheng2, JIANG Pengfei1, HUANG Huina1, DUAN Xuchang1,*
(1. College of Food Science and Engineering, Northwest A&F University, Yangling 712100, China; 2. Shaanxi Huaxing Goat Industry Science and Technology Development Co. Ltd., Yangling 712100, China)
This research was designed to prepare antioxidant peptides derived from goat brain protein. The protein content and amino acids composition of defatted goat brain were determined. The molecular mass distribution of protein hydrolysates by neutral protease from Bacillu s subtilis at different times was analyzed by sodium dodecyl sulfatepolyacrylamide gel electrophoresis (SDS-PAGE), and goat brain protein hydrolysates were separated and purified by Sephadex G-25 gel filtration chromatography and Sephadex G-15 gel filtration chromatography. The antioxidant activity of the resulting fractions was evaluated by DPPH, hydroxyl radical, superoxide anion radical, and nitrite radical scavenging assays. The results showed that the protein content of defatted goat brain was 60.55% and contained seven essential amino acids among which glutamic acid and aspartic acid were the most predominant. The molecular mass of the hydrolysates was below 10 kD. After purification by Sephadex G-25 gel filtration chromatography, the six fractions of the hydrolysates were obtained and F4 fraction showed the strongest antioxidant activity. F4 was further purified into three fractions by Sephadex G-15 gel filtration chromatog raphy, including F4-2 showing the strongest antioxidant activity. The IC50values of F4-2 for scavenging DPPH, hydroxyl radical, superoxide anion radical, and nitrite radicals were 1.64, 2.47, 7.98 and 5.14 mg/mL respectively.
goa t brain protein; peptides; separation and purification; antioxidant activity
10.7506/spkx1002-6630-201601007
TS209
A
1002-6630(2016)01-0033-07
常飞, 杨雪果, 肖士成, 等. 脱脂羊脑蛋白水解多肽的分离纯化及抗氧化活性[J]. 食品科学, 2016, 37(1): 33-39.
DOI:10.7506/spkx1002-6630-201601007. http://www.spkx.net.cn
CHANG Fei, YANG Xueguo, XIAO Shicheng, et al. Purification and antioxidant activity of peptides derived from defatted goat brain protein[J]. Food Science, 2016, 37(1): 33-39. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201601007. http://www.spkx.net.cn
2015-03-09
“十二五”国家科技支撑计划项目(2011BAD28B05-3)
常飞(1987—),男,硕士研究生,主要从事食品加工新技术研究。E-mail:changfeibest@126.com
*通信作者:段旭昌(1965—),男,副教授,博士,主要从事天然产物及食品加工新技术研究。E-mail:duanxc1965@tom.com
