美托洛尔对脓毒性休克患者心脏功能及预后影响的临床研究
2016-11-11徐前程陈尚华刘小彬
徐前程 查 磊 陈尚华 刘小彬⋆
美托洛尔对脓毒性休克患者心脏功能及预后影响的临床研究
徐前程查磊陈尚华刘小彬⋆
目的 评价美托洛尔对脓毒性休克患者心脏功能及预后的影响。方法 早期目标导向治疗(EGDT)达标的脓毒性休克患者50例,分为观察组25例与对照组25例,观察组予以美托洛尔12.5mg鼻饲,2次/d,对照组使用生理盐水,观察两组患者治疗后心脏功能指标及机械通气时机、病死率等指标。结果 观察组经治疗后NT-proBNP逐渐降低,与对照组比较,2d后各时间点明显降低(P<0.05),观察组经治疗后每日液体需求量呈明显下降趋势,与对照组比较,2d、3d每日液体需求量明显降低(P<0.05),对照组下降程度及速度均较观察组慢,4d后与1d比较明显下降(P<0.05);两组患者液体出量差异无统计学意义(P>0.05);观察组EVLWI经治疗后明显下降,3d后各时间点与1d及对照组比较,差异有统计学意义(P<0.05),对照组EVLWI下降缓慢,5d后时间点与1d比较差异明显。观察组患者的ICU病死率、28d病死率、住院病死率、机械通气时间、住ICU病死率比对照组均有降低趋势,但差异均无统计学意义(P>0.05),住院时间比对照组明显降低(P<0.05)。结论 鼻饲美托洛尔治疗脓毒性休克可以降低液体需要量、改善心脏功能、降低EVLWI,有降低住院时间、病死率、机械通气时间的趋势。
脓毒性休克 美托洛尔 心脏功能 临床预后
脓毒性休克是严重感染导致有效循环血量减少、组织灌注不足、细胞代谢紊乱最终出现多脏器功能不全的临床综合征[1]。心功能不全是被公认为脓毒症和脓毒性休克患者器官衰竭的表现之一[2],据统计在脓毒性休克患者中60%患者出现感染相关性心功能不全(SIMD),主要是以射血分数受损为主要表现的左心室功能抑制[3]。研究显示使用多巴酚丁胺提高氧输送至超常值以上,可能对脓毒症导致的多脏器功能障碍综合征(MODS)患者更加有害[4-5]。本文探讨鼻饲美托洛尔对脓毒性休克患者心脏功能及预后的影响,为临床治疗及后续研究提供参考。
1 临床资料
1.1一般资料 选择2013年7月至2014年12月本院重症医学科脓毒性休克经EGDT达标患者50例。脓毒性休克及早期目标导向治疗(EGDT)诊断标准:(1)脓毒性休克:参照严重脓毒症与脓毒性休克诊疗国际指南2012诊断标准[6]。(2)EGDT标准:①CVP 8~12mmHg。②MAP≥65mmHg 。③尿量≥0.5ml/(kg·h)。④SCVO2≥70%或SVO2≥65%。排除:严重肝肾心功能不全、β受体阻滞剂使用禁忌、入院前48h使用过β受体阻滞剂、处于临终状态、鼻饲药物禁忌证、年龄<18岁、HR<60次/min、CI<2.5L/(min·m2)、操作未获得患者或家属同意。所有入选患者按照临床诊疗常规签署有创血压监测知情同意书。且经过医院伦理委员会批准。
1.2方法 所有患者按随机数字表法分为观察组和对照组,观察组给予鼻饲重酒石酸美托洛尔片12.5mg,2次/d,使用10ml温开水融化鼻饲,对照组给予等量的生理盐水鼻饲,使用时间为患者全身炎症反应综合征(SIRS)纠正,余管理方法均参考2012脓毒症诊疗指南[6]。
1.3观察指标 于实验第1、2、3、4、5、6、7天记录患者NT-proBNP、血管外肺水指数(EVLWI)、液体出入量,住院时间、住ICU时间、机械通气时间,28d病死率、ICU病死率、住院病死率。
1.4统计学方法 采用SPSS 22.0统计软件。符合正态分布的计量资料以(x±s)表示,组间比较采用独立样本的t检验,组内各时间比较采用重复测量的方差分析;非正态分布数据用中位数(四分位数)[M,(QL,QU)]表示,采用秩和检验;计数资料以%表示,采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1两组患者基本资料比较结果 见表1。
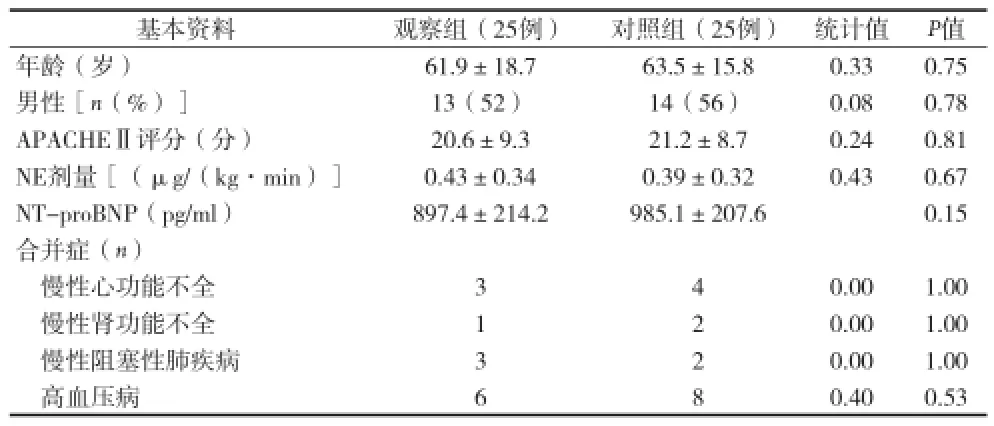
表1 两组患者临床资料比较(x±s)
2.2两组患者脑钠肽、血管外肺水及液体出入量比较 观察组经治疗后NT-proBNP逐渐降低,与对照组比较2d后各时间点明显降低(P<0.05),对照组亦呈升高后逐渐降低的趋势;观察组经治疗后每日液体需求量呈明显下降趋势,与对照组比较,2d、3d每日液体需求量明显降低(P<0.05)。对照组每日液体需求量亦逐渐下降,但下降程度及速度均较观察组慢,4d后与1d比较下降明显(P<0.05);两组患者液体出量差异无统计学意义(P>0.05)。观察组EVLWI经治疗后明显下降,3d后各时间点与1d及对照组比较差异有统计学意义(P<0.05),对照组EVLWI下降缓慢,5d后时间点与1d相比差异明显。见表2。
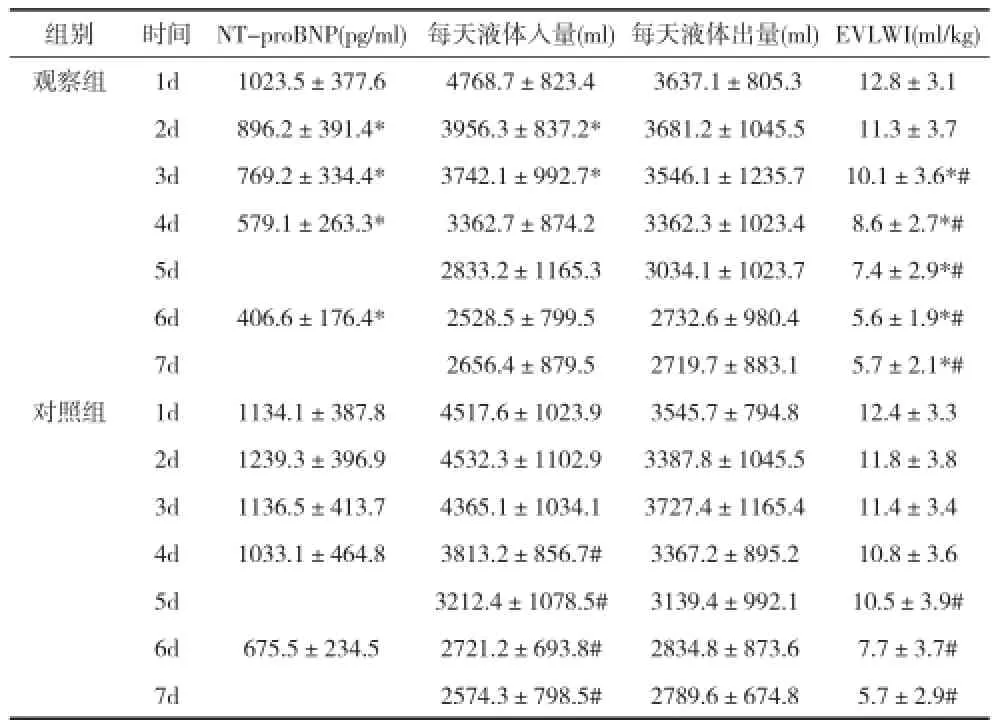
表2 两组患者脑钠肽、血管外肺水及液体出入量比较(x±s)
2.3两组患者主要指标比较 观察组患者ICU病死率、28d病死率、住院病死率较对照组均有降低趋势,但差异均无统计学意义(均P>0.05)。观察组患者住院时间较对照组明显降低,差异有统计学意义(P<0.05),住ICU时间无明显差异,机械通气时间有降低趋势,但差异无统计学意义(P>0.05)。见表3。
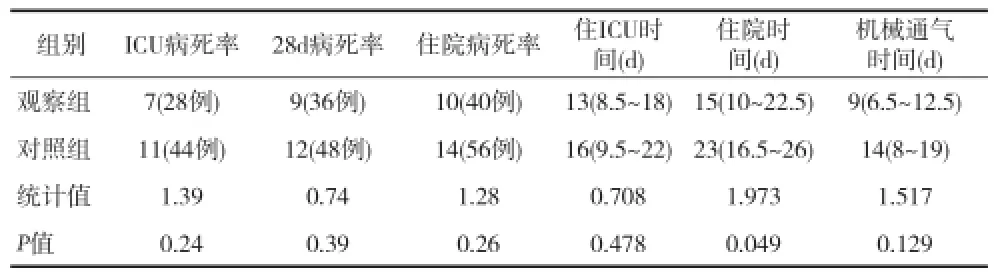
表3 两组患者主要指标比较[n(%)]
3 讨论
目前对脓毒症相关性心功能不全的机制进行了广泛的研究,虽然研究尚不明确,但基本的机制有以下几点:(1)循环中高的儿茶酚胺水平刺激作用,导致心肌细胞水平上肾上腺素能受体下调和受体后信号通路抑制导致对肾上腺素反应的减弱。(2)通过改变细胞内钙离子转运,L型钙通道电流的抑制,脓毒症模型显示可降低ryanodine受体(RYR)密度和活性,改变肌浆网钙再摄取。在肌原细胞水平上,脓毒症影响钙敏感性肌纤维收缩蛋白。(3)研究发现严重的感染可导致心肌细胞遗传编码的改变,感染6h后使用液体复苏的腹膜炎大鼠模型,确定了527个转录基因的显著下调或上调,部分基因的改可导致心脏功能障碍。(4)研究发现脓毒症心肌线粒体功能受损,出现呼吸功能紊乱,主要表现为呼吸链中多个复合体活性降低,使有氧代谢率明显下降,出现氧化磷酸化受损,最终导致ATP合成降低、心肌细胞等全身细胞的功能障碍。
本资料显示,脓毒症患者存在明显的脑钠肽前体升高心功能受损表现。李振华等[7]研究显示死亡组患者血浆NT-proBNP浓度和各项危重病评分明显高于存活组,心脏彩超结果亦显示左室射血分数明显低于存活组,本资料观察组患者经治疗后NT-proBNP呈先升高后逐渐降低的趋势。传统认为使用β受体阻滞剂,对于心功能不全患者影响较大,但近年来,对于心力衰竭的治疗取得重大进展仍是负性肌力药物,但是对于心功能Ⅳ级的患者仍然不建议使用,由于脓毒性休克患者存在心功能不全、低血压,β受体阻滞剂因其潜在的负性肌力作用而备受争议,但越来越多的基础与临床试验得出结论,使用是安全的、可能有效。本资料前期研究与既往多个研究基本得出相似的结论,降低心率作用,改善心脏舒张功能,延长心脏充盈时间,增加心脏每搏量,降低心脏负荷,无明显的副作用,其改善心功能的机制可能不仅是减慢心率所带来的益处,可能与降低炎症反应程度有关。Suzuki等[8]选择β1肾上腺素能阻滞剂艾司洛尔用于脓毒症大鼠模型,研究发现艾司洛尔组大鼠心率、血压和TNF等炎症因子水平比对照组明显降低,动脉血乳酸(Lac)并未增加,和对照组比较,有逐渐降低的趋势,表明为过度的无氧代谢发生,在单独的免疫组织化学实验,发现脓毒症动物β1受体密度显著减少,β1肾上腺素能阻滞剂治疗可钝化这种反应且增加受体的数量,得出结论是在体外实验中β受体阻滞剂可以下调肾上腺素通路,可保护心脏功能。Hagiwara等[9]使用一高选择性、超短半衰期β1肾上腺素能阻滞剂兰地洛尔处理LPS诱导的脓毒症模型小鼠模型,兰地洛尔可减少促炎性细胞因子如IL-1,IL-11,TNF等炎症因子水平,使用灌注技术体外评价心脏功能,显示出良好的收缩与舒张功能。本资料亦发现,使用β受体阻滞剂后液体需要量明显减少,EVLWI较对照组明显降低,下降程度亦明显增快,住ICU时间、住院时间、机械通气时间均逐渐降低,其可能与使用β受体阻滞剂后减慢心率,稳定血流动力性,降低液体需要量,改善心脏功能,降低肺瘀血所致。
目前β受体阻滞剂对脓毒症休克预后的研究不多,大部分为动物实验结果,本资料显示,使用美托洛尔可降低总住院时间,有降低机械通气时间和病死率的趋势,总体可改善脓毒症休克患者预后。Berk等[10]采用脓毒症犬模型,研究发现使用非选择性β-受体阻滞剂普萘洛尔可显著提高生存率,甚至当内毒素注射后60min,使用普萘洛尔也阻止第二阶段低血压,从而减少液体的要求。其他动物实验结果亦得出相似的结论。相比较动物实验,临床使用得出了不一致的结果,Gutierrez等[11]回顾研究83例入住ICU的脓毒症患者,使用β受体阻滞剂29例,逻辑回归分析提示两组患者间并未显示出病死率的差异,同样Galbois[12]回顾68例因严重脓毒症或脓毒症休克收住ICU的肝硬化患者,分为使用β受体阻滞剂组(n=42)和对照组(n=26),两组患者6个月的总体病死率无差别(P=0.27),但在转出ICU的患者中,<6个月使用β受体阻滞剂组病死率更高(P=0.03)。最近由Morelli等[13]主导的关于艾司洛尔对快心室率感染性休克患者预后影响一随机对照研究,研究结果显示,艾司洛尔可降低脓毒性休克患者28d病死率(P<0.001)。本资料未发现在病死率指标上有明显的差异。分析上述研究,动物实验结果较为一致,而临床试验得出不一致的结论,甚至有增加病死率的可能,分析结果可能为临床试验较动物实验混杂因素较多,如患者的年龄、感染的部位、是否合并其他基础疾病、感染的病原体类型等各种因素均可影响试验结果,另外使用不同类型、不同剂量、不同的干预时间点均可对试验结果造成影响,但这些可能为后续进一步研究指明方向。
[1] De Kock I, Van Daele C, Poelaert J,et al. Sepsis and septic shock: pathophysiological and cardiovascular background as basis for therapy. Acta Clin Belg,2010 ,65(5):323-9.
[2] Rudiger A, Singer M. Mechanisms of sepsis-induced cardiac dysfunction. Critical care medicine, 2007, 35(6): 1599-1608.
[3] Vieillard-Baron A, Caille V, Charron C, et al. Actual incidence of global left ventricular hypokinesia in adult septic shock. Critical care medicine, 2008, 36(6): 1701-1706.
[4] Hayes MA, Timmins AC, Yau E, et al. Elevation of systemic oxygen delivery in the treatment of critically ill patients.N Engl J Med 1994, 330:1717-1722.
[5] Gattinoni L, Brazzi L, Pelosi P, et al. A trial of goal-oriented hemodynamic therapy in critically ill patients. N Engl J Med1995,333:1025-1032.
[6] Flierl MA, Rittirsch D, Huber-Lang MS, et al. Molecular events in the cardiomyopathy of sepsis. Molecular medicine, 2008, 14(5-6):3.
[7] 李振华, 董磊, 王国兴,等. 脑利钠肽、肌钙蛋白T和I监测对重症脓毒症和脓毒症休克预后的意义. 中华急诊医学杂志, 2012,21(9):1016-1021.
[8] Suzuki T, Morisaki H, Serita R, et al. Infusion of the β1-adrenergic blocker esmolol attenuates myocardial dysfunction in septic rats. Critical care medicine, 2005, 33(10): 2294-2301.
[9] Hagiwara S, Iwasaka H, Maeda H, et al. Landiolol, an ultrashortacting β1-adrenoceptor antagonist, has protective effects in an LPS-induced systemic inflammation model. Shock, 2009, 31(5): 515-520.
[10] Berk J L, Hagen J F, Dunn J M. The role of beta adrenergic blockade in the treatment of septic shock. Surgery, gynecology & obstetrics, 1970, 130(6): 1025-1034.
[11] Gutierrez J, Hossam A, Lazarezcu R, et al. Effect of beta blockers on sepsis outcome. American Journal of Case Reports, 2009,15(10): CR499-CR503.
[12] Galbois A, Das V, Thabut D, et al. Beta-blockers have no effect on outcomes in patients with cirrhosis and severe infections. Hepatology, 2011, 53(4): 1412-1413
[13] Morelli A, Ertmer C, Westphal M, et al. Effect of heart rate control with esmolol on hemodynamic and clinical outcomes in patients with septic shock: a randomized clinical trial. JAMA,2013, 310(16): 1683-1691.
Objective To observe the effect of metoprolol on cardiac function and clinical outcomes in patients with septic shock . Methods It was a prospective randomized controlled trial. A totally of 50 patients meeting the inclusion criteria and divided into two groups according to whether using metoprolol or not,each group contain 25 patients. Results The baseline was balance and comparable. There is a tendency of decrease of experimental group in NT-proBNP,Contrasted to control group,NT-proBNP reduced signifi cantly after 2d(P<0.05),There was a tendency of decrease of fl uid intake in experimental group,Contrasted to control group,fl uid intake reduced signifi cantly at 2d、3d(P<0.05).the fl uid intake reduced slowly in control group and reduced obviously at 4d compared with 1d(P<0.05),the output was not statistical difference in two groups(P>0.05);There was a tendency of decrease of EVLWI in experimental group,and reduced significantly after 3d compared with 1d,When contrasted to control group the EVLWI level were lower after 3d,but not at 7d,in control group the EVLWI reduced slowly compare with experimental group,and reduced significantly after 5d compared with 1d;There was a tendency of decrease of experimental group in ICU mortality,28days mortality,in-hospital mortality,mechanical ventilation time and length of ICU stay,but does not have statistical differences(P>0.05).But the length of hospital stay in experimental group was shorter than control group(P<0.05). Conclusions Metoprolol can reduce fl uid intake and EVLWI,improve cardiac function.There was a tendency improve clinical outcomes.
Septic shock Metoprolol Cardiac function Clinical outcomes
241000 皖南医学院附属芜湖市第二人民医院
