乳腺癌肝转移患者化疗后维持治疗的疗效及安全性研究
2016-11-10西安市中心医院西安710004
西安市中心医院(西安710004)
王 峥 陈洪志 董济民 马小斌 林 帅 康华峰△
乳腺癌肝转移患者化疗后维持治疗的疗效及安全性研究
西安市中心医院(西安710004)
王 峥 陈洪志 董济民 马小斌 林 帅 康华峰△
目的:评价乳腺癌肝转移患者化疗临床获益后卡培他滨维持治疗的疗效及安全性。方法:乳腺癌肝转移患者53例,给予多西他赛、吉西他滨或长春瑞滨联合卡培他滨化疗,疾病控制患者给予卡培他滨2000 mg/(m2·d)维持治疗,连用14 d,21 d为1周期,直至PD或不良反应不能耐受。主要观测指标为至疾病进展时间(TTP)和有效率(RR),并记录不良反应。结果:53例患者247周期化疗,中位化疗数为4周期。其中CR 7例(13.21%),PR 22例(41.51%),SD 15例(28.30%),PD 9例(13.21%),RR为54.72% (29/53),疾病控制率(DCR,DCR=CR+PR+SD) 为 83.02%(44/53 )。给予卡培他滨单药维持治疗至PD,中位TTP为9.5个月。主要不良反应为骨髓抑制及手足综合征。结论:乳腺癌肝转移患者采用含卡培他滨联合化疗方案达到缓解或稳定后给予卡培他滨维持化疗,患者耐受性及安全性良好,TTP明显延长。
乳腺癌是女性最常见的恶性肿瘤之一,近年来我国发病率迅速增高,据文献报道,我国乳腺癌发病率已经占女性恶性肿瘤的第1位,病死率居第六位。20%~30%的乳腺癌患者术后出现局部复发或远处转移,肝转移的发生率占8%~14%[1],早期病灶隐匿,可以不表现任何临床症状,与其他部位转移相比,肝转移患者对化疗、内分泌等全身治疗的反应差,生存期相对较短,生存时间一般短于常见的其他部位转移(如软组织、骨、肺及胸膜转移),是重要的预后不良因素之一。我们于2010年1月至2013年12月采用多西他赛、吉西他滨或长春瑞滨联合卡培他滨治疗乳腺癌肝转移患者53例,对疾病得到有效控制的44例患者进行卡培他滨维持治疗,现报道如下。
资料与方法
1 一般资料 53例患者均为确诊乳腺癌术后肝转移,预计生存期≥3个月。原发肿瘤均为非特殊性浸润性导管癌,发病年龄35~61岁,中位年龄46岁。肝转移灶经CT、MRI及穿刺活检等检查确诊,其中37例转移灶经超声引导下穿刺活检获得病理诊断并重新用免疫组化方法测定激素受体、Her-2及Ki-67表达状态,均有可测量的影像学指标。治疗前血常规、肝肾功能和心电图均正常。内脏转移仅累及肝者31例,17例患者累及肝、肺2个部位,5例累及肝、肺等3个及以上部位,其中38例合并骨转移;绝经前患者37例,绝经后患者16例;激素受体阳性25例,阴性28例;患者在新辅助治疗中应用过紫杉类药物,至少停药1年以上,或选用非紫杉类药物。患者Karnofsky评分为70~90分。53例乳腺癌肝转移患者的临床病理特征见表1。
表1 53例乳腺癌肝转移患者的临床病理特征[n(%)]
2 化疗方法 化疗方案具体剂量为长春瑞滨25 mg/m2静脉滴注,d1、d8;多西他赛75 mg/m2静脉滴注,d1;吉西他滨1000 mg/m2静脉滴注,d1、d8;卡培他滨2000 mg/m2口服,每日2次,d1-14;21d为1周期。每周期评价不良反应,每2周期后评价疗效。未进展患者化疗4~6周期后,肿瘤不再明显缩小时序贯卡培他滨单药维持治疗,直至疾病进展或不能耐受不良反应。伴骨转移患者应用唑来膦酸4 mg/次,静脉滴注,每28天1次。化疗时常规予以止吐等辅助用药,不良反应按常规处理,Ⅳ度骨髓抑制化疗药物减量20%进行。如肿瘤病灶增大达到PD则更换化疗方案。
3 疗效和不良反应评价 随访截止于2015年6月。治疗疗效依照实体瘤疗效评价标准(RECIST)1.0版进行评价,分为CR、PR、SD、PD,有效率(RR)为CR率+PR率,疾病控制率(DCR)为CR率+PR率+SD率。出现PD的患者立即更换化疗方案。不良反应按通用不良反应术语3.0标准(NCICTCV3.0)分为0~4级。首要终点是至疾病进展时间(TTP),次要终点包括RR、DCR及安全性。
结 果
1 近期疗效 53例共接受247周期化疗,患者至少完成2周期化疗,中位化疗周期4周期(2~9周期)。全组患者疗效评价 CR 7例(13.21%,7/53),PR22例(41.51%,22/53),SD 15例(28.30%,15/53),PD 9例(13.21%,7/53),RR为54.72% (29/53),DCR为 83.02%(44/53 )。其中接受TX方案11例、GX方案24例、NX方案18例。接受TX方案化疗的患者,CR 2例,PR5例,SD3例,PD1例,RR为 63.64% (7/11),DCR为 90.91%(10/11 )。接受GX方案化疗的患者,CR3例,PR9例,SD7例,PD5例,RR为50.00% (12/24 ),DCR为 79.17%(19/24 )。接受NX方案化疗患者,CR2例,PR8例,SD5例,PD3例,RR为 55.56% (10/18),DCR为 83.33%(15/18 )。转移部位≤2个的患者7例获得CR,RR为 56.25% (27/48 ),DCR为83.33%( 40/48 ),转移灶大于2个的患者RR为40.00%(2/5),DCR为 80.00%(4/5)。绝经前患者的RR为 54.05% (20/37 ),DCR为 83.78% (31/37);而绝经后患者的RR为 56.25%(9/16), DCR为83.02%(13/16)。9例疾病进展患者更换方案继续治疗或姑息治疗缓解症状。
2 44例维持治疗患者的疗效观察 44例获得疾病控制的患者均接收卡培他滨单药维持治疗6~18个周期,维持治疗的中位周期数是12个周期,TTP为4.5~21.5个月,中位TTP为9.5个月。
3 毒副反应 见表2。常见不良反应有骨髓抑制、手足综合征 、便秘、腹泻等。均经对症治疗后好转,无粒缺性发热病例,全组无治疗相关死亡病例。
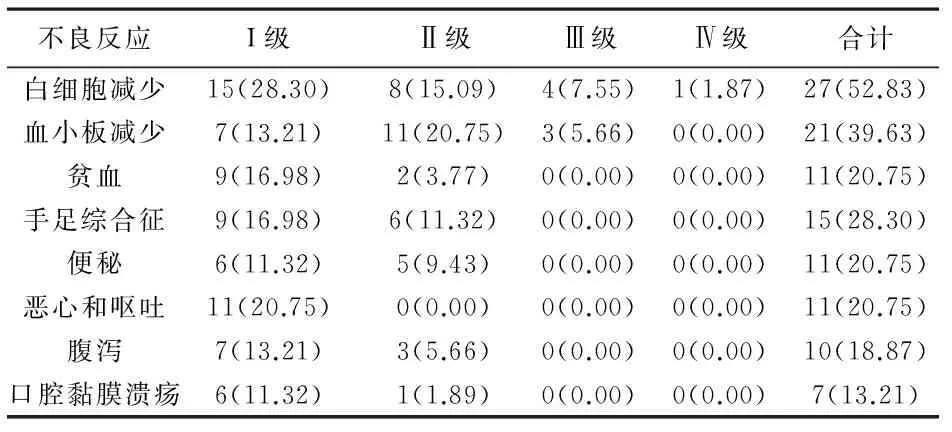
表2 53例乳腺癌肝转移患者的不良反应[n(%)]
讨 论
转移性乳腺癌通常被认为是不可治愈的全身性疾病,治疗目的是在保持最佳生活质量的同时尽可能延长总生存、以姑息性治疗为主。乳腺癌肝转移治疗效果尤差,乳腺癌肝转移患者在接受激素及化学治疗后中位生存时间为24~33个月[2],即使只有孤立转移灶,5年生存率也不足30%[3],疗效较差,因此,乳腺癌肝转移是晚期乳腺癌的治疗难点之一,而维持治疗提供了一种延长无进展生存和总生存期的思路。
随着紫杉类及蒽环类药物在乳腺癌辅助化疗中的广泛应用,对于转移性乳腺癌通常选择卡培他滨、吉西他滨、长春瑞滨等非蒽环类、非紫杉类药物的方案治疗,卡培他滨联合多西他赛、吉西他滨或长春瑞滨均为最常用的联合方案,尤其是卡培他滨主要的代谢相关酶均在肝脏,其药物浓度在肿瘤细胞和肝细胞中要明显高于其他正常组织细胞,属高选择性的细胞毒药物,理论上卡培他滨在乳腺癌肝转移患者中有其独特作用,且因正常组织胸腺嘧啶磷酸化酶含量明显低于肿瘤组织,所以卡培他滨治疗毒性较小,研究表明蒽环类药物耐药的转移性乳腺癌,激素受体阳性患者单用多西他赛中位生存时间为12.5个月,加用卡培他滨后提高到17.7个月;激素受体阴性的患者疾病进展时间也明显延长[4]。针对耐蒽环类耐紫杉类的转移性乳腺癌,单药卡培他滨一线化疗客观缓解率可高达30~36%,二线化疗的客观缓解率也可达到15%~29%,中位生存时间为9.4~15.2月[5-7]。同时,作为一种口服制剂的细胞毒药物,服用简单方便,成为维持治疗的优选药物之一[8]。
本研究依据全程管理理念,对53例乳腺癌肝转移患者给予多西他赛、吉西他滨或长春瑞滨联合卡培他滨化疗,疾病控制的患者给予卡培他滨维持治疗,全组53例患者疗效评价 CR 7例(13.21%),PR22例(41.51%),SD15例(28.30%),PD9例(13.21%),RR为54.72%(29/53),DCR为83.02%(44/53 )。其中 44例获得疾病控制的患者接受了卡培他滨单药维持治疗6~18个周期,维持治疗的中位周期数是12个周期,TTP为4.5~21.5个月,中位TTP为9.5个月,较国内外未进行维持治疗的研究明显延长[4-7]。
有研究报道维持治疗能将完全缓解的晚期乳腺癌的中位TTP显著延长,但同时毒副作用也明显增加[9]。本组患者耐受性良好,最常见Ⅲ、Ⅳ 级不良反应是白细胞下降,发生率约9.43%(5/53)和血小板下降发生率约5.66%(5/53),而非血液学不良反应主要表现为胃肠道反应、手足综合征等,多为Ⅰ、Ⅱ级不良反应,均经对症治疗后好转,全组无粒缺性发热病例,无治疗相关死亡病例。
总之,乳腺癌肝转移患者在以卡培他滨为基础的联合化疗方案取得疾病控制后给予卡培他滨维持化疗,患者耐受性及安全性良好,TTP明显延长,是一种值得继续探索的治疗理念。
[1] Cassera MA,Hammill CW,Ujiki MB,etal.Surgical management of breast cancer liver metastases[J].HPB(Oxford),2011,13(4):272-278.
[2] van Walsum GA,de Ridder JA,Verhoef C,etal.Resection of liver metastases in patients with breast Cancer:survival and prognostic factors[J].Eur J Surg Oncol,2012,38(10):910-917.
[3] Treska V, Cerna M, Kydlicek T,etal.Prognostic factors of breast cancer liver metastasis surgery[J]. Arch Med Sci,2015,11(3):683-685.
[4] Glück S,Russell C,O'Shaughnessy J,etal.Treatment effect of capecitabine and docetaxel or docetaxel alone by oestrogen receptor status in patients with metastatic breast cancer: results of an exploratory analysis[J].Breast,2013,22(6):1087-1093.
[5] Harvey VJ,Sharples KJ,Isaacs RJ,etal.A randomized phase II study comparing capecitabine alone with capecitabine and oral cyclophosphamide in patients with advanced breast cancer-cyclox II[J].Ann Oncol,2013,24(7):1828-1834.
[6] Stockler MR,Harvey VJ,Francis PA,etal.Capecitabine versus classical cyclophosphamide, methotrexate, and fluorouracil as first-line chemotherapy for advanced breast cancer[J].J Clin Oncol,2011,29(34):4498-4504.
[7] Babacan T, Efe O,Hasirci AS,etal. Efficacy of capecitabine monotherapy as the first-line treatment of metastatic HER2-negative breast cancer[J].Tumori,2015,101(4):418-423.
[8] Gligorov J,Doval D,Bines J,etal. Maintenance capecitabine and bevacizumab versus bevacizumab alone after initial first-line bevacizumab and docetaxel for patients with HER2-negative metastatic breast cancer (IMELDA): a randomised, open-label, phase 3 trial[J]. Lancet Oncol,2014,15(12):1351-1360.
[9] 李 飞,杨晓民,宋张骏,等.长春瑞滨联合洛铂治疗晚期乳腺癌30例[J].陕西医学杂志,2012,41(9):1243-1244.
(收稿:2016-02-28)
Effects and safety of capecitabine maintenance therapy after combination chemotherapy for patients with breast cancer liver metastasis
Central Hospital of Xi’an City (Xi’an 710004)
Wang ZhengChen HongzhiDong Jimin et al
Objective: To investigate the therapeutic effects and safety of capecitabine maintenance treatment for patients with breast cancer liver metastasis after combination chemotherapy.Methods:All the 53 patients received doxcetaxal, gemcitabine or vinorelbine combined capecitabine chemotherapeutic regime,patients with clinical benefit received capecitabine maintenance therapy until disease progressed or toxicity could not be tolerated. The response rate(RR), time to progress(TTP)and adverse reactions and were recorded.Results: All the 53 cases of breast cancer liver metastasis received combined chemotherapy for 247 cycles with 7 cases of CR(13.21%,7/53),22 cases of PR(41.51%,22/53),15cases of SD(28.30%,15/53),the response rate(RR, RR=CR+PR)wasR54.72%(29/53),disease control rate(DCR, DCR=CR+PR+SD) was 83.02%(44/53),patients with disease control were administered capecitabine maintenance therapy until PD, the median TTP was 10.0months.Main treatment related adverse reaction was hand-foot syndrome and leucopenia.Conclusion: Capecitabine as maintenance treatment followed combined chemotherapy is an effective and safe method for breast cancer liver metastasis with good tolerability.
Breast neoplasms/drug therapy Liver neoplasms/secondary Prognosis @Capecitabine
△西安交通大学第二附属医院肿瘤科
乳腺肿瘤/药物疗法 肝肿瘤/继发性 预后 @卡培他滨
R737.9
A
10.3969/j.issn.1000-7377.2016.10.017
