细胞因子联合检测对活动性结核与潜伏性结核鉴别诊断的预测价值分析*
2016-11-10李晓非黄山梁桂亮吕松琴资敏刘永亮
李晓非,黄山,梁桂亮,吕松琴,资敏,刘永亮
(1.云南省昆明市第三人民医院检验科,云南 昆明 650041;2.国家传染病诊断试剂与疫苗工程技术研究中心,福建 厦门 361102)
细胞因子联合检测对活动性结核与潜伏性结核鉴别诊断的预测价值分析*
李晓非1,黄山1,梁桂亮1,吕松琴1,资敏1,刘永亮2
(1.云南省昆明市第三人民医院检验科,云南 昆明 650041;2.国家传染病诊断试剂与疫苗工程技术研究中心,福建 厦门 361102)
目的探索细胞因子联合检测在结核患者潜伏性感染及活动性感染鉴别诊断中的预测价值。以期在细胞因子水平找到能够区分结核活动性感染和潜伏性感染的指标,为临床诊断结核提供新的依据。方法采用流式微球阵列法检测72例确诊为活动性肺结核患者,57例确诊为潜伏性感染者的23种血清细胞因子的水平,分析单个细胞因子在潜伏性感染及活动性感染鉴别诊断中的价值,最后进一步用统计学方法分析多个细胞因子联合检测的诊断价值。结果相比于潜伏性感染组,活动性结核组白细胞介素15(IL-15)、干扰素诱导蛋白10(IP-10)、白细胞介素8(IL-8)、白细胞介素2(IL-2)、血清白细胞介素2受体a(IL-2R a)、巨噬细胞炎症蛋白a(MIP-1a)这6种细胞因子水平均升高(P<0.05);其余白细胞介素4(IL-4)、白细胞介素6(IL-6)等17种细胞因子在血清中的含量两组之间差异无统计学意义(P>0.05);在结核活动性的鉴别诊断中,3个细胞因子的AUC值大于0.8,分别为IL-8(0.83)、IL-15(0.89)、IP-10(0.93);(IL-8&IL-15)、(IL-8&IP-10)和(IL-15 &IP-10)两个细胞因子联合检测优于任一单细胞因子的诊断价值(P<0.05);(IL-8&IL-15&IP-10)3个细胞因子联合检测时,曲线下面积值为0.97,可显著提升活动性结核诊断的敏感性和特异性。结论在IFN-γ释放实验的基础上,IL-8、IL-15、IP-10联合检测可以作为区分活动性和潜伏性结核的理想标志物。
细胞因子;活动性结核;潜伏性结核;诊断
结核病是由结核分枝杆菌感染引起的慢性传染病,是一种非常严重的全球性健康问题,全球每年新增结核患者约有900万,因结核病死亡的人数高达170万[1]。根据结核菌感染状态,可将患者分为活动性结核和潜伏性结核,但是两者之间的治疗方案截然不同。
目前,结核诊断在欠发达国家和地区仍有很大的挑战。广泛应用的痰涂片检测敏感性在34%~80%之间,虽然痰培检测敏感性高于痰涂片,但耗时长,同时很多高结核负担国家也无法满足其对实验室条件的要求[2]。
有研究证实,与潜伏性结核患者比较,活动性结核患者外周血中T淋巴细胞在结核特异性抗原剌激后分泌的细胞因子如白细胞介素8(Interleukin8,IL-8)、血管内皮细胞生长因子(vascular endothelial growth factor,VEGF)、白细胞共同抗原抗体(cluster of differentiation 46,CD46)、干扰素诱导蛋白10(interferon-inducibleprotein10,IP-10)等都显著升高[3]。本研究拟通过用流式微球阵列法(cytometric bead array,CBA)检测活动性及潜伏性感染者外周血经结核特异性抗原剌激后白细胞介素15(Interleukin 15,IL-15)、IP-10、IL-8、白细胞介素2(interleukin 2,IL-2)、白细胞介素2受体a(interleukin 2 receptor a,sIL-2Ra)、巨噬细胞炎症蛋白a(macrophage inflammatoryprotein1alpha,MIP-1a)等23种细胞因子的表达量,统计比较各细胞因子在活动性结核诊断中的价值,并进一步分析几种细胞因子联合检测在活动性结核诊断中的价值。
1 资料与方法
1.1一般资料
选取2014年1月-2015年6月于昆明市第三人民医院收治确诊的72例活动性肺结核患者。其中,男性42例,女性30例;平均(52.3±14.6)岁。潜伏性肺结核患者57例。其中,男性28例,女性29例;平均(51.6±16.6)岁。两组患者性别和年龄构成比差异无统计学意义(P<0.05)。
1.2入组诊断标准
本研究入组样本分为临床活动性结核患者组和IFN-γ释放实验阳性潜伏感染者组。活动性结核患者符合下列诊断标准:①明显的临床症状如低热盗汗咳嗽咳血;②X射线及细菌学检查阳性排除其他非结核性肺部疾患。潜伏性结核患者的诊断标准:①与活动性结核人群密切接触的人群;②结核感染T细胞斑点检测(T cell spot test,T-SPOT)、结核分枝杆菌(Tuberculosis,TB)检测阳性;③X射线及细菌学检查阴性;④无临床症状。
所有入组患者均排除使用激素或者患有其他影响免疫功能的疾病如人类免疫缺陷病毒、自身免疫病等。
1.3实验试剂
高糖改良Eagle培养基(dulbecco's modified eagle medium,DMEM)、磷酸缓冲盐溶液(phosphate buffer saline,PBS)、0.25%胰蛋白酶-乙二胺四乙酸二钠、青霉素和链霉素(杭州吉诺公司),FACSCalibur型流式细胞仪(flow Cytometry,FCM)和各细胞因子的CBA Flex Set检测试剂盒(美国Becton Dickinson公司),T-SPOT.TB试剂盒(英国OxfordImmunotec公司),Ficoll密度梯度淋巴细胞分离液、胎牛血清、RPMI 1640(美国Gibco公司),结核分枝杆菌特异性重组蛋白由厦门大学国家传染病诊断试剂与疫苗工程技术研究中心提供。
1.4刺激抗原的制备
本研究利用基因工程技术将致病性结核分枝杆菌特异性抗原ESAT-6和CFP-10融合表达,经大肠杆菌表达纯化后获得重组抗原E1C0。
1.5外周血特异性T细胞的刺激培养及细胞因子的检测
在含有TB特异抗原的培养管中加入新鲜抗凝血,37℃孵育16~24 h后,1 800 r/min离心5 min,收集上清液置入-80℃冰箱冷冻保存。FCM检测,按照检测试剂盒的要求准备仪器调整微球,打开BD FACS Comp软件,用Cali BRITE Beads进行仪器设置。然后打开BD Cell Quest软件,调出CBA仪器调整模板,用仪器调整微球设置本次实验的最佳参数,依次采集各标准管和标本管的数据。每种CK依据CellQuest和CBA软件(BD Pharmingen)生成的标准参照曲线计算其荧光密度进行定量。
1.6统计学方法
采用Medcalc统计软件进行数据分析,计量资料用均数±标准差(x±s)表示,两组均数间比较用单因素方差分析;受试者工作特征曲线(receiver operating characteristic curve,ROC)分析用于各个细胞因子及几种细胞因子联合对诊断活动性结核的敏感性与特异性分析,P<0.05为差异有统计学意义。
2 结果
2.1两组患者血液在结核特异性抗原剌激后细胞因子的释放情况
在用结核特异性抗原剌激后,相比于潜伏性结核感染组,活动性结核组患者血清中IL-8、IL-15、IL-2、IP-10、MIP-1a的水平升高,差异有统计学意义(P<0.01);IL-2Ra的水平升高,差异有统计学意义(P<0.05),其余IL-4、IL-6等17种细胞因子的水平两组比较差异无统计学意义(P>0.05)。见表1。
表1 两组患者血液在结核特异性抗原剌激后血清中23种细胞因子水平的比较(pg/ml±s)

表1 两组患者血液在结核特异性抗原剌激后血清中23种细胞因子水平的比较(pg/ml±s)
组别IL-8IL-15IL-2IL-2RaIP-10MIP-1aIL-4潜伏性结核(n=57)2.62±0.692.28±1.09122.83±24.9625.53±5.415990.12±1502.111006.38±268.13345.23±23.45活动性结核(n=72)3.93±1.174.37±1.70141.73±33.8732.62±15.0410793.53±3121.601252.46±369.32363.91±49.53 F值56.05138.0212.4111.4597.3517.8454.21 P值0.0000.0000.0000.0290.0000.0000.422组别IL-6IL-9IL-12IL-13IL-14M-CSFPF-4ENA-78潜伏性结核(n=57)37.43±5.352.43±0.43123.52±10.4324.72±2.988.34±0.520.92±0.02435.46±23.2483.74±8.27活动性结核(n=72)41.32±8.433.21±0.33142.65±16.2219.43±3.4410.34±0.441.03±0.03452.33±33.7882.98±6.45 F值3.442.671.935.923.232.095.896.32 P值0.5100.5510.5910.1330.5320.5820.1110.108组别PDGFEGFTNF-β1TNF-β2BMPIGF-1NGFOSM潜伏性结核(n=57)91.32±4.2735.53±2.465.32±0.026.87±0.06122.54±10.75453.76±69.234.91±0.4312.24±0.99活动性结核(n=72)95.34±6.7441.43±3.844.99±0.047.88±0.07133.54±12.44542.88±55.895.12±0.6614.22±1.01 F值1.452.531.554.993.424.782.334.11 P值0.6410.6020.6220.2140.5240.3990.5260.402
2.2各细胞因子在区分活动性结核和潜伏性结核中的ROC曲线分析
为了进一步评价这6种细胞因子在鉴别诊断结核感染为潜入性或活动性中的应用,笔者继续对这6种细胞因子做ROC曲线的分析。结果显示6种细胞因子IL-8、IL-15、IL-2、IL-2Ra、IP-10、MIP-1a的曲线下面积(area under the curve,AUC)分别为0.83(95%CI:0.75,0.89)、0.89(95%CI:0.81,0.93)、0.70(95%CI:0.61,0.77)、0.74(95%CI:0.65,0.77)、0.93(95%CI:0.87,0.96)、0.70(95%CI:0.61,0.78)。根据ROC曲线分析,笔者进一步确定对应每种炎症因子用于诊断的最佳cut-off值,以及其在活动性结核和潜伏性结核鉴别诊断中的敏感性和特异性。见表2和图1。

表2 对6种细胞因子在活动性结核诊断中的ROC曲线分析
接着笔者对AUC>0.8的3种细胞因子IL-8、IL-15、IP-10做ROC曲线比较,IL-8与IL-15之间差异无统计学意义(P=0.227);IP-10与IL-15之间差异无统计学意义(P=0.247);IP-10优于IL-8(P<0.05)。见图2。
2.3细胞因子联合检测在区分活动性结核和潜伏性结核中的ROC曲线分析
用多元逻辑回归算得在用2种或3种细胞因子联合检测在鉴别结核为活动性或潜伏性时各细胞因子前的系数(IL-8&IL-15)=1.32*IL-8+1.52*IL-15;(IL-8&IP-10)=0.95*IL-8+0.00081*IP-10;(IL-15 &IP-10)=1.31*IL-15+0.00076*IP10;(IL-8&IL-15 &IP-10)=1.26*IL-8+0.88*IL-15+0.00065*IP10。(IL -8&IL-15)、(IL-8&IP-10)和(IL-15&IP-10)3组两个细胞因子联合检测的AUC值大于任一单细胞因子检测的AUC值(P<0.05)。3组两因子联合检测之间AUC值差异无统计学意义(P<0.05);(IL-8 &IL-15&IP-10)3因子联合检测与(IL-15&IP-10)比较差异无统计学意义(P<0.05),(IL-8&IL-15& IP-10)优于(IL-8&IL-15),(P<0.05),(IL-8& IL-15&IP-10)优于(IL-8&IP-10)(P<0.05)。见图3和表3。

图1 结核抗原刺激后的细胞因子在区分活动性结核和潜伏性结核的ROC曲线分析
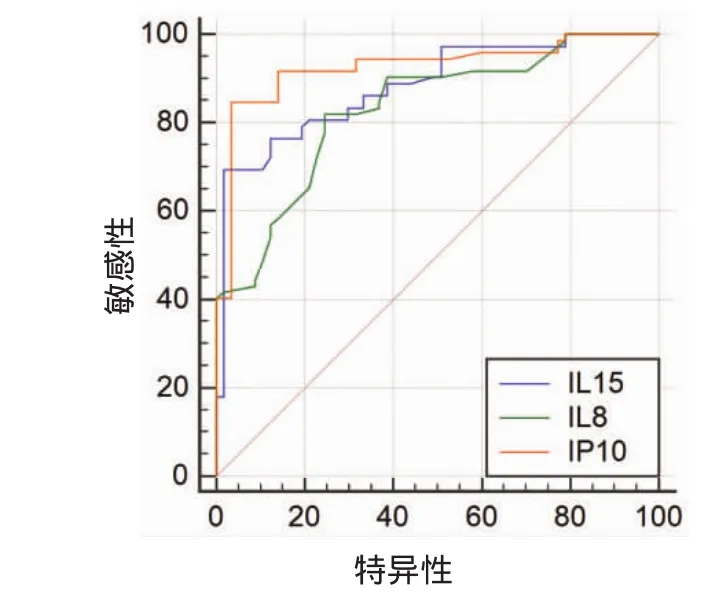
图2 IL-15、IL-8、IP-10在区分活动性结核与潜伏性结核的ROC曲线分析比较
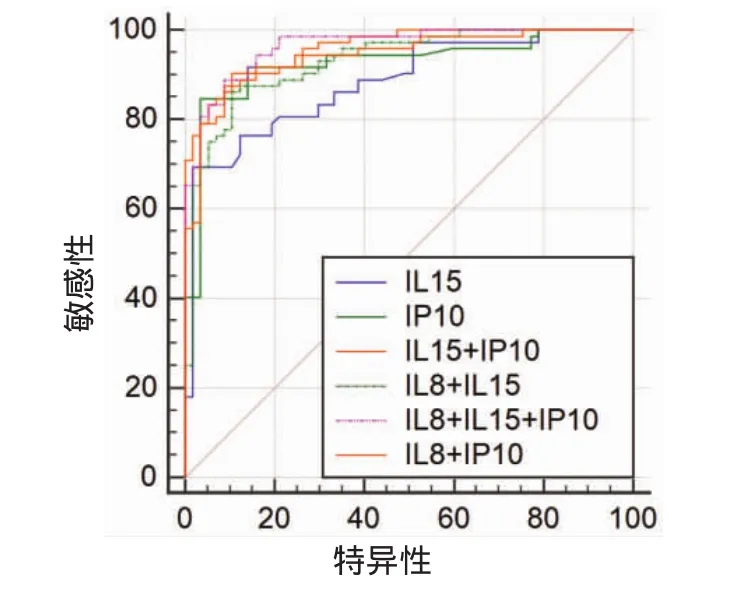
图3 细胞因子联合检测在区分活动性结核与潜伏性结核的ROC曲线分析比较

表3 细胞因子联合检测在区分活动性结核和潜伏性结核的ROC曲线分析
3 讨论
IFN-γ释放实验是确认病原体感染及评估感染状况较为可靠的方法,且有早期诊断价值[4-5]。外周全血或分离的外周血单个核细胞,在结核杆菌特异性的抗原刺激后,感染过结核分支杆菌的个体外周血中的记忆性T细胞能够被再次激活,从而迅速地释放包括IFN-γ在内的多种炎症因子。但是由于目前的IFN-γ释放实验只检测IFN-γ一种分子,敏感性低、容易受机体其他因素干扰,而且仅仅只能够检测到结核杆菌的感染,不能够区分活动性结核和潜伏性结核感染。在结核病高流行的地区和国家,由于潜伏性结核感染的比率较高,使IGRAγ在临床诊断中的应用受到了极大地限制[6-7]。因此发明一种基于T细胞免疫反应的活动性结核诊断方法,发现一种新的T细胞应答标志物非常重要[8]。
德国JACOBSEN等人[9]利用FASCIA和multiplex技术,研究发现,CD64以及GTPase 33A可以用来区分结核患者和潜伏感染者。有大量研究证实,IP-10可以用于活动性结核的鉴别诊断,而且可以作为结核治疗效果的一个指标[10-12]。同样的,国内王莹等人[13]分别应用植物血凝素、纯化的结核分枝杆菌CFP10/ESAT6融合蛋白刺激人全血产生IP-10,用化学发光免疫分析法检测105例活动性结核病患者、52例非结核肺部疾病患者、29例健康对照者全血中IP-10水平,通过ROC曲线确定其诊断活动性结核病的临界值,并评价其诊断效能,并最终证实活动性结核病患者免疫反应增强,全血结核特异的IP-10检测可以作为活动性结核病的辅助诊断指标之一。
本实验通过用结核特异性抗原刺激结核患者的外周血,检测IFN-γ以外23种细胞因子的表达,发现IL-15、IP-10、IL-8、IL-2、IL-2Ra、MIP-1a这6种细胞因子的表达在潜伏性感染组活动性感染组比较差异有统计学意义。与国内外其他研究结果相符[14-15],本实验也证实IP-10具有良好的敏感性和特异性,并且在23个检测指标中AUC值最高,为0.93。虽然不同研究的“cut off”值存在不同,敏感性和特异性也存在差异,但多个研究都显示IP-10对活动性结核具有较高的诊断准确性。
本研究通过后期对数据的统计分析发现,(IL-8 &IL-15),(IL-8&IP-10)和(IL-15&IP-10)3组两个细胞因子联合检测的AUC值大于任一单细胞因子检测的AUC值,且差异有统计学意义。(IL-8& IL-15&IP-10)3个指标联合检测能够有效区分活动性结核和潜伏性结核,AUC值达0.97,高于上述两个细胞因子联合检测的AUC值。同样,最近WANG等人[16]在研究使用ESAT6/CFP10作为刺激抗原子,刺激活动性结核和健康人群后,使用luminex平台检测多重细胞因子发现结核潜伏性感染和活动性感染两组之间IFN-γ、IP-10、MIG、TNF-a有显著差别,并进一步通过数据分析发现,联合使用IFN-γ和IP-10作为检测指标可以调高单独使用IFN-γ检测的敏感性和特异性。随着现在检测技术和设备的提升,在少量的样本中快速、灵敏的对多种细胞因子同时进行检测已成为可能[17]。多种细胞因子的联合检测可以大大提高活动性结核诊断的敏感性和特异性,可以作为区分活动性和潜伏性结核的理想标志物[3,18]。
本研究存在不足之处,首先,没有纳入健康对照组以观察哪些细胞因子在结核患者中升高,仅仅设置了潜伏性结核患者组和活动性结核患者组;其次,由于成本问题,本研究纳入的样本量相对较少,无法对大规模的样本进行初步筛选。笔者将在后续的研究中针对已经筛选出的6种细胞因子,采取前瞻性研究的方法,进一步验证该指标的诊断价值。
[1]LINAS B P,WONG A Y,FREEDBERG K A,et al.Priorities for screening and treatment of latent tuberculosis infection in the U-nited States[J].Am J Respir Crit Care Med,2011,184(5):590-601.
[2]ARINAMINPATHY N,DOWDY D.Understanding the incremental value of noveldiagnostic tests for tuberculosis[J].Nature, 2015,528(7580):S60-S67.
[3]VASIL'EVA E V,VERBOV V N,IVANOVSKII V B,et al.Combined determination of spontaneous and antigen-induced production of cytokines for differential diagnostics of active tuberculosis of lungs and latent tuberculosis infection[J].Zh Mikrobiol Epidemiol Immunobiol,2013,(4):77-85.
[4]ZELLWEGER J P,SOTGIU G,BLOCK M,et al.Risk assessment of tuberculosis in contacts by IFN-gamma release assays.a tuberculosis network european trials group study[J].Am J Respir Crit Care Med,2015,191(10):1176-1184.
[5]SESTER M,VAN LETH F,BRUCHFELD J,et al.Risk assessment of tuberculosis in immunocompromised patients.A TBNET study[J].Am J Respir Crit Care Med,2014,190(10):1168-1176.
[6]DORMAN S E,BELKNAP R,GRAVISS E A,et al.Interfer-on-gamma release assays and tuberculin skin testing for diagnosis of latent tuberculosis infection in healthcare workers in the United States[J].Am J Respir CritCareMed,2014,189(1):77-87.
[7]REDELMAN-SIDI G,SEPKOWITZ K A.IFN-gamma release assays in the diagnosis of latent tuberculosis infection among immunocompromised adults[J].Am J Respir Crit Care Med,2013, 188(4):422-431.
[8]WALLIS R S,PAI M,MENZIES D,et al.Biomarkers and diagnostics for tuberculosis:progress,needs,and translation into practice[J].Lancet,2010,375(9729):1920-1937.
[9]JACOBSEN M,REPSILBER D,GUTSCHMIDT A,et al.Candidate biomarkers for discrimination between infection and disease caused by Mycobacterium tuberculosis[J].JMolMed(Berl), 2007,85(6):613-621.
[10]MIHRET A,BEKELE Y,BOBOSHA K,et al.Plasma cytokines and chemokines differentiate between active disease and nonactive tuberculosis infection[J].J Infect,2013,66(4):357-365.
[11]HOLM L L,ROSE M V,KIMARO G,et al.A comparison of interferon-gamma and IP-10 for the diagnosis of tuberculosis[J]. Pediatrics,2014,134(6):1568-1575.
[12]AABYE MG,LATORRE I,DIAZ J,et al.Dried plasma spots in the diagnosis of tuberculosis:IP-10 release assay on filter paper[J].Eur Respir J,2013,42(2):495-503.
[13]王莹,吴雪琼,于庭.活动性结核病患者全血干扰素诱导蛋白10测定及免疫状态的研究[J].中国实验诊断学,2012,16(2):240-244.
[14]RUHWALD M,BJERREGAARD-ANDERSEN M,RABNA P,et al.CXCL10/IP-10 release is induced by incubation of whole blood from tuberculosis patients with ESAT-6,CFP10 and TB7. 7[J].Microbes Infect,2007,9(7):806-812.
[15]QIU L,HUANG D,CHEN C Y,et al.Severe tuberculosis induces unbalanced up-regulation of gene networks and overexpression of IL-22,MIP-1alpha,CCL27,IP-10,CCR4,CCR5, CXCR3,PD1,PDL2,IL-3,IFN-beta,TIM1,and TLR2 but low antigen-specific cellular responses[J].JInfect Dis,2008, 198(10):1514-1519.
[16]WANG X,JIANG J,CAO Z,et al.Diagnostic performance of multiplex cytokine and chemokine assay for tuberculosis[J].Tuberculosis(Edinb),2012,92(6):513-520.
[17]BUCHWALD U K,ADETIFAI M,BOTTOMLEYC,et al. Broad adaptive immune responses to M.tuberculosis antigens precede TST conversion in tuberculosis exposed household contacts in a TB-endemic setting[J].PLoS One,2014,9(12):DOI: 10.1371/journal.pone.0116268.
[18]RUHWALD M,BODMER T,MAIER C,et al.Evaluating the potential of IP-10 and MCP-2 as biomarkers for the diagnosis of tuberculosis[J].Eur Respir J,2008,32(6):1607-1615.
(张蕾编辑)
Application of combined CKs to differentiate active and latent tuberculosis infection*
Xiao-fei Li1,Shan Huang1,Gui-liang Liang1,Song-qin Lyu1,Min Zi1,Yong-liang Liu2
(1.Department of Laboratory,the Third People's Hospital of Kunming,Kunming,Yunnan 650041,China;2.National Institute of Diagnostics and Vaccine Development in Infectious Diseases,Xiamen,Fujian 361102,China)
Objective To find a new marker which can differentiate active tuberculosis infection and latent tuberculosis infection at the level of cytokine,and to provide new evidence for clinical diagnosis of tuberculosis. Methods Levels of 23 CKs of TB specific antigen from active or latent tuberculosis were evaluated by cytometric bead array.ROC analysis was used to test each CK and the combination of the CKs on the diagnosis of active tuberculosis.Results Compared with latent tuberculosis infection group,the levels of IL-15,IP-10,IL-8,IL-2R,sIL-2Ra,MIP-1ain the active tuberculosis infection group were significantly increased(P<0.05);Another 17 CKs like IL-4 and IL-6 had no significant difference between the two groups.The AUC value of IL-8(0.83),IL-15(0.89),IP-10(0.93)was beyond 0.8.Combination of(IL-8&IL-15),(IL-8&IP-10)or(IL-15&IP-10)had a greater value than one CK,P<0.05.The AUC value of(IL-8&IL-15&IP-10)was significantly increased compared with the combination of two CKs.Conclusions Combination detection of IL-8,IL-15,IP-10 is the idealmarker for differentiation active tuberculosis infection from latent tuberculosis infection. Keywords:cytokine;tuberculosis;latent tuberculosis infection;diagnosis
10.3969/j.issn.1005-8982.2016.20.008
1005-8982(2016)20-0034-06
R 521
A
2016-01-13
昆明市科技计划项目,活动性结核血清学检测靶标筛选(No:2014-04-A-S-02-3091)
