免疫毒素CCL25-PE38抗急性T淋巴细胞白血病实验研究
2016-11-10刘晓蕾高磊崔娜
刘晓蕾,高磊,崔娜
(河北省保定市第一中心医院1.血液内科,2.彩超室,3.妇科,河北 保定 071000)
免疫毒素CCL25-PE38抗急性T淋巴细胞白血病实验研究
刘晓蕾1,高磊2,崔娜3
(河北省保定市第一中心医院1.血液内科,2.彩超室,3.妇科,河北 保定 071000)
目的探讨免疫毒素CCL25-PE38对急性T淋巴细胞白血病(T-ALL)细胞系MOLT4(天然高水平表达CCR 9)的杀伤作用,以期为T-ALL的靶向治疗提供基础。方法通过流式细胞术、共聚焦显微术检测CCL25-PE38与MOLT4细胞的结合及内化,Transwell趋化小室检测其趋化能力,细胞增殖试剂WST-1检测其细胞杀伤能力,Annexin V-FITC/PI染色检测其凋亡诱导效应,建立SCID小鼠白血病细胞异种移植肿瘤(CCR 9+肿瘤)模型检测CCL25-PE38的抑瘤效果。结果WST-1检测结果显示CCL25-PE38能特异性杀伤MOLT4细胞;Annexin V-FITC/PI染色显示CCL25-PE38主要通过凋亡诱导效应引起MOLT4细胞死亡;在SCID小鼠白血病细胞异种移植瘤模型中,注入CCL25-PE38能缓解CCR 9+肿瘤的生长。结论CCL25-PE38通过凋亡诱导作用引起MOLT4细胞死亡,缓解异种移植CCR 9+肿瘤的生长。
CCL25-PE38;急性T淋巴细胞白血病;免疫毒素
白血病在全球发病率呈上升趋势,我国白血病发病率为十万分之三,每年约新增40 000例患者。白血病表现为骨髓造血组织恶性增生,形成大量异常的白细胞,广泛浸润组织器官,引起多种组织器官不可逆损害,直接威胁患者生命。白血病的转移、复发与白血病细胞及其生长微环境相互作用密切相关。免疫毒素是一种由抗体或细胞因子与化学毒素耦合组成的融合蛋白。通过受体介导的内吞作用和随后的毒素成分被转运到细胞质,并与二磷酸腺苷结合,核糖基化延伸因子2(EF-2),从而导致蛋白质合成被抑制和靶细胞死亡[1]。PE38,38 kD的截短型绿脓杆菌外毒素A的衍生物,已被广泛作为免疫毒素毒素组分。例如,抗CD22的重组免疫毒素BL22,基于PE38的作用治疗毛细胞白血病证明是成功的[2]。重组免疫毒素8H9-PE38用于乳腺癌,骨肉瘤,神经母细胞瘤的治疗[3]。因此,重组免疫毒素可能是一种用于治疗癌症患者,尤其是血液肿瘤患者有前途的方法。以趋化因子受体介导的免疫治疗是一个极具吸引力的策略。本研究推测,毒素与趋化因子融合构成的新型免疫毒素,可能对高水平表达CCR9的急性T淋巴细胞白血病(T lineageacutelymphoblastic leukemia,T-ALL)细胞的存活产生影响。为了检验该假设,本研究设计一个免疫毒素分子CCL25-PE38,构建其真核表达载体,并表达在真核细胞293T中,然后检测其对T-ALL细胞系MOLT4的杀伤作用以及抗MOLT4细胞异种移植肿瘤效应。
1 材料与方法
1.1材料
1.1.1主要试剂MOLT4细胞(自然高水平表达CCR9),小鼠成纤维细胞L929,HEK 293T细胞购自美国模式菌科收集中心,RPMI 1640、DMEM、胰酶来源于美国Hyclone公司,青霉素、链霉素购自美国Sigma公司,Fetal bovine serum(FBS)购自美国Gibco公司,限制性内切酶来源于美国NewEngland Biolabs公司,pcDNA3.1(+)载体来源于美国Invitrogen公司,Wizard Plus Maxipreps DNA Purification System来源于Promega,EntransterTM-D来源于中国Engreen,重组人-CCL25来源于美国Peprotech公司,鼠抗人CCR9单克隆抗体购自美国R&D公司,BCA蛋白分析试剂盒购自碧云天生物有限公司,过氧化物酶(HRP)标记羊抗兔IgG,FITC/R-PE标记羊抗兔IgG,R-PE标记驴抗鼠IgG(H+L)来源于美国Protein Tech公司,Annexin V-FITC试剂盒来源于美国BD公司,细胞增殖试剂WST-1来源于美国Roche公司,甘油来源于美国Sigma公司。
1.1.2主要仪器电热恒温培养箱(上海精宏实验设备有限公司),Eppendorf PCR仪(德国Eppendorf AG公司),Air Tech超净工作台(苏州安泰空气技术有限公司),KHB CT-360自动多功能酶标仪(上海科华实验系统有限公司),GENE GENIUS凝胶成像分析系统(英国Syngene公司),Eppendorf移液器(德国Eppendorf AG公司),Eppendorf台式冷冻离心机(德国Eppendorf AG公司),蛋白电泳仪、转印仪(北京六一),Transwell趋化小室(美国Corning公司),细胞培养箱(美国Forma公司),倒置显微镜(日本Nikon公司),流式细胞仪(美国Beckman公司),共聚焦显微镜(德国Leica)。
1.2实验方法
1.2.1重组免疫毒素CCL25-PE38靶向杀伤MOLT4细胞实验收集1×105MOLT4细胞,PBS洗涤。分别取CCL25-PE38、PE38(0.1、0.2、0.3、0.4、0.5、1.0及2.0 nmol/ml,PBS稀释),加至细胞悬液中,混合后加至96孔板的各小孔中。以PBS处理作为阴性对照组。37℃、二氧化碳CO2浓度为5%的细胞培养箱中培养48 h后,加入10μl WST-1(美国Roche公司)继续培养4h。酶标仪测定450nm下的光密度(optical density,OD)值。同时为检测CCL25-PE38对MOLT4细胞的特异性杀伤作用依赖于CCR9,设立CCL25-PE38加抗CCR9抗体(美国R&D公司)处理组。收集MOLT4细胞,PBS洗涤1次。先用抗CCR9抗体处理1 h,然后加入CCL25-PE38。其他处理同上。为检测CCL25-PE38对CCR9-细胞增殖能力的影响,收集1×105L929细胞,PBS洗涤1次。取CCL25-PE38(0.5 nmol/ml,PBS稀释),加至细胞悬液中,混合后加至96孔板的各小孔中。以PBS处理作为阴性对照组。37℃、二氧化碳CO2浓度为5%的细胞培养箱中培养48 h后,加入10μl WST-1继续培养4h。酶标仪测定450nm下的OD值。重组免疫毒素CCL25-PE38凋亡诱导效应,收集1×105MOLT4细胞,PBS洗涤1次。取CCL25-PE38(0.5nmol/ml,PBS稀释),加至细胞悬液中,混合物加至24孔板的各小孔中。37℃、二氧化碳CO2浓度为5%的细胞培养箱中培养0、24及48 h。离心收集处理后的细胞,结合缓冲液洗涤1次,加入AnnexinV-FITC/PI(美国BD公司)于暗处孵育15 min。立即上流式细胞仪(美国Beckman公司)进行检测。
1.2.2重组免疫毒素CCL25-PE38抗肿瘤实验
MOLT4细胞异种移植肿瘤(CCR9+)模型建立:SCID小鼠由武汉大学动物实验中心提供,6~8周龄,雌性,许可证编号:SCXK(鄂)2008-2004。小鼠饲养在无菌隔离器中。一周后无菌条件下将MOLT4细胞接种至SCID小鼠背部皮下(1×107/只),接种后约7~9 d可触及到约300mm3大小的肿瘤块,将未长出肿瘤的小鼠弃掉不用,余下动物分成3组,每组5只。重组免疫毒素CCL25-PE38处理及抗瘤效果观察:于第9天开始分别经尾静脉注射(静脉注射不成功的采用腹腔注射)CCL25-PE38、PE38(0.5 nmol/只/d)、PBS;连续注射14 d。每隔一天测量瘤体的长和宽,并计算瘤体大小。至实验第29天,采取颈椎脱臼方式将SCID荷瘤小鼠处死,剥离肿瘤体并称重。HE染色:用4%中性甲醛固定剥离得到的肿瘤,送本校组织胚胎学教研室进行石蜡包埋、切片、HE染色。在显微镜下观察肿瘤块组织学特点。流式细胞术检测CCR9+肿瘤中CCR9的表达情况:无菌条件下碾磨肿瘤块,使用200目的细胞滤网收集肿瘤细胞,PBS洗涤2次。传代培养3次后,收集细胞检测其表面CCR9的表达水平。分离收集各处理组1×105细胞,加10μg/mL的抗CCR9单克隆抗体(美国R&D公司)至细胞悬液中,于4℃孵育1 h,以MOLT4细胞作为对照,加入PBS处理。PBS洗涤2遍后,加入RPE标记的羊抗鼠IgG(美国ProteinTech公司),4℃孵育30min。PBS洗涤2次后上流式细胞仪(美国Beckman公司)进行检测。
1.3统计学方法
采用Graph Prism 5统计软件进行数据分析,计量资料用均数比较的t检验处理和单因素方差分析,定性资料用独立样本R×C列联表资料的χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1免疫毒素CCL25-PE38靶向杀伤MOLT4细胞能力检测
为检测免疫毒素CCL25-PE38对细胞存活的影响,本研究检测免疫毒素CCL25-PE38对MOLT4细胞的杀伤作用以及对L929细胞增殖的影响。如图1所示,CCL25-PE38能特异性杀伤MOLT4细胞,随着免疫毒素CCL25-PE38浓度的增加其杀伤效应也随着增强,同时其杀伤作用能被抗CCR9的抗体特异性阻断。CCL25-PE38对CCR9表达阴性细胞的增殖无影响。
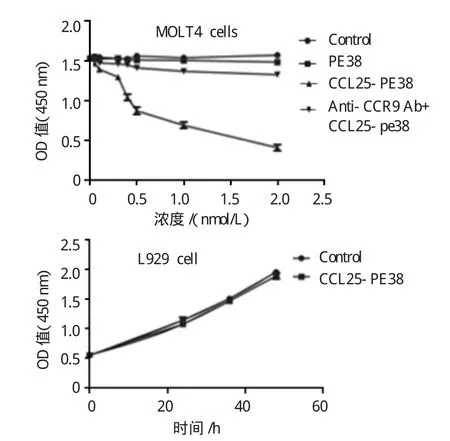
图1 免疫毒素CCL25-PE38细胞毒作用检测
2.2免疫毒素CCL25-PE38凋亡诱导效应
为探讨免疫毒素杀伤MOLT4细胞的机制,本研究检测免疫毒素诱导MOLT4细胞凋亡的作用。随着CCL25-PE38作用于MOLT4细胞时间的增加,发生凋亡的MOLT4细胞数(Annexin-V FITC阳性和Annexin-FITC、PI双阳性细胞)逐渐增加,见图2。24 h凋亡率为30.7%,48h凋亡率达到41.3%。与对照组比较差异有统计学意义(P<0.01)。见附表。
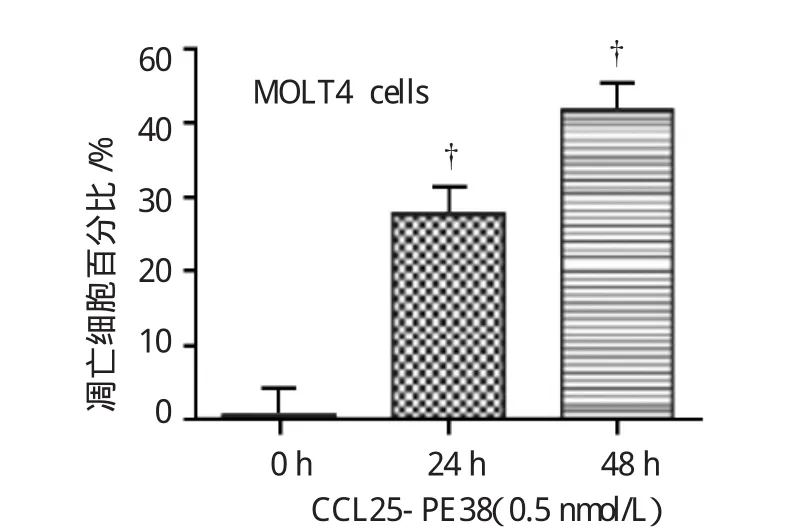
图2 免疫毒素CCL25-PE38诱导MOLT4细胞凋亡效应

附表 两组免疫毒素CCL25-PE38诱导MOLT4细胞凋亡效应的比较%
2.3免疫毒素CCL25-PE38抗CCR9+肿瘤效应
为进一步验证免疫毒素特异性杀伤白血病细胞的能力,本研究检测免疫毒素在体内抗CCR9+肿瘤作用。首先建立MOLT4细胞异种移植CCR9+肿瘤,接种MOLT4细胞9 d后,可检测到大小为300 mm3瘤体。然后注入CCL25-PE38并观察其对移植肿瘤生长的影响。如图3所示,注入CCL25-PE38 12d以后能观察到瘤体的的生长受到抑制。而PBS及PE38处理组瘤体的体积持续增长。因此,采用静脉注射重组免疫毒素CCL25-PE38能有效缓解SCID小鼠异种移植肿CCR9+瘤的生长。

图3 免疫毒素CCL25-PE38抑制异种移植CCR9+肿瘤的生长
2.4HE染色结果
为验证CCL25-PE38体内抑瘤作用,本研究制作肿瘤组织切片并作HE染色。通过组织学分析,发现CCL25-PE38处理组与对照组比较血管分布密度减少,肿瘤细胞数目明显减少。见图4。

图4 肿瘤组织HE染色结果
2.5CCR9+肿瘤中CCR9的表达水平

图5 不同处理组来源的肿瘤细胞表面CCR9表达水平
在本实验中,尽管免疫毒素CCL25-PE38能有效缓解异种移植CCR9+肿瘤生长,但是不能完全消除肿瘤。为探究产生此现象的原因,采用FCM检测了来源于各组瘤体中细胞表面CCR9的表达水平,结果发现在CCL25-PE38处理组,CCR9的表达水平明显降低(66.9%),而PBS和PE38处理组肿瘤细胞表面CCR9水平未有明显改变,见图5。因而可推测CCR9表达水平的下降可能与MOLT4细胞移植到小鼠体内后部分细胞不再表达CCR9有关。
3 讨论
趋化因子和趋化因子受体在疾病发生、发展的过程中发挥重要作用[4]。最近有研究报道,CCX282-B,一个潜在的人CCR9拮抗剂,对肠道炎症具有较好的治疗效果[5]。此外,文献[6]报道,下调CXCR4的表达抑制癌细胞侵袭和转移。针对趋化因子和/或趋化因子受体可能对控制相关疾病的发展进程具有治疗效果。CCR4单克隆抗体已被证明可以诱导T-ALL患者白血病细胞的死亡,抑制表达CCR4肿瘤的进展[7-9]。该作用导致细胞的死亡有赖于抗体依赖性细胞介导的细胞毒作用,但是该治疗方式与患者的免疫功能状态有关。而针对趋化因子或趋化因子受体与细胞毒性药物的免疫毒素,直接杀伤靶细胞可能提供更好的治疗效果。
PE38具有很强的诱导细胞死亡作用已被广泛用作免疫毒素的毒素成份[10-12]。在本研究中,WST-1检测结果显示,CCL25-PE38特异性杀死MOLT4细胞,但不杀伤L929细胞。重要的是靶向杀伤作用可被CCR9中和性抗体有效地阻断,再次确认CCL25-PE38对MOLT4细胞的杀伤作用是由CCR9介导的。随后Annexin V-FITC/PI染色的结果表明,CCL25-PE38呈时间依赖性诱导MOLT4细胞的凋亡。另一项研究报道与本研究一致的结果,VGEFPE38融合毒素进入胞浆后可诱导靶细胞凋亡[13-15]。此外,本研究通过向SCID小鼠注射MOLT4细胞建立白血病细胞荷瘤(CCR9+肿瘤)模型,探讨CCL25-PE38对异种移植CCR9+肿瘤生长的影响。在SCID小鼠白血病细胞移植瘤模型中,注入CCL25-PE38能有效缓解CCR9+肿瘤的生长。经FCM检测发现瘤体(CCL25-PE38处理组)中分离的肿瘤细胞CCR9的表达水平下降,提示有可能一部分细胞在体内丧失表面CCR9分子,对CCL25-PE38产生耐受。因此,提高免疫毒素CCL25-PE38的抗肿瘤效果是本研究下一步的工作目标,可能通过以下途径:①生物信息学方法,优化CCL25-PE38结构,以增加CCL25-PE38活性;②提高CCL25-PE38的稳定性,以促进其吸收;③使用与其他治疗方法如化疗相结合的策略。另外,为进一步研究免疫毒素CCL25-PE38体内抗白血病作用,进行以下实验:建立小鼠白血病模型,观察CCL25-PE38治疗白血病效果;观察CCL25 -PE38的免疫原性、毒性、体内代谢等情况。
综上所述,本研究结果表明,免疫毒素CCL25-PE38能特异性杀伤高水平表达CCR9的MOLT4细胞,而不影响CCR9受体阴性细胞。此外,体内研究表明,CCL25-PE38能缓解CCR9+肿瘤的生长。所以,CCL25-PE38在此呈现的生物活性使其有可能成为潜在治疗高水平表达CCR9癌症潜在的生物制剂,特别是T-ALL。
[1]PASTAN I,HASSAN R,FITZGERALD D J,et al.Immunotoxin treatment of cancer[J].Annu Rev Med,2007,58(1250):221-237.
[2]PEREZ-ATAYDE A R,SALLAN S E,TEDROW U,et al.Spectrum of tumor angiogenesis in the bone marrow of children with acute lymphoblastic leukemia[J].Am J Pathol,1997,150(3):815-821.
[3]SUMINOE A,MATSUZAKI A,HATTORI H,et al.Expression of matrix metalloproteinase(MMP)and tissue inhibitor of MMP (TIMP)genes in blasts of infant acute lymphoblastic leukemia with organ involvement[J].Leuk Res,2007,31(10):1437-1440.
[4]BECKER S E.The disease with hope:hairy cell leukemia[J]. Clin J Oncol Nurs,2007,11(5):731-735.
[5]ONDA M,WANG Q C,GUO H F,et al.In vitro and in vivo cytotoxic activities of recombinant immunotoxin 8H9(Fv)-PE38 against breast cancer,osteosarcoma,and neuroblastoma[J].Cancer Res,2004,64(4):1419-1424.
[6]WALTERS M J,WANG Y,LAI N,et al.Characterization of CCX282-B,anoral lybioavailableantagonistoftheCCR9 chemokine receptor,for treatment of inflammatory bowel disease[J]. J Pharmacol Exp Ther,2010,335(1):61-69.
[7]YADAV V R,SUNG B,PRASAD S,et al.Celastrol suppresses invasion of colon and pancreatic cancer cells through the downregulation of expression of CXCR4 chemokine receptor[J].J Mol Med,2010,88(12):1243-1253.
[8]ISHIDA T,IIDA S,AKATSUKA Y,et al.The CC chemokine receptor 4 as a novel specific molecular target for immunotherapy in adult T-Cell leukemia/lymphoma[J].Clin Cancer Res,2004, 10(22):7529-7539.
[9]CHARRAD R S,GADHOUM Z,QI J,et al.Effects of anti-CD44 monoclonal antibodies on differentiation and apoptosis of human myeloid leukemia cell lines[J].Blood,2002,99(1):290-299.
[10]SONG G,LIAO X,ZHOU L,et al.HI44α,an anti-CD44 monoclonalantibody,induces differentiation and apoptosis of human acute myeloid leukemia cells[J].Leuk Res,2004,28(10): 1089-1096.
[11]KOURTI M,VAVATSI N,GOMBAKIS N,et al.Expression of multidrug resistance 1(MDR1),multidrug resistance-related protein 1(MRP1),lung resistance protein(LRP),and breast cancer resistance protein(BCRP)genes and clinical outcome in childhood acute lymphoblastic leukemia[J].Int J Hematol,2007, 86(2):166-173.
[12]KEPPLER-HAFKEMEYERA,KREITMAN R J,PASTAN I. Apoptosis induced by immunotoxins used in the treatment of hematologic malignancies[J].Int J Cancer,2000,87(1):86-94.
[13]HU C C,KE Y Q,SUN X L,et al.Human mesenchymal stem cells-like cells as cellular vehicles for delivery of immunotoxin in vitro[J].Biotechnol Lett,2009,31(2):181-189.
[14]KAKINUMA T,HWANG S T.Chemokines,chemokine receptors, and cancer metastasis[J].Journal of Leukocyte Biology,2006,79(4): 639-651.
[15]SEEMA S,ANGURAJ S,RAKESH K.Chemokines in tumor angiogenesis and metastasis[J].Cancer Metastasis Rev,2007,26(3/4): 453-467.
(张蕾编辑)
Study of CCL25-PE38 immunotoxin in treatment of T-cell acute lymphoblastic leukemia(T-ALL)
Xiao-lei Liu1,Lei Gao2,Na Cui3
(1.Department of Hematology,Baoding First Central Hospital,Baoding,Hebei 071000,China;2.Ultrasound Department,Baoding First Central Hospital,Baoding,Hebei 071000,China;3.Gynecology,Baoding First Central Hospital,Baoding,Hebei 071000,China)
Objective To investigate the killing effect ofCCL25-PE38immunotoxin on MOLT4 cell line in T-cell acute lymphoblastic leukemia(T-ALL)(CCR9natural high-level expression),and to provide the foundation of targeting treatment of T-cell acute lymphoblastic leukemia(T-ALL).Methods Flow cytometryn and confocal microscopy were used to detect the binding and internalization of CCL25-PE38 and MOLT4 cells.Transwell chemotaxis chamber method was used to detect the chemotaxis.Cell Proliferation Reagent WST and Annexin VFITC/PI stain were used to detect killing ability of cells and the apoptosis induced effect respectively.And antitumous effect ofCCI25-PE38was detected by building the SCID leukemia cells in mice xenograft tumor(CCR9+tumors)model.Results WST-1 test showed thatCCL25-PE38produce specific lethal effect on MOLT4 cell. Annexin V-FITC/PI stain showed that the cause of death of MOLT4 cells was induced by apoptosis ofCCL25-PE38. Injection ofCCL25-PE38in SCID leukemia cells in mice xenograft tumor(CCR9+tumors)model can retard growth speed of CCR9+cancer.Conclusions The cause of death of MOLT4 is induced by apoptosis-inducing effect of CCL25-PE38,which can retard the growth of CCR9+xenotransplanted tumors.
CCL25-PE38;T-cell acute lymphoblastic leukemia(T-ALL);immunotoxin
R 733.71
A
10.3969/j.issn.1005-8982.2016.20.002
1005-8982(2016)20-0006-06
2016-02-18
