三维适型放疗或联合卡培他滨在局部晚期胰腺癌中的疗效比较
2016-11-10张世安吴志贤吕光明李东良
张 霞* 张世安吴志贤吕光明李东良
(1 南京军区福州总医院肝胆病中心肝胆内科,福建 福州 350025;2 南京军区福州总医院 放射治疗中心,福建 福州 350025)
三维适型放疗或联合卡培他滨在局部晚期胰腺癌中的疗效比较
张 霞1* 张世安1吴志贤1吕光明2李东良1
(1 南京军区福州总医院肝胆病中心肝胆内科,福建 福州 350025;2 南京军区福州总医院 放射治疗中心,福建 福州 350025)
目的 评价三维适型放疗单独或联合卡培他滨在晚期胰腺癌中的疗效和耐受性。方法 回顾性分析了43例失去手术机会的局部晚期的胰腺癌患者,采用三维适型放疗或口服卡培他滨联合同步放疗的不同疗效。利用上腹部MRI扫描评价肿瘤有效率;Kaplan-Meier曲线比较两组的生存时间。结果 完成放疗及联合治疗后2个月随访,联合治疗组客观缓解率(CR+PR)为38.1%,疾病控制率(RR)为85.7%,其中完全缓解0例,部分缓解8例;稳定10例;无效0例。1年随访期内有12例死亡。中位PFS为7.4个月,中位OS为9.9个月。无Ⅳ度毒性发生。3例Ⅲ度手足综合征发生。单纯放疗组客观缓解率(CR+PR)为27.6%,疾病控制率(RR)为63.6%,其中完全缓解0例,部分缓解6例;稳定8例;无效0例。1年随访期内有15例死亡。中位PFS为5.9个月,中位OS为9.0个月。无Ⅳ度毒性发生。结论 三维适型放疗联合卡培他滨口服在局部晚期胰腺癌中在延长患者无进展生存期总生存和方面较单纯放疗疗效更好;疾病的短期疗效方面客观缓解率和疾病控制率联合组都有优于单纯放疗组;两种方案对局部晚期胰腺癌患者都是安全有效的,但联合治疗组手足综合征及血液学毒性要重于单药组。
胰腺癌;卡培他滨;三维适型放疗
胰腺癌是一种病死率高的消化系统肿瘤。在美国也占到恶性肿瘤死亡的第4位[1-3],我国发病率在过去的10年亦呈现上升趋势[4]。手术虽然是希望取得根治的唯一方法,但因其发病隐匿,临床症状发生相对较晚,确诊时患者往往失去手术机会。即使手术切除,患者也会因很快复发和转移而不能获得较长时间的生存[5]。在这些失去手术机会的局部晚期胰腺癌患者来说,以放射治疗为基础的系统治疗在过去几十年中已成为标准的治疗手段。但中位生存期也仅有6~9个月,且2年生存率不足10%[6]。近年来以吉西他滨为基础的化疗在晚期胰腺癌中取得了一定的疗效[7-8]。但目前对晚期胰腺癌的治疗尚无统一的标准。本课题我们回顾性分析了2011年4月至2014年12月我院收治的局部晚期胰腺癌患者,比较单纯放疗与联合卡培他滨口服的疗效。报道如下。
1 资料与方法
1.1入组标准:回顾性分析我院2011年4月至2014年12月间诊断为胰腺癌癌,筛选出无手术机会的局部晚期和晚期患者。单纯组:患者接受单纯三维适形放射治疗,具体方案见治疗方案部分。联合治疗组:患者除接受三维适形放射治疗外,同时口服卡培他滨同步化疗。所有患者具备完善的临床资料,包括体格检查、血液学检查、影像学检查(CT或MRI)。所有入选患者需符合以下标准:①无手术机会的局部晚期或晚期胰腺癌患者;②ECOG评分0~2分;③接受一个完整周期的三维适形放射治疗纳入单纯放疗组;④接受三维适形放射治疗的同时口服卡培他滨者纳入联合治疗组;⑤联合组放疗结束后完成至少3个周期的卡培他滨单药口服化疗。入选患者需排除以下标准:①腹膜炎或全身无法控制的感染;②并发恶性胸腹水;③伴难以控制的高血压和高血糖患者;④治疗前行诱导化疗的患者;⑤合并未得到控制的消化系统溃疡的患者。患者的基本临床资料见表1。

表2 两组患者的近期疗效比较 [n(%)]

表3 两种治疗手段的毒性反应比较

表1 两组患者的基本资料
1.2治疗方案:①单纯三维适形放射治疗组:采用医柯达Sinergy直线加速器6MV-X射线和美国CMS公司XIO三维治疗计划系统。在CT模拟床上,热塑面膜固定体位,扫描前空腹4~6 h,扫描前0.5 h开始口服对比剂200~300 mL,给予静脉注射碘海醇增强扫描,扫描层厚为5 mm,获得的影像资料传入三维适形治疗计划系统。勾画治疗靶区,肿瘤区(GTV)包括可见病灶:胰腺原发灶和邻近肿大淋巴结。淋巴结引流区不做预防性照射,没有CTV(临床靶区)。肿瘤区三维方向外扩10 mm为计划靶区(PTV),并勾画出病变周围正常组织。所有患者给予5个共面适形照射野等中心照射,参考剂量体积直方图,95%的靶区体积达处方剂量,正常组织受量在正常范围内,放疗总剂量为50 Gy/(25 f·5 W),每周5次,全部患者按计划完成放疗剂量。②联合治疗组:放射治疗第1天开始口服卡培他滨(推荐剂量每日2500 mg/m2,连用两周,休息1周。每日总剂量分早晚2次于饭后0.5 h用水吞服)。放疗第22天开始口服第2周期的卡培他滨,连续给药14 d,休息7 d。第2周期口服结束后放疗也同时结束。剂量调整按照毒性反应CTC(Common Terminology Criteria)3.0分级,发生3/4级血液学毒性(如手足综合征)或2级以上的非血液学毒性要暂时停药,待毒性降至1级或以下后降低剂量治疗。
1.3评价标准。所有患者开始治疗7 d前要进行基础评价:包括体格检查、全血细胞检查、血液学生活、肿瘤标志物CA19-9(carbohydrate antigen 19-9)以及全腹部CT或MRI扫描。疗效评价按照实体瘤疗效评价标准RECIST 1.1 进行评价,分为完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)和疾病进展(PD),客观缓解率为CR+PR,疾病控制率为CR+部分缓解PR+疾病稳定SD。放疗结束后2个月进行评价(此时联合组已完成4周期的口服化疗)。毒性分级按照美国癌症中心CTC(Common Toxicity Criteria ) 2.0进行分级。
1.4随访:随访无进展生存(PFS)和总生存(OS)时间。PFS指从接受治疗开始到疾病出现进展的时间;OS指从接受治疗到任何原因出现死亡的时间。最长随访时间为17个月。最短随访时间为6个月。死亡或失访时间记录在案。
1.5统计学分析:统计软件选用SPSS18.0。PFS和OS用Kaplan-Meier法进行统计制图。计数资料比较采用χ2检验;计量资料比较采用t检验,P<0.05差异有统计学意义。
2 结 果
2.1基本临床资料:随访我院2011年~2014年间诊断胰腺癌的患者,按照上述入组条件符合入组的共43例。其中单纯三维适形放射治疗组22例,联合口服卡培他滨同步化疗组组21例。两组患者在年龄、性别、ECOG评分、基础血压、血糖和临床分期无统计学差别。见表1。
2.2近期疗效:43例患者完成了1个疗程三维适形放射治疗,联合组除完成放疗外,同时完成了4周期的卡培他滨口服化疗。放疗结束2个月后进行评估,按照RECIST标准,两组患者无达到完全缓解(CR)的病例,联合组在部分缓解率PR(38.1% vs.27.2%)以及疾病控制率(85.7% vs.63.6%)都优于单纯放疗组,差别统计学意义显著。见表2。
2.3毒性反应:两种治疗手段在中重度的粒细胞减少和贫血方面差别不显著;在非血液学毒性方面,恶心呕吐,腹泻的消化系统症状二者差别亦无统计学意义。但在手足综合征的毒性方面,联合组发生7例轻度手足综合征,2例重度手足综合征,迫使口服卡培他滨的剂量进行了调整后继续放疗。见表3。
2.4生存时间:符合入组的43例患者,从2011年4月随访至2014年11月,有完整资料的随访时间为17个月,平均随访时间为10个月。单纯放疗组中位无进展生存时间(PFS)为5.9个月,联合治疗组中位无进展生存时间为7.4个月,两组中位PFS差别显著(P=0.013)。单纯放疗组中位总生存时间(OS)为9.0个月;联合治疗组中位总生存时间为9.9个月,虽延长了0.9个月,两组的中位总生存差别亦显著(P=0.043)。见图1和图2。
3 讨 论
胰腺癌的发病近20年来呈上升趋势,在欧美国家及我国的发病率和病死率都明显提高[1-4]。对于不可切除的局部进展期或转移性胰腺癌,放射治疗、介入治疗以及诱导化疗后同步放化疗等虽然取得一定的疗效,但在改善患者的长期生存方面并未得到明显的优势[9-11]。对局部晚期或晚期胰腺癌的治疗,仍然处于探索研究阶段。虽然放射治疗已经成为局部晚期或晚期胰腺癌的标准治疗手段,在改善患者疼痛,消化系统症状患者的生活质量方面取得了一定的效果,但因胰腺适型度较低,受呼吸动度等影响较大,达不到理想的放疗剂量。三维适型或调强放疗虽然在疾病控制率方面表现出良好的疗效,但并不能明显改善患者的生存[12-13]。

图1 三维适型放疗或联合卡培他滨在局部晚期或晚期胰腺癌的无进展生存时间(group1 为单纯放疗组,group2 为联合治疗组)。两组的中位无进展生存时间(PFS)分别为5.9个月和7.4个月。联合组PFS延长1.5个月(P=0.013)
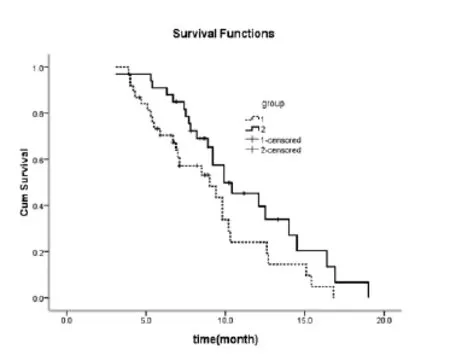
图2 三维适型放疗或联合卡培他滨在局部晚期或晚期胰腺癌的总生存时间(group1 为单纯放疗组,group2 为联合治疗组)。两组的中位总生存时间(OS)分别为9.0个月和9.9个月。联合组PFS延长0.9个月(P=0.043)
化疗在局部晚期或晚期胰腺癌的治疗中亦有一定的地位。根据胰腺癌诊治指南(2014版),积极的化学治疗有助于缓解症状、延长生存期及改善生活质量[14]。根据患者体能状态,可选择的方案包括:吉西他滨单药(Category 1),氟尿嘧啶单药(Category 2B)、吉西他滨+氟尿嘧啶类药物(Category1),吉西他滨+白蛋白结合型紫杉醇(Category 1),FOLFIRINOX方案(Category 1)等。但单纯的化疗疗效亦有限。有报道放疗联合同步化疗在改善患者症状,提高生存期方面得到了一定的结果[15-17]。方案一般选择吉西他滨静脉滴注同步三维适型放疗、立体定向放疗或射波刀治疗,但对于局部晚期或晚期患者,往往伴有乏力,纳差等恶病质的表现,患者耐受性差,很多患者因血液学毒性而改变放疗计划。Zhu等[18]通过对3项随机对照研究和1项回顾性对比研究的meta分析得出,联合吉西他滨的放疗方案优于联合5-FU的方案,但是两个方案都有着较大细胞毒性。临床工作中我们也曾经在一般状况较好的患者中应用吉西他滨或5-FU同步三维适型放疗,患者往往在治疗后期出现重度乏力或血小板减少,贫血等不良反应而放弃继续放疗。因此本研究我们尝试应用口服卡培他滨同步放疗。因卡培他滨(在肿瘤中浓度)使用方便,放疗过程中如果出现明显的不良反应可以按照标准进行减量。我们回顾性分析了我院4年间收治的接受单纯三维适型放疗或联合口服卡培他滨治疗的局部晚期和晚期胰腺癌43例患者,结果发现在短期疗效方面,口服卡培他滨同步放疗组客观缓解率达为38.1%,明显优于上优于单纯放疗组(客观缓解率为27.7%)。疾病控制率也是联合放疗组优于单纯放疗组(85.7% vs. 63.6%)。长期疗效方面,同步口服卡培他滨组亦表现出一定的生存优势。联合组的中位无进展生存达到7.4个月,较单纯放疗组延长了1.5个月(P=0.013);中位总生存时间联合组达到9.9个月,较单纯放疗组延长了0.9个月(P=0.043)。差别具有显著意义。并且联合组在不良反应方面比较单纯放疗组未见明显的非耐受性毒性(只有2例患者出现Ⅲ度手足综合征,对症治疗后好转,未影响到放疗进程)。
其他有关胰腺癌的治疗进展,分子靶向治疗近年来显示出较好的效果。厄洛替尼(Erlotinib)为FDA批准的首个治疗晚期胰腺癌的一种小分子靶向药物。它是一种口服的高效、高特异性、可逆的表皮生长因子受体(EGFR)酪氨酸激酶抑制剂。国际多中心双盲期随机临床研究证实,对胰腺癌吉西他滨联合厄洛替尼用药与单用吉西他滨相比,中位生存期提高(6.2个月vs. 5.9个月),1年生存率提高(23% vs 17%)。在吉西他滨耐药的患者中,联合卡培他滨和厄洛替尼可使3/30的患者部分缓解,且中位生存期提高至6.5个月[19]。另外单克隆抗体尼妥珠单抗在晚期胰腺癌中也显示了一定的疗效,一项Ⅱ期临床试验结果显示[20]所有病情评价稳定的患者中位PFS为19.2周,所有患者的中位PFS为6.7周,1年后无进展生存的患者达10.3%;这些患者的中位OS达18.1周。另外一项研究应用尼妥珠单抗疾病控制率达到55.6%,中位OS达9.29个月,中位PFS为3.71个月。1年生存率为38.9%[21]。分子靶向治疗疗效在改善患者生存方面似乎取得一定成效,但费用较大,并且改善患者的生存期也仅有几个月的时间。一般国内来说患者难以接受。药物经济学上未显示良好优势。其确切的疗效仍需要多中心,大样本,随机对照的临床试验进一步验证。
因本研究为回顾性分析,可能存在抽样误差,结果需要进行大样本的前瞻性研究进一步证实。但对局部晚期或晚期胰腺癌患者来讲,口服卡培他滨联合三维适型放疗是一安全可靠的治疗手段,为在临床推广使用提供了依据。
[1]Jemal A,Bray F,Center MM,et al.Global cancer statistics[J].CA Cancer J Clin,2011,61(2):69-90.
[2]Hariharan D,Saied A,Kocher HM.Analysis of mortality rates for pancreatic cancer across the world[J].HPB (Oxford),2008,10(1):58-62.
[3]Yadav D,Lowenfels AB.The epidemiology of pancreatitis and pancreatic cancer[J].Gastroenterology,2013,144(6):1252-1261.
[4]马臣,姜永晓,刘曙正,等.中国胰腺癌发病趋势分析和预测[J].中华流行病学杂志,2013,34(2):160-163.
[5]Cascinu S,Falconi M,Valentini V,et al.Pancreatic cancer:ESMO clinical practice guidelines for diagnosis,treatment and followup[J].Ann Oncol,2010,21(Suppl 3):v55-v58.
[6]Niederhuber JE,Brennan MF,Menck HR.The National Cancer Data Base report on pancreatic cancer[J].Cancer,1995,76(9):1671-1677.
[7]O'Neil BH,Scott AJ,Ma WW,et al.A phase Ⅱ/Ⅲ randomized study to compare the efficacy and safety of rigosertib plus gemcitabine versus gemcitabine alone in patients with previously untreated metastatic pancreatic cancer[J].Ann Oncol,2015,19:pii:mdv264.
[8]Anota A,Mouillet G,Trouilloud I,et al.Sequential FOLFIRI.3 + Gemcitabine Improves Health-Related Quality of Life Deterioration-Free Survival of Patients with Metastatic Pancreatic Adenocarcinoma:A Randomized Phase Ⅱ Trial[J].PLoS One,2015,10(5):e0125350.
[9]Ikeda M,Ioka T,Ito Y,et al.A multicenter phaseⅡ trial Of S-1 with concurrent radiation therapy for locally advanced pancreatic cancer[J].Int J Radiat Oncol Biol Phys,2013,85(1):163-169.
[10]Blackstock AW,Tepper JE,Niedwiecki D,et a1.Cancer and leukemia group B(CALGB)89805:phase Ⅱ chemo-radiation trial using gemcitabine in patients with Iocoregional adenocarcinoma of the pancreas[J].Int J Gastrointest Cancer,2003,34(2/3):107-116.
[11]Huguet F,Girard N,Guerche CS,et a1.Chemoradiotherapy in the management of locally advanced pancreatic carcinoma:a qualitative systematic review[J].J Clin Oncol,2009,27(13):2269-2277.
[12]Huguet F,Goodm an KA,Azria D,et a1.Radiotherapy technica1 considerations in the management of locally advanced pancreatic cancer:American-French consensus Recommendations[J].Int J Radiat Oncol Biol Phys,2012,83(5):l355-1364.
[13]李光,于洋洋,韩冲,等.81例胰腺癌后程加量三维适形放疗的疗效分析[J].中国医科大学学报,2012,41(12):1134-1143.
[14]中华医学会外科学分会胰腺外科学组.胰腺癌诊治指南[J].中华普通外科学文献,2014,8(6):1-7.
[15]Huguet F,Girard N,Guerche CS,et a1.Chemoradiotherapy in the management of locally advanced pancreatic carcinoma:a qualitative systematic review[J].J Clin Oncol,2009,27(13):2269-2277.
[16]Loehrer PJ Sr1,Feng Y,Cardenes H.Gemcitabine alone versus gemcitabine plus radiotherapy in patients with locally advanced pancreatic cancer:an Eastern Cooperative Oncology Group trial[J]. J Clin Oncol,2011,29(31):4105-4112.
[17]Chuong MD,Springe GM,Freiuch JM,et al.Stereotactic body radiation therapy for locally advanced and borderline resectable pancreatic cancer is effective and well tolerated[J].Int J Radiat Oncol Biol PhyS,2013,86(3):516-522.
[18]Zhu CP,Shi J,Chen YX,et a1.Gemcitabine in the chemoradiotherapy for locally Advanced pancreatic CanCer:ameta-analysis[J].Radiother Oncol,2011,99(2):108-113.
[19]Kulke MH,Blaszkowsky LS,Ryan DP,et al.Capecitabine plus erlotinib in gemcitabine-refractory advanced pancreatic cancer[J].J Clin Oncol,2007,25(30):4787-4792.
[20]Strumberg D,Schultheis B,Scheulen ME,et al.Phase Ⅱ study of nimotuzumab,a humanized monoclonal anti-epidermal growth factor receptor (EGFR) antibody,in patients with locally advanced or metastatic pancreatic cancer[J].Invest New Drugs,2012,30(3):1138-1143.
[21]Su D,Jiao SC,Wang LJ,et al.Efficacy of nimotuzumab plus gemcitabine usage as first-line treatment in patients with advancedpancreatic cancer[J].Tumour Biol,2014,35(3):2313-2318.
Effect of Three-dimensional Conformal Radiotherapy combined with or without Capitabine in Advanced Pancreatic Adenocarcinoma
ZHANG Xia1, ZHANG Shi-an1, WU Zhi-xian1, LV Guang-ming2, LI Dong-liang1
(1 Department of Hepatobiliary Medicine, Hepatology Center, Fuzhou General Hospital of Nanjing Military Command, Fuzhou 350025, China;2 Department of Radiotherapy Center, Fuzhou General Hospital of Nanjing Military Command, Fuzhou 350025, China)
Objective To observe the different effects and tolerance of three dimensional-conformal radiotherapy combined with or without capitabine in advanced pancreatic adenocarcinoma. Methods Data of 43 patients with advanced pancreatic adenocarcinoma who were treated with three dimensionalconformal radiotherapy combined with or without capitabine were respectively analyzed. Tumor response was evaluated by MRI scan 2 months after therapy. Survival analysis was evaluated by kaplan-meier method. Results The tumor responses in combined group were: complete response for 0 patient, partial response for 8 patients, and stable disease for 10 patients after 2 months of treatment. The response rate was 38.1% and the disease control rate was 85.7%. Median progression free survival was 7.4 mo, and median overall survival was 9.9 mo. No grade 4 toxic events were observed. 3 cases Grade 3 hand-food syndrome occurred. The tumor responses in radiotherapy group were: complete response for 0 patients, partial response for 6 patients, and stable disease for 8 patients after 2 months of treatment. The response rate was 27.6% and the disease control rate was 63.6%. Median progression free survival was 5.9 mo,and median overall survival was 9.0 mo. No grade 4 toxic events were observed. Conclusion Three dimensional-conformal radiotherapy combined with or without capitabine also showed promising efficacy in advanced pancreatic adenocarcinoma. Combined treatment could prolong the PFS and OS vs. single dimensional-conformal radiotherapy. And for disease control combined group showed superiority vs. single radiotherapy and the two regimes both showed good safety.
Pancreatic cancer; Capecitabine; Three-dimensional conformal radiotherapy
R735.9
B
1671-8194(2016)27-0006-04
E-mail:liliedzh@189.cn
