卡培他滨联合调强放疗治疗乳腺癌肝转移的疗效观察
2017-06-01文强叶瑞智蒋先明尤光贤刘丽丹
文强 叶瑞智 蒋先明 尤光贤 刘丽丹
作者单位:317502 台州 台州市肿瘤医院放疗科
临床经验
卡培他滨联合调强放疗治疗乳腺癌肝转移的疗效观察
文强 叶瑞智 蒋先明 尤光贤 刘丽丹
作者单位:317502 台州 台州市肿瘤医院放疗科
目的 探讨卡培他滨联合调强放疗(intensitymodulated raduation therapy,IMRT)并序贯卡培他滨治疗乳腺癌肝转移的疗效和不良反应。方法 将52例乳腺癌肝转移患者分为卡培他滨联合放疗组27例和卡培他滨治疗组25例。卡培他滨联合放疗组肝转移灶行IMRT,6 MV-X线照射,以95%剂量曲线包绕99%计划靶区,常规分割,2 Gy/次,1次/d,5次/周,共4~6周,同时给予卡培他滨1 250mg/m2,2次/d口服同步化疗,放疗结束后给予卡培他滨2 510mg/m2,2次/d口服,21 d为1个周期。卡培他滨治疗组仅给予卡培他滨2 510mg/m2,2次/d口服,21 d为1个周期。比较两组疗效及不良反应。结果 卡培他滨联合放疗组和卡培他滨治疗组有效率(RR)分别为74.1%和44%,肿瘤控制率分别为92.6%和68%,两组比较差异均有统计学意义(P<0.05);中位缓解时间分别为13.6个月和8.9个月,中位生存时间分别为17.4个月和11.7个月,1年生存率分别为85.2%和56.0%(P<0.05),2年生存率分别为40.7%和16.0%(P<0.05)。不良反应主要有中性粒细胞减少、胃肠道反应、肝功能损伤等,均以I级、Ⅱ级为主,卡培他滨联合放疗组I级、Ⅱ级不良反应发生率高于卡培他滨治疗组(P<0.05),但两组Ⅲ级、Ⅳ级不良反应发生率差异无统计学意义(P>0.05)。结论 卡培他滨联合调强放疗并序贯卡培他滨治疗乳腺癌肝转移远期生存率优于单药卡培他滨维持治疗,不良反应可耐受,是一种有效的治疗方案。
乳腺肿瘤;肝转移;卡培他滨;调强放疗;疗效
乳腺癌是女性常见的恶性肿瘤之一,在我国其发病率位居所有女性癌症的第一位,死亡率位居第6位[1]。内分泌及靶向治疗新药物的出现,使乳腺癌患者生存期得以延长,但仍有部分患者出现远处转移,而肝脏是最常见的转移部位[2-3]。我院对收治的52例乳腺癌肝转移患者分别采用卡培他滨联合调强放疗(intensity modulated raduation therapy,IMRT)并序贯卡培他滨治疗和单纯卡培他滨维持治疗,现将两种方案的疗效及不良反应报道如下。
1 资料和方法
1.1 一般资料
我院自2013年1月至2015年7月收治52例乳腺癌肝转移患者,均为女性,年龄38~61岁,平均年龄(48.2±2.5)岁,均为蒽环类和紫杉类化疗方案治疗后1年内出现肝转移。Karnofsky评分≥60分,经MRI和CT检查证实肝转移,肝转移瘤数量≤5个,转移瘤最大径≤4 cm,临床分期均为IV期,未经任何其他抗肿瘤治疗,病理类型均为浸润性腺癌。将52例患者分为卡培他滨联合放疗组27例和卡培他滨治疗组25例,两组患者的一般临床资料差异无统计学意义(P>0.05),具有可比性。见表1。
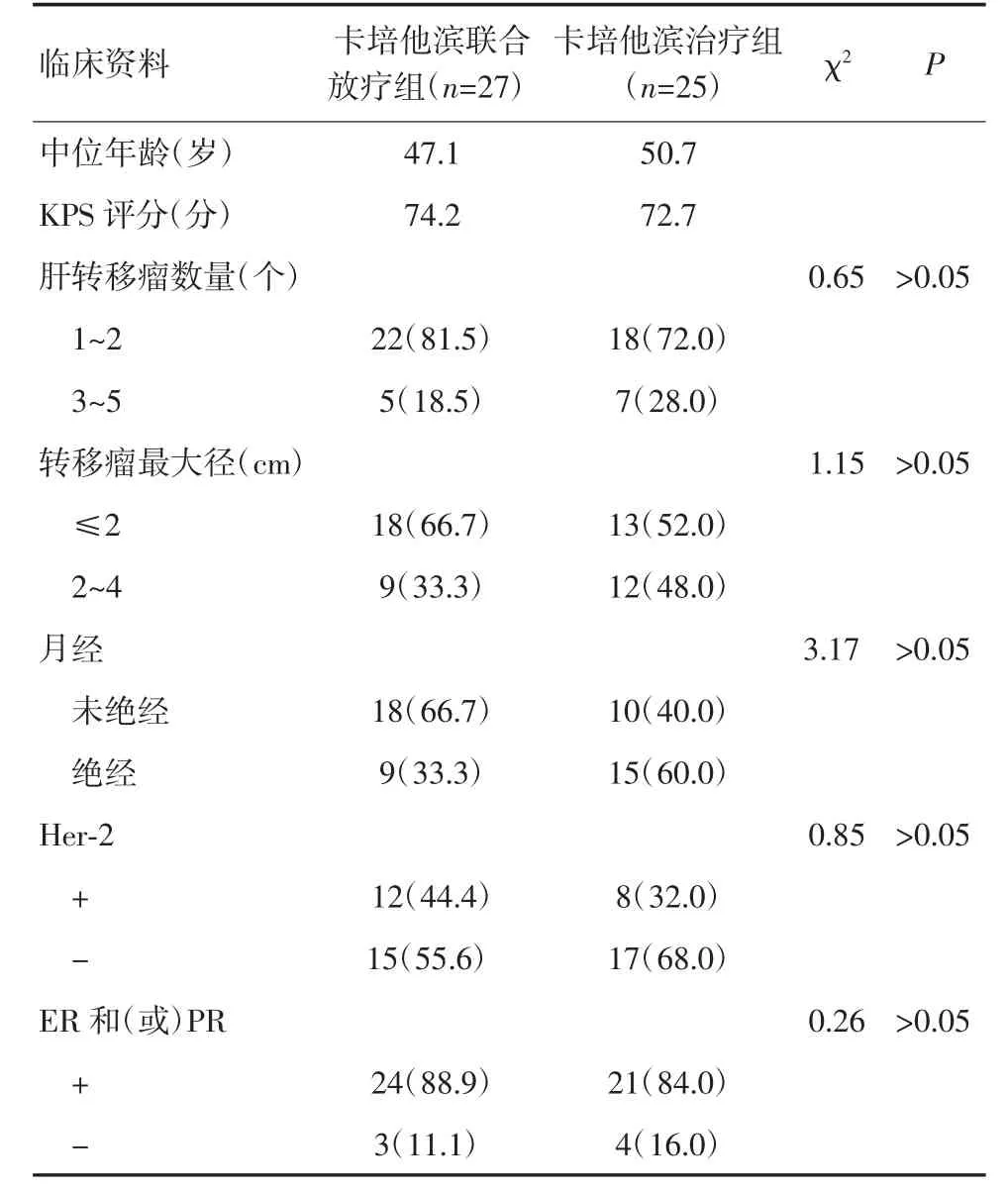
表1 两组患者一般临床资料比较[n(%)]
1.2 治疗方法
卡培他滨联合放疗组:采用真空体模固定,16排大孔径CT扫描定位,层厚5 mm,在CMS治疗计划系统上根据ICRU50和62号文件标准,确定靶区及正常组织体积和范围,应用瓦里安公司直线加速器和MIMic调强多叶准直器,6MV-X线照射,以95%剂量曲线包绕99%计划靶区,采用常规分割,2 Gy/次,1次/d,5次/周,同时给予卡培他滨1 250mg/m2,2次/d同步化疗,放疗结束后给予卡培他滨2 510 mg/m2,2次/d口服,21 d为1个周期。卡培他滨治疗组单纯给予卡培他滨2 510 mg/m2,2次/d口服,21 d为1个周期,直至患者病情进展或不能耐受。
1.3 疗效判定
放化疗治疗结束1个月后复查MRI和CT,按照RECIST 1.0标准判定疗效,分为完全缓解(CR):肝转移灶完全消失;部分缓解(PR):最大径之和缩小≥30%;稳定(SD):最大径之和增大≤20%和最大径之和缩小<30%;进展(PD):最大径之和增大>20%。以CR+PR计算有效率(RR),CR+PR+SD计算肿瘤控制率。不良反应评定标准按照WHO急性、亚急性不良反应分级标准,分为0~IV级。
1.4 统计学处理
采用SPSS 17.0统计软件包进行统计学分析,计数资料比较采用χ2检验。采用Kaplan-Meier法绘制生存曲线,组间生存曲线比较采用log-rank检验。以P<0.05为差异有统计学意义。
2 结果
2.1 近期疗效
卡培他滨联合放疗组获CR 9例、PR 1例、SD 5例、PD 2例,卡培他滨治疗组获CR 2例、PR 9例、SD 6例、PD 8例。卡培他滨联合放疗组和卡培他滨治疗组RR分别为74.1%和44%,差异有统计学意义(χ2=1.12,P<0.05);肿瘤控制率分别为92.6%和68%,差异有统计学意义(χ2=1.30,P<0.05)。
2.2 生存分析
卡培他滨联合放疗组和卡培他滨治疗组中位缓解时间分别为13.6个月和8.9个月,中位生存时间分别为17.4个月和11.7个月,1年生存率分别为85.2%和56.0%,差异有统计学意义(χ2=5.38,P<0.05),2年生存率分别为40.7%和16.0%,差异有统计学意义(χ2=3.84,P<0.05),见图1。

图1 两组生存曲线比较
2.3 不良反应
两组患者治疗后均出现恶心、呕吐、腹痛、腹胀、白细胞减少、血小板减少和肝功能损害等不良反应,以I级、Ⅱ级不良反应为主。卡培他滨联合放疗组主要出现恶心、腹痛等放疗不良反应,未发生十二指肠球部溃疡、放射性皮肤损伤、纤维化等严重不良反应。卡培他滨联合放疗组I级、Ⅱ级不良反应发生率高于卡培他滨治疗组(P<0.05),但两组Ⅲ级、IV级不良反应发生率均较低,差异无统计学意义(P>0.05)。见表2。
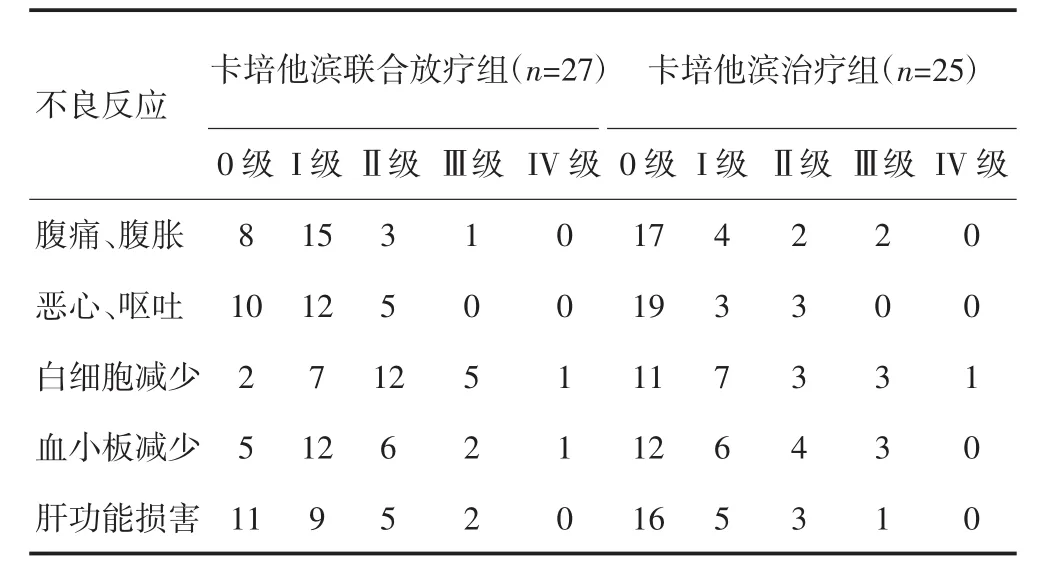
表2 两组患者不良反应的比较(n)
3 讨论
1995年,Hellman等[4]首次提出“局限性转移”观点,认为肿瘤转移的类型存在转移部位限于特定器官且转移灶数量有限的中间状态。局限性转移与传统意义上的转移不同,这个概念的提出对指导存在局限性转移患者的治疗有重要意义,即在全身治疗的基础上进行局部治疗可能使这部分患者获益[5]。局部治疗包括转移灶切除术、射频消融、放疗等。目前,局限性转移尚无严格定义,但大多认为局限性转移为转移脏器有限,且单个脏器转移灶数目≤5个[6]。Tait等[7]提出乳腺癌亦存在局限性转移的状态。在转移性乳腺癌中同样存在以单个或少量转移灶为特征的患者,其被定义为局限性转移,占乳腺癌患者1%~3%[8]。在所有的局限性转移灶中,肝脏被认为是可接受局部治疗的最常见部位之一。局限性肝转移是指转移部位局限于肝脏且转移灶数目有限的转移状态,同时伴或不伴其他部位转移[9]。局部治疗在乳腺癌局限性肝转移中有重要作用,转移灶切除术在整个乳腺癌肝转移患者中所占比例不高,但对于部分患者,肝转移灶切除术有效且安全。射频消融亦可给乳腺癌肝转移患者带来生存获益,可与全身治疗结合,作为体积较小的肝转移灶的局部治疗方法[10-11]。放疗是一种局部治疗手段,较手术侵袭性小,可用于无法耐受(或不愿意接受)侵袭性治疗方法的患者或肿瘤位于某些特殊部位无法实施侵袭性治疗的患者。乳腺癌肝转移的放疗,转移瘤左右径和前后径大小一般不超过4 cm,上下径大小一般控制在3~3.5 cm,但如呼吸活动度小,可将转移瘤上下径控制在4~4.5 cm[12]。本组患者肝转移瘤最大径≤4 cm。
卡培他滨属于氟尿嘧啶衍生物,口服吸收后在肝脏和肿瘤组织经胸腺嘧啶磷酸化酶催化,进而转化为氟尿嘧啶而产生细胞毒性作用,肝脏和肿瘤组织的胸腺嘧啶磷酸化酶浓度远高于其他正常组织,因此具有靶向杀伤肿瘤细胞的作用,且毒性反应较小[13]。研究报道,卡培他滨治疗蒽环类和紫杉类药物耐药的晚期乳腺癌,疗效达20%~26%[14]。卡培他滨联合多西他赛或长春瑞滨治疗乳腺癌肝转移均具有良好效果。目前,卡培他滨与放疗联合应用尚缺乏大样本的临床研究,但卡培他滨具有放射增敏的生物学基础。Sawada等[15]研究显示,放疗可上调肿瘤细胞胸腺嘧啶磷酸化酶活性,因此放疗也可能增加卡培他滨的抗肿瘤活性。放疗一般早期不良反应有恶心、腹痛、发热、疲劳和十二指肠球部溃疡,晚期不良反应包括消化道溃疡和(或)出血、放射性皮肤反应、肌肉骨骼损伤等[16]。本研究结果显示,卡培他滨联合放疗组近期疗效和1年、2年生存率均明显高于卡培他滨治疗组。两组不良反应主要有中性粒细胞减少、胃肠道反应、肝功能损害等,均以I级、Ⅱ级为主,卡培他滨联合放疗组未出现十二指肠球部溃疡等严重不良反应,患者均可耐受,经对症治疗后均可好转,说明卡培他滨联合调强放疗并序贯卡培他滨治疗乳腺癌肝转移具有协同作用,是一种有效、安全的治疗方案。但由于本研究病例数较少,有关结论尚待进一步研究加以证实。
[1] 黄哲宙,陈万青,吴春晓,等.中国女性乳腺癌的发病和死亡现况——全国32个肿瘤登记点2003-2007年资料分析报告[J].肿瘤,2012:32(6):435-439.
[2] Van Walsum GA,de Ridder JA,Verhoef C,et al.Resection of liver metastases in patients with breast cancer:survival and prognostic factors[J].Eur JSurg Oncol,2012,38(10):910-917.
[3] Jemal A,Center MM,DeSantis C,et al.Global patterns of cancer incidence and mortality rates and trends[J].Cancer Epidemiol Biomarkers Prev,2010,19(8):1893-1907.
[4] Hellman S,Weichselbaum RR.Oligometastases[J].J Clin Oncol,1995,13(1):8-10.
[5] Weichselbaum RR,Hellman S.Oligometastases revisited[J].Nat Rev Clin Oncol,2011,8(6):378-382.
[6] Salama JK,Hasselle MD,Chmura SJ,et al.Stereotactic body radiotherapy for multisite extracranial oligometastases:Final report of a dose escalation trial in patients with 1 to 5 sites ofmetastatic disease[J].Cancar,2012,118(11):2962-2970.
[7] Tait CR,Waterworth A,Loncaster J,et al.The oligometastatic state in breast cancer:hypothesisor reality[J].Breast,2005,14(2):87-93.
[8] Pagani O,Senkus E,Wood W,et al.International guidelines for management of metastatic breast cancer:can metastatic breast cancer be cured?[J].JNatl Cancer Inst,2010,102(7):456-463.
[9] Rusthoven KE,Kava nagh BD,Cardenes H,et al.Multiinstitutional phase I/II trial of stereotactic body radiation therapy for livermetastas i s[J].JClin Oncol,2009,27(10):1572-1578.
[10]Mainenti PP,ManciniM,Mainolfi C,et al.Detection of colo-rectal liver metastases:prospective comparison of contrast enhanced US,multidetector CT,PET/CT,and 1.5 Tesla MR with extracellular and reticulo-endothelial cell specific contrast agents[J].Abdom Imaging,2010,35(5):511-521.
[11]张丽,郭小毛.局部治疗在乳腺癌局限性肝转移中的作用[J].中国癌症杂志,2013,23(12):1007-1013.
[12]殷蔚伯,余子豪,徐国镇,等.肿瘤放射治疗学[M].北京:中国协和医科大学出版社,2007,1326-1328.
[13]Morishita M,Leonard RC.Capecitabine and docetaxel combination for the treatment of breast cancer[J].Womens Health(Lond),2008,4:11-22.
[14]陈云兰,韩江琼,赵金奇.长春瑞滨联合卡培他滨治疗37例乳腺癌肝转移的临床观察[J].重庆医学,2013,42(2):203-205.
[15]Sawada N,Ishikaawa T,Sekiguchi F,et al.X-ray irradiation induces thymidine phosphorylase and enhances the efficacy of capecitabine(Xeloda)in human cancerxenografts[J].Clin Cancer Res,1999,5(10):2948-2953.
[16]Goodman KA,Wiegner EA,Maturen KE,et al.Dose-escalation study of single-fraction stereotactic body radiotherapy for liver malignancies[J].Int JRadiatOncol Biol Phys,2010,78(2):486-493.
[2016-10-29收稿][2016-12-20修回][编辑 罗惠予]
Clinical observation of capecitabine combined with intensity-modulated radiotherapy in the treatment of livermetastasis of breast cancer
Wen Qiang,Ye Ruizhi,Jiang Xianming,You Guangxian,Liu Lidan(Department of Radiotherapy,Taizhou Tumor Hospital,Taizhou 317502,P.R.China)
Objective To study the efficacy and side effects of capecitabine combined with intensity-modulated radiation therapy(IMRT)against breast cancer that has metastasized to the liver.Methods A total of 52 patients with breast cancer that had metastasized to the liver were divided into 27 cases who were treated with capecitabine and radiation(capecitabine combined with radiotherapy group)and 25 cases who were treated with capecitabine only(capecitabine group).IMRT was performed on liver metastatic lesions of the capecitabine combined with radiotherapy group,and the 95%dose curve was wrapped around the 99% planned target,with conventional fractionation,2 Gy per time,5 times per week for 4-6 weeks;concurrently,capecitabine therapy(1250 mg/m2)was given 2 times/day orally.After radiotherapy,the patients were treated with capecitabine 2510 mg/m2(2 times/day orally)for a 21-day cycle.The control group was given only capecitabine at 2510 mg/m2(2 times/day orally)for a 21-day cycle. Results Totalefficacy ratewas74.1%in the capecitabinecombinedwith radiotherapygroup,and 44%in the capecitabinegroup(P<0.05). The tumor control probability(CR+PR+SD)was 92.6%in the capecitabine combined with radiotherapy group and 68%in the capecitabine group(P<0.05).The median duration of response in the capecitabine combined with radiotherapy group was 13.6 months,compared to 8.9 months in the capecitabine group(P<0.05).The median survival time in the capecitabine combined with radiotherapy group was 17.4 months and 11.7 months in the capecitabine group.Respective 1-year survival rates were 85.2%and 56.0%(P<0.05);2-year survival rates were 40.7%and 16.0%(P<0.05).Adverse reactions were mainly neutropenia,gastrointestinal reactions,and liver injury,and reactions were grade I and II.Conclusions Capecitabine combined with intensity-modulated radiotherapy for livermetastasis of breast cancer can improve patient survival rate,and adverse reactions can be tolerated.
Breast neoplasms;Liver metastasis;Capecitabine;Intensity-modulated radiotherapy;Efficacy
R737.9
A
1674-5671(2017)01-04
10.3969/j.issn.1674-5671.2017.01.13
温岭市科技计划资助项目(2014C312080)
