瞬态吸收和共振拉曼光谱研究硝基对联苯氮宾、氮宾离子反应活性的影响
2016-11-08李亚芳程博文郑旭明薛佳丹汤文建浙江理工大学生态染整技术教育部工程研究中心杭州008浙江理工大学化学系杭州008中国计量学院太赫兹技术与应用研究所杭州008安徽医科大学药学院合肥00
李亚芳 程博文 沈 超 郑旭明 薛佳丹,,* 杜 勇 汤文建(浙江理工大学生态染整技术教育部工程研究中心,杭州008;浙江理工大学化学系,杭州008;中国计量学院太赫兹技术与应用研究所,杭州008;安徽医科大学药学院,合肥00)
瞬态吸收和共振拉曼光谱研究硝基对联苯氮宾、氮宾离子反应活性的影响
李亚芳2程博文2沈超2郑旭明2薛佳丹1,2,*杜勇3,*汤文建4
(1浙江理工大学生态染整技术教育部工程研究中心,杭州310018;2浙江理工大学化学系,杭州310018;3中国计量学院太赫兹技术与应用研究所,杭州310018;4安徽医科大学药学院,合肥230032)
利用光解芳基叠氮化合物得到单重态氮宾,运用纳秒瞬态吸收光谱、瞬态共振拉曼光谱实验手段,辅以密度泛函理论(DFT)计算,研究了4′-硝基-4-联苯氮宾在乙腈和水溶液中的光化学反应中间体。实验结果表明,在非质子溶剂中,4′-硝基-4-联苯氮宾发生系间窜越反应生成三线态氮宾;在质子溶剂中,单重态氮宾可被质子化产生氮宾离子。与4-联苯氮宾和氮宾离子相比,硝基对单重态氮宾系间窜越反应路径影响很小;降低了氮宾离子与水和叠氮阴离子的反应活性,却提高了其与鸟苷的反应活性。
芳基叠氮;氮宾;氮宾离子;瞬态吸收;共振拉曼
doi:10.3866/PKU.WHXB201511191
1 引言
芳基氮宾、氮宾离子均为具有高度活性的短时中间体。芳基氮宾在光亲和标记1,2、光刻技术3、导电聚合物的形成4、有机合成、聚合物表面的共价修饰改性5,6等方面具有广泛的应用。芳基氮宾离子是硝基多环芳烃、芳基胺类等含氮化学污染物在生物体内代谢的主要活性中间体,研究发现其与DNA嘌呤碱基反应生成C8加合物是这些含氮污染物在生物体内致癌的主要原因7。
芳基氮宾和氮宾离子在实验室可以通过溶液中光解芳基叠氮产生8。以苯基叠氮(phenyl azide,PhN3)为例,光解芳基叠氮化合物的反应路径如示意图1所示:叠氮在光照下很不稳定,容易生成单重态开壳层氮宾(Ph1N),Ph1N在非质子溶液中可系间窜越生成三线态氮宾(Ph3N),或发生环扩散反应经氮杂环丙烯(azirine)中间体生成烯酮亚胺(ketenimine)。Ph3N室温下不稳定,聚合生成偶氮化合物;ketenimine可被二乙胺猝灭,在没有猝灭剂时会发生聚合反应。研究8,9表明,系间窜越速率常数(kISC)不随温度变化,而环扩散速率常数(kR)是温度的函数,符合Arrhenius方程lnk=-Ea/TR+lnA(其中,k为速率常数,R为摩尔气体常量,T为热力学温度,Ea为表观活化能,A为指前因子)。在质子溶剂中,单线态氮宾可被质子化生成氮宾离子7,10,如示意图1所示。多数氮宾离子可与NaN3以扩散速率(~109mol-1∙L∙s-1)进行反应。
光解对位苯基取代的4-联苯叠氮(4-biphenyl azide,BiPhN3)产生单线态氮宾(BiPh1N),其具有很强的夺质子能力(pKb=-2)11,水溶液中即可产生氮宾离子(BiPhNH+)。BiPhNH+已被证实是香烟烟雾中的4-氨基联苯在生物体内代谢生成的具有致癌性的活性中间体12。激光闪光光解的研究7显示BiPhNH+与2'-脱氧鸟苷(2'-deoxyguanosine,dG)的反应速率kdG=2.0×109mol-1∙L∙s-1。值得注意的是,BiPhN3的紫外-可见吸收光谱与2'-脱氧鸟苷的重合(图S1,Supporting Information),故在泵浦-探测时间分辨光谱实验中,无法保证反应发生在Bi-PhNH+与基态鸟苷。基于此,我们试图利用硝基取代使叠氮化合物的紫外-可见吸收峰红移,进而可以用芳基叠氮做先驱体,用时间分辨吸收和拉曼光谱研究氮宾离子与DNA鸟苷的反应机理。
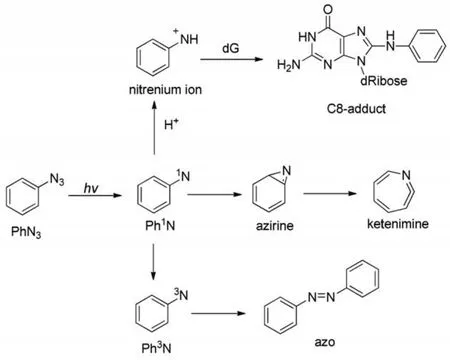
示意图1 光解苯基叠氮得到的单线态氮宾的光化学反应机理Scheme 1 Photochemistry mechanism of singlet phenylnitrene upon photolysis of phenyl azide
另一方面,研究发现取代基对氮宾的系间窜跃速率常数kISC有显著影响,而对环扩散的活化能Ea影响较小。比如无取代的单重态氮宾Ph1N系间窜越速率常数是kISC≈3.2×106s-1,F、Cl等吸电子基团可以加速系间蹿跃速率13,但效果不明显。强π给电子基团则能显著提高kISC,比如对位―OCH3取代的叠氮苯的kISC>500×106s-1;更强的给电子基团对系间窜越速率加速更明显,―N(CH3)2取代的kISC≈8300×106s-1。这种显著的影响与氮宾分子内的电荷分布有关。强给电子基团使单重态开壳层氮宾分子的正负电荷中心分离,呈现类似双自由基的结构,可提高自旋轨道耦合常数进而可以大大提升系间窜越速率8。而与氮宾不同,某些给电子基取代使氮宾离子与亲核试剂反应活性大大降低,如McClelland等14研究发现对位甲基乙酰氨基取代的芳基氮宾离子与鸟苷反应的速率常数kdG=9.0×106mol-1∙L∙s-1,而无取代的PhNH+与鸟苷反应的速率常数是kdG=2.0×109mol-1∙L∙s-1。合适的吸电子基团如卤素则能提高氮宾离子与亲核试剂如NaN3反应的速率14。
以上这些已有的研究成果使我们对搞清楚4'-硝基-4-联苯叠氮(4'-Nitro-4-Biphenyl azide,NBiPhN3)的光化学反应路径产生兴趣。本文运用纳秒瞬态吸收光谱实验和共振拉曼光谱手段,研究了NBiPhN3在乙腈和水溶液中的光化学反应;辅以密度泛函理论计算,指认实验中观测到的中间体。通过BiPhNH+和NBiPhNH+两种氮宾离子与亲核试剂的反应速率常数对比,试图研究强吸电子取代基对氮宾离子反应活性的影响。
2 实验和理论模拟
2.1实验试剂
4'-硝基-4-联苯胺,99%,上海百灵威公司。乙腈,99.9%,色谱纯,美国TEDIA公司。二氯甲烷,99%,分析纯。浓盐酸,99.5%,分析纯。NaNO2,99%,分析纯。乙醚,99.5%,分析纯。无水MgSO4,99.0%,分析纯。
2.2叠氮先驱体的合成
叠氮先驱体的合成按照文献15的方法进行。将2.1422 g(10 mmol)4'-硝基-4-联苯胺溶于10 mL CH2Cl2中,置于0°C的冰水浴中,加入10 mL浓HCl,再加入1.035 g(15 mmol)NaNO2的饱和水溶液,搅拌1 h,加入1.3 g(20 mmol)NaN3的饱和水溶液,搅拌2 h。将反应溶液放入冰箱冷冻12 h,用乙醚萃取,取有机层用无水MgSO4干燥,过滤,旋蒸除去溶剂,得到棕黄色固体4'-硝基-4-联苯叠氮。
2.3激光闪光光解实验
激光闪光光解实验所用仪器是LP-920激光闪光光解仪(Edinburgh Instruments,UK)。激发光(266,355 nm)由Nd:YAG调Q激光器产生的三次和四次谐波提供,探测光由450 W氙灯提供,两束光垂直汇聚在1 cm的石英比色皿上。瞬态物种信号由Hamamatsu R928光电倍增管探测,经阵列Czerny-Turner单色仪分光,最终传输到电脑终端。
2.4单光束高低能量共振拉曼光谱实验
单光束高低能量共振拉曼光谱实验采用的装置与普通共振拉曼光谱实验的装置相同16,17,为自建仪器。Nd:YAG激光器(脉宽10 ns,重复频率10 Hz)激发氢受激拉曼位移管产生所需波长(368.9 nm)的激光,经聚焦的激光光束在流动样品上的直径为0.5 mm。单光束高低能量共振拉曼利用同一束激光引发样品的光化学反应和激发拉曼散射。低能量激光激发的拉曼光谱包含大部分基态物种的信号和少量的瞬态物种信号;而用高能量激光获得的拉曼光谱含有较少的基态物种而大部分的瞬态物种信号。将高低能量获得的拉曼光谱相减所得的差谱即为此波长激光激发分子后0-10 ns的瞬态物种的共振拉曼光谱18。
2.5理论模拟方法
三重态氮宾在B3LYP/6-31G(d)19,20计算水平上进行构型优化和振动频率计算,垂直跃迁运用含时密度泛函理论(TD-DFT)计算。氮宾离子在BPW91/ cc-PVDZ21,22计算水平上进行构型优化和振动频率计算,垂直跃迁运用TD-DFT计算。本文所有量子化学计算均利用Gaussian 09W程序包23完成。
3 结果与讨论
3.1乙腈溶剂中的纳秒瞬态吸收光谱
图1a为乙腈溶液中激光(λexc.=266 nm)光解NBiPhN3的10 ns瞬态吸收光谱。在380和500 nm附近出现了两个特征吸收峰。380 nm处的动力学过程如图1b和1c所示,先有一个快速的衰减(τ≈90 ns),然后是强度缓慢的增加(τ≈114 μs)。这个动力学特性与乙腈溶液中光解BiPhN3获得的350 nm处的动力学特性相同(图S2,Supporting Information)。Platz小组24研究发现,非质子溶剂中光解BiPhN3的主要产物是由于系间窜越生成的三重态氮宾(BiPh3N)。因此我们用TD-DFT计算预测NBiPh3N的垂直跃迁能量和振子强度(f)(表S1,Supporting Information)。计算结果显示其最大跃迁在393 nm(f=0.458),如图1a中柱状图所示,与实验结果吻合很好。此外,τ≈80-90 ns的寿命对于单重态氮宾来说太长8,因此我们有理由把乙腈溶液中光解NBiPhN3的10 ns瞬态吸收光谱归属为三重态氮宾NBiPh3N。实验过程中还发现激发光强度影响NBiPh3N的短时动力学,光强越大衰减越快;而对其长时动力学影响不大。因此推测三重态氮宾聚合的过程可能是两个三重态氮宾先通过弱相互作用形成复合物,然后再成键形成偶氮化合物。
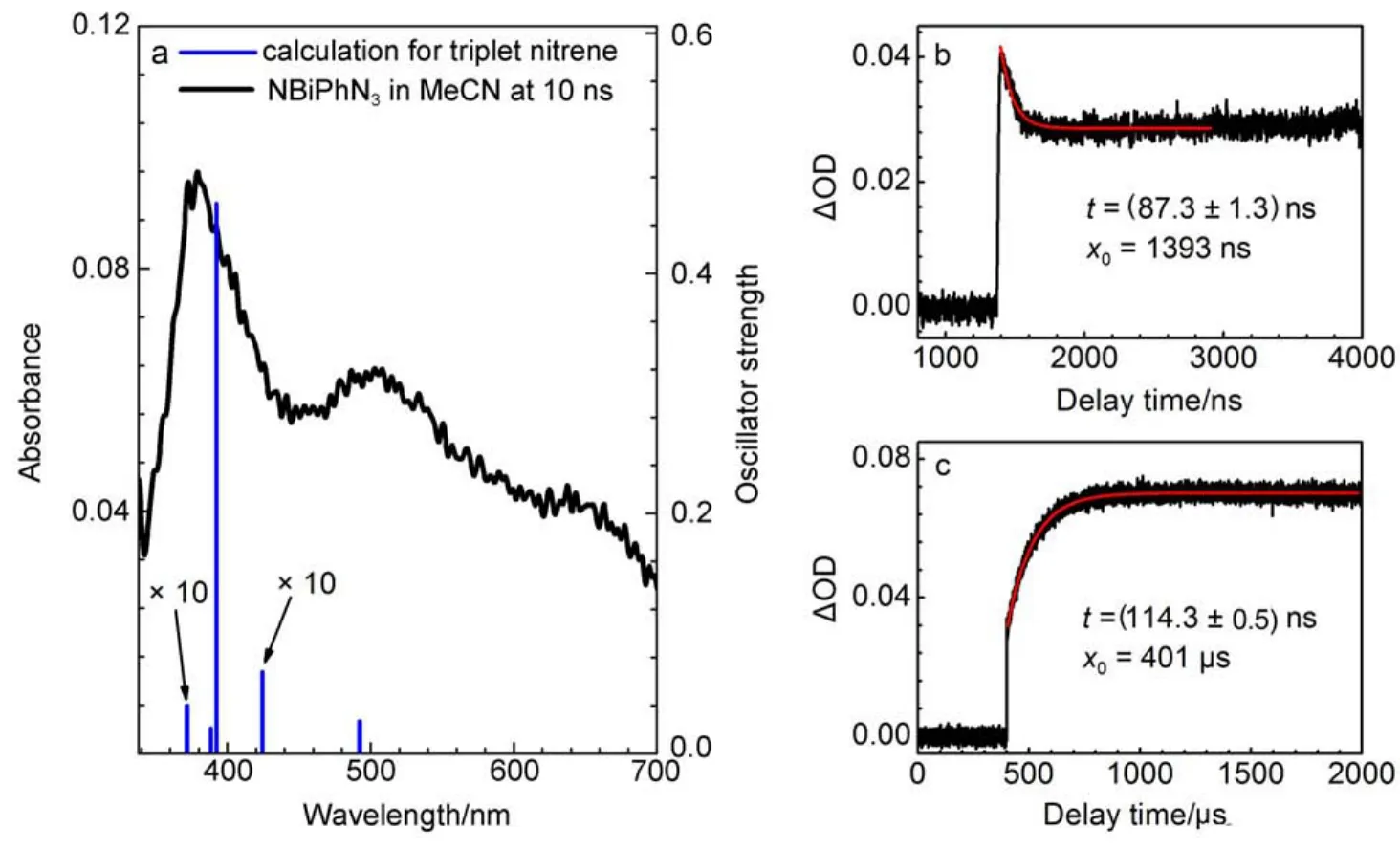
图1 (a)乙腈中266 nm光解NBiPhN3在10 ns时的瞬态吸收光谱和计算的三重态氮宾NBiPh3N的振子强度;(b)乙腈中光解NBiPhN3获得的380 nm处短时动力学过程;(c)乙腈中光解NBiPhN3获得的380 nm处长时动力学过程Fig.1 (a)Transient absorption spectrum obtained at 10 ns after 266 nm photolysis of NBiPhN3in acetonitrile,and calculated oscillator strength for triplet nitrene NBiPh3N;(b)380 nm kinetics at early time region by photolysis of NBiPhN3in acetonitrile;(c)380 nm kinetics at post time region by photolysis of NBiPhN3in acetonitrile
3.2乙腈溶剂中的瞬态共振拉曼光谱
为了进一步证实乙腈溶液中光解NBiPhN3获得的瞬态物种的归属,我们做了其在乙腈中的单光束高低能量共振拉曼实验。将高低能量获得的共振拉曼光谱进行差谱,再扣除溶剂的特征峰,我们获得了光解NBiPhN3后0-10 ns的瞬态物种的共振拉曼光谱,如图2b所示。结合UB3LYP/6-31G (d)计算的NBiPh3N拉曼光谱,对振动模进行指认,结果见图2和表1(更详细的NBiPh3N拉曼振动计算结果见表S2,Supporting Information)。实验和理论计算结果显示,1550-1580 cm-1振动来源于苯环的C―C伸缩,在实验中可以很明显地观测到。这说明共振拉曼光谱中观测到的瞬态物种不可能是环扩散反应的中间体azirine或ketenimine。此外,实验的共振拉曼峰位与计算的三线态氮宾NBiPh3N的拉曼光谱峰平均偏差为11 cm-1(15个振动频率),考虑到溶剂效应等影响,认为二者吻合较好。图2中实验与计算谱图中某些拉曼峰的强度差异是由于实验获得的拉曼光谱是共振增强的,而计算的是普通、非增强的拉曼光谱的原因。因此,乙腈溶液中光解NBiPhN3产生瞬态物种应该是三重态氮宾,即单重态氮宾主要发生系间窜越反应。
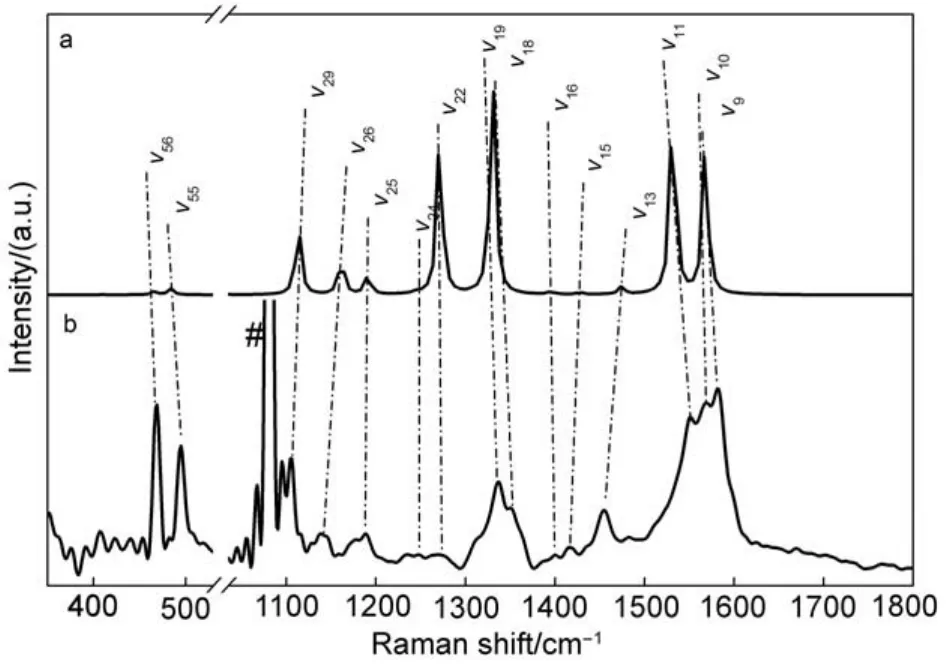
图2 (a)在UB3LYP/6-31G(d)水平下计算的三线态氮宾拉曼光谱;(b)NBiPhN3在乙腈中368.9 nm激发波长下高低功率共振拉曼差谱Fig.2 (a)Normal Raman spectrum for triplet nitrene NBiPh3N calculated at UB3LYP/6-31G(d)level;(b)transient resonance Raman spectrum excited by 368.9 nm laser with high power and low power
3.3水溶液中的纳秒瞬态吸收实验
在含有70%甲酸的乙腈溶液([H+]≈0.057 mol∙L-1)中,光解(λexc.=266 nm)NBiPhN3获得的0 ns的瞬态吸收光谱如图3所示,与图1a中的三重态氮宾光谱不同,图3中440 nm处产生了很强的吸收峰,因此在酸性水溶液中单重态氮宾NBiPh1N发生了与乙腈溶液中不同的反应,有新物种生成。我们计算了(TD-DFT,BPW91/cc-PVDZ)单重态氮宾离子NBiPhNH+的垂直跃迁吸收能(表S3,Supporting Information)。计算结果显示,NBiPhNH+在439.6 nm处振子强度f=0.5259,与实验结果吻合极好。因此图3中具有440 nm吸收峰的物种归属为氮宾离子NBiPhNH+。不含甲酸乙腈:水(3:7(V:V))溶液中440 nm处的动力学呈单指数衰减(图S3,Supporting Information),且其衰减速率与NaN3浓度呈线性关系,如图4a所示。线性拟合得到NBiPhNH+与NaN3的二级反应速率常数kaz=5.75× 109mol-1∙L∙s-1。这一结果也证实了440 nm吸收峰是由NBiPhNH+产生的,因为芳基氮宾离子一个显著特征是可以被NaN3以接近扩散速率猝灭25。类似的,乙腈:水(3:7(V:V))溶液中监测520 nm处的动力学,其也为单指数规律衰减(图S4,Supporting Information),与NaN3的二级反应速率常数是kaz= 5.29×109mol-1∙L∙s-1(图4b)。这一结果与440 nm处动力学的规律吻合,说明520 nm也是氮宾离子NBiPhNH+的特征吸收。

表1 三重态氮宾NBiPh3N实验和计算振动频率指认Table 1 Comparison of experimental Raman frequencies to the calculated ones for the triplet nitrene NBiPh3N,and the vibration descriptions from computations

图3 70%甲酸的乙腈溶液中([H+]=0.057 mol∙L-1)光解NBiPhN3在0 ns时的瞬态吸收光谱和BPW91/cc-PVDZ水平下计算的氮宾离子NBiPhNH+的振子强度Fig.3 Transient absorption spectrum obtained at 0 ns after photolysis of NBiPhN3in 70%formic acid and acetonitrile mixed solvent([H+]=0.057 mol∙L-1),and calculated oscillator strength at BPW91/cc-PVDZ level for nitrenium ion NBiPhNH+
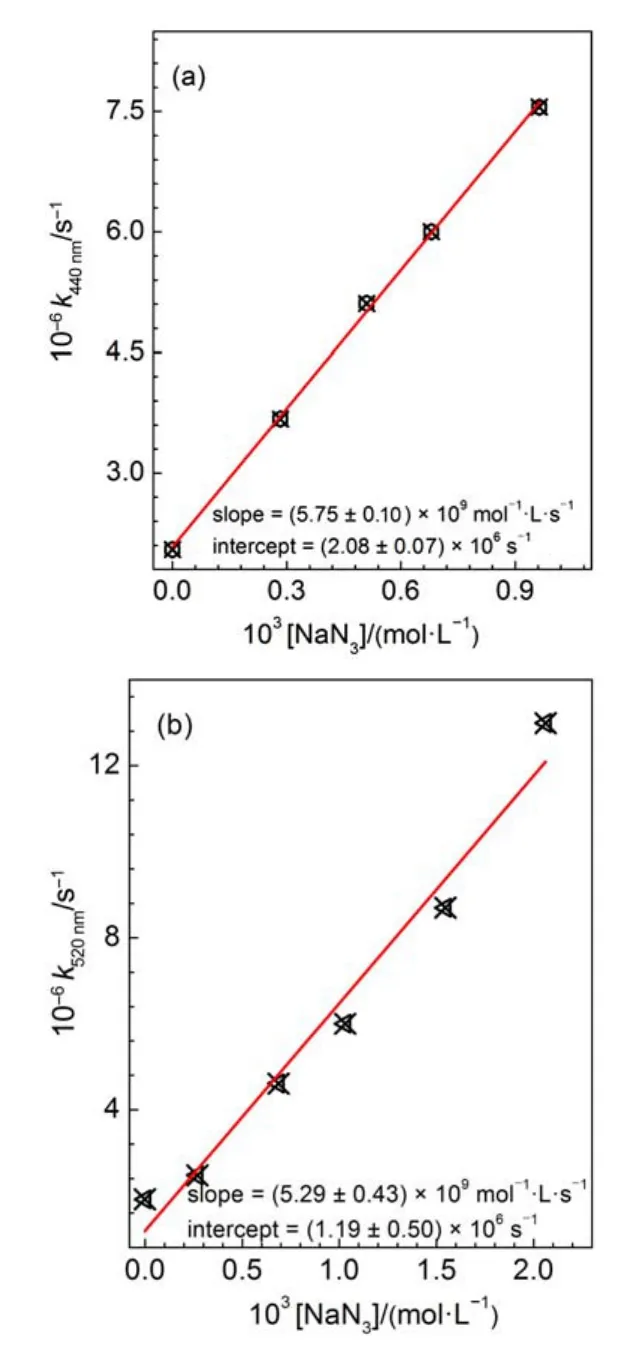
图4 乙腈:水(3:7(V:V))中氮宾离子NBiPhNH+衰减速率常数(k)与NaN3浓度关系Fig.4 Plots of decay rate constants(k)of nitrenium ion NBiPhNH+and the concentration of NaN3record in acetonitrile:water(3:7(V:V))solvent
在瞬态吸收实验中还观察到了2′-脱氧鸟苷对NBiPhNH+的猝灭作用。在含有某浓度2′-脱氧鸟苷的乙腈:水(3:7(V:V))溶液中,520 nm处获得的NBiPhNH+衰减动力学呈单指数衰减(图S5,Supporting Information)。拟合得到2′-脱氧鸟苷与NBi-PhNH+的二级反应速率常数为kdG=3.58×109mol-1∙L∙s-1(图5)。
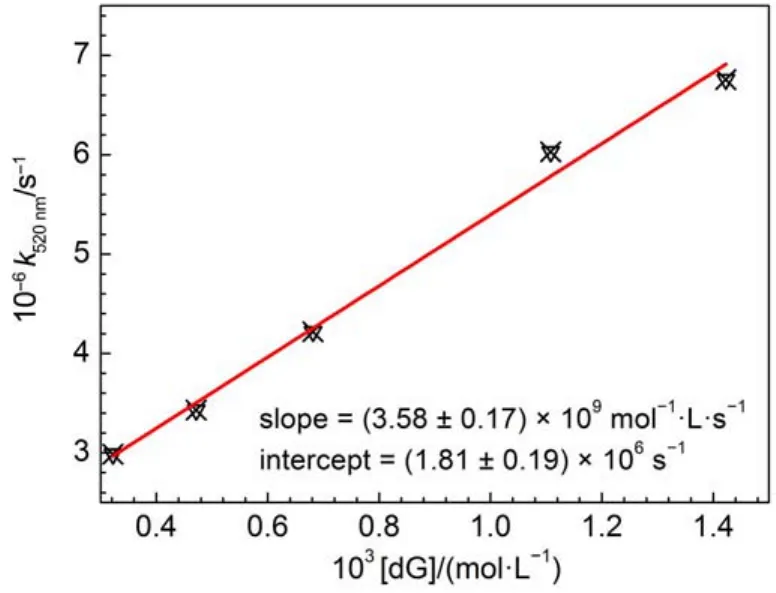
图5 在乙腈:水(3:7(V:V))溶液中NBiPhNH+的衰减速率常数与2′-脱氧鸟苷(dG)浓度关系图Fig.5 Plots of decay rate constant of nitrenium ion NBiPhNH+and the concentration of 2′-deoxyguanosine (dG)in acetonitrile:water(3:7(V:V))solution
3.4硝基对光解BiPhN3光化学反应路径及中间体性质的影响
表2列出了硝基取代前后两种氮宾离子与NaN3和2′-脱氧鸟苷的反应速率常数。值得注意的是,NBiPhNH+与水、NaN3反应速率比无硝基取代的BiPhNH+速率常数降低了一半,而与鸟苷反应的速率常数却是BiPhNH+的2倍。这表明硝基取代降低了BiPhNH+与水和N‒3的反应活性,却提高了与鸟苷的反应活性。BiPhNH+的正电荷并不是完全集中在氮宾离子的N上,苯环的p-π共轭将正电荷分散到整个共轭体系中,如示意图2所示的共振构型7都可能存在。因此苯环上邻位和对位的C反应活性都较强,易与亲核物质反应。而硝基取代使靠近硝基氮的C上带有更多正电荷,连接氮宾离子的苯环上电荷分布减少,用自然键轨道(NBO)计算的两种离子的电荷分布见图S6(Supporting Information),因而与水和叠氮阴离子的反应活性降低。氮宾离子与鸟苷的反应机理虽然还未明确,但时间分辨共振拉曼光谱实验中已观测到二者反应的中间体,是由氮宾离子的N直接进攻鸟苷的C8位产生26-28。因此不难理解氮宾离子N的电负性减小会提高氮宾离子对鸟苷的反应活性。
3例病人因疾病影响,较长时间离开岗位,从而产生无法胜任工作的担忧。病人C:“我是服装厂仓库保管员,如果换了别的岗位自己也不知道能否适应?”

表2 氮宾离子与叠氮化钠和2'-脱氧鸟苷反应的速率常数Table 2 Reaction rate constants for the nitreniums with azide anion and 2'-deoxyguanosine
硝基取代对于单重态联苯氮宾反应影响很小。硝基取代前后的联苯氮宾都主要发生系间窜越的反应。这与Gritsan等13,29的吸电子基团对kISC影响较小结论相符。此外,在70%甲酸的乙腈溶液([H+]=0.057 mol∙L-1)光解NBiPhN3中可以看到较强的氮宾离子吸收峰,在乙腈:水(3:7(V:V))溶液中,只能看到微弱的氮宾离子吸收峰。对比BiPhN3在少量水溶液中就可以看到较强的氮宾离子的吸收峰,说明硝基取代使氮宾质子化能力降低。
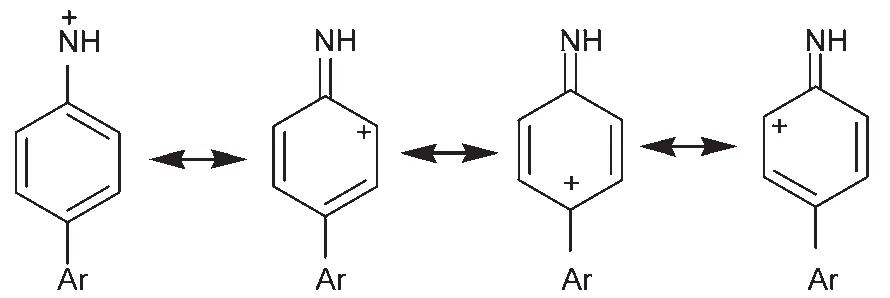
示意图2 芳基氮宾离子的四种共振构型Scheme 2 Four kinds of resonance structures of model arylnitrenium ions
4 结论
通过瞬态吸收光谱和瞬态共振拉曼光谱捕捉乙腈和水溶液中光解4′-硝基4-联苯叠氮(NBiPhN3)产生的中间体,辅以密度泛函理论计算对中间体进行指认。发现,单重态氮宾主要发生系间窜越生成三重态氮宾;在甲酸和水溶液中单重态氮宾可被质子化生成氮宾离子。叠氮化钠和2′-脱氧鸟苷的猝灭实验表明,硝基取代降低了4-联苯氮宾离子对于水和叠氮阴离子的反应活性,却提高了其与鸟苷的反应活性。这主要是由氮宾离子与叠氮阴离子和鸟苷的不同反应机理造成的。
Supporting Information:available free of charge via the internet at http://www.whxb.pku.edu.cn
References
(1)Panov,M.S.;Voskresenska,V.D.;Ryazantsev,M.N.; Tarnovsky,A.N.;Wilson,R.M.J.Am.Chem.Soc.2013,135 (51),19167.doi:10.1021/ja405637b
(2)Voskresenska,V.;Marshall Wilson,R.;Panov,M.;Tarnovsky, A.N.;Krause,J.A.;Vyas,S.;Winter,A.H.;Hadad,C.M. J.Am.Chem.Soc.2009,131(32),11535.doi:10.1021/ ja902224m
(3)Breslow,D.S.IndustrialApplications.InAzides and Nitrenes;Scriven,E.F.V.Ed.;Academic Press:New York,1984;pp 491-521.
(5)Niino,H.;Sato,T.;Yabe,A.Appl.Phys.A 1999,69(6),605 doi:10.1007/s003390051039
(6)Cai,S.X.;Glenn,D.J..;Keana,J.F.W.J.Org.Chem.1992, 57(4),1299.doi:10.1021/jo00030a046
(7)McClelland,R.A.;Gadosy,T.A.;Ren,D.Can.J.Chem.1998, 76(10),1327.doi:10.1139/v98-187
(8)Platz,M.S.Nitrene.In Reactive Intermediate Chemistry; Moss,R.A.,Platz,M.S.,Jones,M.,Jr.Eds.;John Wiley &Sons:Hoboken,New Jersey,2004;pp 501-559.
(9)Gritsan,N.P.;Tigelaar,D.;Platz,M.S.J.Phys.Chem.A. 1999,103(23),4465.doi:10.1021/jp990004u
(10)Ren,D.;McClelland,R.A.Can.J.Chem.1998,76(1),78. doi:10.1139/v97-204
(11)McClelland,R.A.;Kahley,M.J.;Davidse,P.A.;Hadzialic,G. J.Am.Chem.Soc.1996,118(20),4794.doi:10.1021/ ja954248d
(12)Talaska,G.;Al-Juburi,A.Z.S.S.;Kadlubar,F.F.Proc.Natl. Acad.Sci.U.S.A.1991,88(12),5350.doi:10.1073/ pnas.88.12.5350
(13)Gritsan,N.P.;Gudmundsdottir,A.D.;Tigelaar,D.;Zhu,Z.D.; Karney,W.L.;Hadad,C.M.;Platz,M.S.J.Am.Chem.Soc. 2001,123(9),1951.doi:10.1021/ja9944305
(14)Ruane,P.H.;McClelland,R.A.Can.J.Chem.2001,79(12), 1875.doi:10.1139/v01-178
(15)Brown,B.R.;Yielding,L.W.;White,Jr.W.E.;Mutat.Res. 1980,70(1),17.doi:10.1016/0027-5107(80)90054-8
(16)Ouyang,B.;Xue,J.D.;Zheng,X.M.;Fang,W.H.J.Chem. Phys.2014,140(19),194305.doi:10.1063/1.4875807
(17)Li,D.;Xue,J.D.;Zheng,X.M.Acta Phys.-Chim.Sin.2014, 30(12),2216.[李丹,薛佳丹,郑旭明.物理化学学报, 2014,30(12),2216.]doi:10.3866/PKU.WHXB201410221
(18)Phillips,D.L.;Kwok,W.M.;Ma,C.An Introduction to Time-Resolved Resonance Raman Spectroscopy and ItsApplication to Reactive Intermediates.In Reviews of Reactive Intermediate Chemistry;Platz,M.S.,Moss,R.A.,Jones,M.,Jr.Eds.;John Wiley&Sons:Hoboken,New Jersey,2007;pp 123-182.
(19)Becke,A.D.J.Chem.Phys.1993,98(7),5648.doi:10.1063/ 1.464913
(20)Schäefer,A.;Horn,H.;Ahlrichs,R.J.Chem.Phys.1992,97 (4),2571.doi:10.1063/1.463096
(21)Perdew,J.P.;Burke,K.;Wang,Y.Phys.Rev.B 1996,54(23), 16533.doi:10.1103/PhysRevB.54.16533
(22)Dunning,T.H.,Jr.J.Chem.Phys.1989,90(2),1007.doi: 10.1063/1.456153
(23)Frisch,M.J.;Trucks,G.W.;Schlegel,H.B.;et al.Gaussian 09,Version 7.0;Gaussian Inc.:Wallingford CT,2009.
(24)Tsao,M.L.;Gritsan,N.;James,T.R.;Platz,M.S.J.Am. Chem.Soc.2003,125(31),9343 doi:10.1021/ja0351591
(25)McClelland,R.A.;Davidse,P.A.;Hadzialic,G.J.Am.Chem. Soc.1995,117(14),4173.doi:10.1021/ja00119a035
(26)McClelland,R.A.;Ahmad,A.;Dicks,A.P.;Licence,V.E. J.Am.Chem.Soc.1999,121(14),3303.doi:10.1021/ ja9836702
(27)Chan,P.Y.;Kwok,W.M.;Lam,S.K.;Chiu,P.;Phillips,D.L. J.Am.Chem.Soc.2005,127(23),8246.doi:10.1021/ ja0505651
(28)Xue,J.;Chan,P.Y.;Du,Y.;Guo,Z.;Chung,C.W.Y.;Toy,P. H.;Phillips,D.L.J.Phys.Chem.B 2007,111(44),12676. doi:10.1021/jp074778j
(29)Gritsan,N.P.;Platz,M.S.Chem.Rev.2006,106(9),3844. doi:10.1021/cr040055+
Investigation of the Influence of Nitro-Substitution on the Reaction of Biphenyl-Nitrene and Nitrenium Ion by Transient Absorption and Resonance Raman Spectroscopic Techniques
LI Ya-Fang2CHENG Bo-Wen2SHEN Chao2ZHENG Xu-Ming2XUE Jia-Dan1,2,*DU Yong3,*TANG Wen-Jian4
(1Engineering Research Center for Eco-Dyeing&Finishing of Textiles,Ministry of Education,Zhejiang Sci-Tech University, Hangzhou 310018,P.R.China;2Department of Chemistry,Zhejiang Sci-Tech University,Hangzhou 310018,P.R.China;3Centre for Terahertz Research,China Jiliang University,Hangzhou 310018,P.R.China;4School of Pharmacy,Anhui Medical University,Hefei 230032,P.R.China)
Arylnitrenes and arylnitrenium ions are both short-lived intermediates that are highly reactive.In this work,nanosecond transient absorption and transient resonance Raman spectroscopic measurements were used to detect and identify the intermediates generated from the singlet 4′-nitro-4-biphenylnitrene after photolysis of the corresponding aryl azide in acetonitrile and aqueous solution.Combined with the density functional theory (DFT)simulation results,the structural and electronic characteristics of the above experimental intermediates were specified.The spectral results indicate that in aprotic solvents(such as acetonitrile),the singlet 4′-nitro-4-biphenylnitrene undergoes intersystem crossing(ISC)to the triplet nitrene.In contrast,in a protic solvent(such as the mixed aqueous solution used in this work),the singlet 4′-nitro-4-biphenylnitrene can be protonated to produce the nitrenium ion.Compared with its un-substituted counterpart,the nitro substitution has little influenceon the ISC reaction pathway of the singlet 4-biphenylnitrene.With regard to the un-substituted nitrenium ion, the nitro group decreases its reactivity towards water and azide anion,while accelerating its reaction rate towards 2′-deoxyguanosine based on the different quench reaction rates between the nitrenium ion and azide anion/2′-deoxyguanosine.These results provide rich structural and kinetic information about related arylnitrenes and arylnitrenium ions,providing insights into their photolysis mechanism(s)through electronic and vibrational spectroscopic techniques.
Aryl azide;Nitrene;Nitrenium ion;Transient absorption;Resonance Raman
July 21,2015;Revised:November 17,2015;Published on Web:November 19,2015.
O643
*Corresponding authors.XUE Jia-Dan,Email:jenniexue@126.com;Tel:+86-571-86843627.DU Yong,Email:yongdu@cjlu.edu.cn; Tel:+86-571-86875618.
The project was supported by the National Natural Science Foundation of China(21202032,21205110),Science Foundation of Zhejiang Sci-Tech University,China(1206841-Y),Zhejiang Provincial Top KeyAcademic Discipline of Chemical Engineering and Technology,Zhejiang Sci-Tech University,China(YR2013009),and Zhejiang Provincial Natural Science Foundation,China(LY16B030008).
国家自然科学基金(21202032,21205110),浙江理工大学科研启动基金(1206841-Y),浙江理工大学化学工程与技术浙江省重中之重(一级)学科开放基金(YR2013009)及浙江省自然科学基金(LY16B030008)资助项目
©Editorial office ofActa Physico-Chimica Sinica
