2,6-二甲氧基-2-嘧啶氧基-N-芳基苄胺衍生物的酸催化Smiles重排反应动力学
2016-11-08张培志叶美君胡伟莲浙江科技学院生物与化学工程学院杭州00浙江科技学院浙江省废弃物生物质循环利用与生态处理技术重点实验室杭州00中华全国供销合作总社杭州茶叶研究院杭州006浙江大学化学系杭州007
张培志 叶美君 胡伟莲 吴 军(浙江科技学院生物与化学工程学院,杭州00;浙江科技学院,浙江省废弃物生物质循环利用与生态处理技术重点实验室,杭州00;中华全国供销合作总社杭州茶叶研究院,杭州006;浙江大学化学系,杭州007)
2,6-二甲氧基-2-嘧啶氧基-N-芳基苄胺衍生物的酸催化Smiles重排反应动力学
张培志1,2,*叶美君3胡伟莲1吴军4,*
(1浙江科技学院生物与化学工程学院,杭州310023;2浙江科技学院,浙江省废弃物生物质循环利用与生态处理技术重点实验室,杭州310023;3中华全国供销合作总社杭州茶叶研究院,杭州310016;4浙江大学化学系,杭州310027)
研究了酸催化下的2,6-二甲氧基-2-嘧啶氧基-N-芳基苄胺衍生物Smiles重排反应的动力学,考察了盐酸的初始浓度、溶剂、反应温度和取代基对反应速率的影响。结果表明,盐酸的初始浓度增加,重排反应速率加快;在单一溶剂中反应速率的顺序为:甲醇>乙醇>二甲基亚砜>乙腈,而在甲醇/水(1:1,V/V)的混合溶剂中反应速率明显增加,其表观反应速率常数(kobs)值是甲醇溶剂中的5.27倍;在25-45°C温度范围内,各衍生物的反应速率随着温度的升高而加快,其活化能(73.99-76.92 kJ∙mol-1)、活化焓(71.57-74.38 kJ∙mol-1)及Gibbs自由能(81.51-85.77 kJ∙mol-1)数值相近,仅活化熵(-24.38--47.11 J∙K-1∙mol-1)有一定的差别;取代基常数和表观速率常数之间呈现一定的线性关系,环上吸电子基团的存在有利于反应速率的提高;实验验证了反应机理的合理性。
动力学;反应机理;2,6-二甲氧基-2-嘧啶氧基-N-芳基苄胺衍生物;Smiles重排;酸催化反应
doi:10.3866/PKU.WHXB201512082
1 引言
Smiles重排反应通常以碱为催化剂1-6,该反应是典型的分子内亲核取代反应,常见的主要有N―O、N―S和O―S型Smiles重排,反应式如图1所示,其中,Y代表离去基团,X代表亲核基团,R1和R2代表苯环上的取代基;Z―Z代表基团X与Y之间的连接,这种连接可以是脂肪链,也可以是芳香环,提高X的亲核性和增加芳环的正电性有利于反应进行。
Smiles重排反应也可在酸性条件下进行,但研究报道相对较少。1958年,Takahashi和Moki7首次报道了含硫吡啶化合物在盐酸催化下可发生Smiles重排反应。1964年,Rodig等8在Takahashi的研究基础上初步提出了酸催化的Smiles重排反应机理,但许多关键影响因素尚不明确。1980年,Sunamoto等9开展了酸催化的Smiles重排反应动力学研究,考察了pH值、Cu(II)和胶束等对反应速率的影响,建立了相应的动力学方程。同样,酸催化的Smiles重排反应在药物分子设计中也得到了重要应用。质子泵抑制剂(proton pump inhibitors,PPIs)是治愈溃疡病的有效药物,研究发现其药效发挥与酸催化的Smiles重排反应历程有关10-13,Shin等14采用动力学方法,建立了反应速率与这类药物的酸度常数(pKa)的关系,提出了可能的活化途径。
丙酯草醚、异丙酯草醚是一类具有自主知识产权的新型油菜田除草剂15,16,属于2,6-二甲氧基-2-嘧啶氧基-N-芳基苄胺衍生物,在酸催化下极易发生Smiles重排反应而失效17,18。有关酸度、温度、溶剂等因素对该反应的速率影响尚未见报道。本文以2,6-二甲氧基-2-嘧啶氧基-N-芳基苄胺衍生物为反应底物,开展酸催化下的反应动力学研究。
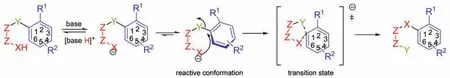
图1 碱催化的Smiles重排反应机理Fig.1 Mechanism of bases-catalyzed Smiles rearrangement
2 实验部分
2.1仪器与试剂
Waters 2695高效液相色谱仪(HPLC,美国Waters公司);色谱柱(4.6 mm×250 mm,5 μm,大连依利特分析仪器有限公司);SPX-100B-Z生化培养箱(上海博迅实业有限公司医疗设备厂);AL204电子天平(梅特勒-托利多仪器上海有限公司)。
2,6-二甲氧基-2-嘧啶氧基-N-芳基苄胺衍生物(化合物1)按文献19方法合成和纯化,纯度大于98%。甲醇和乙腈(色谱纯,Scharlau公司,西班牙),盐酸、氢氧化钠、甲醇、乙醇、乙腈等试剂均为市售分析纯,纯净水(杭州娃哈哈有限公司)。
2.2动力学实验方法
移取10.4 mL 37%盐酸(密度为1.19 g∙mL-1)于250 mL容量瓶中,加入相应的有机溶剂配制成浓度为0.05 mol∙L-1的盐酸混合溶液。准确称取0.0100 g(精确到0.0001 g)自制标准品于小烧杯中,加少量0.05 mol∙L-1盐酸混合溶液超声溶解,转移至100 mL容量瓶中,用0.05 mol∙L-1盐酸混合溶液稀释至浓度为100 mg∙L-1的反应溶液。将配制好的100 mg∙L-1的反应溶液分装于若干个微型反应器中置于恒温培养箱中,每隔一定时间取样,经适量NaOH溶液中和以终止反应,用0.45 μm有机滤膜过滤后,由高效液相色谱测定样品的浓度。实验做三次重复。
根据公式(1)可计算化合物1的转化率(η),其中[10]为化合物1的初始浓度,[1t]为化合物1反应t时的液相检测浓度。通过使盐酸用量相对于化合物1高倍过量的方法20,21,可使酸催化的Smiles重排反应符合假一级反应动力学,并可按方程(2)和(3)求得表观速率常数(kobs)和半衰期(t1/2)。
3 结果与讨论
用盐酸处理化合物1,在室温下发生Wang等18报道的Smile重排反应,生成重排产物2,经NaOH处理得产物3(图2)。
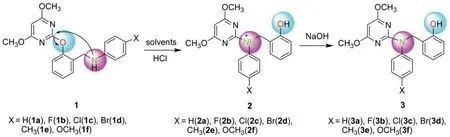
图2 酸催化的2,6-二甲氧基-2-嘧啶氧基-N-芳基苄胺衍生物Smiles重排反应Fig.2 Acid-catalyzed Smiles rearrangement of 2,6-dimethoxy-2-pyrimidinyloxy-N-arylbenzylamine derivatives
3.1盐酸初始浓度对反应速率的影响
以化合物1a为反应底物,考察盐酸初始浓度变化对Smiles重排反应的影响。实验表明,在盐酸浓度为5.0×10-4-5.0×10-2mol∙L-1的范围内,反应符合假一级反应动力学模型,直线的线性相关性良好(表1),且随盐酸浓度增大,1a的重排反应速率增加,反应半衰期缩短。
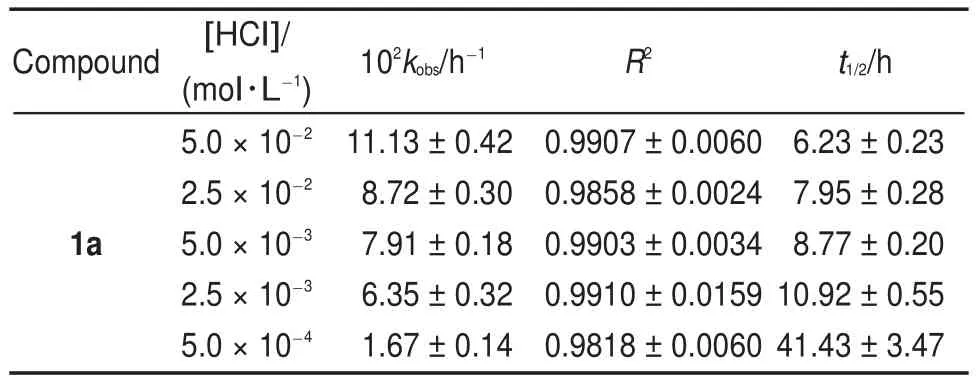
表1 化合物1a在甲醇/水(1:1(V/V))体系中的假一级速率常数Table 1 Pseudo-first-order rate constant of compound 1a in CH3OH/H2O(1:1(V/V))system
3.2溶剂对反应速率的影响
以1d为反应底物,考查了多种溶剂对反应的影响(表2)。由表2可知,溶剂的性质对反应速率的影响较显著22,23,表观速率常数kobs在单一溶剂中的顺序为:甲醇>乙醇>二甲基亚砜>乙腈,如在甲醇中的kobs值是二甲基亚砜的2.55倍;相对于非质子的极性溶剂二甲基亚砜和乙腈,二者的kobs值相差不大,但在甲醇中加入水(1:1,V/V)后,极大地促进了反应的进行,其kobs值是甲醇的5.27倍,是二甲基亚砜的13.5倍。显然,质子性溶剂更有利于反应的进行。
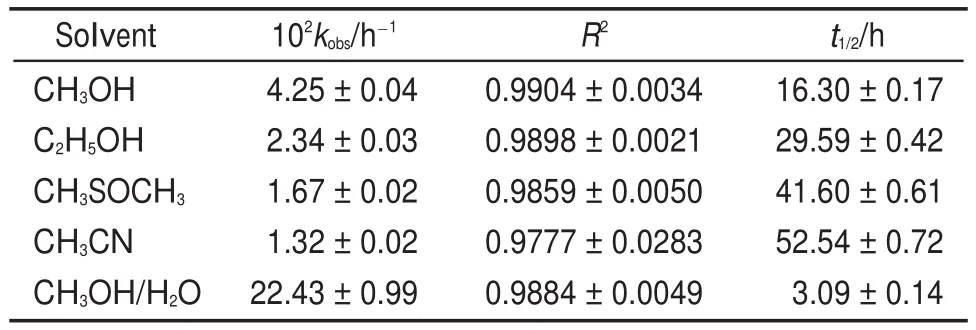
表2 不同溶剂下化合物1d假一级速率常数Table 2 Pseudo-first-order rate constant of compound 1d in different solvents
3.3温度对反应速率的影响

在25-45°C下,考察温度变化对表观速率常数kobs的影响。由表3可知,反应速率随温度的升高而加快。反应表现活化能(Ea)可用Arrhenius方程(4)来描述:其中,R为摩尔气体常数(8.314 J∙K-1∙mol-1),A为指前因子,T为绝对温度(K)。根据式(4),以lnkobs对1/T作图(图3),由直线斜率-Ea/R求得反应的表观活化能Ea(表4)。
方程式(7)由Eyring方程(5),结合Gibbs自由能方程式(6)得出:

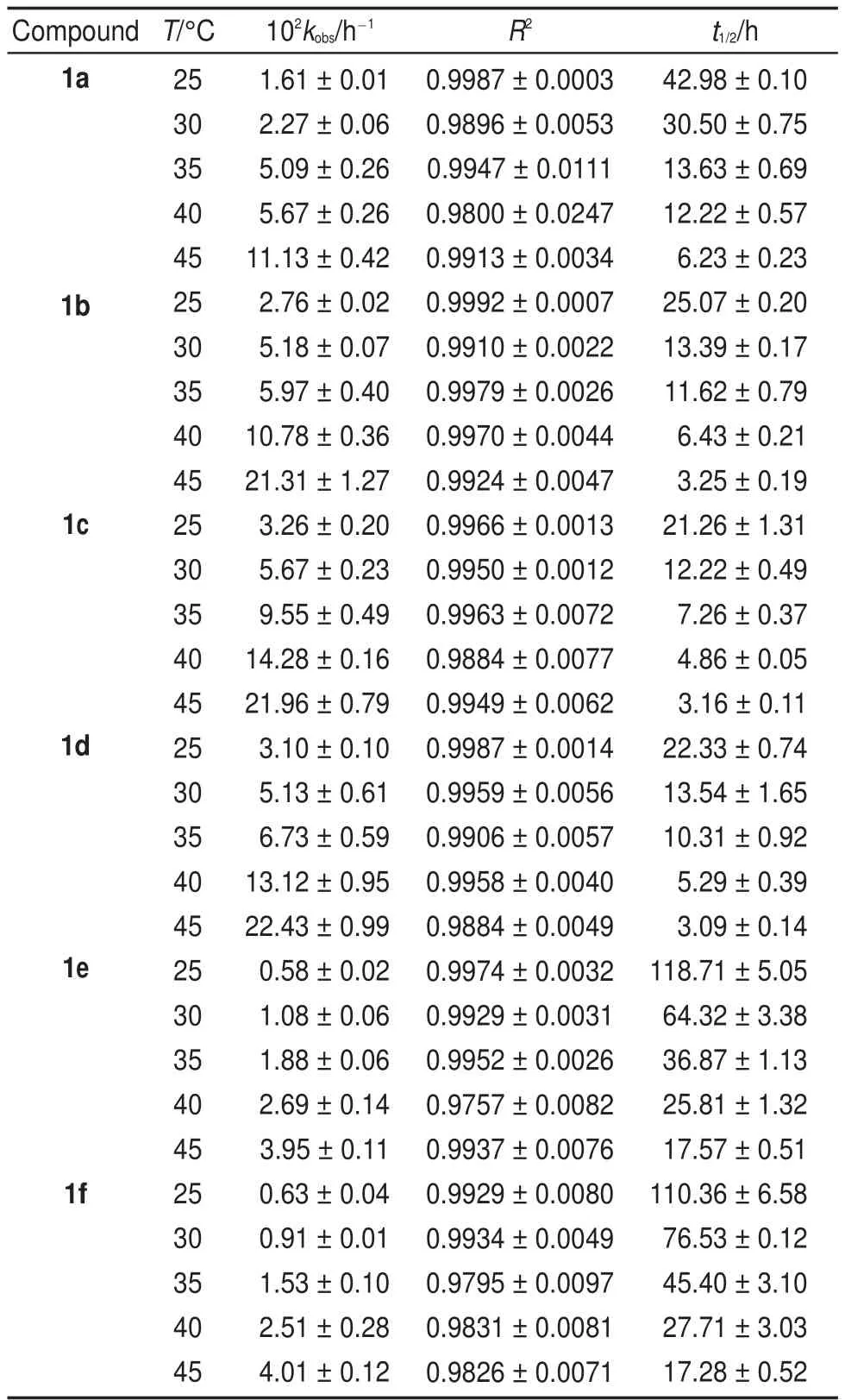
表3 不同温度下化合物1在甲醇/水(1:1(V/V))体系中的假一级速率常数Table3 Pseudo-first-orderrateconstantofcompound1 in CH3OH/H2O(1:1(V/V))systematdifferenttemperatures
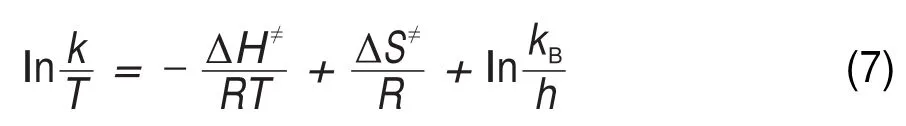
其中,k是反应速率常数,△G≠是反应的活化自由能,kB是Boltzmann常数(1.3085×10-23J∙K-1),h是Planck常数(6.6256×10-34J∙S)。
以ln(kobs/T)对1/T作图(图4),由直线的斜率和截距分别求得化合物的活化焓△H≠和活化熵△S≠,由公式(6)得到相应的△G≠(表4)。由表4可知,取代基效应对反应的表观活化能Ea和活化焓△H≠作用不大,但对活化熵影响较明显,其值介于-24.38--47.11 J∙K-1∙mol-1之间,表明从反应物到过渡态的有序性增加,因而使体系的熵减少24;由公式(6)及表4数据可见,-T△S≠对△G≠的贡献远小于△H≠,说明反应决速步骤为焓控反应25。
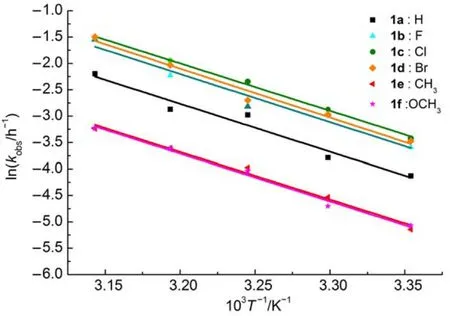
图3 在甲醇/水(1:1(V/V))体系中化合物1的lnkobs与1/T关系Fig.3 Plots of lnkobsversus 1/T of compound 1 in CH3OH/H2O(1:1(V/V))system
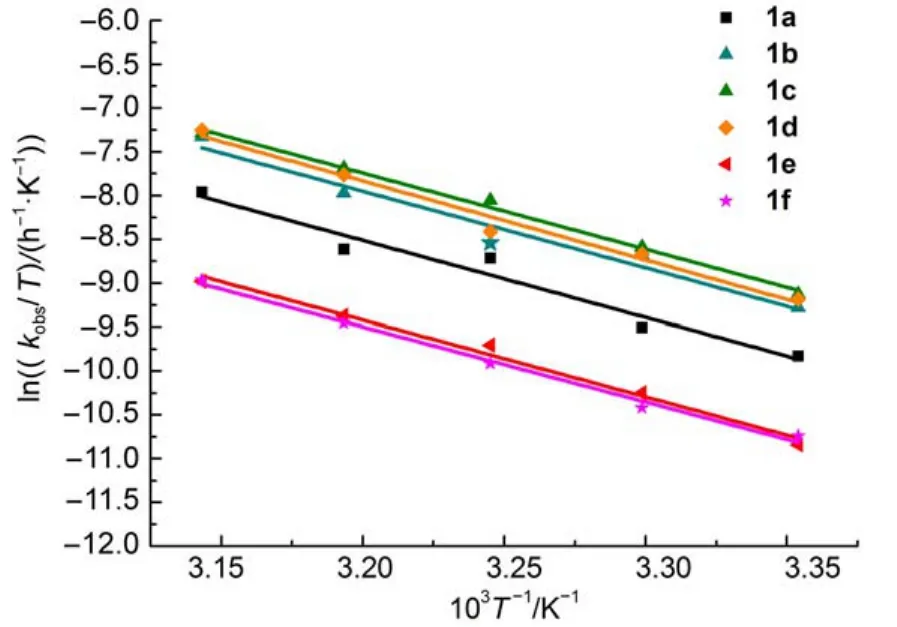
图4 甲醇/水(1:1(V/V))体系中化合物1的ln(kobs/T)与1/T关系Fig.4 Plots of ln(kobs/T)versus 1/T of compound 1 in CH3OH/H2O(1:1(V/V))system
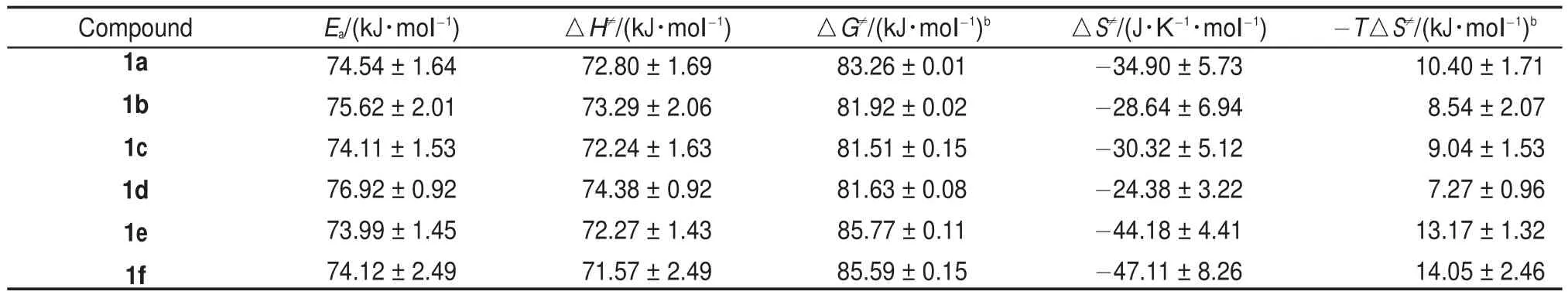
表4 在甲醇/水(1:1(V/V))体系中化合物1的活化参数Table 4 Activation Parameters of compound 1 in CH3OH/H2O(1:1(V/V))systema
3.4取代基对反应速率的影响
由取代基常数σp26及化合物1的表观速率常数kobs(表3),结合Hammett方程(8),以lg(kX/kH)对σp作图得一直线(图5),斜率ρ为1.5878。ρ表示反应对取代基效应的敏感程度,与反应种类和介质有关20,27。若ρ˃0,吸电子基团(σp˃0)将促进反应的进行,而供电子基团(σp˂0)则减缓反应20。这一结论与实验吻合,化合物1b、1c、1d明显快于1e和1f(表3),即环上的吸电子基团有利于酸催化Smiles重排反应的进行。
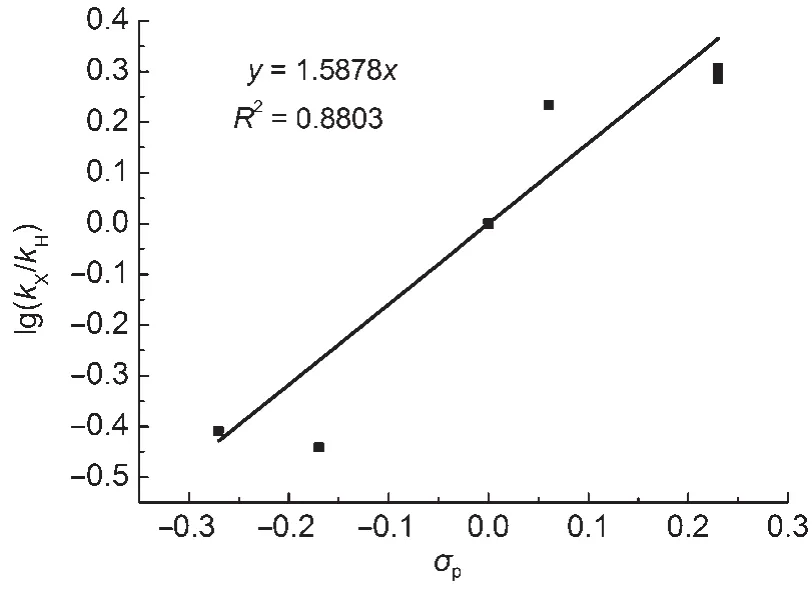
图5 化合物1a的lg(kX/kH)与σp值b的关系Fig.5 Plot of lg(kX/kH)of compound 1aagainst σpvalueb

3.5反应速率方程
由实验结果及文献14,18,我们提出了一种酸催化的单质子化机理(图6)。在酸催化下,化合物1中的N3原子碱性(pKa≈2.76)要比嘧啶环上的N1原子的碱性(pKa≈1.48)强,N3原子首先捕获质子,形成1的共轭酸A;然后,A发生分子内的质子转移反应得到关键中间体B;活化的B生成后立刻发生Smiles重排反应生成季铵盐2;经碱处理后得到最终产物3。

图6 酸催化的2,6-二甲氧基-2-嘧啶氧基-N-芳基苄胺衍生物Smiles重排反应机理Fig.6 Mechanism of the acid-catalyzed Smiles rearrangement of 2,6-dimethoxy-2-pyrimidinyloxy-N-arylbenzylamine derivatives
以[1]、[A]、[B]、[2]、[3]分别表示反应过程中所涉及的化合物1、A、B、2和3的浓度,基于此反应机理,反应速率方程可表示为:

根据平衡态近似原理得:

活泼中间体B生成后立刻发生Smiles重排反应,可采用稳态近似(steady-state approximation)处理:

即:

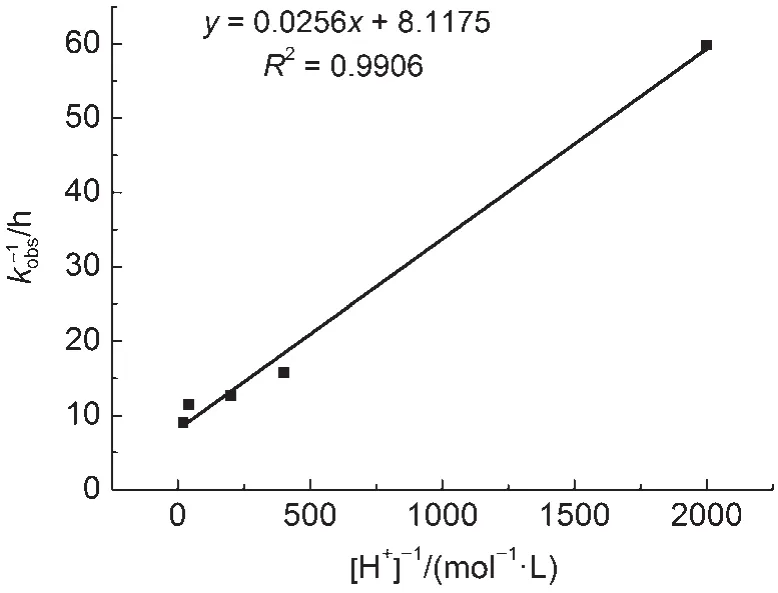
图7 化合物1a的1/kobs与1/[H+]的关系Fig.7 Plot of 1/kobsof compound 1a against 1/[H+]
将式(12)代入式(9)得:

为终止反应需加入NaOH使反应体系呈中性,1t可认为是反应物1浓度与其质子化中间体A和B浓度的总和,产物2和3的浓度相等,即:

Smiles重排是单分子反应,可认为1 mol底物的消失,全部转化为等量的产物,整个反应过程中体系的化合物1总浓度保持不变,则:

在假一级反应条件下,反应速率存在如下关系:
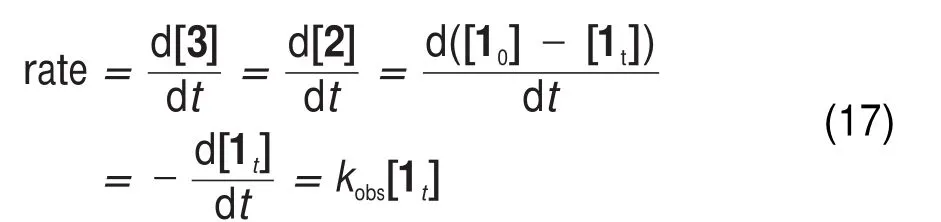
由方程式(10)、(12)、(13)、(14)和(17),可得kobs与酸度的关系式(18):
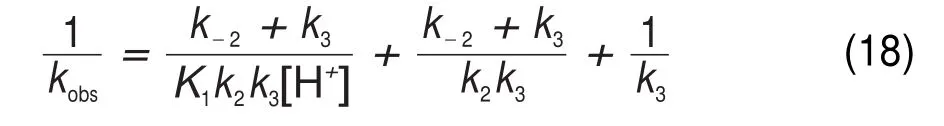
基于表1所测定的数据,以化合物1a的1/kobs对1/[H+]作图,图7呈现出良好的线性关系,这和推得的动力学方程(18)相吻合28,同时也证实了我们提出单质子化机理的合理性。
4 结论
酸催化下2,6-二甲氧基-2-嘧啶氧基-N-芳基苄胺类衍生物的Smiles重排反应的动力学研究表明,具有吸电子基团(F、Cl、Br)化合物的重排反应速率明显快于具有推电子基团(CH3、OCH3)的化合物;溶剂的性质对重排反应速率影响较大,甲醇/水的混合溶剂可显著加快反应。热力学研究表明,各反应物的表观活化能、活化焓和Gibbs自由能的数值相近,而活化熵有较大的差别,并呈现负值,表明从反应底物到过渡态的有序性增加,反应主要为焓控反应。此外,在一定的酸度范围内,酸度增加有利于重排反应发生,推导的表观速率常数kobs与酸度之间的关系式和实验结果高度吻合,验证了单质子化机理的合理性。对这类除草剂的研究及开发具有一定的理论意义。
References
(1)Liu,S.H.;Hu,Y.;Qian,P.F.;Hu,Y.W.;Ao,G.Z.;Chen,S. H.;Zhang,S.L.;Zhang,Y.N.Tetrahedron Lett.2015,56(17), 2211.doi:10.1016/j.tetlet.2015.03.062
(2)Nechepurenko,I.V.;Komarova,N.I.;Shernyukov,A.V.; Vasiliev,V.G.;Salakhutdinov,N.F.Tetrahedron Lett.2014,55 (44),6125.doi:10.1016/j.tetlet.2014.09.059
(3)Xiao,Y.X.;Zhang,Z.C.;Chen,Y.B.;Shao,X.S.;Li,Z.;Xu, X.Y.Tetrahedron 2015,71(12),1863.doi:10.1016/j. tet.2015.01.059
(4)Kitching,M.O.;Hurst,T.E.;Snieckus,V.Angew.Chem.Int. Edit.2012,51(12),2925.doi:10.1002/anie.201106786
(5)Yu,J.Z.;Wang,Y.T.;Zhang,P.Z.;Wu,J.Synlett 2013,24 (11),1448.doi:10.1055/s-00000083
(6)Yu,J.Z.;Zhang,P.Z.;Wu,J.;Shang,Z.C.Tetrahedron Lett. 2013,54(24),3167.doi:10.1016/j.tetlet.2013.04.028
(7)Takahashi,T.;Maki,Y.Chem.Pharm.Bull.1958,6(4),369.
(8)Rodig,O.R.;Collier,R.E.;Schlatzer,R.K.J.Org.Chem. 1964,29(9),2652.
(9)Sunamoto,J.;Kondo,H.;Yanase,F.;Okamoto,H.B.Chem. Soc.Jpn.1980,53(5),1361.
(10)Lindberg,P.;Nordberg,P.;Alminger,T.;Brandstrom,A.; Wallmark,B.J.Med.Chem.1986,29(8),1327.
(11)Terauchi,H.;Tanitame,A.;Tada,K.;Nakamura,K.;Seto,Y.; Nishikawa,Y.J.Med.Chem.1997,40(3),313.
(12)Kuhler,T.C.;Swanson,M.;Christenson,B.;Klintenberg,A. C.;Lamm,B.;Fagerhag,J.;Gatti,R.;Olwegard-Halvarsson, M.;Shcherbuchin,V.;Elebring,T.J.Med.Chem.2002,45 (19),4282.
(13)Potashman,M.H.;Duggan,M.E.J.Med.Chem.2009,52(5), 1231.
(14)Shin,J.M.;Cho,Y.M.;Sachs,G.J.Am.Chem.Soc.2004,126 (25),7800.
(15)Wu,J.;Cheng,J.;Lu,L.J.Arg.Food Chem.2006,54(16), 5954.doi:10.1021/jf061063p
(16)Wu,J.;Zhang,P.Z.;Lü,L.;Yu,Q.S.;Hu,X.R.;Gu,J.M. Chin.J.Struct.Chem.2003,22(5),613.[吴军,张培志,吕龙,俞庆森,胡秀荣,顾建明.结构化学,2003,22(5),613.]
(17)Wang,H.Y.;Zhang,X.;Guo,Y.L.;Tang,Q.H.;Lu,L.J.Am. Soc.Mass Spectrom.2006,17(2),253.
(18)Wang,H.Y.;Liao,Y.X.;Guo,Y.L.;Tang,Q.H.;Lu,L. Synlett 2005,8,1239.
(19)Wu,H.F.;Zhang,P.Z.;Wu,J.J.Zhejiang Univ.-Sci.B 2010, 11(2),94.
(20)Wei,Y.Y.;Li,J.Z.An Introduction to Chemical Reaction Mechanism;Science Press:Beijing,2003;pp 37-77.[魏运洋,李建著.化学反应机理导论.北京:科学出版社,2003:37-77.]
(21)Richardson,D.E.;Yao,H.R.;Frank,K.M.Bennett,D.A. J.Am.Chem.Soc.2000,122(8),1729.
(22)Zou,J.W.;Shang,Z.C.;Yi,P.G.;Yu,Q.S.;Lin,R.S.Chin. J.Org.Chem.2000,20(4),537.[邹建卫,商志才,易平贵,俞庆森,林瑞森.有机化学,2000,20(4),537.]
(23)Peng,M.J.;Lu,G.B.;Chen,W.H.;Chen,L.P.;Lü,J.Y.Acta Phys.-Chim.Sin.2013,29,2095.[彭敏君,路贵斌,陈网桦,陈利平,吕家育.物理化学学报,2013,29,2095.]doi: 10.3866/PKU.WHXB201307122
(24)Casey,C.P.;Singer,S.W.;Powell,D.R.;Hayashi,R.K.; Kavana,M.J.Am.Chem.Soc.2001,123(6),1090.
(25)Zhu,X.Q.;Cao,L.;Liu,Y.;Yang,Y.;Lu,J.Y.;Wang,J.S.; Cheng,J.P.Chem.-Eur.J.2003,9(16),3937.
(26)Hansch,C.;Leo,A.;Taft,R.W.Chem.Rev.1991,91(2),165.
(27)Cao,C.T.;Wei,B.Y.;Cao,C.Z.Acta Phys.-Chim.Sin.2015, 31,204.[曹朝暾,魏佰影,曹晨忠.物理化学学报,2015,31, 204.]doi:10.3866/PKU.WHXB201412191
(28)Hassan,R.M.;Alaraifi,A.;Fawzy,A.;Zaafarany,I.A.; Khairou,K.S.;Ikeda,Y.;Takagi,H.D.J.Mol.Catal.AChem.2010,332,138.
Kinetics of Acid-Catalyzed Smiles Rearrangement of 2,6-Dimethoxy-2-pyrimidinyloxy-N-arylbenzylamine Derivatives
ZHANG Pei-Zhi1,2,*YE Mei-Jun3HU Wei-Lian1WU Jun4,*
(1SchoolofBiologicalandChemicalEngineering,ZhejiangUniversityof Scienceand Technology,Hangzhou 310023,P.R.China;2Key Laboratory of Recycling and Eco-treatment of Waste Biomass of Zhejiang Province,Zhejiang University of Science and Technology,Hangzhou 310023,P.R.China;3Hangzhou Tea Research Institute,China COOP,Hangzhou 310016,P.R. China;4Department of Chemistry,Zhejiang University,Hangzhou 310027,P.R.China)
The kinetics of the acid-catalyzed Smiles rearrangement reactions of 2,6-dimethoxy-2-pyrimidinyloxy-N-arylbenzylamine derivatives was investigated.The effects of initial concentrations of hydrochloric acid,solvent, temperature,and substituent on reaction rates were examined.The results show that the rates increase with an increase in the initial concentration of hydrochloric acid.The reactivity order is CH3OH>C2H5OH> CH3SOCH3>CH3CN in a single solvent,but rates markedly increase in mixed CH3OH/H2O(1:1,V/V)and the apparent reaction rate constant(kobs)is 5.27 times that of methanol.The rates for the derivatives are found to increase with an increase in temperature at 25-45°C,and no significant differences in activation energy(73.99-76.92 kJ∙mol-1),activation enthalpy(71.57-74.38 kJ∙mol-1),and Gibbs free energy(81.51-85.77 kJ∙mol-1) are observed between them,except that there is difference in activation entropy(-24.38--47.11 J∙K-1∙mol-1). There is a good linear relationship between substituents and the apparent reaction rate constants,and it is speculated that electron-withdrawing groups in the benzene ring will increase the reaction rates.A relevantreaction mechanism is suggested.
Kinetics;Reaction mechanism;2,6-Dimethoxy-2-pyrimidinyloxy-N-arylbenzylamine derivatives;Smiles rearrangement;Acid-catalyzed reaction
August 24,2015;Revised:December 7,2015;Published on Web:December 8,2015.
O643
*Corresponding authors.ZHANG Pei-Zhi,Email:zhangpz@zust.edu.cn;Tel:+86-571-85070370.WU Jun,Email:wujunwu@zju.edu.cn.
The project was supported by the National Natural Science Foundation of China(31471807)and Special Fund forAgro-scientific Research in the Public Interest,China(201403030).
国家自然科学基金(31471807)和公益性行业(农业)科研专项(201403030)资助
©Editorial office ofActa Physico-Chimica Sinica
