莠去津对中华绒螯蟹精子LDH、ACP活性的影响
2016-11-07穆淑梅樊高君张才达王海玲康现江
穆淑梅,樊高君,张才达,王海玲,康现江
(河北大学 生命科学学院,河北 保定 071002)
莠去津对中华绒螯蟹精子LDH、ACP活性的影响
穆淑梅,樊高君,张才达,王海玲,康现江
(河北大学 生命科学学院,河北 保定071002)
为了评估莠去津对雄性中华绒螯蟹的生殖毒性,以成熟雄性中华绒螯蟹为材料,采用莠去津梯度(0.001、0.01、0.1、1 mg/L)暴露方式进行体内染毒2周,通过分光光度法和聚丙烯酰胺凝胶电泳酶谱法,分析中华绒螯蟹精子中乳酸脱氢酶(LDH)和酸性磷酸酶(ACP)的活性,比较其催化能力的变化.结果显示,0.1 mg/L莠去津处理组精子的LDH、ACP比活力是所有组别中最高的,且显著高于对照组(P<0.05);1 mg/L的次之,但同2个低质量浓度组(0.001、0.01 mg/L)的一样,均较对照组差异不显著(P>0.05).凝胶电泳后活性染色分析结果显示2种酶的催化能力的变化与分光光度法结果一致.实验结果表明,一定质量浓度的莠去津对雄性中华绒螯蟹具生殖毒性,可为莠去津对人类生殖健康的影响提供参考数据.
莠去津;中华绒螯蟹;精子;乳酸脱氢酶(LDH);酸性磷酸酶(ACP)
近年来,随着环境污染日益严重,环境与生殖健康越来越受到人们的关注.李卫华等[1]在分析中国环境对生殖健康的危害现状时指出,中国男性精液质量不断下降,直接导致生育能力降低;而与国民生计有关的6~7万种化学物质中20%具有生殖毒性.
莠去津(atrazine,ATR)作为一种高效除草剂被广泛应用,但是其残效期长、水溶性较大,可随地表径流进入河流、湖泊,对地下水和地表水造成污染.目前,莠去津已成为世界公认的环境内分泌干扰物,对人类和其他动物的生殖系统、内分泌系统、免疫系统等造成负面影响[2-3].
中华绒螯蟹(Eriocheirsinensis)俗称河蟹、大闸蟹,是中国传统名贵水产品之一,养殖范围更是遍布全国.研究表明,莠去津干扰中华绒螯蟹蜕皮激素[4]、蜕皮抑制激素[5]的分泌,甚至造成血淋巴细胞的DNA损伤[6].本实验通过分光光度法和聚丙烯酰胺凝胶电泳酶谱法分析、检测莠去津暴露后中华绒螯蟹精子中乳酸脱氢酶(LDH)、酸性磷酸酶(ACP)的活性变化,评估莠去津对雄性中华绒螯蟹的生殖毒性,为该除草剂对人类生殖健康的影响提供参考数据.
1 材料与方法
1.1材料
正常性成熟雄性中华绒螯蟹购自河北省白洋淀,体质量平均为(121.2±3.2)g.实验动物暂养于实验室水族箱中,水深6~8 cm,每日早晚各投喂1次,每2天换水1次.投喂饵料为玉米和虾混合物.
1.2试剂及仪器
主要试剂:莠去津(质量分数>99%,Sigma);丙烯酰胺、甲叉双丙烯酰胺、NAD、NBT、PMS(Biotopped);Tris(BBI life sciences);通用蛋白裂解/抽提试剂、BCA蛋白质量浓度测定试剂盒(博迈德生物科技有限公司);乳酸脱氢酶活性测定试剂盒、酸性磷酸酶活性测定试剂盒(南京建成生物科技有限公司).其余试剂均为国产分析纯.
主要仪器:微型电动组织匀浆机(Kimble),2-16PK高速冷冻离心机(Sigma),电热恒温水浴锅(上海启胜仪器有限公司),DYY-6C恒流稳压电泳仪(北京市六一仪器厂),24DN电泳槽(北京市六一仪器厂),凝胶成像系统(Bio-Rad),Filter Max F5多功能酶标仪(Molecular Devices).
1.3方法
1.3.1莠去津梯度暴露
成熟雄性中华绒螯蟹于实验室暂养7~10 d,以便其适应实验室的环境.挑选体型均匀且活跃的中华绒螯蟹为实验材料.在玻璃水族箱中加入3 L曝气水(每L水含海水晶20 g)和莠去津储液,使莠去津的终质量浓度分别为0.001、0.01、0.1、1 mg/L,对照组以dd H2O代替莠去津,每组设置3个平行处理.莠去津暴露时间2周.
1.3.2精荚(子)蛋白制备及质量浓度测定
解剖莠去津处理后的成熟雄性中华绒螯蟹,取储精囊置于预冷的无钙人工海水中,用手术剪剪碎至无明显块状组织后,于冰上静置10 min,弃去上清液,再次加入预冷的无钙人工海水,清洗精荚,重复3次.将清洗后的精荚转入离心管中,4 ℃,3 000 r/min,离心5 min,弃上清液,沉淀即为精荚(内含精子).
按1 g精荚加入1 mL组织裂解液的比例,将精荚和组织裂解液混合,微型电动组织匀浆机低温(冰浴)匀浆2 min,冰上静置5 min,使组织充分裂解.4 ℃,1 4 000 r/min,离心20 min,收集上清液即为精荚(子)蛋白.
按BCA蛋白质量浓度测定试剂盒说明书的操作步骤测定精荚(子)蛋白质量浓度,以计算分光光度法和聚丙烯酰胺凝胶电泳的加样量.
1.3.3分光光度法测定酶的比活力
分别按照乳酸脱氢酶活性测定试剂盒、酸性磷酸酶活性测定试剂盒说明书测定莠去津暴露后中华绒螯蟹精子乳酸脱氢酶、酸性磷酸酶比活力.
乳酸脱氢酶酶活力定义:每g组织蛋白在37 ℃反应条件下与基质作用15 min,反应体系中产生1 μmol丙酮酸为1个酶活力单位.比活力(U/g)计算公式参见乳酸脱氢酶活性测定试剂盒(南京建成生物技术有限公司)说明书.
酸性磷酸酶酶活力定义:每g组织蛋白在37 ℃与基质作用30 min产生1 mg酚为1个活力单位.比活力(U/g)计算公式参见酸性磷酸酶活性测定试剂盒(南京建成生物技术有限公司)说明书.
1.3.4聚丙烯酰胺凝胶电泳法分析酶活性
采用质量分数7.5%的分离胶、4%浓缩胶,进行聚丙烯酰胺凝胶电泳.根据所测得的蛋白质量浓度,计算每组蛋白上样量,确保上样后每组总蛋白含量相同.
电泳完毕,取出凝胶分别置于事先配制好的乳酸脱氢酶、酸性磷酸酶特异显色液中,37 ℃恒温孵育1.5 h,待凝胶上出现明显条带后,即可弃去显色液.用dd H2O漂洗凝胶后加入体积分数7%的冰醋酸固定.
用凝胶成像系统对凝胶进行呈像并拍照.将图片上的特异显色条带用Quantity One软件进行分析,以便分析莠去津对中华绒螯蟹精子中乳酸脱氢酶、酸性磷酸酶活性的影响.
1.3.5数据分析
数据以平均数±标准差(M±SD)表示.利用SPSS19.0统计分析软件进行单因素方差分析,采用Duncan多重比较分析各组间均数的差异显著性.P<0.05差异显著.
2 结果
2.1莠去津对中华绒螯蟹精子乳酸脱氢酶比活力的影响
将测得的蛋白质量浓度和样品的吸光值代入乳酸脱氢酶比活力计算公式中,得到对照组和各莠去津处理组乳酸脱氢酶比活力之间的差异(表1).对获得的数据进行统计分析,发现在所有组别中,0.1 mg/L组精子的乳酸脱氢酶比活力最高,为227.85 U/g,显著高于对照组(P<0.05);1 mg/L组的次之,为222.01 U/g,但相比对照组差异不显著(P>0.05);而2个较低质量浓度组0.001 mg/L和0.01 mg/L与对照组相比,中华绒螯蟹精子乳酸脱氢酶比活力亦无显著变化,0.001 mg/L组酶比活力基本与对照组相同,0.01 mg/L组酶比活力略高,为181.47 U/g.

表1 莠去津暴露后中华绒螯蟹精子乳酸脱氢酶(LDH)比活力的变化
标有不同字母者表示组间差异显著(P<0.05);标有相同字母者表示组间差异不显著(P>0.05).
聚丙烯酰胺凝胶电泳结果(图1)显示乳酸脱氢酶特异性染色条带.将聚丙烯酰胺凝胶电泳所得乳酸脱氢酶酶谱用Quantity One软件分析,对其灰度赋值后进行数据统计分析.结果(图2)显示,0.1 mg/L组乳酸脱氢酶活性仍是所有组别中最高的,且显著高于对照组(P<0.05);1 mg/L组的酶活同样是次高,但相较于对照组并未表现出显著差异(P>0.05);0.001 mg/L和0.01 mg/L组与对照组相比亦无显著变化(P>0.05).分析结果与分光光度法测定结果一致.
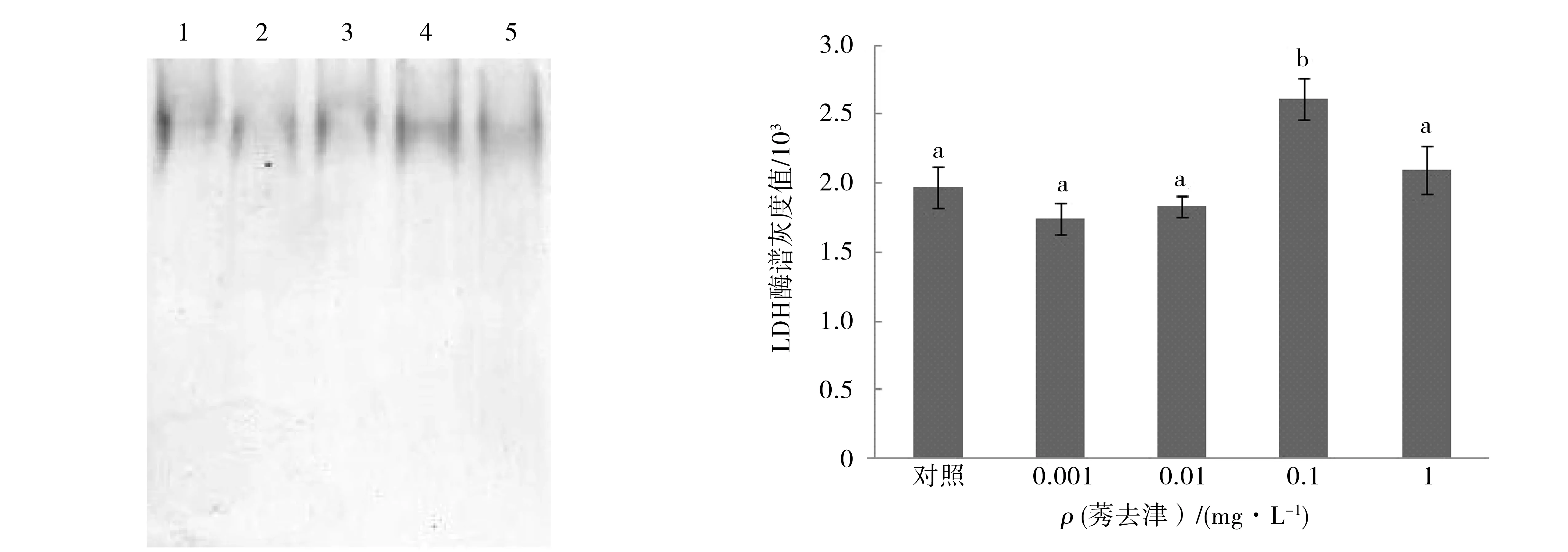
1.对照;2.0.001 mg/L;3.0.01 mg/L; 标有不同字母者表示组间差异显著(P<0.05);标有相同字4.0.1 mg/L;5.1 mg/L. 母者表示组间差异不显著(P>0.05).图1 莠去津处理后中华绒螯蟹精子乳酸脱氢酶(LDH)聚 图2 聚丙烯酰胺凝胶电泳检测莠去津对中华绒螯蟹精丙烯酰胺凝胶电泳酶谱子乳酸脱氢酶(LDH)活性的影响(n=6)Fig.1 Polyacrylamide gel electrophresis results of LDH in Fig.2 Effects of atrazine on the activity of LDH in spermatozoaEriocheir sinensis spermatozoa exposed to atrazineof Eriocheir sinensis detected by polyacrylamide gel electrophresis
2.2莠去津对中华绒螯蟹精子酸性磷酸酶比活力的影响
莠去津暴露后,利用分光光度法测定中华绒螯蟹精子酸性磷酸酶的活性,如表2.数据分析结果显示:0.1 mg/L组中华绒螯蟹精子酸性磷酸酶比活力为23.93 U/g,显著高于对照组(P<0.05).其他暴露组均较对照组酶活有所升高,但是均未产生显著差异(P>0.05).
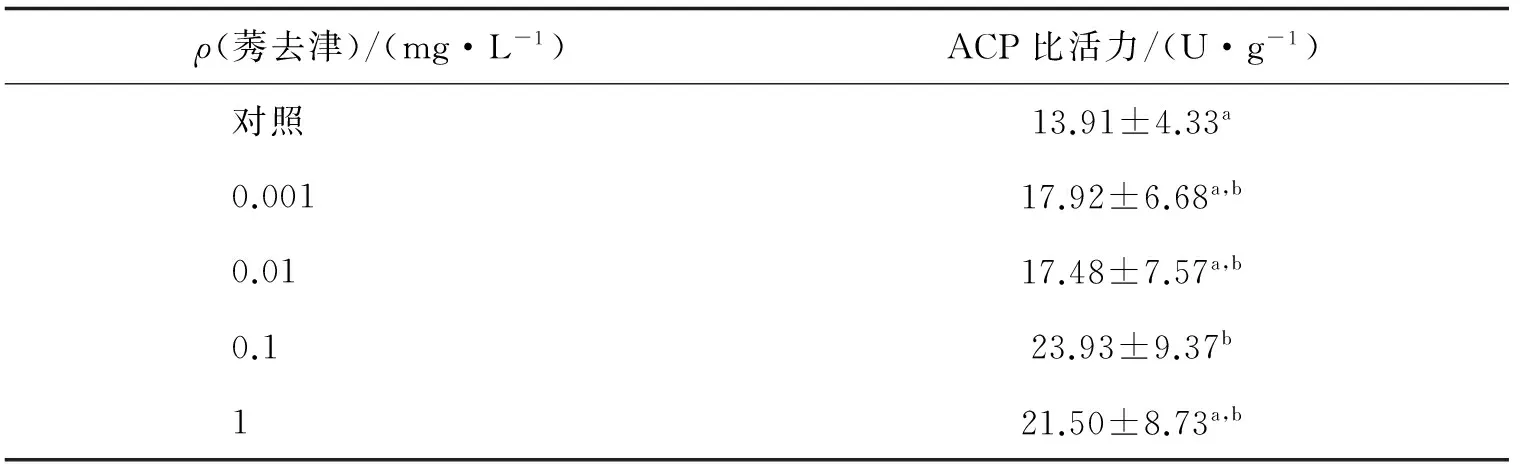
表2 莠去津暴露后中华绒螯蟹精子酸性磷酸酶(ACP)比活力的变化
标有不同字母者表示组间差异显著(P<0.05);标有相同字母者表示组间差异不显著(P>0.05).
通过聚丙烯酰胺凝胶电泳获得中华绒螯蟹精子中酸性磷酸酶酶谱(图3),同样利用Quantity One软件进行灰度赋值,并对数据进行统计分析,结果(图4)表明:莠去津暴露后,0.1 mg/L组中华绒螯蟹精子中酸性磷酸酶活性亦在所有组别中最高,且显著高于对照组(P<0.05),其他处理组酸性磷酸酶活性均无显著变化(P>0.05).分析结果与分光光度法测定结果相符.

1.对照;2.0.001 mg/L;3.0.01 mg/L; 标有不同字母者表示组间差异显著(P<0.05);4.0.1 mg/L;5.1 mg/L. 标有相同字母者表示组间差异不显著(P>0.05).图3 莠去津处理后中华绒螯蟹精子酸性磷酸图4 酶谱法分析莠去津对中华绒螯蟹精子酸性磷酸酶(ACP)酶(ACP)聚丙烯酰胺凝胶电泳酶谱 活性的影响(n=6)Fig.3 Polyacrylamide gel electrophresis results of ACP Fig.4 Effects of atrazine on the activity of ACP of Eriocheir sinensis in Eriocheir sinensis spermatozoa exposed to atrazine sperm detected by polyacrylamide gel electrophresis(n=6)
3 讨论
本实验研究莠去津对中华绒螯蟹精子乳酸脱氢酶、酸性磷酸酶活性的影响,精子取自中华绒螯蟹储精囊,进入到储精囊中的精子已完全成熟,紧密排布在精荚中[7],精子的代谢活动也主要发生在精荚中[8].中华绒螯蟹的精荚由精子、精荚基质、精荚壁组成,精荚基质为精巢分泌物,而精荚壁实质上也是由外周的精荚基质浓缩而成[7].因此,中华绒螯蟹精荚中主要成分是精子,提取精荚并破碎匀浆后获得的蛋白也基本能反映精子中蛋白组成,故本研究从储精囊中获得精荚后即制备蛋白提取液用于酶活检测,而并未再破碎精荚获得纯精子后再制备其蛋白提取液,这样减少了处理步骤,以减少对酶活的影响.
在检测酶活性方面,分光光度法是常用的方法之一.本实验中,采用分光光度法检测了莠去津处理后2种酶比活力的变化.比活力反应酶的纯度,其大小可用来比较每单位质量蛋白质的催化能力[9]336.早在1980年,Heussen和Dowdle就提出了用聚丙烯酰胺凝胶电泳酶谱法检测尿激酶等纤溶酶原激活剂活性的方法,在他们的实验中最低酶活检出量为1 mU[10].Huang等[11]改变底物浓度,尿激酶的检出量甚至可以低至0.39 μU(约0.78 ng).此外,不同条件下(如温度、pH等)的酶活性比较,亦可以通过聚丙烯酰胺凝胶电泳酶谱法进行分析检测[12].实验中采用上述2种方法分析莠去津体内暴露后中华绒螯蟹精子乳酸脱氢酶、酸性磷酸酶活性的变化,2种方法所得结果互相印证,可增加毒理实验结果的可靠性.
乳酸脱氢酶是一种糖酵解酶,以NADH为供氢体,催化丙酮酸羰基的还原生成乳酸,与细胞的能量代谢有关.精子乳酸脱氢酶在精子发生过程中转录、表达,使发育中的精子能够利用丙酮酸作为能源[13]84.精子乳酸脱氢酶不仅与精子的发生有关,而且与精子的代谢、获能和受精过程密切相关[14-15].因此,乳酸脱氢酶活性可以作为检测精子质量的重要指标.
实验中采用分光光度法和聚丙烯酰胺凝胶电泳酶谱法,测定、分析莠去津体内暴露后中华绒螯蟹精子乳酸脱氢酶活性的变化,2种检测方法结果趋势相同,均为0.1 mg/L处理组酶活最高,且与对照组相比差异显著(P<0.05).1 mg/L处理组的酶活次之,但同2个低质量浓度组(0.001、0.01 mg/L)的一样,均较对照组差异不显著(P>0.05).实验结果表明,0.1 mg/L的莠去津可造成中华绒螯蟹精荚中精子代谢异常.乳酸脱氢酶比活力升高,催化能力增强,将导致其参与的氧化还原反应的产物乳酸在精子内的蓄积,使精子内部pH值降低.研究表明,Ca2+在动物精子顶体反应的离子调控中起主导作用,哺乳动物中Ca2+内流可导致H+外流,精子内部pH升高,诱发顶体反应[13]102.据此,实验中,由于乳酸脱氢酶活性的升高导致的精子内部pH值降低,可影响中华绒螯蟹精子的顶体反应,不利于精卵结合.
酸性磷酸酶是一类在酸性条件下催化磷酸酯类水解的酶,可参与机体的各种代谢过程,如渗透调节,发育分化,蛋白质合成,营养物质的吸收与转运,性腺发育等[16-17];同时,精子中酸性磷酸酶活性变化会引起精子顶体反应异常,因此,精子酸性磷酸酶活力水平通常是判断精子活力的标准之一[18].
中华绒螯蟹成熟精子中的酸性磷酸酶主要分布在顶体管中,与精卵结合时精子的顶体反应有关[19].本实验分析测定了莠去津体内暴露后中华绒螯蟹精子中酸性磷酸酶活性的变化,2种方法检测显示0.1 mg/L处理组精子酸性磷酸酶活性最高,且显著高于对照组(P<0.05);其余各处理组相较对照组无显著差异(P>0.05).就人类而言,男性个体生殖健康检查指标中显示精子酸性磷酸酶活性升高与细胞受损的程度呈正相关;同时精子顶体中酸性磷酸酶酶活性升高,也反应出精子发生顶体反应的速度加快[21-22].本实验结果中,0.1 mg/L莠去津组中华绒螯蟹成熟精子酸性磷酸酶活性升高,预示着该质量浓度莠去津使中华绒螯蟹精子受损,加快了其顶体反应速度.精子顶体反应是精卵结合的先决条件,过快或过慢的顶体反应过程均会造成精卵结合障碍,从而影响受精作用.
本实验乳酸脱氢酶、酸性磷酸酶的结果均呈现出莠去津暴露后的倒“U”形毒性效应,即毒性效应出现在中间质量浓度组.毒理学研究中受试物的“U”形效应和倒“U”形效应是比较常见的现象,如焦满静等[4]考察了莠去津作用后中华绒螯蟹血清中蜕皮激素含量的变化,发现仅0.1 mg/L质量浓度组对血清中蜕皮激素含量影响显著,而0.001、0.01 mg/L组和1 mg/L组并未显现毒性效应,亦符合倒“U”形效应规则.
中国关于莠去津生产企业污染物的排放标准中规定,莠去津排放不得超过1 mg/L[22].本实验中,一定质量浓度的莠去津(0.1 mg/L)对雄性中华绒螯蟹显现出生殖毒害作用,提示应加强该农药生产排污后的监管与监测,同时严格控制该除草剂使用时的施药质量浓度.
[1]李卫华,王健,丁训城.新世纪中国环境与生殖健康的状况和展望[J].世界科学,2010(2):29-30.DOI:10.3969/j.issn.1000-0968.2010.02.014.
[2]郑磊,张依章,张远,等.太子河流域莠去津的空间分布及风险评价[J].环境科学,2014,35(4):1263-1270.DOI:10.13227/j.hjkx.2014.04.008.
ZHENG Lei,ZHANG Yizhang,ZHANG Yuan,et al.Spatial distribution and risk assessment of atrazine in Taizi River Basin,China[J].Environmental Science,2014,35(4):1263-1270.DOI:10.13227/j.hjkx.2014.04.008.
[3]SONG Y,JIA Z C,CHEN J Y,et al.Toxic effects of atrazine on reproductive system of male rats[J].Biomedical and Environmental Sciences,2014,27(4):281-288.DOI:10.3967/bes2014.050.
[4]焦满静,曹佳培,陈勤娜,等.莠去津对中华绒螯蟹蜕皮激素分泌的影响[J].河北大学学报(自然科学版),2013,33(2):181-184.DOI:10.3969/j.issn.1000-1565.2013.02.013.
JIAO Manjing,CAO Jiapei,CHEN Qinna,et al.Effects of atrazine on ecdyson secretion inEriocheirsinensis[J].Journal of Hebei University(Natural Science Edition),2013,33(2):181-184.DOI:10.3969/j.issn.1000-1565.2013.02.013.
[5]张志甫,穆淑梅,康现江,等.莠去津对中华绒螯蟹蜕皮抑制激素表达的影响[J].水产科学,2011,30(4):225-228.DOI:10.3969/j.issn.1003-1111.2011.04.009.
ZHANG Zhifu,MU Shumei,KANG Xianjiang,et al.Effects of atrazine exposoure on molt-inhibiting hormone expression in Chinese mitten-handed crab,Eriocheirsinensis[J].Fisheries Science,2011,30(4):225-228.DOI:10.3969/j.issn.1003-1111.2011.04.009.
[6]穆淑梅,康现江,张志甫,等.莠去津慢性染毒对河蟹血淋巴细胞DNA的影响[J].生态学杂志,2010,29(6):1240-1244.
MU Shumei,KANG Xianjiang,ZHANG Zhifu,et al.Impacts of ateazine chronic poisoning on hemolymph DNA ofEriocheirsinensis[J].Chinese Journal of Ecology,2010,29(6):1240-1244.
[7]王群,赵云龙,赖伟,等.中华绒螯蟹精荚形成的超微结构研究[J].华东师范大学学报,2000,2000(3):98-103.DOI:10.3969/j.issn.1000-5641.2000.03.017.
WANG Qun,ZHAO Yunlong,LAI Wei,et al.Ultrastructural study on spermatophore formation inEriocheirsinensisH.Milne Edwards[J].Journal of East China Normal University,2000,2000(3):98-103.DOI:10.3969/j.issn.1000-5641.2000.03.017.
[8]王群,赵云龙,陈立侨.中华绒螯蟹雄性生殖系统生化组成及精子代谢[J].水产学报,2002,26(5):411-416.DOI:10.3321/ j.issn:1000-0615.2002.05.005.WANG Qun,ZHAO Yunlong,CHEN Liqiao.Biochemical composition and sperm metabolism in the reproductive system of the male,Eriocheirsinensis[J].Journal of Fisheries of China,2002,26(5):411-416.DOI:10.3321/j.issn:1000-0615.2002.05.005.
[9]王镜岩,朱圣庚,徐长法.生物化学[M].3版.北京:高等教育出版社,2002.
[10]HEUSSEN C,DOWDLE A B.Electrophoretic analysis of plasminogen activators in polyacrylamide gels containing sodium dodecyl sulfate and copolymerized substrates [J].Analytical Biochemistry,1980,102:196-202.DOI:10.1016/0003-2697(80) 90338-3.
[11]HUANG M X,YU X Q,YE Y.A study of fibrin zymography method for the assay of plasminogen activators [J].Advanced Materials Research,2012,569:789-794.DOI:10.4028/www.scientific.net/AMR.569.789.
[12]SANTOS A F,PIRES F,JESUS H E.Detection of proteases fromSporosarcinaaquimarinaandAlgoriphagusantarcticusisolated from Antarctic soil [J].Anais da Academia Brasileira de Ciências,2015,87(1):1-11.DOI:10.1590/0001-3765201520 130519.
[13]张红卫.发育生物学[M].3版.北京:高等教育出版社,2013.
ZHANG Hongwei.Developmental Biology [M].3rd ed.Beijing:Higher Education Press,2013.
[14]刘雅峰,欧建平,周灿权,等.精浆/精子乳酸脱氢酶活性与男性不育的相关性[J].中国优生与遗传杂志,2010,18(2):121-122.
LIU Yafeng,OU Jianping,ZHOU Canquan,et al.Correlation of activity of seminal plasma or spermatozoa lactate dehydrogenase isoenzyme and male infertility [J].Chinese Journal of Birth Health and Heredity,2010,18(2):121-122.
[15]刘新雄.乳酸脱氢酶同工酶X与男性不育关系的初步研究[J].中国优生与遗传杂志,2011,19(3):103-104.
LIU Xinxiong.Study of relation ship between lactated ehydrogenase X isoenzyme and infertile man [J].Chinese Journal of Birth Health and Heredity,2011,19(3):103-104.
[16]EL-ASWAD A F,BADAWY M E I.Inhibition kinetics of acid and alkaline phosphatases by atrazine and methomyl pesticides[J].Journal of Environmental Science and Hhealth,Part B,2015,50:484-491.DOI:10.1080/03601234.2015.1018759.
[17]JIANG H X,YANG H M,KONG X H,et al.Response of acid and alkaline phosphatase activities to copper exposure and recovery in freshwater fishCarassiusauratusgibeliovar[J].Life Science Journal,2012,9(3):233-245.
[18]黄新河,冯兴,刘鑫,等.瘦肉型猪[PIC344]精液酸性磷酸酶部分性质研究[J].四川动物,2005,24(1):17-21.DOI:10.396 9/j.issn.1000-7083.2005.01.005.
HUANG Xinhe,FENG Xing,LIU Xin,et al.Partial characterisitcs of acid phosphatase from sperm of PIC pigs (PIC344) [J].Sichuan Journal of Zoology,2005,24(1):17-21.DOI:10.3969/j.issn.1000-7083.2005.01.005.
[19]刘桂荣,康现江,郭明申,等.中华绒螯蟹精子形成过程酸性磷酸酶的分布特征[J].台湾海峡,2006,25(1):25-29.
LIU Guirong,KANG Xianjiang,GUO Mingshen,et al.Study on the localization of acid phosphatase activity during sperm iogenesis inEriocheirsinensis[J].Journal of Oceanography in Taiwan Strait,2006,25(1):25-29.
[20]张韫,谢琪璇,潘善培,等.人精子顶体反应 3 种检测方法的比较与评价[J].中华男科学杂志,2005,11(6):41-421.DOI:10.3969/j.issn.1009-3591.2005.06.005.
ZHANG Yun,XIE Qixuan,PAN Shanpei,et al.Comparison of three methods for evaluating acrosome reaction in human spermatozoa [J].National Journal of Andrology,2005,11(6):419-421.DOI:10.3969/j.issn.1009-3591.2005.06.005.
[21]杨麦贵,杨阳,郝晓柯,等.男性不育者精液中一氧化氮和顶体酶、透明质酸酶、酸性磷酸酶的变化[J].检验医学,2005,20(5):431-433.DOI:10.3969/j.issn.1673-8640.2005.05.008.
YANG Maigui,YANG Yang,HAO Xiaoke,et al.Determination of nitric oxide,acrosome enzyme,hyaluronidase and acid pho sphatase in human semen [J].Laboratory Medicine,2005,20(5):431-433.DOI:10.3969/j.issn.1673-8640.2005.05.008.
[22]GB21523—2008,中华人民共和国国家标准:杂环类农药工业水污染物排放标准[S].
GB21523—2008,PRC national standards:effluent standards of pollutants for heterocyclic pesticides industry [S].
(责任编辑:赵藏赏)
Effects of atrazine on the enzymatic activities of LDH and ACP in spermatozoa of Eriocheir sinensis
MU Shumei,FAN Gaojun,ZHANG Caida,WANG Hailing,KANG Xianjiang
(College of Life Sciences,Hebei University,Baoding 071002,China)
In order to evaluate the reproductive toxicities of atrazine on male Chinese mitten handed crab,Eriocheirsinensis,mature male crabs were treated with 0.001,0.01,0.1,1 mg/L of atrazine for 2 weeks.The enzymatic activities of lactate dehydrogenase (LDH) and acid phosphatase (ACP) in the spermatozoa of the crabs were measured by spectrophotometry and polyacrylamide gel electrophresis.As for 0.1 mg/L atrazine groups,the activities of LDH and ACP were the highest and they were also significantly higher than the control groups (P<0.05).There was no significant difference in the activities of LDH and ACP between the control and the atrazine treated groups (0.001,0.01,1 mg/L;P>0.05).The changes of the activities of LDH and ACP after atrazine treatment detected by polyacrylamide gel electrophresis and spectrophotometry were consistent with each other.The results indicate that atrazine exposure affects the reproductivity of maleE.sinensis.Our study can provide reference data for atrazine impact on human reproductive health.
atrazine;Eriocheirsinensis;spermatozoa;lactate dehydrogenase (LDH) ;acid phosphatase (ACP)
10.3969/j.issn.1000-1565.2016.02.009
2015-07-10
国家自然科学基金资助项目(31202000,31272309);河北省自然科学基金资助项目(C2011201028);河北大学博士基金资助项目(2012-239);河北省重点实验室项目(14967611D);河北省生物学强势特色学科建设项目;河北大学中西部高校提升综合实力工程项目
穆淑梅(1972—),女,河北曲阳人,河北大学副教授,主要从事生殖毒理学研究.E-mail:shumeimu@126.com
康现江(1964—),男,河北邯郸人,河北大学教授,博士生导师,主要从事细胞发育分化及其调控方面的研究.
E-mail:xjkang@hbu.edu.cn
X503.225;Q959.223.63
A
1000-1565(2016)02-0162-07
