复方甘草酸苷对皮肤斑贴试验的影响
2016-11-06郭焱孙晓东施辛刘润秋经晶陈晶晶沈悦俞翠萍闫志华陈小建陈玲玲
郭焱 孙晓东 施辛 刘润秋 经晶 陈晶晶 沈悦 俞翠萍 闫志华 陈小建 陈玲玲
215004苏州大学附属第二医院皮肤科[郭焱(现在江苏省盐城市第三人民医院皮肤科,224002)、孙晓东(现在河北省唐山市丰南区妇幼保健院皮肤科)、施辛、刘润秋(现在江苏省盐城市第一人民医院皮肤科)、经晶、陈晶晶、沈悦、俞翠萍、闫志华(现在苏州大学附属第二医院高新区医院皮肤科)];苏州市立医院本部皮肤科(陈小建、陈玲玲)
·论著·
复方甘草酸苷对皮肤斑贴试验的影响
郭焱 孙晓东 施辛 刘润秋 经晶 陈晶晶 沈悦 俞翠萍 闫志华 陈小建 陈玲玲
215004苏州大学附属第二医院皮肤科[郭焱(现在江苏省盐城市第三人民医院皮肤科,224002)、孙晓东(现在河北省唐山市丰南区妇幼保健院皮肤科)、施辛、刘润秋(现在江苏省盐城市第一人民医院皮肤科)、经晶、陈晶晶、沈悦、俞翠萍、闫志华(现在苏州大学附属第二医院高新区医院皮肤科)];苏州市立医院本部皮肤科(陈小建、陈玲玲)
目的 探讨复方甘草酸苷制剂对皮肤斑贴试验的影响。方法 选取皮肤斑贴试验镍阳性(++)或甲醛阳性(++)患者84例,分别给予复方甘草酸苷制剂中剂量干预(复方甘草酸苷片50 mg每天3次)和高剂量干预(复方甘草酸苷片75 mg每天3次)均2周后重复皮肤斑贴试验以及静脉途径干预(复方甘草酸苷注射液,60 ml/d)1周后重复皮肤斑贴试验。应用SPSS 19.0版软件进行秩和检验,从斑贴试验定性和反应程度两个角度分别进行统计学分析。结果 中剂量干预完成研究81例患者,第2次斑贴试验时,66例++,13例+,2例+++,无阴性结果者。两次斑贴试验结果定性无变化;反应程度Z=-2.84,P=0.005,差异有统计学意义。高剂量干预完成研究82例患者,第2次斑贴试验时,37例++,36例+,9例阴性。两次斑贴试验结果:定性Z=-3.000,P=0.003;反应程度Z=-6.247,P=0.000,差异均有统计学意义。静脉途径干预完成研究58例患者,第2次斑贴试验时,12例++,10例+,36例阴性。两次斑贴试验结果:定性Z=-6.000,P=0.000;反应程度Z=-6.289,P=0.000,差异均有统计学意义。结论 复方甘草酸苷制剂口服高剂量和静脉途径应用时,对皮肤斑贴试验反应有明显抑制作用。建议做斑贴试验前应停此药2周。
皮炎,接触性;斑片试验;镍;甲醛;复方甘草酸苷
皮肤斑贴试验是皮肤科重要的辅助检查手段,常用于寻找皮炎湿疹类皮肤病的变应原。实施皮肤斑贴试验有许多限制条件,其中包括试验前2周停服激素,试验前3天停用抗组胺药物。以往临床试验证实,常规剂量和高剂量抗组胺药物对斑贴试验无影响[1-2]。目前皮肤科临床使用复方甘草酸苷制剂具有一定的抗炎效果,在斑贴试验限制条件中[3]未提及复方甘草酸苷制剂是否必须回避。为此,我们设计了不同剂型及剂量的复方甘草酸苷制剂作为干预因子,以期明确其对皮肤斑贴试验的影响。
对象与方法
1.受试者资料:2012年9月至2015年9月,苏州大学附属第二医院、苏州大学附属第二医院高新区医院和苏州市立医院本部三家医院皮肤科门诊皮肤斑贴试验镍阳性(++)或甲醛阳性(++)患者。入选标准:①有皮炎湿疹表现,处于非急性或亚急性状态;②对变应原斑贴试剂中镍或甲醛呈阳性反应;③镍及甲醛过敏与临床表现有强烈关联。研究方案经苏州大学附属第二医院和苏州市立医院本部医学伦理委员会批准,入选患者均签署知情同意书,共84例患者(镍阳性者48例、甲醛阳性者36例)入选本研究3次试验。受试者按就诊顺序排列,其中男31例,女53例,年龄18~66岁,平均36岁(经SPSS 19.0软件Q-Q图检验年龄呈正态分布)。根据国际接触性皮炎研究小组(international contact dermatitis research group,ICDRG)指南,入选者对镍或甲醛变应原反应程度分级为++,排除+和+++患者,排除+是因为判读易产生偏差;排除+++是因为测试局部反应强烈,患者难以接受且与医学伦理相悖。排除标准:①有特应性体质患者;②测试部位有红斑、丘疹、疖肿、糜烂等皮损;③有肝肾功能不全和心脏疾病;④有甘草酸苷制剂过敏史;⑤受试前1个月内有系统用激素史;⑥受试前1周内有免疫调节剂使用史;⑦受试前1个月内有暴晒或接受紫外线照射史。
2.斑贴试验:第1次斑贴试验后分别给予:①中剂量干预:复方甘草酸苷片50mg每天3次口服,2周后重复皮肤斑贴试验;②高剂量干预:复方甘草酸苷片75 mg每天3次口服,2周后重复皮肤斑贴试验;③静脉途径干预:复方甘草酸苷注射液,60 ml/d,1周后重复皮肤斑贴试验。为避免药物蓄积作用参照试验清洗期相关要求,各个剂量剂型干预间隔时间均为2个月。复方甘草酸苷制剂:美能,日本米诺发源制药株式会社生产。斑贴试验变应原由瑞典化学诊断AB公司购入,测试板IQ小室所用材料为惰性聚乙烯材料,按说明书操作。干预后重复斑贴试验部位在背部脊柱第1次斑贴试验阳性相对应的另一侧进行,48 h后揭下,72 h记录皮肤反应并进行评估。
斑贴试验结果判定标准:根据ICDRG判读标准来评估皮肤反应程度[3]:-为阴性,±为可疑阳性(轻度红斑),+为弱阳性(红斑、浸润、可有丘疹),++为强阳性(红斑、浸润、丘疹、水疱),+++为极强阳性(强烈红斑、浸润、大疱)。斑贴试验结果均由同一技术人员判定。
3.统计学方法:数据统计应用SPSS 19.0版软件,用等级资料量样本比较的秩和检验。①斑贴试验是否有反应性质改变的定性角度:编秩方法为-转换为数值0,+、++、+++统一转换为数值1行统计学分析;②斑贴试验反应程度角度:编秩方法为由-、+、++、+++统一转换为数值 0、1、2、3 行统计学分析;③±可疑阳性的处理:择时重做,如果仍为可疑阳性或以下,记阴性;如果阳性或以上,记阳性,同时相应编秩。统计检验采用双侧检验,P<0.05为差异有统计学意义。
结 果
1.完成情况:3例退出中等剂量干预试验(未按时服药2例、出差1例);2例退出高剂量干预试验(出差1例,未按时服药1例);23例受试者不愿参加静脉途径干预试验,3例退出静脉途径干预试验(合并用药1例、未按时完成用药2例)。见表1。
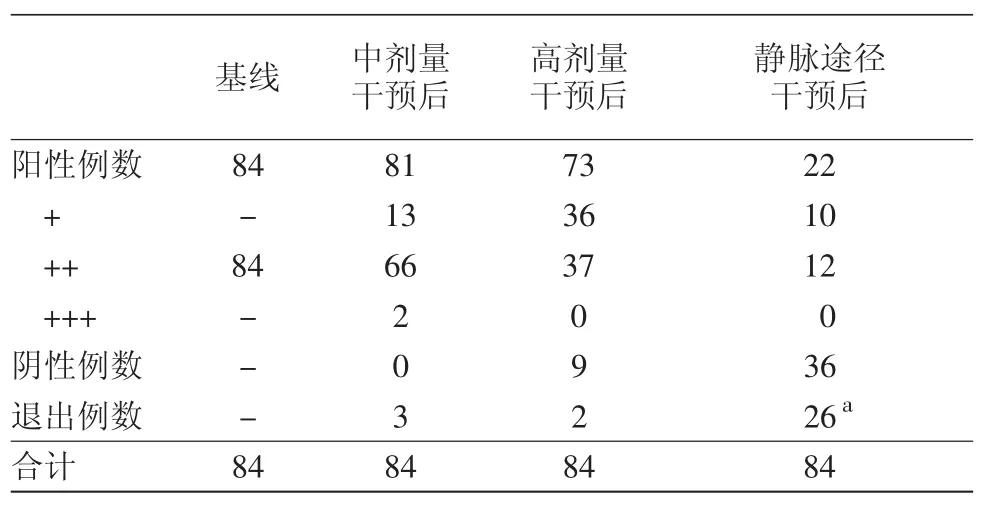
表1 斑贴试验数据(例)
2.结果:①完成中剂量干预试验的81例患者,第2次斑贴试验时,66例为强阳性(++),13例为弱阳性(+),2例为极强阳性(+++),无阴性结果者。两次斑贴试验结果从定性上无阴性结果,故对斑贴试验无影响;从反应程度角度,经过秩和检验,Z=-2.840,P=0.005,差异有统计学意义;②完成高剂量干预试验的82例患者,第2次斑贴试验时,37例为强阳性(++),36例为弱阳性(+),9例为阴性(-)。两次斑贴试验结果:定性 Z=-3.000,P=0.003;反应程度Z=-6.247,P=0.000;差异均有统计学意义;③完成静脉途径干预试验的58例患者,第2次斑贴试验时,12例为强阳性(++),10例为弱阳性(+),36例为阴性(-)。有两次斑贴试验结果:定性Z=-6.000,P=0.000;反应程度 Z=-6.289,P=0.000;差异均有统计学意义。
参考意向性分析原则,推测中途退出的受试者及不愿参加试验者在第2次斑贴试验时反应由++强阳性变为-阴性,纳入两次斑贴试验结果进行统计,其结果为:①中剂量干预:定性Z=-1.732,P=0.083,差异无统计学意义;反应程度Z=-3.252,P=0.001,差异有统计学意义;②高剂量干预:定性 Z=-3.317,P=0.001;反应程度 Z=-6.333,P=0.000;差异均有统计学意义。静脉途径干预:定性角度Z=-7.874,P=0.000;反应程度角度Z=-8.031,P=0.000;差异均有统计学意义。
讨 论
斑贴试验用于Ⅳ型变态反应的病因诊断,是协助诊断变应性接触性皮炎(allergic contact dermatitis,ACD)、查找确定接触变应原的经典试验。在可能影响斑贴试验的药物中,既往我们的研究已显示,常规剂量氯雷他定对硫酸镍阳性皮肤斑贴试验反应程度无抑制作用[1],双倍剂量地氯雷他定对皮肤斑贴试验阳性等级结果无影响[2],并进一步验证了白三烯受体拮抗剂孟鲁司特对甲醛阳性皮肤斑贴试验反应无抑制作用[4],也对常规筛查系列皮肤斑贴试验反应无抑制作用[5]。由于在斑贴试验临床应用专家共识[3]中并未提到在临床上广泛应用于治疗皮炎湿疹类皮肤病的复方甘草酸苷制剂,因此我们设计了不同剂量及剂型的复方甘草酸苷制剂作为干预因子,观察对皮肤斑贴试验的影响。有研究[6]指出,ACD斑贴试验检出阳性抗原比例最多的为硫酸镍[7],可高达20.1%阳性率,同时甲醛为9.7%阳性率,故本研究选择硫酸镍和甲醛作为斑贴试验变应原。
在本研究结果中,复方甘草酸苷中等剂量干预试验从定性角度因未出现阴性结果者,故对斑贴试验结果无影响;但对斑贴试验反应程度有一定影响,能改变(减弱)斑贴试验的反应程度(P<0.01)。在高剂量干预和静脉途径干预试验的复方甘草酸苷制剂从定性角度均出现数例阴性改变,能显著抑制斑贴试验(均P<0.01),从反应程度均能显著改变(减弱)斑贴试验的反应程度(均P<0.01)。为了避免中途退出者对结果造成可能的选择性统计偏差,本研究参考意向性分析原则,所有进入干预的患者都作为临床试验的一部分,不管是否完成研究;推定中途退出的受试者在第2次斑贴试验时反应程度由++变为阴性再进行统计分析,发现各组结论没有改变。
推测其原因:甘草酸苷及代谢产物11β-甘草次酸的化学结构与激素的结构非常类似[8],对人体的激素代谢酶11β-羟基类固醇脱氢酶有强的竞争性抑制作用[9],能竞争性与之结合从而减缓激素的代谢速度,使内源性激素含量增加、作用增强,故用于治疗皮炎湿疹类疾病。其次,ACD因皮肤反复接触过敏原而产生由T淋巴细胞介导的迟发型变态反应性炎症,有树突细胞、朗格汉斯细胞、CD4+Th1和CD8+TCL 等效应性 T 细胞[10]、CD4+CD25+Foxp3+调节性T细胞参与。研究[11-12]显示在这些过程中,复方甘草酸苷除发挥糖皮质激素样作用,还能上调树突细胞的CD40、CD86和MHCⅡ表达,从而增强树突细胞的抗原提呈能力[11];调节Th1/Th2类细胞因子比例[12]。增加 γ 干扰素和 IL-10、减少 IL-4;增强CD4+CD25+Foxp3+的作用;增强Th1效应细胞反应能力,在多个环节均能针对Th1型免疫反应为主导的ACD发挥抗炎作用,尤其是大剂量和静脉应用针对镍阳性(++)或甲醛阳性(++)诱发的ACD表现出一定疗效。本研究提示,复方甘草酸苷类药物患者做斑贴试验前应参照激素停药方法(因其药代动力学为非线性的[9],建议停药 >2周),严格停药之后再进行相关斑贴试验。
[1]黎平,孙晓东,施辛,等.常规剂量氯雷他定对皮肤斑贴试验反应程度的影响[J].中华皮肤科杂志,2011,44(11):765-767.DOI:10.3760/cma.j.issn.0412-4030.2011.11.003.Li P,Sun XD,Shi X,et al.Influences of routine-dose loratadine on the intensity of patch test reaction[J].Chin J Dermatol,2011,44(11):765-767.DOI:10.3760/cma.j.issn.0412-4030.2011.11.003.
[2]Chen XJ,Chen LL,Shi X,et al.The effect of desloratadine on patch test reactions in Chinese patients[J].Asian Pac J Allergy Immunol,2012,30(3):209-213.
[3]中国医师协会皮肤性病学分会过敏与临床免疫专业委员会.斑贴试验临床应用专家共识[J].中华皮肤科杂志,2015,48(1):8-10.DOI:10.3760/cma.j.issn.0412-4030.2015.01.004.Subcommittee on Allergy and Clinical Immunology,Chinese Dermatologist Association.Clinical application of patch test:an expert consensus statement[J].Chin J Dermatol,2015,48(1):8-10.DOI:10.3760/cma.j.issn.0412-4030.2015.01.004.
[4]陈玲玲,陈小建,施辛,等.白三烯受体拮抗剂孟鲁司特对皮肤斑贴试验反应的影响[J].中华皮肤科杂志,2015,48(2):97-99.DOI:10.3760/cma.j.issn.0412-4030.2015.02.009.Chen LL,Chen XJ,Shi X,et al.Effect of a leukotriene receptor antagonist,montelukast,on skin patch test reactions[J].Chin J Dermatol,2015,48(2):97-99.DOI:10.3760/cma.j.issn.0412-4030.2015.02.009.
[5]陈玲玲,陈小建,施辛,等.白三烯受体拮抗剂对常规筛查系列皮肤斑贴试验反应的影响[J].中华皮肤科杂志,2015,48(3):195-196.DOI:10.3760/cma.j.issn.0412-4030.2015.03.015.Chen LL,Chen XJ,Shi X,et al.Influence of a leukotriene receoptor antagonist,montelukast,on patch test reactions to routine screening series of allergens[J].Chin J Dermatol,2015,48 (3):195-196.DOI:10.3760/cma.j.issn.0412-4030.2015.03.015.
[6]温志华,姚煦,王宝玺.中国皮肤科斑贴试验临床应用分析[J].中华皮肤科杂志,2013,46(11):834-836.DOI:10.3760/cma.j.issn.0412-4030.2013.11.021.Wen ZH,Yao X,Wang BX.Clinical application of patch test in dermatology:a retrospective analysis in China[J].Chin J Dermatol,2013,46(11):834-836.DOI:10.3760/cma.j.issn.0412-4030.2013.11.021.
[7]NijhawanRI,JacobSE.Contact alternatives to nickel[J].Dermatitis,2013,24(5):222-226.DOI:10.1097/DER.0b013e3182a5a1bf.
[8]Asl MN,Hosseinzadeh H.Review of pharmacological effects of Glycyrrhiza sp.and its bioactive compounds[J].Phytother Res,2008,22(6):709-724.DOI:10.1002/ptr.2362.
[9]Isbrucker RA,Burdock GA.Risk and safety assessment on the consumption ofLicorice root (Glycyrrhiza sp.),its extract and powder as a food ingredient,with emphasis on the pharmacology and toxicology of glycyrrhizin[J].Regul Toxicol Pharmacol,2006,46(3):167-192.DOI:10.1016/j.yrtph.2006.06.002.
[10]Cavani A,Mei D,Guerra E,et al.Patients with allergic contact dermatitis to nickel and nonallergic individuals display different nickel-specific T cell responses.Evidence for the presence of effector CD8+and regulatory CD4+T cells[J].J Invest Dermatol,1998,111(4):621-628.DOI:10.1046/j.1523-1747.1998.00334.x.
[11]Bordbar N,Karimi MH,Amirghofran Z.The effect of glycyrrhizin on maturation and T cell stimulating activity of dendritic cells[J].Cell Immunol,2012,280 (1):44-49.DOI:10.1016/j.cellimm.2012.11.013.
[12]Ma C,Ma Z,Liao XL,et al.Immunoregulatory effects of glycyrrhizic acid exerts anti-asthmatic effects via modulation of Th1/Th2 cytokines and enhancement of CD4(+)CD25(+)Foxp3+regulatory T cells in ovalbumin-sensitized mice[J].J Ethnopharmacol,2013,148(3):755-762.DOI:10.1016/j.jep.2013.04.021.
Effect of compound glycyrrhizin on skin patch test results
Guo Yan,Sun Xiaodong,Shi Xin,Liu Runqiu,Jing Jing,Chen Jingjing,Shen Yue,Yu Cuiping,Yan Zhihua,Chen Xiaojian,Chen Lingling
Department of Dermatology,Second Affiliated Hospital of Soochow University,Suzhou 215004,China(Guo Y[current affiliation:Department of Dermatology,Yancheng Third People′s Hospital,Yancheng 350001,Jiangsu,China],Sun XD[current affiliation:Department of Dermatology,Fengnan District Maternal and Child Health Care Hospital of Tangshan City,Tangshan 063300,Hebei,China],Shi Xin,Liu RQ [current affiliation:Department of Dermatology,First People′s Hospital of Yancheng City,Yancheng 224005,Jiangsu,China],Jing J,Chen JJ,Shen Y,Yu CP,Yan ZH[current affiliation:Department of Dermatology,High-Tech Zone Hospital,Second Affiliated Hospital of Soochow University,Suzhou 215151,China]);Department of Dermatology,Suzhou Municipal Hospital,Suzhou 215006,China (Chen XJ,Chen LL)
Objective To evaluate the effect of compound glycyrrhizin on skin patch test results.Methods A total of 84 patients who showed moderate positive(++)patch test reactions to nickel or formaldehyde were enrolled into this study.After the baseline patch tests,patients administrated 50 mg of compound glycyrrhizin tablets thrice a day for 2 weeks(middle-dose compound glycyrrhizin intervention),then 70 mg of compound glycyrrhizin tablets thrice a day for 2 weeks (high-dose compound glycyrrhizin intervention),and finally
intravenous injection of compound glycyrrhizin 60 ml once a day for 1 week (intravenous injection intervention).Skin patch tests were conducted after each intervention.The results of skin patch tests were evaluated qualitatively and quantitatively.Statistical analysis was carried out by using the Wilcoxon rank sum test with the SPSS 19.0 software.Results Totally,81 patients completed the middledose compound glycyrrhizin intervention trial,of whom,66 were moderate positive (++),13 mild positive (+),and 2 strong positive(+++)for skin patch tests following the trial,and no patient was negative.Significant differences were observed in the degree of reactivity (Z=-2.84,P=0.005),but not in qualitative results between the baseline and first post-intervention SPTs.Among 82 patients who completed the high-dose compound glycyrrhizin intervention,37 were moderate positive (++),36 mild positive (+),and 9 negative for the second post-intervention skin patch tests,with significant differences in qualitative results (Z=-3.000,P=0.003)and degree of reactivity (Z=-6.247,P=0.000)between the baseline and second post-intervention SPTs.Finally,58 patients completed the intravenous injection intervention,of whom,12 were moderate positive (++),10 mild positive (+),and 36 negative for the post-intervention patchtests,withsignificantdifferencesinqualitative results(Z=-6.000,P=0.000)and the degree of reactivity(Z=-6.289,P=0.000)between the baseline and third post-intervention SPTs.Conclusion Both high-dose oral compound glycyrrhizin and intravenous compound glycyrrhizin could evidently suppress skin patch test reactions,and compound glycyrrhizin is recommended to be withdrawn 2 weeks before skin patch tests.
Dermatitis,contact;Patch tests;Nickel;Formaldehyde;Compound glycyrrhizin
s:Shi Xin,Email:shx9@163.com;Chen Lingling,Email:chenlingling031@126.com
施辛,Email:shx9@163.com;陈玲玲,Email:chenlingling031@126.com
10.3760/cma.j.issn.0412-4030.2016.06.009
苏州市科教兴卫青年基金(KJXW2011024);盐城市医学科技发展计划项目(YK2015026)
Fund programs:Suzhou City′s Municipal Youth Fund of Science and Education (KJXW2011024);Yancheng Municipal Medical Science Development Program(YK2015026)
2015-11-27)
(本文编辑:吴晓初)
