银屑病调节性T细胞的功能异常及STAT3通路调控机制研究
2016-11-06杨璐婷李冰张倩党二乐王刚
杨璐婷 李冰 张倩 党二乐 王刚
710032西安,第四军医大学西京皮肤医院
·论著·
银屑病调节性T细胞的功能异常及STAT3通路调控机制研究
杨璐婷 李冰 张倩 党二乐 王刚
710032西安,第四军医大学西京皮肤医院
目的 研究银屑病患者外周血调节性T细胞(Treg)的功能,探讨与功能异常相关的STAT3信号通路机制。方法 寻常性银屑病患者81例,银屑病面积和严重度指数(PASI)评分10~30,均为慢性斑块状。对照组46例,为健康献血者。采用流式细胞仪检测外周血中Treg细胞的比例,用体外淋巴细胞混合培养方法检测银屑病患者和健康人外周血中Treg细胞的增殖活性及对效应性T细胞(Tresp)的抑制功能,用流式细胞仪及qRT-PCR检测Treg细胞中磷酸化STAT3的比例及分泌促炎因子干扰素γ(IFN-γ)、肿瘤坏死因子α(TNF-α)、白细胞介素17(IL-17)的水平。最后,用STAT3通路抑制剂Stattic V处理银屑病患者Treg细胞,观察其增殖及抑制功能的恢复及分泌促炎因子的变化。结果 银屑病患者组外周血Treg细胞数量(6.437%±0.186%)与对照组(6.812%±0.241%)比较差异无统计学意义(t=1.224,P>0.05),但银屑病患者组外周血Treg细胞增殖活性及对Tresp细胞的抑制功能明显降低,磷酸化STAT3表达水平显著升高,分泌促炎因子IFN-γ、TNF-α、IL-17的水平显著升高(均P<0.05)。经50 μg/L Stattic V作用后,银屑病患者Treg细胞对Tresp抑制率为61.670%±4.640%,未处理组为28.820%±11.490%,两组差异有统计学意义(P<0.05);50 μg/L Stattic V作用后,促炎因子IFN-γ、TNF-α、IL-17 mRNA表达量(2-△△Ct)分别为1.654±0.879、0.850±0.705、0.572±0.135,均显著低于未处理组(分别为23.350±6.721、4.847±1.525、3.095±0.650),差异均有统计学意义(P<0.05)。结论 银屑病患者Treg细胞对Tresp细胞的负向调控功能降低,其机制与STAT3信号通路异常活化有关,抑制STAT3通路的活化有可能一定程度地恢复Treg细胞功能。
银屑病;T淋巴细胞,调节性;STAT3转录因子;干扰素γ;肿瘤坏死因子α;白细胞介素17;Stattic V
调节性 T 细胞(regulatory T cells,Treg)是一群具有负向免疫调节功能的细胞,在维持免疫稳态和免疫耐受中发挥重要的作用[1]。银屑病是一种慢性炎症性皮肤病,发病机制复杂,目前普遍认为,T细胞活化是银屑病发病的中心环节[2-3]。近来研究发现,银屑病患者Treg细胞可能存在数量或功能的异常,参与银屑病的发生与发展,然而其具体的异常情况及其机制仍不明确。我们通过检测银屑病患者外周血Treg细胞的比例及其信号转导与转录因子3(signal transducer and activator of transcription 3,STAT3)活性,分析Treg细胞自身增殖和对效应性T 细胞(responder T cells,Tresp)的抑制作用,探讨Treg细胞在银屑病发病中的作用及其机制。
材料和方法
1.临床资料:西京皮肤医院2014年3月至2015年2月明确诊断为寻常性银屑病患者81例,男47例,女34例,年龄20~45岁,平均33岁,所有患者均为活动期,PASI评分10~30,4周内未接受免疫抑制剂和外用药物治疗。46例健康志愿者作为对照组,男28例,女18例,年龄20~40岁,平均28岁。本研究经患者知情同意及第四军医大学西京医院伦理委员会批准。
2.主要仪器与试剂:分选用流式细胞仪(美国Beckman公司),鉴定用流式细胞仪(美国BD公司),激光共聚焦显微镜(日本Olympus公司),流式抗体 CD3-FITC、CD4-APC/Cy7、CD25-PE、CD25-FITC、CD127-FITC、Foxp3-APC、pSTAT3-PE、干扰素 γ(IFN-γ)-PE、肿瘤坏死因子 α(TNF-α)-PE、白细胞介素 17(IL-17)A-PE(美国 Biolegend 公司),T细胞活化混合剂(美国BD公司),细胞固定/破膜液(美国eBioscience公司),Stattic V(美国Santa Cruz公司),CFSE(美国 Life Technologies公司),重组人白细胞介素 2(IL-2,美国 Peprotech公司),CD3单抗(美国eBioscience公司),兔抗人pSTAT3抗体、FITC-羊抗兔荧光二抗(英国的Abcam公司)。
3.外周血Treg细胞数量检测:以CD4+CD25+Foxp3+为标记检测Treg细胞。抽取每例受试者静脉血20 ml,加入肝素抗凝管,用淋巴细胞分离液分离人外周血单个核细胞后,进行表面荧光抗体染色,将培养细胞加入到流式检测管,每管加入CD3-FITC、CD4-APC/Cy7、CD25-PE 各 5 μl,空白管中加入相同量的流式抗体,4℃孵育30 min,加入2 ml无菌PBS离心,固定液室温避光固定反应30 min后离心弃上清液,PBS洗涤1次,测试管加入破膜剂打孔,离心后弃上清液,测试管加入Foxp3-APC 5 μl,4℃孵育1 h。流式细胞仪各参数设置完毕之后,对Treg细胞占CD4+T细胞的比例进行检测。
4.Treg细胞和Tresp细胞的分离:同上述方法分离得到的外周血单个核细胞进行表面荧光抗体染色,将培养细胞加入到流式检测管,每管中加入CD4-APC/Cy7、CD25-PE、CD127-FITC 各 5 μl,空白管中加入相同量的流式抗体,4℃孵育30 min,加入2 ml无菌PBS,209×g离心5 min,弃上清液。加入1 ml无菌PBS,上机分选。分别收集CD4+CD25+CD127-的 Treg细胞和 CD4+CD25-CD127+的 Tresp细胞。
5.Treg细胞增殖及免疫抑制功能检测:将流式分选得到的Treg细胞进行CFSE染色,每个流式管加入1 ml无菌PBS溶液,5 μmol/L CFSE室温避光孵育15 min,加入RPMI 1640培养基终止反应,209×g离心5 min,弃上清液。将5×104CFSE染色的Treg细胞接种于5 mg/L CD3包被的96孔U型板,每组设3孔。加入50 μg/L的IL-2刺激Treg细胞活化。7 d后,流式细胞仪检测Treg细胞增殖比例。将5×104CFSE染色的Tresp细胞、5×104Treg细胞单独及两者按照1∶1的比例接种于5 mg/L CD3包被的96孔U型板,每组设3孔。加入50 μg/L的IL-2刺激Tresp细胞活化。7 d后,流式细胞仪检测Tresp细胞增殖比例。抑制率=[1-(两种T细胞共培养Tresp的增殖率/Tresp单独培养的增殖率)]×100%。
6.Treg细胞中pSTAT3比例及分泌促炎因子水平检测:将分离得到的外周血单个核细胞培养于6孔板,加入T细胞活化混合剂1μl,37℃培养4~6h。加入CD4-APC/Cy7、CD25-FITC进行表面抗体染色,固定破膜后加入 Foxp3-APC 5 μl,4 ℃孵育 30 min,分别加入 pSTAT3-PE、IFN-γ-PE、TNF-α-PE、IL-17A-PE 5 μl,4 ℃孵育 30 min。流式细胞仪检测pSTAT3及分泌促炎因子的比例变化。
7.STAT3抑制剂对Treg细胞增殖及抑制功能的作用检测:在5×104CFSE染色的银屑病患者Treg细胞培养的96孔U型板中,加入10和50 μg/L的Stattic V,7 d后,流式细胞仪检测银屑病患者Treg细胞增殖率的变化。在5×104CFSE染色的银屑病患者Tresp细胞、5×104Treg细胞混合培养的96孔U型板中,分别加入10和50 μg/L的Stattic V,7 d后,流式细胞仪检测银屑病患者Treg细胞抑制率的变化。
8.实时RT-PCR检测Treg细胞分泌炎症因子的水平:用Trizol试剂提取CD4+CD25+CD127-Treg细胞总RNA。用逆转录试剂盒进行cDNA逆转录,并以此模板进行qRT-PCR检测。qRT-PCR扩增条件:95℃预变性 1 min,95℃变性 5 s,59℃退火 30 s,72℃延伸30 s,40个循环,72℃延伸10 min。每次反应设3个复孔。反应结束后采用Thermal cycler软件包计算Ct值,分析荧光强度。mRNA相对表达量采用2-△△Ct表示。根据Primer Premier 5.0软件设计各目的基因的特异性引物,引物设计跨越外显子。IFN-γ 上游引物:5′-GACCAGAGCATCCAAAAGA G-3′,下游引物 5′-GAGTTCATGTATTGCTTTGCG-3′,扩增产物长度153 bp。TNF-α上游引物:5′-GGTCT ACTTTGGGATCATTGCC-3′,下游引物 5′-GTTCTA AGCTTGGGTTCCGAC-3′,扩增产物长度163 bp。IL-17A 上游引物:5′-CGGCTGGAGAAGATACTGG T-3′,下游引物 5′-TTAGTCCGAAATGAGGCTGTC-3′,扩增产物长度172 bp。内参照为β肌动蛋白,上游引物:5′-GGCTACAGCTTCACCACCAC-3′,下游引物 5′-TGCGCTCAGGAGGAGC-3′,扩增产物长度418 bp。
9.统计学分析:采用Graphpad Prism统计软件分析并作图,数据以±s表示,各组间比较采用t检验,P<0.05为差异有统计学意义。
结 果
1.银屑病患者外周血Treg细胞比例无明显变化:对照组外周血中CD4+CD25+Foxp3+占CD4+淋巴细胞的6.812%±0.241%,银屑病患者组为6.437%±0.186%,两组差异无统计学意义(t=1.224,P> 0.05),见图1。
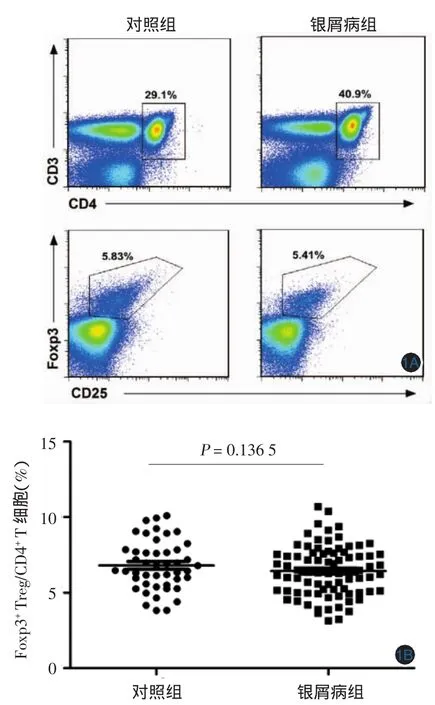
图1 银屑病患者外周血调节性T细胞(Treg细胞)比例 1A:流式细胞图显示银屑病及健康对照外周血CD3+CD4+CD25+Foxp3+Treg细胞占CD4+T细胞比例的变化。1B:46例健康对照和81例银屑病患者Treg细胞比例统计结果图
2.银屑病患者Treg细胞增殖及对Tresp细胞抑制功能减弱:对照组Treg细胞体外增殖率为64.700%±7.022%,银屑病患者组为27.620%±5.173%,银屑病患者组Treg细胞增殖功能显著降低(t=4.034,P<0.01)。在体外Treg细胞和Tresp细胞共培养时发现,对照组Treg细胞对Tresp的抑制率为56.280%±6.305%,而银屑病组仅为22.670%±4.928%,两组比较,t=4.044,P< 0.01。见图2。
3.银屑病患者Treg细胞磷酸化STAT3比例升高,分泌炎症因子水平升高:流式细胞仪检测发现,银屑病患者外周血CD4+CD25+Foxp3+Treg细胞中pSTAT3的比例、分泌 IFN-γ、TNF-α、IL-17的比例均显著高于对照组,差异均有统计学意义(P<0.05)。qRT-PCR检测同样发现,银屑病患者外周血Treg细胞表达 IFN-γ、TNF-α、IL-17 mRNA 水平显著高于对照组(均P<0.05)。见表1。
4.STAT3抑制剂能显著恢复银屑病Treg细胞抑制功能并降低炎症因子的表达:加入10 μg/L的Stattic V于银屑病患者外周血Tresp和Treg共培养体系中,Treg细胞对Tresp的抑制率与未处理组相比,差异无统计学意义(t=0.784,P>0.05);当加入50μg/L的Stattic V 处理后,银屑病患者Treg细胞对Tresp的抑制率显著高于未处理组,差异有统计学意义(t=2.787,P<0.05)。见图3。而不同浓度Stattic V处理银屑病患者Treg细胞后,Treg细胞增殖功能无明显改变(t值依次为 0.004、0.106,均P> 0.05)。见图4。50 μg/L的Stattic V作用于银屑病患者外周血Treg细胞后,炎症因子 IFN-γ、TNF-α、IL-17 mRNA表达量均较银屑病未处理组降低,差异有统计学意义(t值依次为3.721、3.565、4.267,均P< 0.05)。见图5。

图2 流式细胞仪检测银屑病患者外周血调节性T细胞(Treg细胞)与效应性T细胞(Tresp细胞)共培养体系中Tresp细胞增殖率及Treg细胞抑制率 2A:流式细胞仪检测Tresp细胞增殖率;2B:2A的柱状统计图;2C:Treg细胞抑制率,银屑病患者Treg细胞抑制Tresp细胞增殖能力显著低于健康对照,P<0.01

图3 STAT3抑制剂(Stattic V)对银屑病患者外周血调节性T细胞(Treg细胞)和效应性T细胞(Tresp细胞)共培养体系中Treg细胞的抑制率 加入10 μg/L Stattic V组Treg细胞抑制率与未加Stattic V的对照组相比,差异无统计学意义;加入50 μg/L Stattic V组则显著高于对照组(P<0.05)
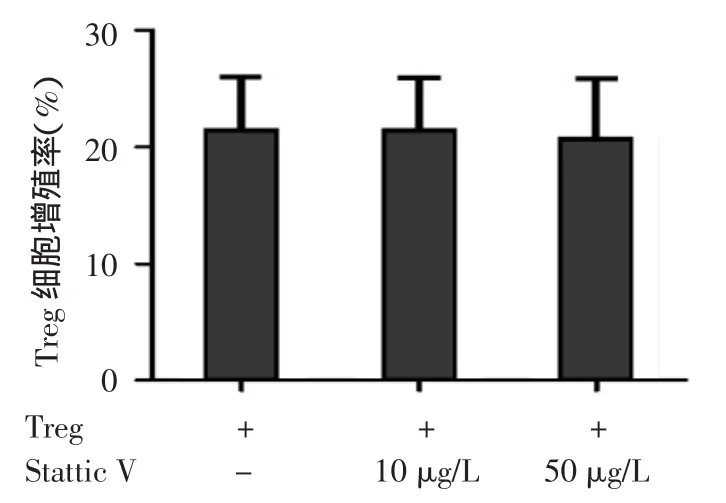
图4 STAT3抑制剂(Stattic V)对银屑病患者外周血调节性T细胞(Treg细胞)的增殖率 Stattic V处理Treg细胞后不能恢复其增殖功能
表1 银屑病患者外周血调节性T细胞(Treg细胞)pSTAT3比例及分泌炎症因子的细胞比例和mRNA表达水平(±s)

表1 银屑病患者外周血调节性T细胞(Treg细胞)pSTAT3比例及分泌炎症因子的细胞比例和mRNA表达水平(±s)
注:IFN-γ:干扰素 γ;TNF-α:肿瘤坏死因子 α;IL-17:白细胞介素 17
组别例数在CD4+CD25+Foxp3+Treg细胞中所占比例(%)Treg细胞表达炎症因子mRNA水平(2-△△Ct)pSTAT3 IFN-γ TNF-α IL-17 IFN-γ mRNA TNF-α mRNA IL-17 mRNA银屑病组 81 64.580±6.223 9.174±1.443 8.473±1.502 5.378±0.708 23.350±6.721 4.847±1.525 3.095±0.650对照组 45 37.750±1.996 0.749±0.081 1.038±0.113 2.367±0.910 1.014±0.004 1.013±0.003 1.020±0.006 t值 3.848 5.829 4.935 2.532 3.617 2.515 2.697 P值 <0.05 <0.05 <0.05 <0.05 <0.05 <0.05 <0.05
讨 论
Treg细胞是一群可负向调控机体免疫反应的CD4+T细胞,对于维持机体免疫耐受和免疫应答稳态具有非常重要的作用。在健康人外周血中,Treg细胞占CD4+T细胞的比例约为5%~10%。虽然其在外周血中所占比例较小,但却能显著抑制自身反应性T细胞的过度增殖和活化。研究表明,Treg细胞数量上的变化和(或)功能异常参与多种自身免疫性疾病的发生发展,例如类风湿性关节炎、系统性红斑狼疮、银屑病等[4-8]。
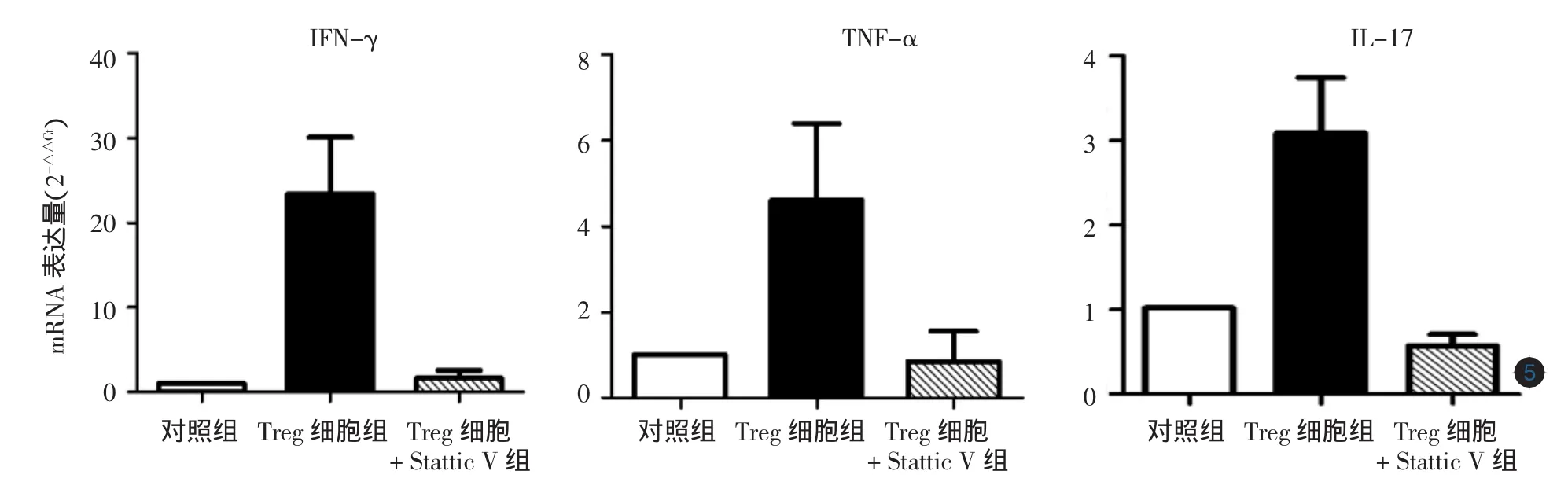
图5 50 μg/L Stattic V作用于银屑病患者外周血调节性T细胞(Treg细胞)后炎症因子干扰素γ(IFN-γ)、肿瘤坏死因子α(TNF-α)、白细胞介素17(IL-17)mRNA表达量(2-△△Ct)银屑病患者Treg细胞加Stattic V组IFN-γ、TNF-α和IL-17 mRNA表达水平显著低于银屑病未处理组,均P<0.05
关于Treg细胞在银屑病患者皮损及外周血中数量和功能的变化,目前研究结果并不一致。部分研究认为,银屑病患者外周血中Treg细胞的变化与银屑病的严重程度及疾病分期密切相关。Yan等[9]发现,在进展期寻常性银屑病患者外周血中Treg细胞的数量明显低于稳定期和消退期,消退期明显高于稳定期,并且其所占CD4+T细胞的比例与患者的PASI评分及疾病严重程度呈明显正相关。而Chen等[10]研究发现,中度银屑病患者外周血中Treg细胞数量与健康对照无明显差异,而重度银屑病患者外周血中Treg细胞数量明显低于正常人。我们通过流式细胞仪分析了81例中重度银屑病患者及46例健康对照外周血中Treg细胞数量的变化,发现银屑病患者外周血Treg细胞数量未发生明显变化,该结果与Sugiyama等[11]研究结果一致。目前学术界对银屑病患者外周血中Treg细胞的数量变化仍存在争议,而研究结果的差异也主要归因于以下几个方面:①病例数量的差异;②银屑病患者的疾病严重程度及分期不同;③因Treg细胞有不同种类的分型,其分子标志物各不相同,使得研究结果各异。本研究通过检测较大的临床样本量,选择特异性的分子标志,所得到的结果更准确地反映了银屑病患者Treg细胞数量和比例状态。
我们首先证实了银屑病患者外周血Treg细胞自身增殖活性减弱,同时还发现,银屑病患者Treg细胞对Tresp细胞的抑制增殖作用减弱,提示Treg细胞功能的紊乱参与了银屑病的发病。
STAT3通路可以调控细胞增殖、分化,影响细胞因子分泌。近年来,有学者在银屑病患者皮损处检测到激活的 STAT3。Sano 等[12-13]研究发现,银屑病患者皮损处角质形成细胞中pSTAT3的表达显著高于健康人,在K5.STAT3c转基因小鼠模型中STAT3处于持续激活状态,且小鼠的皮损及组织病理学改变均与银屑病类似,提示STAT3通路的持续激活可能影响自身免疫稳态,导致银屑病样改变。另有研究发现,STAT3可以通过抑制Foxp3的表达影响Treg细胞的发育,降低 Foxp3+Treg 细胞数量[14]。因此我们推测,在银屑病患者Treg细胞中,STAT3通路的活化状态发生改变,导致银屑病患者Treg细胞抑制功能异常。我们通过流式细胞仪证实,银屑病患者外周血Treg细胞STAT3通路过度活化,高表达pSTAT3。当使用STAT3抑制剂作用后,银屑病患者Treg细胞对Tresp抑制增殖作用有明显恢复,进一步证实STAT3通路异常活化是银屑病患者Treg细胞功能异常的重要分子机制。
正常情况下,Treg细胞主要通过分泌IL-10、TGF-β等发挥免疫抑制作用,不表达或表达低水平的炎症因子 IFN-γ、TNF-α、IL-17等。Th17细胞是产生IL-17的T细胞亚群,介导一系列炎症反应,Treg细胞则发挥免疫抑制功能,限制过度的免疫应答,两者的平衡有利于免疫稳态的维持。近年来研究发现,Treg细胞向Th17细胞的转换可能是Treg细胞功能异常的重要分子机制[15]。我们在银屑病患者Treg细胞中检测到高比例IL-17+CD25+Foxp3+的三阳性细胞,并首次在Treg细胞中检测到高比例IFN-γ+CD25+Foxp3+三阳性细胞,提示银屑病患者体内Treg细胞向分泌IL-17细胞及IFN-γ细胞转变的可能,进而加重炎症反应。
本研究首次发现STAT3通路参与了银屑病患者Treg细胞抑制功能的改变,与此同时发现银屑病患者Treg细胞可能存在功能转换,通过分泌促炎因子加重炎症反应,为深入了解银屑病Treg细胞功能缺陷的分子机制奠定了基础。
[1]Sakaguchi S,Ono M,Setoguchi R,et al.Foxp3+CD25+CD4+natural regulatory T cells in dominant self-tolerance and autoimmune disease[J].Immunol Rev,2006,212:8-27.DOI:10.1111/j.0105-2896.2006.00427.x.
[2]Michalak-Stoma A,Pietrzak A,Szepietowski JC,et al.Cytokine network in psoriasis revisited[J].Eur Cytokine Netw,2011,22(4):160-168.DOI:10.1684/ecn.2011.0294.
[3]Reich A,Welz-Kubiak K,Rams L.Apprehension of the disease by patients suffering from psoriasis [J].Postepy Dermatol Alergol,2014,31(5):289-293.DOI:10.5114/pdia.2014.44010.
[4]Mesquita D,Cruvinel WM,Araujo JA,et al.Imbalanced expression of functional surface molecules in regulatory and effector T cells in systemic lupus erythematosus[J].Braz J Med Biol Res,2014,47(8):662-669.DOI:10.1590/1414-431X20143483.
[5]Soler DC,Sugiyama H,Young AB,et al.Psoriasis patients exhibit impairment of the high potency CCR5(+)T regulatory cell subset[J].Clin Immunol,2013,149(1):111-118.DOI:10.1016/j.clim.2013.06.007.
[6]Alunno A,Manetti M,Caterbi S,et al.Altered immunoregulation in rheumatoid arthritis:the role ofregulatory T cells and proinflammatory Th17 cells and therapeutic implications[J].Mediators Inflamm,2015,2015:751793.DOI:10.1155/2015/751793.
[7]Mattozzi C,Salvi M,D′Epiro S,et al.Importance of regulatory T cells in the pathogenesis of psoriasis:review of the literature[J].Dermatology,2013,227(2):134-145.DOI:10.1159/000353398.
[8]Fujimura T,Okuyama R,Ito Y,et al.Profiles of Foxp3+regulatory T cells in eczematous dermatitis,psoriasis vulgaris and mycosis fungoides[J].Br J Dermatol,2008,158 (6):1256-1263.DOI:10.1111/j.1365-2133.2008.08504.x.
[9]Yan KX,Fang X,Han L,et al.Foxp3+regulatory T cells and related cytokines differentially expressed in plaque vs.guttate psoriasis vulgaris[J].Br J Dermatol,2010,163(1):48-56.DOI:10.1111/j.1365-2133.2010.09742.x.
[10]Chen L,Shen Z,Wang G,et al.Dynamic frequency of CD4+CD25+Foxp3+Treg cells in psoriasis vulgaris[J].J Dermatol Sci,2008,51(3):200-203.DOI:10.1016/j.jdermsci.2008.04.015.
[11]Sugiyama H,Gyulai R,Toichi E,et al.Dysfunctional blood and target tissue CD4+CD25high regulatory T cells in psoriasis:mechanism underlying unrestrained pathogenic effector T cell proliferation[J].J Immunol,2005,174(1):164-173.DOI:10.4049/jimmunol.174.1.164.
[12]Sano S,Chan KS,DiGiovanni J.Impact of Stat3 activation upon skin biology:a dichotomy of its role between homeostasis and diseases[J].J Dermatol Sci,2008,50(1):1-14.DOI:10.1016/j.jdermsci.2007.05.016.
[13]Sano S,Chan KS,Carbajal S,et al.Stat3 links activated keratinocytes and immunocytes required for development of psoriasis in a novel transgenic mouse model[J].Nat Med,2005,11(1):43-49.DOI:10.1038/nm1162.
[14]Laurence A,Amarnath S,Mariotti J,et al.STAT3 transcription factor promotes instability of nTreg cells and limits generation of iTreg cells during acute murine graft-versus-host disease[J].Immunity,2012,37 (2):209-222.DOI:10.1016/j.immuni.2012.05.027.
[15]Bovenschen HJ,van de Kerkhof PC,van Erp PE,et al.Foxp3+regulatory T cells of psoriasis patients easily differentiate into IL-17A-producing cells and are found in lesional skin[J].J Invest Dermatol,2011,131(9):1853-1860.DOI:10.1038/jid.2011.139.
Dysfunction of regulatory T cells in patients with psoriasis and related mechanisms of regulation by the STAT3 signaling pathway
Yang Luting,Li Bing,Zhang Qian,Dang Erle,Wang Gang
Department of Dermatology,Xijing Hospital,Fourth Military Medical University,Xi′an 710032,China
ObjectiveTo evaluate the function of regulatory T (Treg)cells in peripheral blood from patients with psoriasis,and to explore the possible role of the STAT3 signaling pathway in Treg cell dysfunction.MethodsTotally,81 patients with psoriasis vulgaris,who all presented with chronic plaques and had a psoriasis area and severity index(PASI)score of 10-30,were enrolled into this study.Forty-six healthy blood donors served as the control group.Venous blood samples were collected from these subjects followed by isolation of Treg cells and responder T (Tresp)cells.Flow cytometry was performed to determine the proportion of Treg cells in peripheral blood as well as that of cells secreting phosphorylated-STAT3(p-STAT3),interferon γ(IFN-γ),tumor necrosis factor α(TNF-α)and interleukin 17(IL-17)in Treg cells,and quantitative real-time PCR (qRT-PCR)to measure the expression levels of IFN-γ,TNF-α and IL-17 mRNAs in Treg cells.Some Treg cells and Tresp cells were culturedin vitroalone or in combination,and flow cytometry was conducted to estimate cellular proliferative activity on day 7 after stimulation with IL-2.Some patient-derived Treg cells were classified into several groups to be cultured alone or in combination with Tresp cells with or without the presence of the STAT3 pathway inhibitor,Stattic V (10 or 50 μg/L),for 7 days.Subsequently,flow cytometry was performed to evaluate the proliferative activity of Tresp cells,and qRT-PCR to measure the expression levels of IFN-γ,TNF-α and IL-17 mRNAs in Treg cells.ResultsNo significant differences were observed in the proportion of Treg cells in peripheral blood between the patient group and control group(6.437%±0.186%vs.6.812%±0.241%,t=1.224,P>0.05).Compared with control-derived Treg cells,the patient-derived Treg cells showed significantly decreased proliferative activity and inhibitory effects on Tresp cells,but increased proportion of cells secreting p-STAT3,IFN-γ,TNF-α and IL-17 (allP< 0.05).After the treatment with 50 μg/L Stattic V,a significant increase was observed in the inhibitory effect of patient-derived Treg cells on Tresp cells(inhibition rate:61.670%±4.640%vs.28.820%±11.490%,P< 0.05),but a significant decrease in the mRNA expressions of IFN-γ (2-△△Ct:1.654 ± 0.879 vs.23.350 ± 6.721,P<0.05),TNF-α(0.850±0.705 vs.4.847±1.525,P<0.05)and IL-17(0.572±0.135 vs.3.095±0.650,allP<0.05)in patient-derived Treg cells compared with untreated patient-derived Treg cells.ConclusionsThe negative regulatory effect of Treg cells on Tresp cells is decreased in patients with psoriasis,which may be associated with abnormal activation of the STAT3 signaling pathway,and inhibition of the pathway may restore the function of Treg cells to a certain extent.
Psoriasis;T-lymphocytes,regulatory;STAT3 transcription factor;Interferon-gamma;Tumor necrosis factor-alpha;Interleukin-17;Stattic V
Wang Gang,Email:xjwgang@fmmu.edu.cn
王刚,Email:xjwgang@fmmu.edu.cn
10.3760/cma.j.issn.0412-4030.2016.04.002
国家自然科学基金(81430073、81301349)
Fund program:National Natural Science Foundation of China(81430073,81301349)
2016-01-26)
(本文编辑:颜艳)
