纳米金的制备、表征及应用研究
2016-11-04周睿璐付大友吴永强谯康全
周睿璐, 付大友, 袁 东, 吴永强, 谯康全
(四川理工学院化学工程学院, 四川 自贡 643000)
纳米金的制备、表征及应用研究
周睿璐, 付大友, 袁东, 吴永强, 谯康全
(四川理工学院化学工程学院, 四川自贡643000)
纳米金材料基于其良好的光学和电子学特性,近年来已成为科学家们研究的热点之一。实验以氯金酸为原料,柠檬酸三钠为还原剂,采用经典的柠檬酸三钠还原法制备出纳米金溶液,利用目测法、紫外-可见分光光度法和扫描探针显微镜法对其进行表征,结果表明:纳米金粒子尺寸均匀、呈球形单分散分布。利用自组装单分子膜原理,通过层层组装将纳米金粒子和DNA探针依次固定到玻碳电极表面制备探针电极,利用电化学工作站检测其信号,结果表明纳米金标记DNA探针可显著增强目标DNA的检测信号,提高检测的灵敏度,并使响应电流增强。
纳米金;金标记;DNA
纳米金即指金的微小颗粒,直径一般为1 nm~100 nm,通常以胶体金的形态存在于水溶液中。纳米金的性质主要取决于金颗粒的尺寸及其表面特性,当金粒子尺寸减小到纳米范围时就会表现出表面效应、量子效应、宏观量子隧道效应等特性[1]。纳米金材料在生物化学中的应用,使其成为当今国际分析科学领域的前沿[2-3]。纳米金的制备一般分为物理法和化学法。物理法是利用各种技术将块状固体金分散为金纳米微粒,包括软着陆法、真空蒸镀法及激光消融法等[4-6]。化学法是以金的化合物为原料,与还原剂反应生成金纳米微粒,在形成金纳米颗粒时可以通过控制还原剂的用量来控制粒子的生长,使其维持纳米尺度,包括溶胶法、晶种生长法、反胶束法、相转移法及模板法等[7-9]。
基于纳米金粒子特殊的性能和应用,实验采用经典的柠檬酸三钠还原法[10-12]制备了纳米金溶液并进行了表征;将纳米金粒子和DNA探针依次固定到玻碳电极表面制备探针电极,用于检测目标DNA的浓度,改善浓度检测信号,提高检测的灵敏度。
1 实验部分
1.1实验试剂和仪器
氯金酸(分析纯,国药集团化学试剂有限公司);柠檬酸三钠、硝酸、磷酸氢二钠、磷酸二氢钠、壳聚糖、冰乙酸、浓硫酸、铁氰化钾、亚铁氰化钾、氯化钾、无水乙醇(分析纯,并购于成都市科龙化工试剂厂);巯基己醇(分析纯,上海静融生物科技有限公司);DNA探针、目标DNA(上海生物有限公司);超纯水≥18.25 MΩ·cm。
SPA400型多功能扫描探针显微镜(日本精工);UV1100/752型紫外-可见分光光度计(上海奥普勒仪器有限公司);PHS-4C型精密酸度计(成都世纪方舟科技有限公司);微量移液器(上海求精生化试剂仪器有限公司);TWCL-T型磁力搅拌器(上海越众仪器设备有限公司);优普系列超纯水机(成都超纯科技有限公司);AS10200B型超声波清洗机(天津奥特赛恩斯仪器有限公司);600D型电化学工作站(上海辰华仪器仪器有限公司);101型电热鼓风干燥箱(北京中兴伟业仪器有限公司);AR1140型电子天平(梅特勒托利多仪器有限公司);TDL80-2B型台式离心机(上海安亭科学仪器厂)。
1.2纳米金溶液的制备
所有玻璃仪器都用3 mol/L的HNO3溶液浸泡24 h,用超纯水洗净,自然晾干备用。
将100 mL新鲜配制的质量分数为0.01%的氯金酸溶液倒入圆底烧瓶,加热搅拌至溶液沸腾并持续2 min,加入4 mL质量分数为1%的柠檬酸三钠溶液,继续反应10 min至合成液不再变色,停止加热,继续搅拌,待合成液冷却至室温后,放入4 ℃冰箱储存,以备表征和标记应用。采用目测法、紫外-可见分光光度计、扫描探针显微镜对合成的溶液进行表征。
1.3玻碳电极的修饰
玻碳电极依次用1.0 mm、0.3 mm、0.05 mm的Al2O3粉末抛光至产生平滑、光亮表面。将电极分别放入HNO3、无水乙醇、超纯水中超声清洗3 min,在0.5 mol/L的H2SO4溶液中于0.3~0.7 V的电位范围内以50 mV/s的速度扫描,直至得到稳定的伏安图。将电极浸入0.1 mol/L [Fe(CN)6]3-/4-的PBS缓冲溶液中,使用电化学工作站测定其交流阻抗,阻值小于200 Ω即可使用。将10 μL质量分数为0.5%的壳聚糖溶液滴至电极表面,自然晾干,制得Chits/GCE电极,将Chits/GCE电极浸入1×10-5mol/L纳米金溶液中静置12 h后用超纯水冲洗,制得GNs/Chits/GCE电极。准确吸取10 μL 1×10-5mol/L的DNA探针溶液滴加在GNs/Chits/GCE电极表面,自然晾干后用超纯水冲洗,制得Probe/GNs/Chits/GCE/ssDNA电极;将电极垂直浸入1×10-5mol/L巯基己醇封闭试剂中静置1 h,取出后用超纯水冲洗,完成探针电极制备。将探针电极分别浸入已配制的不同浓度的目标DNA溶液中室温静置3 h,取出后用超纯水冲洗,在0.1 mol/L[Fe(CN)6]3-/4-的PBS缓冲溶液中进行电化学检测。
1.4电化学检测
电化学检测在CHI600D型电化学工作站进行,采用三电极系统,以不同修饰层的玻碳电极为工作电极,饱和甘汞电极为参比电极,铂片电极为辅助电极,在0.1 mol/L[Fe(CN)6]3-/4-的PBS缓冲溶液(pH=7.0)中,用交流阻抗法(EIS)以及循环伏安法(CV)检测玻碳电极电化学信号并记录。
交流阻抗法:初始电位为0.192 V,频率范围为105HZ~0.1 HZ,振幅为0.005 V。
循环伏安法:初始电位为0.4 V,电位范围为0.8 V~-0.4 V,扫描速度为50 mV/s。
2 结果与讨论
2.1表征结果
2.1.1目测分析
纳米金溶液在合成过程中的变色情况为:无色→浅灰色→深灰色→深红色→紫红色→酒红色→透亮红色。制备出的纳米金溶液颜色透亮、澄清,透明度良好,几乎没有杂质颗粒,可初步判断此溶液为纳米金溶液[13]。
2.1.2紫外-可见分光光度分析
将合成液于400~600 nm的波长范围内进行扫描,结果如图1所示。主峰宽度较小,合成液的最大吸收峰波长λmax=521 nm,最大吸光度Amax=0.421,符合纳米金溶液吸光特征[14-15],可确认此合成液为纳米金溶液。
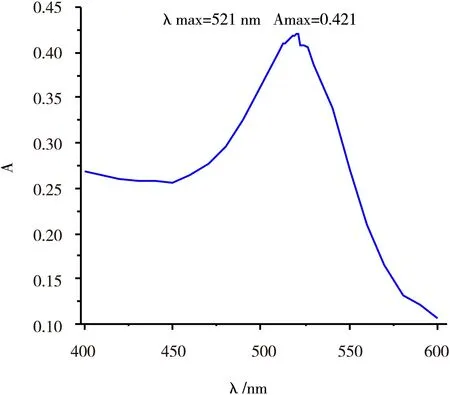
图1金纳米粒子的可见光吸收光谱图
2.1.3扫描探针显微镜分析
用扫描探针显微镜对合成的纳米金溶液进行形貌分析,结果如图2所示。纳米金粒子尺寸均匀、球型状比率高、分散性较好[22],粒径约为80 nm。
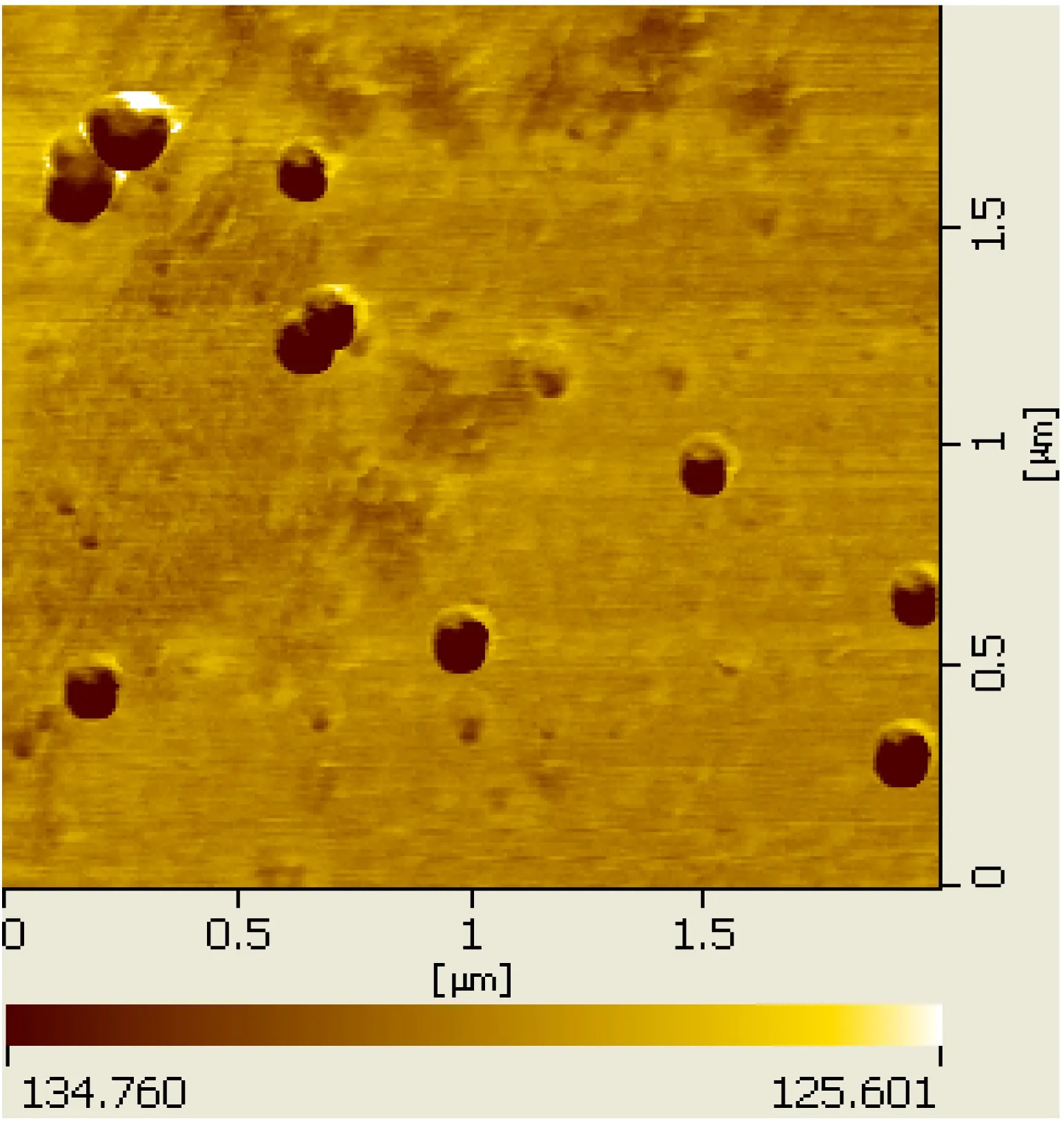
图2金纳米粒子的SPM图
2.2不同修饰层电极的电化学阻抗图谱
图3为不同修饰层电极在0.1 mol/L[ Fe(CN)6]3-/4-的PBS缓冲溶液(pH=7.0)中的电化学阻抗图谱。由图3可知,裸玻碳电极(曲线A)的阻抗约为200 Ω,明显高于Chits/GCE电极阻抗值(曲线B),这主要源于Chits表面所拥有的大量荷正电的氨基,有利于带负电的电活性物质[Fe(CN)6]3-/4-靠近电极表面,促进氧化还原电子转移。然而,当电极修饰纳米金后(GNs/Chits/GCE,曲线C)其阻抗明显增加,超过裸玻碳电极的阻抗,这说明尽管纳米金具有促进电子传递减小阻抗的能力,但它的负电性在此占了主导地位,对电活性物质[Fe(CN)6]3-/4-有较强的排斥作用,不利于电极表面氧化还原反应的进行。在电极表面修饰ssDNA探针后(ssDNA/GNs/Chits/GCE,曲线D),阻抗值进一步增加,影响[Fe(CN)6]3-/4-靠近电极表面的物质来源于ssDNA中带负电性的磷酸骨架,它使得电极表面氧化还原反应更加难以进行。当巯基己醇作为封闭剂封闭电极表面后(巯基己醇/ssDNA/GNs/Chits/GCE,曲线E),电极上物质更加致密,阻抗又有较小幅度增大。当将浓度为1×10-8mol/L的目标DNA溶液修饰在电极上后(目标DNA/巯基己醇/ssDNA/GNs/Chits/GCE,曲线F),负电性的磷酸骨架量增加,使阻抗值又出现较大幅度的增长。此电化学阻抗图谱为DNA的定性定量检测提供了基础。
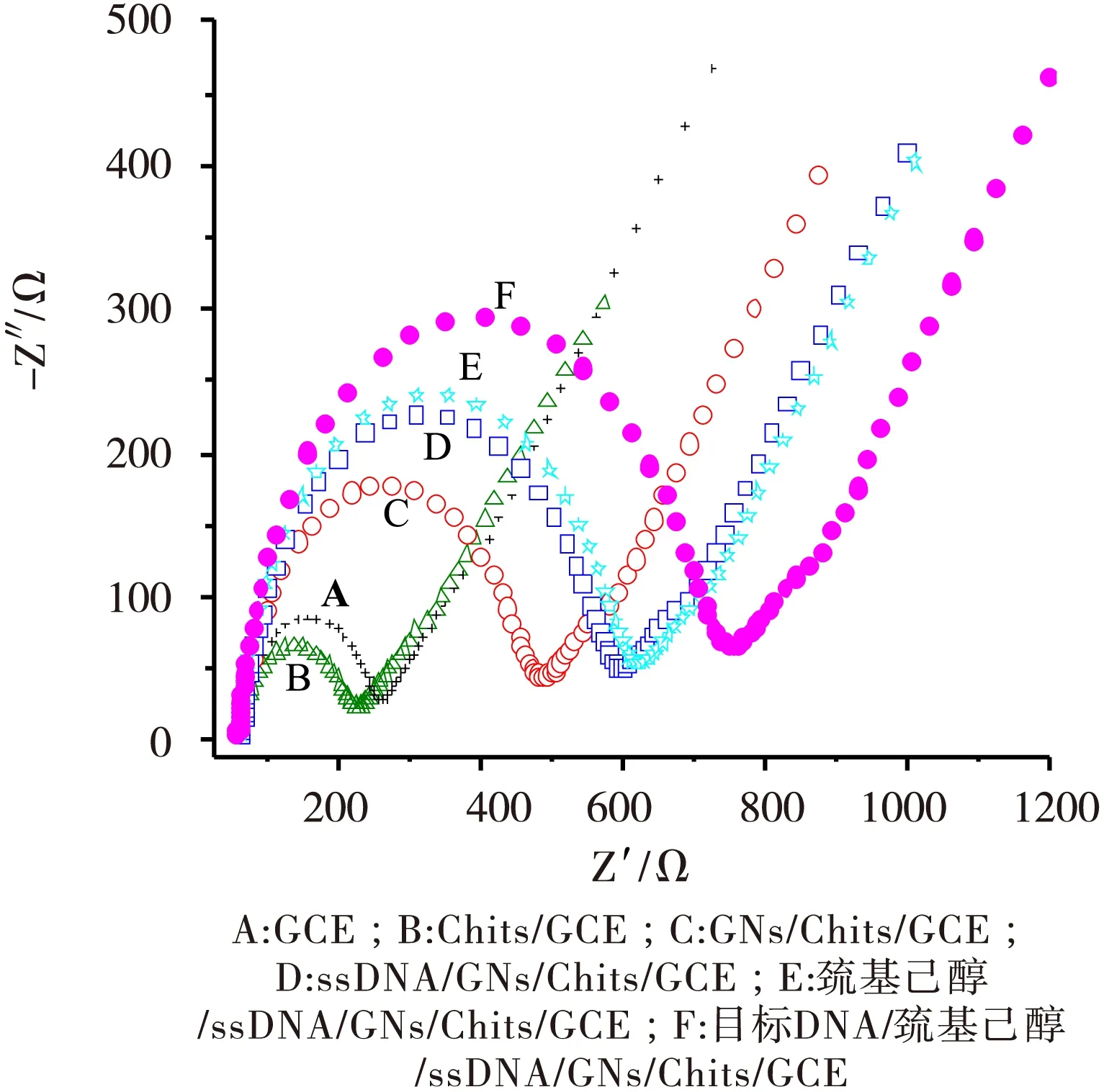
图3不同修饰层电极的电化学阻抗谱图
2.3不同浓度目标DNA修饰的玻碳电极的电化学阻抗图谱
图4为巯基己醇/ssDNA/GNs/Chits/GCE电极与不同浓度的目标DNA杂交后的电化学阻抗谱图。由图4可知,当电极与不同浓度的目标DNA杂交后,高频区阻抗半径随着目标物DNA浓度的增大而呈现增大趋势,这主要源于更高浓度的目标DNA会促使电极表面负电性的磷酸骨架吸附量增多,从而使得[Fe(CN)6]3-/4-平衡电对向电极表面传递电子的能力逐渐减弱,导致电极表面电子传递电阻逐渐增大。由图4可知,在目标DNA浓度为1×10-9~1×10-7mol/L的范围内,阻抗增加具有较强的规律性。
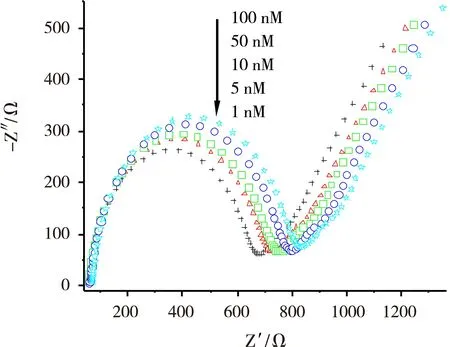
图4不同浓度的目标DNA修饰的玻碳电极的电化学阻抗图谱
2.4目标DNA浓度-电极阻抗的线性对数关系图
电化学阻抗值与目标DNA的浓度定量关系结果如图5所示,在目标DNA浓度为1×10-9~1×10-7mol/L的范围内,电化学阻抗值与目标DNA浓度的负对数呈现良好的线性关系,线性回归方程式为Z(Ω)=64.23 LOG[C(mol/L)]+1162.14,相关系数R=0.995 56,其中Z(Ω)为电极阻抗值,C(mol/L)为目标DNA浓度的负对数值。
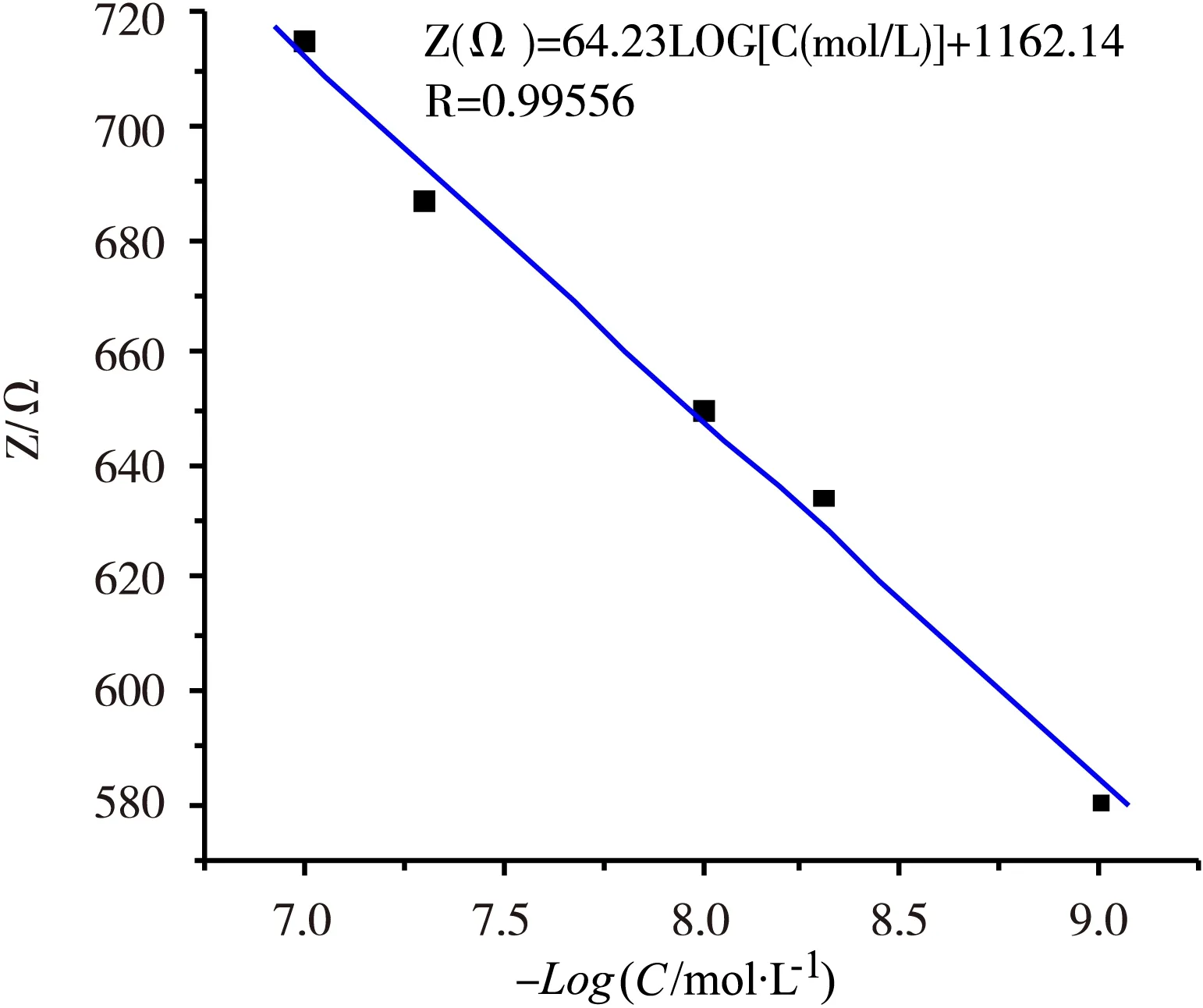
图5目标DNA-电极阻抗的线性对数关系图
2.5不同浓度下目标DNA修饰的玻碳电极的循环伏安图谱
在用电化学阻抗法分析电极的基础上,还采用循环伏安法进一步分析。图6是测量浓度分别为1×10-9mol/L、1×10-8mol/L、1×10-7mol/L的目标DNA的CV图。由图6可知,CV图中氧化过程曲线与还原过程曲线对称性好,表明体系具有良好的可逆性。值得一提的是,CV峰电流随目标DNA的增加呈现减小趋势,且减小的幅度与浓度的负对数具有一定的线性关系,这也契合了图4中阻抗与目标DNA浓度之间的类似关系,这表明即使运用不同的电化学测量方法,其待测物浓度与电化学信号之间的关系也具有一致性。
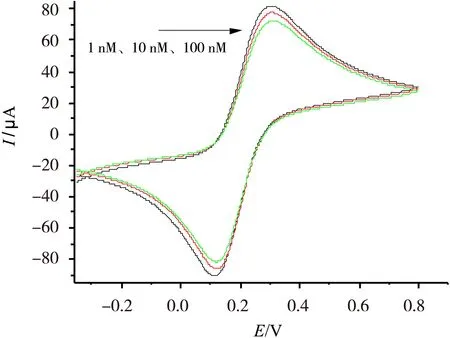
图6目标DNA修饰的玻碳电极的循环伏安图谱
2.6纳米金标记DNA探针在检测目标DNA中的作用
为探明纳米金标记DNA探针在检测目标DNA中的作用,实验采用相同的实验条件和修饰过程,对未使用纳米金标记和使用纳米金标记的电极在检测1×10-8mol/L目标DNA时的电化学信号进行了比较,结果见表1。纳米金标记DNA探针可显著增强目标DNA的检测信号,这与纳米金比表面积小、生物相容性好、对生物探针的吸附力强等特性相关。
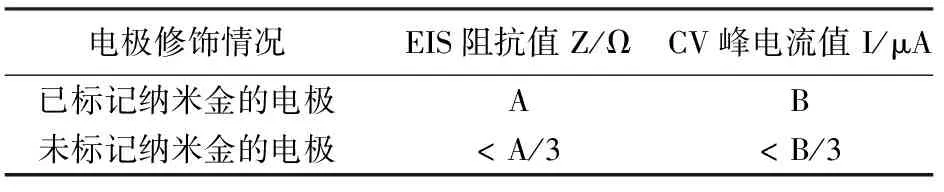
表1 电极修饰情况在检测目标DNA中的电信号结果比较
3 结束语
通过采用柠檬酸钠还原法制备纳米金溶液并进行表征,结果表明:纳米金粒子尺寸均匀、呈球形单分散分布且分散性较好。通过层层组装将纳米金粒子和DNA探针依次固定到玻碳电极表面制备探针电极并检测其信号,通过分析比较发现,纳米金标记DNA探针可显著增强目标DNA的检测信号,提高并改善检测的灵敏度,使响应电流增强。纳米金标记的DNA探针在生物检测分析中具有重大科学研究价值和潜在应用价值。
[1] RAGHURAMAN K,VALERIE R,CATHY C,et al.Nano compatible chemistry toword fabrication of arget-specific gold nanoparticles[J].J Am Chem Soc,2006,128(78):11342-11343.
[2] 陈雪皎.金纳米粒子在传感器中的应用探索[D].上海:华东师范大学,2012.
[3] 刘珊娜,葛怀娜,孟繁桐,等.李斯特菌免疫检测用胶体金的制备及抗体标[J].食品科技,2016,41(1):321-324.
[4] 钟坚海.纳米金在化学传感器中的应用研究[D].福建:福州大学,2010.
[5] 王振宽.功能分子-金纳米粒子体系的组装及应用研究[D].辽宁:大连理工大学,2015.
[6] PAOLO P,LUCIA P.Gold nanoparticles protected by fluorinated ligands:Syntheses,properties and applications[J].Journal of Fluorine Chemistry,2015,177:2-10.
[7] 吕碧琪.功能化纳米金溶胶的制备及其对含巯基氨基酸的传感[D].北京:北京化工大学,2014.
[8] GHODSELAHI T,AGHABABAIE N,MOBASHERI H,et al.Fabrication and characterization and biosensor application of gold nanoparticles on the carbon nanotubes[J].Applied Surface Science,2015,355(15):1175-1179.
[9] ABHISHEK D,RIDHIMA C,NANDITA M,et al.Synthesis of pH sensitive gold nanoparticles for potential application in radio sensitization[J].Materials Science and Engineering:C,2015,55(1):34-41.
[10] 许艳敏.不同粒径及形貌纳米金的制备与催化性能研究[D].河南:郑州大学,2014.
[11] SOON C,YOUNGSEO M,HYOJONG Y.Finely tunable fabrication and catalytic activity of gold multipod nanoparticles[J].Journal of Colloid and Interface Science,2016,469(1):269-276.
[12] 刘颖沙,李建科,张琳.胶体金制备技术的改进与优化[J].食品与发酵工业,2015,41(11):110-114.
[13] 吴皎,刘亚刚,贾清,等.免疫胶体金技术在畜禽疫病检测中的应用和研究进展[J].西南民族大学学报,2005,46(4):46-48.
[14] TURKEVICH J.Colloidal Gold.Part I:Historical and Preparative Aspects,Morphology and Structure[J].Gold Bull,1985,18(3):86-91.
[15] TURKEVICH J.Colloidal Gold.Part II:Colour,Coagulation,Adhesion,Alloying and Catalytic Properties[J].Gold Bull,1985,18(4):125-126.
Preparation, Characterization and Application of Gold Nanoparticles
ZHOURuilu,FUDayou,YUANDong,WUYongqiang,QIAOKangquan
(School of Chemical Engineering, Sichuan University of Science & Engineering, Zigong 643000, China)
With good optical and electronic properties, nano gold materials have become one of the hot spots in recent years. Nano gold solutions were prepared with chloroauric acid as raw material sodium citrate as reducing agent. Visual method, UV visible spectrophotometric method and scanning probe microscopy were used. The results showed that the gold nanoparticles were spherical and monodisperse. Using self-assembled monolayers principle, gold nanoparticles and DNA probes were fixed to the surface of glassy carbon electrode respectively to make probe electrode. Using electrochemical workstation to detect the signal, the results showed that the detection signal of the target DNA was enhanced and the detection sensitivity was improved, besides, the current response was greatly enhanced.
gold nanoparticle; gold labeling; DNA
2016-03-24
四川省教育厅重点项目(13ZA0123)
周睿璐(1991-),女,四川自贡人,硕士生,主要从事工业分析方面的研究,(E-mail)zrl1991808@163.com
1673-1549(2016)03-0014-05
10.11863/j.suse.2016.03.04
O611;O614.123
A
