黑曲霉F5产高温α-糖化酶酶学性质及产酒精能力研究
2016-11-04常吕珍杨云娟张润美李万军牟兴玲黄遵锡唐湘华
常吕珍,杨云娟,2,张润美,李万军,牟兴玲,黄遵锡,2,唐湘华,2
(1.云南师范大学生命科学学院,云南昆明650500;2.云南省生物质能与环境生物技术重点实验室,云南昆明650500)
黑曲霉F5产高温α-糖化酶酶学性质及产酒精能力研究
常吕珍1,杨云娟1,2,张润美1,李万军1,牟兴玲1,黄遵锡1,2,唐湘华1,2
(1.云南师范大学生命科学学院,云南昆明650500;2.云南省生物质能与环境生物技术重点实验室,云南昆明650500)
通过对黑曲霉F5的代谢产物糖化酶进行了酶学性质的研究,实验结果表明,该酶的最适反应温度为65℃,最适反应pH值为5.0。在80℃条件下热稳定半衰期为2.67 min;酶促动力学中,Km值为0.836 mg/mL,Vmax为2.255 mmoL/L·min。通过对1%的底物进行糖化实验,55 min后其DE值为67.5。产酒精能力测试中,料水比1∶3,添加30 IU/g原料的糖化酶,在65℃、pH5.0条件下酶解20 h,冷却接种1%液体酿酒酵母,以28℃培养9 d,酒精度为19.6%vol/60 g干物质,原料出酒率为32.2%(v/w)。
黑曲霉;糖化酶;酶学性质;半衰期;糖化率;酒精度
糖化酶(Glucoamylase,EC 3.2.1.1)又名葡萄糖淀粉酶,是一种酸性糖苷水解酶,从淀粉或者淀粉类似物的非还原端按顺序切开α-1,4糖苷键,也能水解α-1,6糖苷键、α-1,3糖苷键,产生葡萄糖。目前,糖化酶广泛用于燃料乙醇、固态白酒、饲料行业、抗菌素、有机酸、氨基酸等发酵工业和轻工纺织业,是世界上产量最大和用途最广的酶类[1-6]。
糖化酶的开发与创新是当前发展的一项重要任务,如何最大化提升糖化酶的功能和改造构建酶蛋白的热稳定性都是当前开发的研究方向。我国大量的科研工作者如贺莹[7]、粱新红等[8]对黑曲霉产酶性质进行了研究,发现黑曲霉产酶的最适温度在40~60℃之间,最适pH值在3.5~7.0之间;陈冠军等[9]对黑曲霉产酶热稳定性进行研究,发现糖化酶在60℃时易失活;刘洋[10]对黑曲霉糖化酶的热稳定性机制进行研究,发现向GAM-1和GAM-2中分别加入1 M山梨醇和海藻糖后,在75℃和80℃条件下,热失活常数减小,半衰期延长。在对糖化酶的应用研究中,王中林[11]、张严洪[12]、张守财[13]、郭本跃[14]等分别对不同的生产菌株进行产酒精能力测试,发现不同的生产菌在不同条件下获得的酒精含量不同。糖化酶的添加缩短了酒精发酵周期,提高了酵母产酒精能力。
本实验对高温α-糖化酶进行了酶学性质的分析及研究,并利用其糖化高粱原料进行产酒精能力测试,从云南小曲清香型酒的生产工艺考虑,旨在加强固态发酵的后续糖化能力和酒质的控制,加强原料的利用率。
1 材料与方法
1.1材料及仪器
黑曲霉F5,由云南师范大学微生物实验室选育保藏。
发酵培养基(%):马铃薯浸出汁30、蛋白胨2、磷酸二氢氨0.4、MgSO40.05、FeSO40.001、KCl 0.05、pH4.5,定容至100 mL。
仪器设备:移液枪、磁力搅拌器、离心机、超净台、电热恒温水浴锅、高压灭菌锅、摇床、涡旋振荡器、紫外分光光度计、pH计。
1.2实验方法
1.2.1葡萄糖标准曲线的制作[15]
1.2.2粗酶液的制备
配制发酵培养基100 mL,在121℃、0.1 MPa下灭菌30 min,冷却,接种培养3 d的1 cm2左右F5孢子菌丝体,在30℃、188 r/min条件下摇床培养4 d,取发酵培养液离心,上清液作为待测酶液使用。
1.2.3酶活力测定
取3支试管,分别编号为空白管、样品管A、样品管B,向3支管中分别加入pH5.0的1%可溶性淀粉底物1.8 mL,65℃保温5 min;向样品管A、B中加入一定稀释梯度的待测酶液0.2 mL,65℃精确保温15 min后加入3 mL DNS试剂终止反应,混合均匀;另向空白管中补加待测酶液0.2 mL;将3支管放入沸水浴中煮沸5 min,流水冷却,加入10 mL蒸馏水,涡旋振荡器上混匀,540 nm下测定吸光度。
酶活定义:在pH5.0、65℃条件下,1 mL酶液1 min水解1%的淀粉底物产生1 μmol还原糖所需要的酶量为1个酶活单位,用U表示。
1.3α-糖化酶最适反应温度、最适反应pH值的分析
最适反应温度的测定:取制备好的粗酶液分别在温度为20℃、30℃、40℃、50℃、55℃、60℃、65℃、70℃、75℃、80℃条件下反应15 min,测定酶活,分析最适反应温度。
最适反应pH值的测定:取制备好的粗酶液分别在pH值为3.0、4.0、5.0、6.0、7.0、8.0的1%淀粉底物中,65℃反应15 min,测定酶活,分析最适反应pH值。
1.4α-糖化酶耐热稳定性分析
将制备好的粗酶液放在80℃电热恒温水浴锅中分别保温0、10 min、20 min、30 min、40 min、50 min、60 min后取该保温不同时间的粗酶液进行酶活力测定,并分析其耐热稳定性。
1.5α-糖化酶反应动力学
分别配制pH5.0,浓度为0、1.25 mg/mL、2.5 mg/mL、5 mg/mL、10 mg/mL、20 mg/mL、40 mg/mL的可溶性淀粉底物各1.8 mL,放置于65℃条件下预热5 min,加入0.4 U的糖化酶反应5 min,测定还原糖含量,通过双倒数法计算Km和Vmax。
1.6α-糖化酶对淀粉底物的降解能力分析
取pH5.0,1%可溶性淀粉底物35 mL放置于65℃恒温水浴锅中预热5 min,然后加入5 mL酶液混合均匀,每隔5 min,取出1 mL测定还原糖含量,总反应时间为60 min。
1.7淀粉酶活力测定[16]
1.8α-糖化酶添加量对酵母发酵产酒精能力的影响
称取5份60 g的高粱经冲洗后将其分别放入5个300 mL的锥形瓶中,然后按3∶1的水料比加入热水浸泡24 h;以121℃、0.1 MPa灭菌30 min,将灭菌冷却后的高粱按每克原料添加5 U、10 U、15 U、20 U、25 U、30 U、35 U、40 U的糖化酶的比例添加,搅拌均匀放在65℃的恒温箱中反应1 d,然后每瓶加入3%经过活化的酵母10 mL搅拌均匀后放在28℃的恒温箱中发酵9 d,对发酵液蒸馏测定酒精含量。
2 结果与分析
2.1葡萄糖标准曲线的制作(图1)
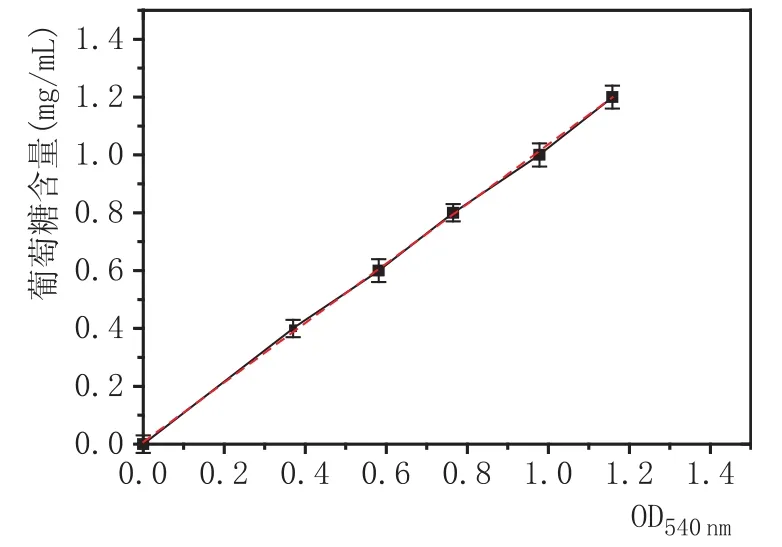
图1 葡萄糖标准曲线图
由图1可知,葡萄糖标准曲线为y=1.02907x+ 0.00731,R2=0.99941>0.95,线性关系显著,可用于后续的研究工作。
2.2α-糖化酶最适反应温度、最适反应pH值的分析
由图2、图3可知,黑曲霉F5菌株最适反应温度为65℃,低于50℃,酶活性不足,高于80℃则酶蛋白变性、失活;最适pH值为5.0,4~6之间,酶活力能保持80%以上,比较适合与淀粉酶配合使用进行糖化过程。

图2 最适反应温度

图3 最适反应pH值
2.3α-糖化酶耐热稳定性分析(图4)

图4 耐热稳定性分析
2.4α-糖化酶反应动力学

该由图5进行双倒数曲线的绘制得到图6,由图6得到公式:糖化酶的Km值为0.836 mg/mL,最大反应速度Vmax为2.255 mmoL(葡萄糖)/L·min。由图5和图6可知,该酶的动力学常数Km=0.836 mg/mL,Vmax=2.255 mmoL/L·min。 Km值越低,表明酶与底物的结合力大,有助于酶对底物的降解。
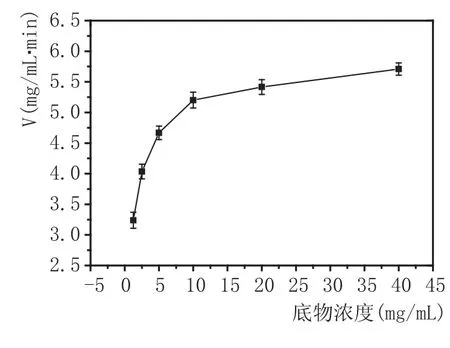
图5 酶反应动力学图
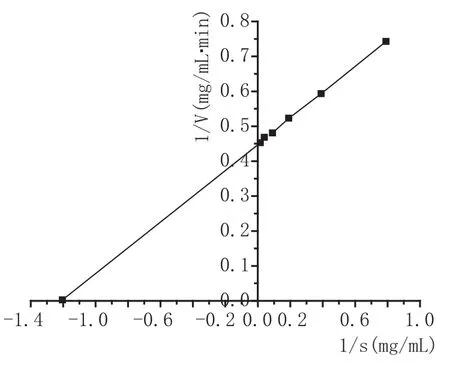
图6 酶反应动力学双倒数曲线图
2.5α-糖化酶对底物的降解能力分析(图7)
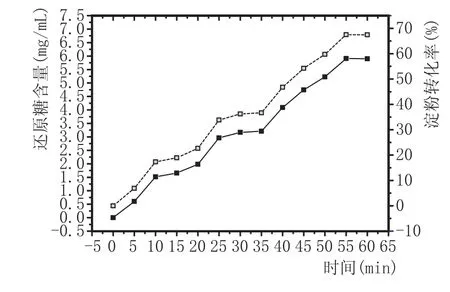
图7 酶对底物的降解实验图
由图7可看出,该酶添加量为1 U/mL,随着反应时间的延长,该酶得到的还原糖含量越来越高。当反应时间达到55 min时,形成的还原糖含量最大为5.90 mg/mL,淀粉转化率为67.51%。随着后期时间越来越长,还原糖含量维持平衡,糖化酶的催化能力受到一定的抑制效应。
2.6淀粉酶活力测定
按照国标GB/T 24401—2009对糖化酶中是否含有淀粉酶进行测定分析,得到淀粉酶活力为0.008 U,对粗酶液进行糖化酶的测定,得到糖化酶活力为91.3 U,表明该酶受到淀粉酶的协调效应很弱,该黑曲霉F5形成的产物基本上为糖化酶,对应用于只需糖化酶的其他产品开发带来了一定的运用价值。
2.7α-糖化酶添加量对产酒精能力的测试(图8)

图8 不同酶添加量对产酒精能力的影响
由图8可知,出酒率和酒精含量都呈上升趋势,出酒率为32.2%时,料水比为1∶3,酒精度达到19.6%vol/60 g干物质,该糖化酶在酒精发酵的应用中有助于提高原料利用率,能获得较高的酒精度。
3 结论
通过对黑曲霉F5的代谢产物糖化酶进行了酶学性质的研究,结果表明,该酶最适温度为65℃,最适pH5.0。该酶的耐热温度比国内报告的高,可以用于制糖行业、食品行业和饲料行业的应用。在80℃条件下进行耐热稳定性分析,得到半衰期为2.67 min,对在温度较高的饲料颗粒制造业中有一定的应用价值,只要在80℃条件下不超过2.67 min,就能保证50%以上的酶活。酶反应动力学中,Km为0.836 mg/mL,最大反应速度Vmax为2.255 mmoL/L·min,表明该酶对淀粉底物的结合程度较强,Km比方善康等[17]报道的以玉米淀粉为底物对糖化酶组分分析的要大,Vmax较小。但由于酶反应温度条件不一样,可比性较小。通过对1%的淀粉底物进行糖化转化实验,55 min后其DE值为67.5%。对淀粉酶活力进行测定只有0.08 U,粗酶液样品糖化酶活力为91.3 U/g,表明该酶受到淀粉酶的协调效应很弱。通过产酒实验发现,出酒率为32.2%时,酒精度为19.6%vol/60 g干物质,这比根霉糖化酶用于产酒精能力要强。从云南小曲清香型酒的生产工艺考虑,旨在加强固态发酵的后续糖化能力和酒质的控制,加强原料的利用率。
[1]吕丽华,梁丽荣,赵良启.高糖化酶活菌株的选育及其在山西老陈醋酿造中的应用[J].食品与发酵工业,2007,33(9):83-85.
[2]Giordano R L C,Trovati J,Schmidell W.Continuous production of ethanol from starch using glucoamylase and yeast co-immobilized in pectin gel[J].Applied Biochemistry& Biotechnology,2008,147(1-3):47-61.
[3]Wallis G L,Swift R J,Hemming F W,et al.Glucoamylase overexpression and secretion inAspergillus niger:analysis of glycosylation[J].Biochimica et BiophysicaActa,1999,1472(3):576-586.
[4]Kumar P,Satyanarayana T.Optimization of culture variables for improving glucoamylase production by alginate-entrapped Thermomucor indicae-seudaticae using statistical methods[J]. Bioresource Technology,2007,98(6):1252-1259.
[5]李冰洁.黑曲霉变异株Sp-56在糖化酶生产工业中的应用[J].微生物学杂志,1995(1):16-20.
[6]单海艳.黑曲霉生产糖化酶及酶活测定[J].牡丹江大学学报,2010,19(7):92-94.
[7]贺莹.黑曲霉产糖化酶发酵工业优化及酶学特性研究[J].山西大学,2012(6):14-42.
[8]梁新红,孙俊良,唐玉,等.黑曲霉糖化酶分离纯化与酶学性质研究[J].河南科技学院学报(自然科学版),2011,39(4):24-27.
[9]陈冠军,曹淑桂,罗贵民,等.黑曲霉糖化酶热稳定性的研究[J].中国生物工程杂志,1990(3):29-33.
[10]刘洋.黑曲霉糖化酶的表征及热稳定机制研究[D].长春:吉林大学,2013.
[11]王中林,王念伟,梅文星.以糖化酶和AADY提高曲酒产酒率[J].酿酒科技,1996(1):72-74.
[12]张严洪.用AADY糖化酶和大曲酒丢糟生产优质酒[J].酿酒科技,1993(4):80-81.
[13]张守财.酒精活性干酵母与糖化酶在大曲酒压窖后转排生产中的应用[J].酿酒科技,2007(3):68-70.
[14]郭本跃.生香ADY、TH-AADY、己酸菌液和糖化酶混合使用提高浓香型曲酒的质量[J].酿酒科技,2002(5):87-89.
[15]孔维瑞,郭福宗,唐湘华,等.产糖化酶根霉菌的分离及其酶学性质研究[J].酿酒科技,2012(9):32-35.
[16]全国食品工业标准化技术委员会.α淀粉酶制剂:GB/T 24401—2009[S].北京:中国标准出版社,2010.
[17]方善康,周凤臻.黑曲霉S4生淀粉糖化酶纯化组分的性质及其动力学常数[J].工业微生物,1994,24(2):5-9.
Enzymatic Properties and Alcohol-Producing Capacity of High-Temperature α-glucoamylase from Aspergillus Niger F5
CHANG Lvzhen1,YANG Yunjuan1,2,ZHANG Runmei1,LI Wanjun1,MOU Xingling1,HUANG Zunxi1,2and TANG Xianghua1,2
(1.School of Life Science,Yun'nan Normal University,Kunming,Yun'nan 650500;2.Yun'nan Key Lab for Biomass Energy and Environmental Biotechnology,Kunming,Yun'nan 650500,China)
α-glucoamylase,the metabolite of Aspergillus niger F5,its enzymatic properties were investigated in this study.The experimental results showed that,its optimum reaction temperature was 65℃,its best reaction pH was 5.0,the half-life of enzymatic thermal stability was 2.67 min at 80℃;in enzymatic kinetics,Kmvalue was 0.836 mg/mL,and Vmaxvalue was 2.255 mmoL/L·min.Saccharification experiments showed that saccharification rate was 67.5%for 1%starch concentration in optimum reaction conditions after 55 min.In alcohol-producing capacity test,the ratio of sorghum material to water was 1∶3,30 IU/g glucoamylase was added at 65℃and pH 5.0.After 20 h hydrolysis and cooling,1%liquid S.cerevisiae was inoculated,and then cultivated for 9 d at 28℃.Finally,the alcohol concentration was 19.6%vol/60 g(dry substance),and liquor yield of sorghum materials reached up to 32.2%(v/w).
Aspergillus niger;glucoamylase;enzymatic properties;half-life;saccharification rate;alcohol
TQ920;Q55;TS262.3
A
1001-9286(2016)10-0030-04
10.13746/j.njkj.2016154
2014年云南师范大学大学生科研训练基金项目;生物能源持续开发利用教育部工程中心开发基金(JK2015021)。
2016-05-03
常吕珍(1990-),女,云南镇雄人,在读本科生,生物技术专业,E-mail:changlvzhen2011@126.com。
唐湘华(1973-),男,讲师,从事应用微生物发酵工程研究,E-mail:txhdom@163.com。
优先数字出版时间:2016-07-11;地址:http://www.cnki.net/kcms/detail/52.1051.TS.20160711.1050.002.html。
