过表达RhoD对人黑素瘤A375细胞骨架和迁移侵袭的影响
2016-11-02温斯健倪娜娜周晓伟吴琼王小坡宋昊张韡孙建方
温斯健 倪娜娜 周晓伟 吴琼 王小坡 宋昊 张韡 孙建方
210042南京,中国医学科学院 北京协和医学院 皮肤病研究所病理科(温斯健、吴琼、王小坡、宋昊、张韡、孙建方),江苏省皮肤病性病分子生物学重点实验室(倪娜娜、周晓伟)
过表达RhoD对人黑素瘤A375细胞骨架和迁移侵袭的影响
温斯健 倪娜娜 周晓伟 吴琼 王小坡 宋昊 张韡 孙建方
210042南京,中国医学科学院 北京协和医学院 皮肤病研究所病理科(温斯健、吴琼、王小坡、宋昊、张韡、孙建方),江苏省皮肤病性病分子生物学重点实验室(倪娜娜、周晓伟)
目的探讨RhoD对人黑素瘤细胞株A375细胞骨架、迁移和侵袭能力等的影响及作用机制。方法实验分为A375⁃RhoD组和A375⁃增强型绿色荧光蛋白(EGFP)组,分别用携带RhoD的慢病毒载体和阴性对照慢病毒载体转染。罗丹明标记鬼笔环肽染色观察细胞骨架,Transwell小室实验检测细胞的迁移和侵袭能力,流式细胞仪检测细胞周期,Western印迹法检测丝切蛋白、磷酸化丝切蛋白、Diaph2和RhoD的表达。结果与A375⁃EGFP组细胞相比,A375⁃RhoD组细胞体积增大,应力纤维变细,软弱无力,黏着斑增多;丝状伪足形成增加;皱褶缘和板状伪足无明显变化。Transwell迁移实验显示,A375⁃EGFP组和A375⁃RhoD组平均每200倍视野下穿膜细胞数分别为152.67±11.23和72.67±5.03,两组间差异有统计学意义(t=11.25,P<0.05)。Transwell人工基底膜侵袭试验显示,A375⁃EGFP组和A375⁃RhoD组平均每200倍视野下穿膜细胞数分别为78.33±12.34和9.00±1,两组间差异有统计学意义(t=9.70,P< 0.05)。A375⁃EGFP和A375⁃RhoD两组间G1期、S期和G2期细胞所占百分比差异均无统计学意义(P>0.05)。Western印迹结果显示,A375⁃RhoD组细胞可在RhoD的刺激下激活下游信号效应分子Diaph2,促进其表达,而A375⁃EGFP组未能激活,两组间丝切蛋白和磷酸化丝切蛋白表达差异不显著。结论RhoD过表达可能通过下游效应分子Diaph2调节细胞骨架进而抑制A375细胞的迁移和侵袭能力。
黑色素瘤,实验性;GTP磷酸水解酶类;细胞骨架;细胞迁移分析;A375细胞;RhoD
皮肤恶性黑素瘤(CMM)侵袭和转移机制尚未完全阐明。细胞骨架的重塑和细胞运动是黑素瘤细胞迁移和侵袭所必须的,影响细胞骨架和运动的因素必然影响黑素瘤细胞的迁移和侵袭[1]。RhoD是Rho家族成员之一,通过参与应力纤维形成、黏着斑运动、细胞运动和迁移、囊泡运输、细胞分裂等参与肿瘤细胞的侵袭过程[2]。我们设计并构建RhoD慢病毒载体并转染人黑素瘤A375细胞,观察转染前后A375细胞骨架、运动及侵袭能力等改变,分析RhoD对黑素瘤细胞体外生物学行为的影响,初步探索其作用的可能分子机制。
材料与方法
一、细胞培养和试剂
人黑素瘤A375细胞株:中国医学科学院皮肤病医院保存细胞株。慢病毒过表达RhoD载体及其阴性对照慢病毒载体[不含目的基因RhoD,含增强型绿色荧光蛋白(EGFP)]来自广州赛业生物科技有限公司。RhoD、Diaph2、丝切蛋白(cofilin)、磷酸化丝切蛋白(P⁃cofilin)和β肌动蛋白一抗、辣根过氧化物酶标记的羊抗兔二抗(英国Abcam公司),Transwell小室(美国Corning公司),Matrigel胶(美国BD公司),细胞周期检测试剂盒(南京凯基生物技术股份有限公司),罗丹明标记鬼笔环肽(上海翊圣生物科技有限公司),化学发光液和聚偏氟乙烯(PVDF)膜(美国Millipore公司),丙烯酰胺、四甲基乙二胺(TEMED)、十二烷基硫酸钠(SDS)和牛血清白蛋白(BSA)(美国Sigma公司)。
二、细胞分组及处理
实验分为A375⁃RhoD组和A375⁃EGFP组,分别用携带RhoD的慢病毒载体和阴性对照慢病毒载体转染。72 h后流式细胞仪分析转染效率。
三、罗丹明标记的鬼笔环肽染色观察细胞骨架
A375⁃EGFP和A375⁃RhoD细胞分别用0.25%胰酶消化,计数,以4×105个/ml接种到放有盖玻片的6孔板中,添加培养基至2 ml,培养24 h。PBS洗3遍,4%多聚甲醛固定30 min,0.2%Triton X⁃100透膜10 min,PBS洗涤3次,每次5 min,1 ml 2%BSA封闭2 h,加封闭液稀释的鬼笔环肽4℃孵育过夜。纯水洗3次,每次5 min。添加4′,6⁃二脒基⁃2⁃苯基吲哚(DAPI),孵育5 min,纯水洗6次,每次5 min。在载玻片上滴3~4 μl 50%甘油,将盖玻片倒扣在上面,用封片液封住盖玻片四周,晾干,超高分辨率激光共聚焦显微镜观察细胞骨架。
四、Transwell迁移和侵袭试验
胰酶消化并重悬,计数A375⁃EGFP和A375⁃RhoD细胞。取24孔板,加入500 μl无血清培养基至刚好接触Transwell底部。取2×104细胞混合在500 μl含10%血清的培养基中,接种到Transwell上室中(迁移实验和侵袭实验的不同在于后者要事先在Transwell小室内加制一层人工基底膜Matrigel胶),37℃、5%CO2培养箱中培养5 h至细胞完全贴壁。将培养基去掉,Transwell上室中添加无血清培养基,下室添加含10%血清的培养基继续培养过夜。4%多聚甲醛固定30 min,用DAPI染色10 min。纯水洗涤6遍,每遍5 min。倒置荧光显微镜观察穿膜细胞数并进行统计。
五、细胞周期检测
取对数生长期A375⁃EGFP和A375⁃RhoD两组细胞,胰蛋白酶消化、计数,按相同密度接种于直径6 cm细胞培养皿,72 h后分别收获约1×106个细胞于离心管,258×g离心5 min,收集细胞沉淀,冷PBS洗涤2次,弃上清,每管加预冷的75%乙醇1 ml固定,4℃过夜。PBS洗涤细胞2次,弃上清,加入100 μl不含DNA酶的RNA酶A,37℃水浴30 min;400 μl碘化丙啶(PI,50 g/L),4℃避光孵育 30 min。上机检测,记录激发波长488 nm处红色荧光。实验重复3次。
六、Western印迹检测Diaph2、丝切蛋白、磷酸化丝切蛋白和RhoD蛋白表达
A375⁃EGFP和A375⁃RhoD两组细胞转染72 h后提取总蛋白,并用BCA蛋白测定试剂盒检测总蛋白浓度。将等量样品通过SDS⁃聚丙烯酰胺凝胶电泳(PAGE)后转膜。分别加入不同浓度一抗4℃孵育过夜,清洗后二抗室温孵育1.5 h。β肌动蛋白作为内参照。
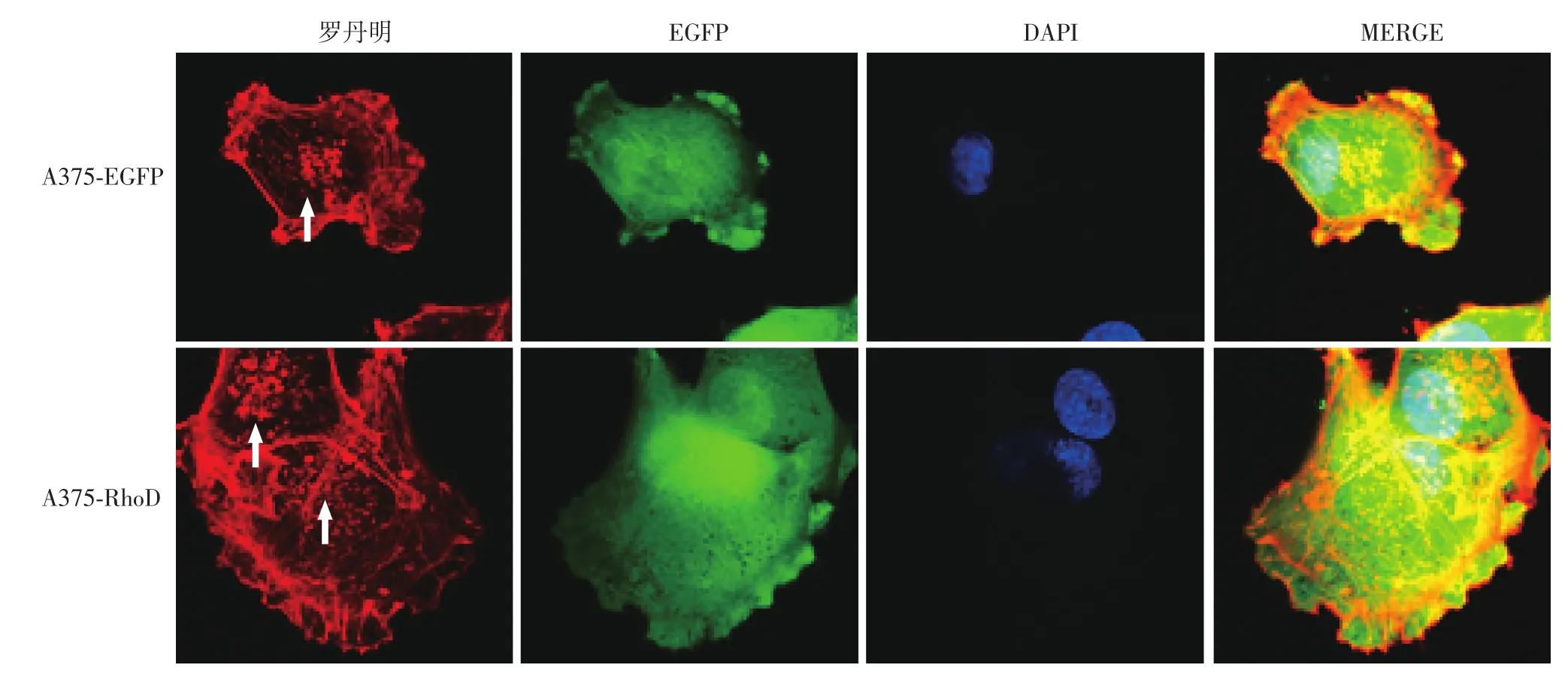
图1 超分辨率激光共聚焦显微镜观察A375⁃增强型绿色荧光蛋白(EGFP)和A375⁃RhoD细胞微丝骨架的改变(×63) 肌动蛋白丝被罗丹明染成红色,绿色代表转染了携带EGFP的病毒颗粒,4′,6⁃二脒基⁃2⁃苯基吲哚(DAPI)将细胞核染成蓝色,MERGE是前三种颜色的合成图。与A375⁃EGFP组细胞相比,A375⁃RhoD组细胞体积增大,应力纤维变细,黏着斑增多(如箭头所示),丝状伪足形成增加,皱褶缘和板状伪足无明显变化
七、统计学方法
结 果
一、慢病毒转染目的细胞A375
转染A375细胞72 h后,荧光显微镜下可观察到明显的绿色荧光,约90%的细胞表达EGFP。流式细胞仪检测显示,A375⁃EGFP细胞EGFP表达率为97.3%,A375⁃RhoD细胞EGFP表达率为82.9%。
二、细胞骨架的改变
见图1。罗丹明标记的鬼笔环肽染色后,与A375⁃EGFP细胞对比,A375⁃RhoD细胞体积增大,应力纤维变细,软弱无力,黏着斑增多;丝状伪足形成增加;皱褶缘和板状伪足无明显变化。
三、转染RhoD对A375细胞迁移的影响
见图2。A375⁃EGFP组和A375⁃RhoD组穿膜细胞数分别为152.67±11.23和72.67±5.03,两组差异有统计学意义(t=62.9,P=0.00)。
四、转染RhoD对A375细胞侵袭的影响
见图3。A375⁃EGFP组和A375⁃RhoD组穿膜细胞数分别为78.33±12.34和9.00±1.00,两组差异有统计学意义(t=9.69,P=0.001)。
五、转染RhoD对细胞周期的影响
见图4。A375⁃EGFP组G1期、S期和G2期细胞百分比分别为(55.96±2.37)%、(18.93±2.37)%、(22.40±2.52)%,A375⁃RhoD组分别为(55.23±4.27)%、(22.70 ± 2.76)%、(20.13 ± 1.91)%,两组各期细胞所占百分比差异均无统计学意义(t值分别为0.26、1.79和1.24,均P>0.05)。
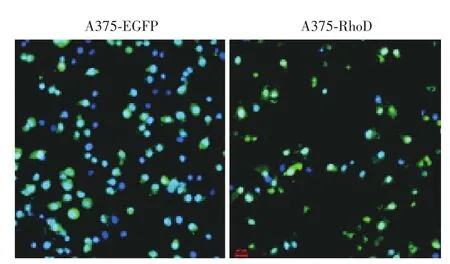
图2 荧光显微镜观察A375⁃增强型绿色荧光蛋白(EGFP)和A375⁃RhoD细胞迁移情况(× 200) 蓝色代表4′,6⁃二脒基⁃2⁃苯基吲哚(DAPI)染色,绿色代表EGFP。A375⁃EGFP组穿膜细胞数多于A375⁃RhoD组

图3 荧光显微镜观察A375⁃增强型绿色荧光蛋白(EGFP)和A375⁃RhoD细胞侵袭情况(× 200) 蓝色代表4′,6⁃二脒基⁃2⁃苯基吲哚(DAPI)染色,绿色代表EGFP。A375⁃EGFP组细胞穿膜细胞数多于A375⁃RhoD组细胞

图4 流式细胞仪检测A375⁃EGFP和A375⁃RhoD细胞周期变化
六、Diaph2、丝切蛋白、磷酸化丝切蛋白和RhoD蛋白表达
Western印迹法检测显示,转染后A375⁃RhoD组RhoD表达量明显增高,Diaph2表达升高,而丝切蛋白和磷酸化丝切蛋白在两组中表达量差异不显著。见图5。
讨 论
Rho蛋白是一种相对分子质量为21 000~30 000的单体鸟核苷酸调节蛋白(G蛋白),因其具有GTP酶活性,又被称为Rho GTP酶。Rho GTP酶属于小G蛋白家族,目前在人类已发现该家族至少有20多种蛋白质成员,分为8个亚组[3],主要功能是调节细胞骨架和影响细胞的运动和迁移,此外还参与胞质分裂、细胞增殖、形态发生、轴突生长等过程[4]。近年研究发现,Rho GTP酶在多种恶性肿瘤中异常表达,所介导的细胞运动可能在恶性肿瘤细胞的侵袭和转移、细胞恶性转化方面发挥重要作用[5]。Rho GTP酶在多种恶性肿瘤中异常表达,并与肿瘤进展密切相关[6]。如RhoA在睾丸癌[7]和乳腺癌[8]中表达升高并且与肿瘤进展相关;RhoC在炎症性乳癌[9]和结直肠癌[10]中表达升高;Rac1在乳腺癌[8]和白血病[11]中表达升高;Cdc42在非小细胞肺癌[12]中表达升高;RhoB在乳腺癌[8]中表达异常升高并且与肿瘤进展相关。而另外的一些研究则发现,RhoB在鳞癌中表达下降[13],在进展期肺癌则表达缺失[14],提示RhoB可能发挥抑制肿瘤的作用。
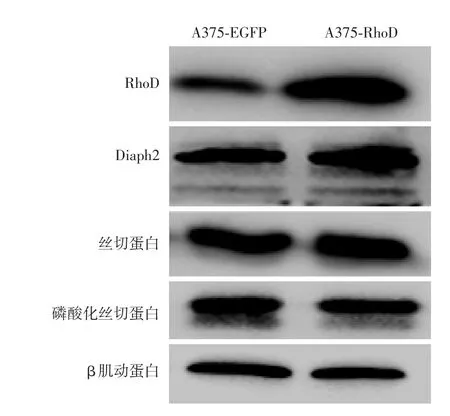
图5 Western印迹检测两组A375细胞中丝切蛋白、磷酸化丝切蛋白、Diaph2和RhoD蛋白的表达
关于RhoD在黑素瘤发生发展中的可能作用至今尚未见报道。我们构建慢病毒过表达RhoD载体并将其转入人黑素瘤细胞株A375,通过荧光显微镜观察、流式细胞仪计算转染效率以及Western印迹法检测转染后RhoD的表达量,以上实验均表明慢病毒载体成功转染并高表达,可用于研究RhoD在细胞中的作用。
Transwell小室跨膜迁移和侵袭实验结果显示,转染RhoD的A375细胞不管是跨膜运动能力还是侵袭能力均明显下降。一项采用phagokinetic移动轨道法的研究显示,表达显性激活突变体RhoD/G26V后,在成纤维细胞中出现细胞迁移能力下降[15]。还有研究发现,不管趋化因子(如成纤维细胞生长因子)是否存在,过表达RhoD/G26V的内皮细胞运动能力均明显下降[16]。本研究结果与文献报道相一致,RhoD可以抑制细胞的运动和侵袭能力。
RhoD对细胞迁移和侵袭的影响可能通过其对细胞骨架的影响来实现。RhoD对肌动蛋白系统的组装有重要影响,已证实RhoD在几株细胞系中均可以诱发外周突起形成,如BHK、HELA、NIH3T3和猪主动脉内皮细胞[17⁃18]。细长丝状伪足的形成总伴随着短束状肌动蛋白丝的组装[18]。与传统的应力纤维由长的平行束状的肌动蛋白丝组装不同,RhoD 诱导的应力纤维常失去极性[18⁃19]。组成性表达显性激活突变体RhoD/G26V后,细胞会形成短且无序的应力纤维,且抑制细胞的运动,这可能与黏着斑形成的减少有关[15]。结合本实验结果和相关文献,认为RhoD正是通过改变细胞骨架,尤其是使黏着斑增加,进而使应力纤维变细、无序和无力等达到抑制肿瘤细胞运动、迁移和侵袭的作用。Diaph2是RhoD特征性的下游效应物,RhoD诱导的细胞骨架改变需要Diaph2的共同参与[20]。Western印迹结果显示,转染RhoD使其过表达后,Diaph2亦随之激活,其蛋白表达量上升,而丝切蛋白和磷酸化丝切蛋白表达量不变。说明RhoD正是通过Diaph2调节细胞的应力纤维和黏着斑的形成影响黑素瘤细胞迁移和侵袭。
有文献报道[15],转染RhoD会诱导培养的细胞出现多核化。显微注射显性激活突变体RhoD(G26V)到非洲爪蟾的受精卵和胚胎中会导致细胞的分裂受阻并出现多个细胞核。这些结果提示RhoD并不影响细胞核的分裂,但是可能通过阻止收缩环(由肌动蛋白组成)的形成进一步干扰胞质分裂。我们在实验过程中发现,转染RhoD的细胞亦有多核形成,细胞体积明显增大;细胞周期检测表明,RhoD过表达对细胞周期无影响。因此,我们认为RhoD并不影响细胞核的分裂,而是通过影响细胞骨架进而影响其胞质分裂。
综上所述,本次研究证明,RhoD过表达可以通过Diaph2调节细胞的应力纤维和黏着斑形成,改变细胞骨架进而抑制细胞的迁移和侵袭能力;RhoD过表达还可能抑制胞质分裂。这可能为黑素瘤侵袭和转移的靶向治疗提供一定的理论依据,RhoD有可能成为黑素瘤转移治疗的新靶点。
[1]Espinha G,Osaki JH,Costa ET,et al.Inhibition of the RhoA GTPase activity increases sensitivity of melanoma cells to UV radiation effects[J].Oxid Med Cell Longev,2016,2016:2696952.DOI:10.1155/2016/2696952.
[2]Aspenström P.Atypical Rho GTPases RhoD and Rif integrate cytoskeletal dynamics and membrane trafficking[J].Biol Chem,2014,395(5):477⁃484.DOI:10.1515/hsz⁃2013⁃0296.
[3]Orgaz JL,Herraiz C,Sanz⁃Moreno V.Rho GTPases modulate malignant transformation of tumor cells[J].Small GTPases,2014,5:e29019.DOI:10.4161/sgtp.29019.
[4]Rath N,Olson MF.Rho⁃associated kinases in tumorigenesis:re⁃considering ROCK inhibition for cancer therapy[J].EMBO Rep,2012,13(10):900⁃908.DOI:10.1038/embor.2012.127.
[5]Jaffe AB,Hall A.Rho GTPases:biochemistry and biology[J].Annu Rev Cell Dev Biol,2005,21:247⁃269.DOI:10.1146/annurev.cellbio.21.020604.150721.
[6]Sahai E,Marshall CJ.RHO ⁃GTPases and cancer[J].Nat Rev Cancer,2002,2(2):133⁃142.DOI:10.1038/nrc725.
[7]Kamai T,Yamanishi T,Shirataki H,et al.Overexpression of RhoA,Rac1,and Cdc42 GTPases is associated with progression in testicular cancer[J].Clin Cancer Res,2004,10(14):4799 ⁃4805.DOI:10.1158/1078⁃0432.CCR⁃0436⁃03.
[8]Fritz G,Brachetti C,Bahlmann F,et al.Rho GTPases in human breast tumours:expression and mutation analyses and correlation with clinical parameters[J].Br J Cancer,2002,87(6):635⁃644.DOI:10.1038/sj.bjc.6600510.
[9]van Golen KL,Wu ZF,Qiao XT,et al.RhoC GTPase,a novel transforming oncogene for human mammary epithelial cells that partially recapitulates the inflammatory breast cancer phenotype[J].Cancer Res,2000,60(20):5832⁃5838.
[10]Wang HB,Liu XP,Liang J,et al.Expression of RhoA and RhoC in colorectal carcinoma and its relations with clinicopathological parameters[J].Clin Chem Lab Med,2009,47(7):811⁃817.DOI:10.1515/CCLM.2009.186.
[11]Wang J,Rao Q,Wang M,et al.Overexpression of Rac1 in leukemia patients and its role in leukemia cell migration and growth[J].Biochem Biophys Res Commun,2009,386(4):769⁃774.DOI:10.1016/j.bbrc.2009.06.125.
[12]Liu Y,Wang Y,Zhang Y,et al.Abnormal expression of p120⁃catenin,E⁃cadherin,and smallGTPasesissignificantly associated with malignant phenotype of human lung cancer[J].Lung Cancer,2009,63(3):375⁃382.DOI:10.1016/j.lungcan.2008.12.012.
[13]Adnane J,Muro⁃Cacho C,Mathews L,et al.Suppression of rho B expression in invasive carcinoma from head and neck cancer patients[J].Clin Cancer Res,2002,8(7):2225⁃2232.
[14]Mazieres J,Antonia T,Daste G,et al.Loss of RhoB expression in human lung cancer progression[J].Clin Cancer Res,2004,10(8):2742⁃2750.
[15]Tsubakimoto K,Matsumoto K,Abe H,et al.Small GTPase RhoD suppresses cell migration and cytokinesis[J].Oncogene,1999,18(15):2431⁃2440.DOI:10.1038/sj.onc.1202604.
[16]Murphy C,Saffrich R,Olivo⁃Marin JC,et al.Dual function of rhoD in vesicular movement and cell motility[J].Eur J Cell Biol,2001,80(6):391⁃398.DOI:10.1078/0171⁃9335⁃00173.
[17]Murphy C,Saffrich R,Grummt M,et al.Endosome dynamics regulated by a Rho protein[J].Nature,1996,384(6608):427⁃432.DOI:10.1038/384427a0.
[18]Gad AK,Nehru V,Ruusala A,et al.RhoD regulates cytoskeletal dynamics via the actin nucleation⁃promoting factor WASp homologue associated with actin Golgi membranes and microtubules[J].Mol Biol Cell,2012,23(24):4807⁃4819.DOI:10.1091/mbc.E12⁃07⁃0555.
[19]Aspenström P,Fransson A,Saras J.Rho GTPases have diverse effects on the organization of the actin filament system[J].Biochem J,2004,377(Pt 2):327⁃337.DOI:10.1042/BJ20031041.
[20]Koizumi K,Takano K,Kaneyasu A,et al.RhoD activated by fibroblastgrowth factor induces cytoneme⁃like cellular protrusions through mDia3C[J].Mol Biol Cell,2012,23(23):4647⁃4661.DOI:10.1091/mbc.E12⁃04⁃0315.
Effects of RhoD overexpression on the cytoskeleton,migration and invasion of a human melanoma cell line A375
Wen Sijian,Ni Nana,Zhou Xiaowei,Wu Qiong,Wang Xiaopo,Song Hao,Zhang Wei,Sun Jianfang
Department of Pathology,Institute of Dermatology,Chinese Academy of Medical Sciences and Peking Union Medical College,Nanjing 210042,China(Wen SJ,Wu Q,Wang XP,Song H,Zhang W,Sun JF);Jiangsu Key Laboratory of Molecular Biology for Skin Diseases and STIs,Institute of Dermatology,Chinese Academy of Medical Sciences and Peking Union Medical College,Nanjing 210042,China(Ni NN,Zhou XW)Corresponding author:Sun Jianfang,Email:fangmin5758@aliyun.com
ObjectiveTo evaluate effects of RhoD overexpression on the cytoskeleton,migration and invasion of a human melanoma cell line A375,and to explore their mechanisms.MethodsCultured A375 cells were divided into 2 groups to be transfected with a lentiviral vector carrying the RhoD gene(A375⁃RhoD group)and a negative lentiviral vector expressing enhanced green fluorescent protein(EGFP)(A375⁃EGFP group)respectively.After additional culture for 24 hours,rhodamine⁃phalloidin was used to stain cytoskeletal proteins,Transwell assay was conducted to evaluate migratory and invasive activities of cells,flow cytometry to estimate cell cycle distribution,and Western⁃blot analysis to measure protein expressions of cofilin,phosphorylated cofilin(p⁃cofilin),Diaph2 and RhoD.ResultsCompared with the A375⁃EGFP group,the A375⁃RhoD group showed larger cells with thinner,softer and weaker stress fibers,more focal adhesions and filopodias,but no obvious changes in lamellipodias or ruffled borders.Transwell assay showed that the number of A375 cells crossing the polycarbonate membrane as well as that crossing the artificial basement membrane(matrigel)per high⁃power field(× 200)were significantly smaller in the A375⁃RhoD group than in the A375⁃EGFP group(migration assay:72.67±5.03vs.152.67±11.23,t=11.25,P<0.05;invasion assay:9.00±1.00vs.78.33±12.34,t=9.70,P<0.05).There were no significant differences in proportions of cells in G1,S or G2 phase between the two groups(allP> 0.05).Western⁃blot analysis showed that RhoD overexpression activated and promoted the expression of the downstream signaling protein Diaph2 in the A375⁃RhoD group,which was not observed in the A375⁃EGFP group.In addition,there were no significant differences in expressions of cofilin or p⁃cofilin between the two groups.ConclusionOverexpression of RhoD may regulate the cytoskeleton and suppress migratory and invasive activities of A375 cells by activating the downstream effector molecule Diaph2.
Melanoma,experimental;GTP phosphohydrolases;Cytoskeleton;Cell migration assays;A375 cells;RhoD
孙建方,Email:fangmin5758@aliyun.com
10.3760/cma.j.issn.0412⁃4030.2016.12.009
国家自然科学基金(81272992);江苏省自然科学基金(BK20131063)
Fund programs:National Natural Science Foundation of China(81272992);Natural Science Foundation of Jiangsu Province of China(BK20131063)
2016⁃01⁃18)
(本文编辑:尚淑贤)
