UPLC-MS/MS法测定乳品中L-羟脯氨酸的含量
2016-11-01黄蓓蓓
黄蓓蓓
(三门峡职业技术学院,河南三门峡472000)
UPLC-MS/MS法测定乳品中L-羟脯氨酸的含量
黄蓓蓓
(三门峡职业技术学院,河南三门峡472000)
采用超高效液相色谱-串联质谱法(UPLC-MS/MS)测定乳制品中L-羟脯氨酸的含量。试样经牛蛋白酶酶解,乙腈萃取,HLB固相萃取柱净化后,UPLC BEH C18色谱柱分离,多反应监测(MRM)模式,定量离子对(m/z):132.1/86.2;定性离子对(m/z):132.1/68.3。结果表明:L-羟脯氨酸加标回收率在94.53%~98.42%之间,相对标准偏差不大于7.3%;按信噪比RSN=10计算,方法定量限(LOQ)为5.0μg/kg。
超高效液相色谱-串联质谱法;L-羟脯氨酸;乳制品;测定
动物水解蛋白是由动物皮革及其制品下脚料等水解得到的蛋白质,长期误食,可导致关节疏松、肿大,造成重金属中毒。2009年卫生部公布《食品中可能违法添加的非食用物质和易滥用的食品添加剂品种名单(第二批)》中明确规定:乳及乳制品、含乳饮料中不得添加水解动物蛋白。然而部分违规企业为降低生产成本,经常会在鲜奶、奶粉等乳品中掺入动物水解蛋白,以期提高乳品中蛋白质含量,这严重影响了乳品加工企业产品质量,威胁消费者人身健康,尤其是婴幼儿、孕产妇、病人等特殊人群。L-羟脯氨酸是动物水解蛋白中特征性氨基酸,约占胶原蛋白氨基酸总量的10%,而乳蛋白质中不含L-羟脯氨酸[1]。为此,L-羟脯氨酸已作为检测乳及乳制品中是否非法掺入动物水解蛋白的重要标示物。
目前,国内外对L-羟脯氨酸的检测方法主要有分光光度法[2]、液相色谱法[3]、氨基酸分析仪法[4]、毛细管电泳-激光诱导荧光检测法[5]等,而这几种方法存在样品前处理复杂,特异性、灵敏度、准确度较差等缺点;而液相色谱-质谱法是通过液相色谱将待测样品中的有机物分离,再利用质谱对分开的有机物逐个的分析,得到有机物分子量、结构和浓度等信息,显著提高了检测方法的准确度、灵敏度。但目前关于超高效液相色谱-串联质谱法(UPLC-MS/MS)测定乳制品中L-羟脯氨酸含量的相关研究较少。本文以乳制品为研究对象,探索超高效液相色谱-串联质谱法测定乳制品中L-羟脯氨酸含量的分析方法,为乳制品行政监督部门、检测机构、乳制品加工企业提供实际的检测方法参考。
1 材料与方法
1.1 仪器与试剂
超高效液相色谱-串联四极杆质谱仪(Waters Acquity UPLC Quattro Premier XE):美国沃特世公司;电子分析天平(XS-205型):赛多利斯北京有限公司;超纯水器(Milli-Q型):美国Millipore公司;有机微孔滤膜(0.22 μm):岛津企业管理(中国)有限公司;固相萃取装置(DG-24B型):美国Supelco公司。
L-羟脯氨酸标准溶液(1 000 μg/mL):准确称取L-羟脯氨酸标准品100 mg(精确至0.1 mg),用0.01 mol/L盐酸溶解并定容至100 mL,-4℃以下避光保存。
奶粉、酸奶、鲜奶:购自当地超市。所用试剂除特别标注外均为分析纯试剂,水为超纯水。L-羟脯氨酸标准物质(L-Hydroxyproline,C5H9NO3,CAS:51-35-4),纯度≥99.5%:购自美国SIGMA公司;乙腈、甲醇、正己烷(色谱纯):德国默克公司;氮气、氩气(纯度≥99.99%):张家口市宣化燕山气体有限公司;HLB固相萃取小柱(200 mg/3 mL):美国Waters公司。
1.2 仪器工作条件
1.2.1 色谱条件
ACQUITY UPLC BEH C18(2.1 mm×150 mm,1.7 μm)色谱柱;流动相A:乙腈;流动相B:0.1%甲酸水溶液;流速:0.2 mL/min;柱温:30℃;梯度洗脱程序见表1。

表1 梯度洗脱程序Table 1 Gradient elution program of the mobile phase
1.2.2 质谱条件
电离方式:电喷雾电离,正离子模式,ESI(+);检测方式:多反应监测(MRM);离子源温度:150℃;脱溶剂气:氮气,600 L/h,350 ℃;锥孔气:氮气,45 L/h;碰撞气:氩气;喷雾电压:2.5 kV;定性离子对(m/z):132.1/68.3;定量离子对(m/z):132.1/86.2;锥孔电压:20 V;碰撞电压:25 V。
1.3 样品前处理
称取固态试样2 g(精确至0.01 g)置于50 mL塑料离心管中,100 mmol/L甲酸铵缓冲盐溶液5 mL,牛蛋白酶液50 μL,漩涡混合2 min,50℃下酶解3 h后,加入5 mL乙腈,涡旋振荡2 min,以10 000 r/min离心5 min,上清液用HLB小柱净化,待自然流干后,用0.1%甲酸-乙腈4 mL清洗上述离心管,并将清洗液依次过柱,收集全部流出液体,35℃水浴氮气吹至近干,准确加入1.0 mL乙腈-甲酸水溶液超声2 min后再涡旋溶解,经0.22 μm微孔滤膜过滤,供超高效液相色谱-串联质谱仪测定。
1.4 标准曲线绘制
称取相同基质的空白试样6份,每份2 g,分别加入适量的标准工作溶液,制备成含L-羟脯氨酸浓度依次为 5.0、10.0、20.0、50.0、100.0 μg/kg 的样品,按 1.2 和1.3节进行操作,以特征离子色谱峰面积为纵坐标,L-羟脯氨酸标准溶液浓度为横坐标,绘制标准曲线,求回归方程和相关系数。
2 结果与讨论
2.1 质谱条件优化
L-羟脯氨酸是弱酸性化合物,故采用正离子模式扫描。用乙腈将L-羟脯氨酸标准储备液稀释成浓度均为1.0 μg/mL的单标溶液,用蠕动泵以10 μg/mL的流速,将L-羟脯氨酸标准溶液注入质谱检测器中,进行一级质谱扫描,得到m/z为132.1的准分子离子峰[M+H]+,优化锥孔电压等参数使分子离子峰达到最大强度;对分子离子峰进行碰撞碎裂优化,选择多反应监测(MRM)模式采集,离子源温度为150℃,碰撞气为氩气,锥孔电压为25 V,碰撞电压为25 V,对分子离子进行二级质谱分析(子离子扫描),得到较多的碎片离子信息(图1),定量离子对为m/z 132.1/86.2;定性离子对(m/z)为132.1/68.3。在上述质谱条件下,L-羟脯氨酸多反应监测色谱图峰型对称尖锐,峰型良好,未见明显的干扰峰(图2)。
2.2 UPLC色谱条件的优化
本试验采用Waters ACQUITY UPLC BEH C18(2.1 mm×150 mm,1.7 μm)色谱柱分析,考察了不同比例的乙腈-水、甲醇-水、乙腈-0.1%甲酸水、甲醇-0.1%甲酸水作为流动相时,色谱图基线、L-羟脯氨酸响应值、峰型、与干扰杂质峰的分离度等因素,试验表明:在水溶液中加入少量甲酸有助于L-羟脯氨酸的离子化,响应值更高;乙腈-0.1%甲酸水溶液体系能较好的分离L-羟脯氨酸峰,经优化筛选获得较佳的流动相梯度洗脱程序(表1),分离度大于1.5、基线平稳、出峰时间适中,半峰宽窄、峰型对称尖锐(图2),并且由于使用0.1%甲酸而抑制水相中微生物的滋生,延长了流动相使用期限。故选择乙腈-0.1%甲酸水溶液为流动相。

图1 L-羟脯氨酸二级质谱扫描图Fig.1 Two-stage scan spectra of L-Hydroxyproline
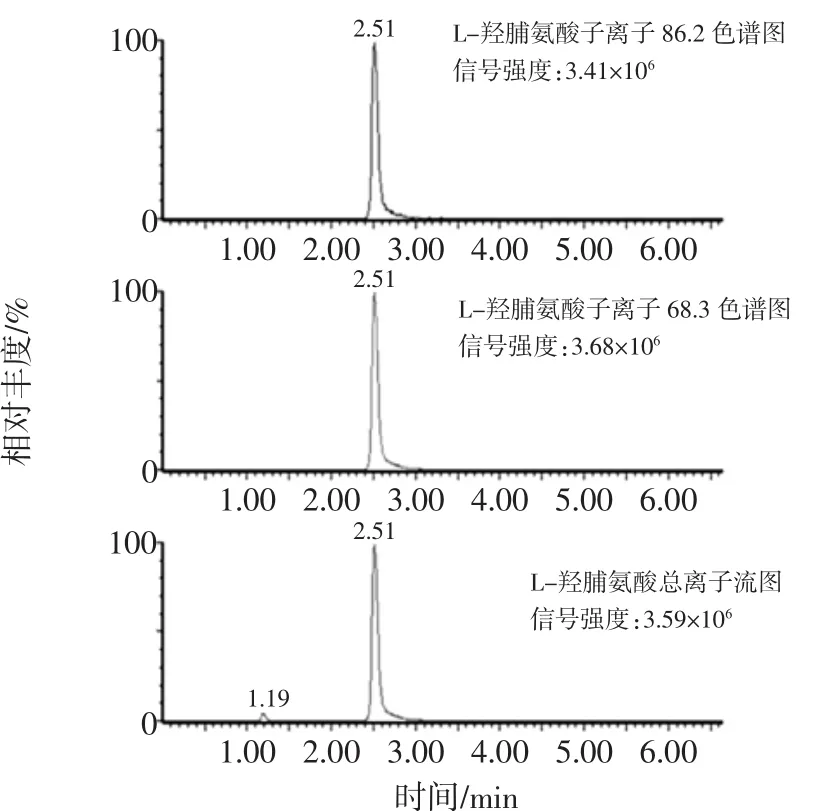
图2 L-羟脯氨酸标准品高效液相色谱-质谱图Fig.2 Chromatography of L-Hydroxyproline by performance liquid chromatography tandem mass spectrometry
2.3 提取溶剂的选择
不同溶剂对L-羟脯氨酸提取效果的影响见表2。

表2 不同溶剂对L-羟脯氨酸提取效果的影响(n=6)Table 2 Effects of different solvent on L-Hydroxyproline extraction(n=6)
从表2中可知:二氯甲烷、乙腈、乙酸乙酯、环己烷等4种试剂均可提取乳制品中的L-羟脯氨酸,其中乙酸乙酯和环己烷萃取时会带入大量脂溶性杂质和干扰峰,且无法萃取已溶于水相中的部分L-羟脯氨酸,造成L-羟脯氨酸部分提取,引起提取率不高;乙腈可提取乳制品试样中4-HR,且杂质干扰峰较少,故本文选择乙腈作为提取溶剂。
2.4 净化方式的选择
为获得较好的净化效果及回收率,本文考察了液液萃取、分散固相萃取、固相萃取(C18柱、中性氧化铝柱、HLB柱、石墨化碳粉柱、氨基柱、二醇柱等)3种净化方式对乳制品中L-羟脯氨酸含量测定的影响见表3。

表3 不同净化方式条件下的加标回收率(n=6)Table 3 The recoveries under different purification conditions(n=6)
从表3中可知:采用分散固相萃取法与固相萃取法,L-羟脯氨酸回收率均较高,尤其是HLB固相萃取小柱净化效果最佳,回收率高达96.7%,且杂质干扰峰少;而采用液液萃取法,L-羟脯氨酸回收率约80%左右,明显低于采用分散固相萃取法与固相萃取法。故最终净化方式选择HLB固相萃取。
2.5 方法线性范围、检出限和定量限
称取基质相同的空白试样6份,每份2 g,分别加入适量的标准工作液,制备成L-羟脯氨酸终浓度依次为 5.0、10.0、20.0、50.0、100.0 μg/kg 的待测样,按 1.2 和1.3节进行测定(表4)。

表4 线性方程、相关系数、检出限和定量限(n=6)Table 4 Linear equation,correlation coefficient,the detection limit and quantitation limit(n=6)
从表4中可知:在不同乳制品中L-羟脯氨酸在5.0 μg/kg~100.0 μg/kg 范围内,线性关系良好,相关系数(R2)在 0.998 6~0.999 7之间;按信噪比 RSN= 10计算,方法定量限(LOQ)为5.0 μg/kg,满足国内乳制品中L-羟脯氨酸限量的检测要求。
在乳制品中依次添加终浓度为5.0、10.0、50.0 μg/kg的L-羟脯氨酸,每个水平设6个平行,L-羟脯氨酸的加标回收率及相对标准偏差见表5。
从表5中可知:在3种乳制品基质中,敌百虫的平均加标回收率为94.53%~98.42%,精密度(相对标准偏差,RSD)为 3.7% ~7.3%。

表5 回收率和精密度(n=6)Table 5 Recovery and precision(n=6)
2.6 实际样品的测定
随机选取30份市售乳制品,采用本文所建立的超高效液相色谱-串联质谱法法测定乳制品中L-羟脯氨酸的含量。检测结果表明:30份乳制品中,L-羟脯氨酸的含量有所差异,检出率为6.7%,即2个样品中检测出含有L-羟脯氨酸的成份,可判定这2个厂家可能在乳制品中掺入廉价的水解动物蛋白来冒充或替代乳蛋白质,以提高乳制品中蛋白的质量分数,从而降低成本;而这些掺入的水解动物蛋白可能会影响乳制品风味和口感,且因L-羟脯氨酸不易消化,造成营养价值降低,导致人体吸收利用率下降,影响消费者的人身健康安全。因此,为了确保乳制品质量安全和维护消费者权益,相关行政部门有必要加强对乳制品中L-羟脯氨酸行政监督与日常监测。
3 结论
动物水解蛋白是由动物皮革及其制品下脚料等水解得到的蛋白质,长期误食,可导致关节疏松、肿大,造成重金属中毒,目前L-羟脯氨酸已作为检测乳及乳制品中是否非法掺入动物水解蛋白的重要标示物。本文采用超高效液相色谱-串联质谱法,将试样经牛蛋白酶酶解,乙腈萃取,HLB固相萃取柱净化后,UPLC BEH C18色谱柱分离,多反应监测(MRM)模式,定量离子对(m/z):132.1/86.2;定性离子对(m/z):132.1/68.3。结果表明:L-羟脯氨酸加标回收率在94.53%~98.42%之间,相对标准偏差不大于7.3%;按信噪比RSN=10计算,方法定量限(LOQ)为5.0 μg/kg。该方法准确度高、灵敏度好、稳定性强,将为乳制品行政监督部门、第三方检测机构、乳制品加工企业提供实际的检测方法指导。
[1] 李景红,孟祥晨.高效液相色谱法检测牛乳中掺加的胶原水解蛋白[J].中国乳品工业,2008,36(11):56-59
[2] 赵天珍,袁秀金,谭贵良,等.比色法快速测定奶粉和含乳饮料中游离L-羟脯氨酸[J].食品研究与开发,2008,29(12):111-113
[3] 胡华,吕定,杜青,等.高效液相色谱法检测酱油中羟脯氨酸的含量[J].中国调味品,2010,35(4):106-109
[4] Peter Bohlen,Michel Mellet.Automated fluorometric amino acid analysis:The determination of proline and hydroxyproline[J].Analytical Biochemistry,1979,94(2):313-321
[5] 邹晓莉,周春艳,黎源倩.毛细管电泳-激光诱导荧光检测肌腱和肌腱细胞中的羟脯氨酸[J].分析化学,2006,34(10):1441-1444
Determination of L-Hydroxyproline in Dairy Products by Ultra Performance Liquid Chromatography-Tandem Mass Spectrometry
HUANG Bei-bei
(Sanmenxia Polytechnic,Sanmenxia 472000,Henan,China)
A method for determining the residues of L-Hydroxyproline in dairy products was established by an ultra performance liquid chromatography tandem mass spectrometry.Samples was enzymatic digest of bovine,and ultrasonic extracted with ethyl acetate,and purified with HLB solid phase extraction cartridge,and separated by UPLC BEH C18column,and quantitative analysis was performed by the multi-reaction-monitoring(MRM)mode.The qualitative ion pair (m/z)was 132.1/86.2;the quantitative ion pair (m/z)was 132.1/68.3.The results showed that the recoveries were between 94.53%-98.42%,and the relative standard deviation were less than 7.3%;according to RSN=10,the limit of quantificationn was 5.0 μg/kg.
ultra performance liquid chromatography tandem mass spectrometry;L-Hydroxyproline;dairy products;determination
10.3969/j.issn.1005-6521.2016.14.032
黄蓓蓓(1981—),女(汉),讲师,硕士,研究方向:食品分析与发酵工程。
2016-02-18
