内含肽在构建亲和纯化系统中的应用
2016-11-01王姝婧陈丙友王玉君冯利利夏海锋
王姝婧,陈丙友,王玉君,冯利利,夏海锋,2
内含肽在构建亲和纯化系统中的应用
王姝婧1,陈丙友1,王玉君1,冯利利1,夏海锋1,2
1 江南大学生物工程学院工业生物技术教育部重点实验室,江苏无锡 214122 2 江南大学粮食发酵工艺与技术国家工程实验室,江苏无锡 214122
内含肽是前体未成熟蛋白中的一段具有自我剪接功能的多肽链,在蛋白质纯化、蛋白质连接、环肽制备、蛋白标记以及生物传感器等方面广泛应用。本文综述了内含肽应用于蛋白质亲和纯化的发展历程,分别对层析型和非层析型内含肽纯化体系进行了分析和讨论,并总结了对控制内含肽断裂反应所进行的研究,为进一步改善内含肽介导蛋白质纯化提供依据和线索。
连续型内含肽,断裂内含肽,亲和纯化系统,断裂反应
1990年,蛋白质内含肽酿酒酵母VMA1被首次发现[1]。之后,随着在不同细胞中发现越来越多的内含肽种类,内含肽作为一种新的分子生物学研究手段得到了更深入的研究。因内含肽在多肽链的剪接和断裂反应中发挥着重要作用,使其在对蛋白的控制及修饰作用方面的应用也越来越广泛。至今,蛋白质内含肽在蛋白质工程领域有着广泛的应用。这些应用包括蛋白质纯化、蛋白质连接、环肽制备、蛋白标记以及生物传感器等方面。其中,蛋白质内含肽在蛋白纯化方面的研究最为广泛和深入。科学家们对不同种类的内含肽使用多种手段进行了探索。本文以这些探索经验为基础,对内含肽在蛋白纯化领域的应用进行分析总结,为找出一种最为有效的蛋白纯化途径提供依据。
1 内含肽简介
蛋白质内含肽 (又称蛋白质内含子,Intein)是前体未成熟蛋白质中的一段多肽链,它通过一系列重排、转酯、环化等自我催化的反应过程,可以从前体蛋白中切除并将两端的蛋白多肽链 (蛋白质外显肽,Extein) 通过一个天然的肽键连接,即通过蛋白质自我剪接作用实现蛋白质结构的重新布局[2-3]。断裂内含肽是内含肽的一种结构类型。在结构上,它的N端区域 (本文表示为IN) 和C 端区域 (本文表示为IC) 相互分离,而当IN和IC两个片段连接恢复结构后可按照标准内含肽剪接途径完成两端外显肽的拼接。
Perler FB将典型的蛋白质内含肽分为8个模块,其中剪接结构域中包含A、B、F、G模块,中间的归巢核酸内切酶结构域则包含C、D、E、H模块[4-5]。断裂内含肽不含归巢核酸内切酶结构域,因此只包含剪接结构域A、B、F、G模块。这些模块中存在一些比较保守的氨基酸残基 (图1)。而且,各模块中的氨基酸一般为某一类性质的氨基酸,尤其是疏水氨基酸,这些氨基酸残基在剪接或剪切反应过程中起着重要的作用[6]。例如,模块A中首位氨基酸Cys1/Thr1/Ser1的羟基参与剪接反应第一步的酰基重排过程;模块B中的Thr-His残基可以与主链原子形成氢键并稳定蛋白质构象,从而导致N端的酰基转移反应的发生。C端部分的模块G的倒数第二个残基His通过与Asn形成氢键,并最终导致C端断裂反应的发生。此外,一般通用的内含肽氨基酸位点从N端开始记为1,依次直到内含肽C端。N端外显肽为负,与IN的N末端相连的开始记为-1。C端外显肽为正,与IC的C末端相连的开始记为+1。

图1 内含肽的结构模式图[4]
内含肽的剪接反应是一个不需要酶催化的自发进行的过程。它是经4步亲核反应完成的,包括:1) N-S酰基重排 (Acyl rearrangement);2) 转酯 (Transesterification) 反应;3) 末位氨基酸Asn环化;4) S-N酰基重排。将内含肽的剪接反应改造成断裂反应就是通过突变剪接结构模块中的保守氨基酸,使剪接反应中的一部分不能进行而只能完成一端的断裂[7]。另外,断裂内含肽的IN和IC具有极强的相互识别能力[8],两者的亲和结合是断裂反应能够进行的基础。断裂内含肽在构建亲和纯化系统中的应用就是基于内含肽的断裂反应以及IN和IC片段之间亲和识别结合原理实现的。
与其他亲和纯化系统 (如免疫亲和层析、金属螯合亲和层析) 相比,内含肽介导的亲和纯化系统可以诱导断裂反应的发生,使其在纯化的过程中除去纯化标签并得到不含任何外来序列的目标蛋白。同时,也避免了使用其他手段除去纯化标签的麻烦。
2 内含肽亲和纯化系统发展简史
经过对内含肽亲和纯化系统的考察和分析,本文将内含肽亲和纯化系统应用的发展总结归纳为两个时期。前期研究主要集中于对连续内含肽在亲和纯化中的应用;近期研究主要集中于断裂内含肽在亲和纯化中的应用。
2.1 前期——连续内含肽时期
在内含肽应用于纯化系统的早期,一般使用这种连续型内含肽作为纯化辅助手段。通过氨基酸突变只保留一端断裂活性的内含肽,与纯化标签和目标蛋白共同组合成前体蛋白。先借助纯化标签将前体蛋白从杂蛋白中纯化出来,再利用内含肽一端的断裂反应将目标蛋白从前体中切除并洗脱纯化出来。
内含肽在亲和纯化中的应用最早在1997年。Ming等以C末端突变 (Asn454Ala) 的VMA内含肽为基础,在其C端连接CBD (Chitin binding domain) 亲和标签并在N端连接目标蛋白构建纯化体系进行蛋白纯化[9]。VMA内含肽是最早被发现的1种内含肽。利用这种内含肽构建了商品化的IMPACTTM-CN (NEB) 蛋白表达纯化体系。但这种内含肽的断裂速率较慢,对于N端断裂反应,23 ℃、有还原剂DTT诱导的条件下,达到95%的断裂率需要16 h[9]。C端断裂反应速率更低。而且,VMA内含肽分子量较大 (56 kDa),不利于前体蛋白的可溶性表达。
后来又出现了经过改造后的微小型连续内含肽mini-产甲烷嗜热杆菌RecA (mini-RecA)[10]和蟾分枝杆菌GryA (.GryA)[11]。与VMA内含肽不同的是,这些内含肽在N端断裂反应被阻止 (mini-RecA的C1A突变;GryA的-1位氨基酸突变) 的条件下,可以通过调节pH和温度控制C端断裂反应的进行。在Wood等的研究中,将RecA内含肽改造成只有18 kDa的C端断裂型内含肽。而且C端断裂反应通过调节pH和温度控制断裂反应的进行,从而避免了还原剂DTT的使用。37 ℃时,12 h达到97%以上的断裂效率[10]。此外,NEB公司还研究了1种天然的微小型连续内含肽集胞藻属sp. PCC 6903 DnaB (DnaB)。这种内含肽的断裂效率和断裂条件与mini-RecA相似。利用这种内含肽,NEB公司又推出了IMPACTTM-TWIN蛋白表达纯化体系。
虽然对多种连续型内含肽进行了一系列的改造及在亲和纯化方面的应用研究,但在蛋白表达和前体蛋白纯化过程中内含肽提前断裂的问题依然无法解决。因此,为了解决提前断裂的问题,有研究将连续型内含肽人工断裂为两部分并分别表达。分别表达的两片段可以相互识别结合并完成剪接反应,而且其反应速率并未受到影响[12-13]。
2.2 近期——断裂内含肽时期
虽然断裂内含肽在1998年就被发现,但其应用于蛋白的纯化却是从2011年才开始的。Jian 等将人工断裂内含肽DnaB的IN和IC分别与亲和标签和目标蛋白相连,并分别表达。通过亲和标签将内含肽的一端片段 (IN或IC) 与层析介质亲和结合,再利用IN与IC之间的亲和识别结合能力固定前体蛋白,然后通过诱导断裂将目标蛋白纯化出来[14]。此外,根据内含肽的结构将DnaB从不同位置处断开,还构建了S1型和S11型DnaB断裂内含肽。
除了人工断裂内含肽,天然断裂内含肽在蛋白纯化系统中的应用也是近几年刚刚开始的。其中研究最多的是点形念珠藻属DnaE (DnaE)内含肽。DnaE内含肽与DnaB内含肽在蛋白序列上具有较高的同源相似性而且断裂反应速率较快,因此,针对这2种系统的改造也较多。除了避免提前断裂之外,改造后的DnaE内含肽的断裂速率已有较大提高,已达到5 min内断裂率达90%以上[15]。断裂速率的提高也极大提高了蛋白纯化系统的纯化效率。因此,这也是一种极具前景的研究方向。
断裂内含肽亲和纯化系统对目标蛋白纯化的过程原理大致相似 (图2),主要包括:1) 配基 (断裂内含肽的IN或IC) 与介质的结合形成亲和层析介质。2) 平衡,前体蛋白上样至亲和层析介质中,IN与IC因亲和作用而相互识别结合。3) 洗涤,将不能与配基识别结合的杂蛋白除去。4) 洗脱,通过改变条件诱导断裂反应的发生,获得不含标签的目标蛋白。5) 亲和层析介质的再生,通过提高环境的pH使IN和IC失去亲和作用而相互分离,还原亲和层析介质。图2中比较了连续型内含肽纯化系统与断裂内含肽纯化系统纯化过程。

* is an amino acid mutation on N-terminal of INor C-terminal of IC;represents protein of interest;represents ligand;represents impure protein
图2 连续型内含肽纯化系统(A)与断裂内含肽纯化系统(B)的比较
Fig. 2 Comparison between continuous intein-mediated purification system (A) and split intein-mediated purification system (B).
3 内含肽介导的纯化体系研究
从纯化体系的类型上来划分,可以将内含肽介导的纯化体系分为层析型和非层析型两类。层析型亲和纯化系统在应用研究中占主要地位,而非层析型的研究相对较少。两者的主要区别在于含有内含肽的蛋白片段是否连接到层析介质上并形成一种固相的层析体系。以下分别对这2种纯化系统进行介绍。
3.1 层析型亲和纯化体系中配基与介质的结合方式
本文大部分内容都是基于层析型纯化体系的讨论,包括上文的纯化体系发展历程和下文中对断裂反应控制的研究。因此,我们主要介绍层析型纯化体系中配基与介质的结合方式。
对基于层析介质的亲和纯化体系,配基与介质的结合强度决定着亲和介质可以重复使用的次数。对断裂内含肽介导的亲和纯化体系,我们可以将亲和标签和与其相连的IN或IC片段作为整体并视为一种亲和配基。将一段多肽链与介质结合,其结合方式不同结合的强度也不同,从而影响了配基在介质上的稳定性。因此,在讨论内含肽断裂反应的控制之前,配基与介质的偶联方式也是一个重要的问题。
多数研究中采用CBD纯化标签与Chitin介质亲和结合的形式,将一端连有CBD标签的断裂内含肽配基与介质结合[14, 16-17]。这种方法的成本较低,但由于结合的稳定性和特异性较低,配基很容易从介质上脱落,造成目标蛋白污染,同时也降低了介质重复使用次数。Chen等使用此方法证明,亲和层析介质的有效纯化次数在4次左右[17]。此外,可以使用特异性和稳定性较好的His标签与Ni的亲和结合,但这一层析介质会受到还原剂、二价金属离子等多种条件的影响。在断裂内含肽相互结合发生断裂反应的过程中这些因素无法避免,也就阻碍这种方法的应用。
在最近的研究中,有采用共价偶联的方式将配基连到介质上。这种方法在内含肽的末端添加1个Cys,利用Cys的巯基对介质上的活化基团进行亲核攻击,形成共价连接。这种方法制备的亲和层析介质的配基较稳定,但其偶联后的配基与内含肽的另一端的结合能力以及断裂反应速率都有可能降低。
3.2 内含肽介导的非层析介质亲和纯化系统
非层析的亲和纯化系统借助一种非层析蛋白纯化标签,它与内含肽的IN或IC一起作为控制蛋白的分子开关,通过条件控制达到纯化目标蛋白的目的。
ELP (Elastin like polypeptide) 标签是应用最多的1种非层析蛋白纯化标签。它是一段含有VPGXG (X为除Pro之外的任何氨基酸) 多重复肽链,且其是1种温度敏感型蛋白。当温度高于一定的阈值时会发生聚集反应,而当温度低于这个阈值其又会重新溶解。含有ELP标签的融合蛋白也可以简单地通过几步温度转变纯化得到。因此,目标蛋白与IN或IC的融合蛋白可以借助于非层析标签纯化得到,再通过蛋白质内含子的自我断裂将目的蛋白从融合蛋白中释放[18]。
施长华等将RecA断裂成N端和C端2个片段并分别与ELP标签融合,目标蛋白融合于C端片段末端。在此模型中,含有目的蛋白和ELP标签的C端融合蛋白为前体蛋白,而蛋白质内含子的N端与ELP标签融合蛋白则是1个分子开关蛋白[19]。ELP纯化标签可以使2个蛋白片段通过改变温度的手段在体外条件下分别纯化得到。然后,在体外添加N端分子开关蛋白则可激活蛋白质内含子的C端断裂活性并最终端释放目的蛋白。
另外,施长华等还构建了一种利用小肽控制的基于S1型断裂内含肽的非层析蛋白亲和纯化系统[20]。此系统将小肽控制的断裂内含肽系统和非层析标签ELP的功能相结合,含有缺失N端11个氨基酸的内含肽与ELP的融合蛋白在体内没有断裂活性,表达过程中前体蛋白得到了很好的保留。表达通过ELP标签可纯化得到前体蛋白,然后通过添加N端11个氨基酸的小肽诱导内含肽发生C端断裂并得到目的蛋白。
这种不基于层析介质的纯化方法可以避免层析介质与配基蛋白片段结合的不稳定而造成的蛋白脱落。同时,IN与IC在体外条件下的结合作用更强,可以减少目标蛋白中出现的未断裂的前体蛋白。这种新型的纯化手段为解决内含肽提前断裂的问题提供了一种新思路。
4 对内含肽断裂反应的控制
迄今为止,已经有多种内含肽应用于构建亲和纯化系统。不同内含肽的断裂反应速率和条件会导致纯化效率不同。因此,本文对应用于亲和纯化系统的内含肽断裂反应特性进行了比较 (表1)。早期发现的内含肽一般C端断裂反应速率较慢、反应时间长,而N端断裂又需要高浓度的硫醇还原剂[22]。而且,对于连续型内含肽,其表达过程中的提前断裂无法避免。因此,提高连续型内含肽的断裂反应速率、阻止提前断裂是研究的关键。最近的一些研究采用了将一段连续的内含肽人为分为两部分,虽然这种方法在抑制提前断裂方面有作用,但分开后的两片段亲和力较差[23]。而自然断裂内含肽的发现解决了内含肽在体外重组效率较低的问题,对内含肽亲和纯化领域的应用产生了重要的影响,但同时也存在断裂速率不可控制的问题。针对以上内含肽在应用中存在的问题,以下将具体讨论内含肽应用于亲和纯化时对内含肽断裂反应进行的改造研究。
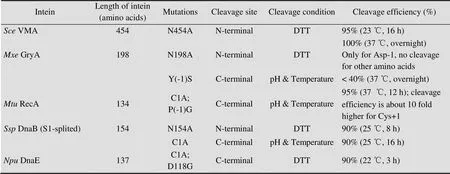
表1 用于构建亲和纯化系统的内含肽断裂反应特性比较[17,21]
4.1 内含肽序列的改造
用于构建商品化IMPACT-TWIN的内含肽GyrA是一种应用于连续型内含肽。这种纯化体系中内含肽的提前断裂问题是影响蛋白产量的关键。由于断裂反应需要内含肽首位氨基酸为带有自由巯基的Cys,因此,有研究通过突变内含肽内部的2个氨基酸为Cys,使其与首位氨基酸Cys之间形成二硫键,从而抑制断裂反应提前进行[24]。
鉴于天然断裂内含肽的断裂位置,很多连续型内含肽被改造成断裂内含肽 (断裂位点为归巢核酸内切酶区域,称为S0型)。人工断裂内含肽的应用以DnaB最为典型。DnaB是由12个β-sheet组成的马蹄形结构,在此基础上,靠近剪接活性区域两端的新型断裂内含肽在近几年也被成功构建。如前11位氨基酸发生断裂的S1型断裂内含肽 (第2个与第3个β-sheet之间发生断裂)[25],以及在微小内含肽末6 位断裂的S11型断裂内含肽 (第11和12个β-sheet之间发生断裂)[26]。这些基于DnaB的断裂内含肽的断裂速率与连续型内含肽相当,25 ℃、16 h断裂率约为90%。另外,DnaB S1型断裂内含肽可以将N端11个氨基酸的小肽在体外合成,并添加到C端片段的前体蛋白中诱导断裂。但这种方法的成本较高。
另一种断裂内含肽纯化系统是以DnaE为基础构建的。与DnaB不同的是,如果DnaE的N端断裂反应被阻止那么C端断裂反应也无法进行[16,27]。Chen等根据同源性相近的内含肽DnaE与mini-RecA之间的序列比对和分子建模,确定DnaE的Asp118是阻止C端断裂反应的关键因素[15]。将DnaE的Asp118突变为Gly后,便解除了N端突变后对C端断裂反应的抑制。经改造后的DnaE内含肽的C端断裂反应速率较快,在室温、DTT的条件下,3 h断裂反应完成80%。
4.2 空间位阻对断裂反应的作用
对断裂型内含肽来说,IN和IC两端连接肽链的大小对断裂反应速率也有影响。根据对DnaE内含肽IN和IC相互识别结合作用方式的分析,如果多肽链分别位于IN和IC的两端 (即N端和C端),此时空间位阻最大,断裂反应速率就会下降 (图3)。Chen等将位于INN端的亲和标签移动到C端,这样就降低了IN和IC亲和结合时的空间位阻,使断裂反应速率大大提高——在室温、DTT的条件下,30 min就可以完成全部的断裂反应[17]。

图3 基于断裂反应空间位阻改造后的断裂内含肽纯化系统
目前,内含肽空间位阻对断裂反应速率的影响只在DnaE内含肽的基础上尝试应用过。按照其相互作用方式推测,这种思路也应同样适用于其他种类的内含肽中。
4.3 Zn2+对断裂反应的抑制
如果内含肽两片段识别结合后的断裂反应速率很快并且不可控制,会导致在层析纯化中前体蛋白与配基结合后就会发生断裂,目标蛋白随杂蛋白被洗下,从而会导致纯化效率降低。因此,在提高内含肽断裂反应速率的同时需要确定可控断裂的反应条件。
在蛋白质内含肽的结构晶体解析过程中发现,蛋白质内含肽PI-SceI的C端剪接区域存在一个Zn2+结合区域[27]。随后Paulus等证明Zn2+可以抑制内含肽RecA和DnaE的剪接反应,并且在较低的浓度下就可达到完全抑制内含肽的剪接反应。Evans等进一步研究了Zn2+对DnaE的剪接与断裂反应的影响[28]。尽管在多种内含肽的结构中都发现了Zn2+结合区域,但这些结合区域却不完全一样。例如在DnaE中Zn2+的结合区域是由His48、Asp140、His110以及+1 Cys组成[29],而RecA中Zn2+的结合区域则是由His429、Glu424、Asn440以及相邻分子的His439组成[30]。此外,Zn2+对内含肽剪接反应的抑制主要是通过影响蛋白质剪接过程中的电荷传递,从而最终使剪接反应无法顺利进行[31]。虽然内含肽与Zn2+的结合非常牢固,但这种结合力却不如金属螯合剂 (例如EDTA) 与Zn2+的结合能力强,因此可通过金属螯合剂将Zn2+从内含肽中去除以恢复剪接反应[32]。此外,除Zn2+外的其他二价金属离子也有抑制内含肽断裂反应的作用,例如Cu2+、Ni2+、Mg2+等,但它们的抑制效率低于Zn2+[33]。
虽然Zn2+对内含肽RecA和DnaE的剪接反应有抑制效果,但实验表明,对于改造后的断裂内含肽DnaE体系Zn2+的抑制效果并不明显。而且,Zn2+浓度过高 (大于2.5 mmol/L)很容易导致蛋白沉淀。因此,对于断裂内含肽在亲和纯化系统的应用方面,Zn2+对不同内含肽断裂反应的控制还需要更多的研究。
5 结论与展望
应用于亲和纯化系统的内含肽已从起初的连续型内含肽发展为改造的断裂内含肽,从需要其他亲和纯化手段的辅助到形成独立的系统。从其发展的方向来看,断裂内含肽介导的快速且具有自发除去亲和标签功能的亲和纯化系统的应用前景最为广阔;同时,这种新型亲和纯化系统的构建需要对断裂内含肽的反应进行控制。当前对于内含肽断裂反应控制方面的研究还远远不足。如果能够找到一种在一定诱导条件下能快速发生断裂,并且在一定控制条件下能完全抑制断裂的内含肽及其控制手段,那么将对内含肽在亲和纯化系统中的应用带来极大的进步;将非层析标签与断裂内含肽系统相结合构建的非层析内含肽亲和纯化系统的研究虽然不多,但这种新型的纯化手段为解决内含肽提前断裂的问题提供了一种新思路,也具有广阔的应用前景。
REFERENCES
[1] Shah NH, Muir TW. Inteins: nature's gift to protein chemists. Chem Sci, 2014, 5(1): 446–461.
[2] Cooper AA, Stevens TH. Protein splicing- self-splicing of genetically mobile elements at the protein level. Trends Biochem Sci, 1995, 20(9): 351–356.
[3] Pietrokovski S. Modular organization of inteins and C-terminal autocatalytic domains. Protein Sci, 1998, 7(1): 64–71.
[4] Perler FB. InBase: the intein database. Nucleic Acids Res, 2002, 30(1): 383–384.
[5] Perler FB. Protein splicing of inteins and hedgehog autoproteolysis: structure, function, and evolution. Cell, 1998, 92(1): 1–4.
[6] Eryilmaz E, Shah NH, Muir TW, et al. Structural and dynamical features of inteins and implications on protein splicing. J Biol Chem, 2014, 289(21): 14506–14511.
[7] Mathys S, Evans TC, Chute IC, et al. Characterization of a self-splicing mini-intein and its conversion into autocatalytic N- and C-terminal cleavage elements: facile production of protein building blocks for protein ligation. Gene, 1999, 231(1/2): 1v13.
[8] Saleh L, Perler FB. Protein splicing in cis and in trans. Chem Rec, 2006, 6(4): 183–193.
[9] Chong SR, Mersha FB, Comb DG, et al. Single-column purification of free recombinant proteins using a self-cleavable affinity tag derived from a protein splicing element. Gene, 1997, 192(2): 271–281.
[10] Wood DW, Derbyshire V, Wu W, et al. Optimized single-step affinity purification with a self-cleaving intein applied to human acidic fibroblast growth factor. Biotechnol Prog, 2000, 16(6): 1055–1063.
[11] Southworth MW, Amaya K, Evans TC, et al. Purification of proteins fused to either the amino or carboxy terminus of thegyrase A intein. Biotechniques, 1999, 27(1): 110–120.
[12] Wu H, Xu MQ, Liu XQ. Protein trans-splicing and functional mini-inteins of aDnaB intein. Bba-Protein Struct M, 1998, 1387(1/2): 422–432.
[13] Volkmann G, Sun W, Liu XQ. Controllable protein cleavages through intein fragment complementation. Protein Sci, 2009, 18(11): 2393–2402.
[14] Lu W, Sun Z, Tang Y, et al. Split intein facilitated tag affinity purification for recombinant proteins with controllable tag removal by inducible auto-cleavage. J Chromatogr A, 2011, 1218(18): 2553–2560.
[15] Ramirez M, Valdes N, Guan D, et al. Engineering split intein DnaE fromfor rapid protein purification. Protein Eng Des Sel, 2013, 26(3): 215–223.
[16] Zettler J, Schutz V, Mootz HD. The naturally splitDnaE intein exhibits an extraordinarily high rate in the protein trans-splicing reaction. Febs Lett, 2009, 583(5): 909–914.
[17] Guan D, Ramirez M, Chen ZL. Split intein mediated ultra-rapid purification of tagless protein (SIRP). Biotechnol Bioeng, 2013, 110(9): 2471–2481.
[18] Fong BA, Wu WY, Wood DW. Optimization of ELP-intein mediated protein purification by salt substitution. Protein Expres Purif, 2009, 66(2): 198–202.
[19] Shi CH, Meng Q, Wood DW. A dual ELP-tagged split intein system for non-chromatographic recombinant protein purification. Appl Microbiol Biotechnol, 2013, 97(2): 829–835.
[20] Shi CH. Intein optimization for recombinant protein production and its application in bacteria biosensor [D]. Shanghai: Donghua University, 2014 (in Chinese). 施长华. 蛋白质内含子介导的纯化系统的优化及其在生物传感器中的应用[D]. 上海: 东华大学, 2014.
[21] Paulus H. Protein splicing and related forms of protein autoprocessing. Annu Rev Biochem, 2000, 69: 447–496.
[22] Wood DW, Camarero JA. Intein applications: from protein purification and labeling to metabolic control methods. J Biol Chem, 2014, 289(21): 14512–14519.
[23] Callahan BP, Stanger M, Belfort M. A redox trap to augment the intein toolbox. Biotechnol Bioeng, 2013, 110(6): 1565–1573.
[24] Cui CX, Zhao WT, Chen JL, et al. Elimination ofcleavage between target protein and intein in the intein-mediated protein purification systems. Protein Expres Purif, 2006, 50(1): 74–81.
[25] Sun WC, Yang J, Liu XQ. Synthetic two-piece and three-piece split inteins for protein trans-splicing. J Biol Chem, 2004, 279(34): 35281–35286.
[26] Appleby JH, Zhou KS, Volkmann G, et al. Novel split intein for trans-splicing synthetic peptide onto C-terminus of protein.J Biol Chem, 2009, 284(10): 6194–6199.
[27] Martin DD, Xu MQ, Evans TC. Characterization of a naturally occurring trans-splicing intein fromsp. PCC6803. Biochemistry, 2001, 40(5): 1393–1402.
[28] Poland BW, Xu MQ, Quiocho FA. Structural insights into the protein splicing mechanism of PI-SceI. J Biol Chem, 2000, 275(22): 16408–16413.
[29] Nichols NM, Benner JS, Martin DD, et al. Zinc ion effects on individualDnaE intein splicing steps: regulating pathway progression. Biochemistry, 2003, 42(18): 5301–5311.
[30] Sun P, Ye S, Ferrandon S, et al. Crystal structures of an intein from the split dnaE gene ofsp. PCC6803 reveal the catalytic model without the penultimate histidine and the mechanism of zinc ion inhibition of protein splicing. J Mol Biol, 2005, 353(5): 1093–1105.
[31] Van Roey P, Pereira B, Li Z, et al. Crystallographic and mutational studies ofRecA mini-inteins suggest a pivotal role for a highly conserved aspartate residue. J Mol Biol, 2007, 367(1): 162–173.
[32] Zhang LY, Zheng YC, Xi ZY, et al. Metal ions binding to recA inteins from. Mol Biosyst, 2009, 5(6): 644–650.
[33] Mills KV, Paulus H. Reversible inhibition of protein splicing by zinc ion. J Biol Chem, 2001, 276(14): 10832–10838.
(本文责编 陈宏宇)
Application of inteins in building protein affinity purification system
Shujing Wang1, Bingyou Chen1, Yujun Wang1, Lili Feng1, and Haifeng Xia1,2
1,,,,214122,,National Engineering Laboratory for Cereal Fermentation TechnologyJiangnan UniversityWuxiJiangsuChina
Intein is a part of polypeptide in the premature protein with the capability of self-splicing, which is widely applied in protein purification, protein conjuction, cyclopeptide preparation, protein labeling and biosensor. In this review, we summarized the development of intein used in protein purification, discussed intein-mediated chromatographic and non-chromatographic purification systems, and summarized the researches in manipulating intein cleavage reaction. This work is to provide clues for improvement of intein-mediated protein purification.
continuousinteins, split inteins, affinity purification system, cleavage reaction
December 22, 2015; Accepted: March 18, 2016
Haifeng Xia. Tel/Fax: +86-510-85197123; E-mail: hfxia@jiangnan.edu.cn
Supported by: National Natural Science Foundation of China (No. 21206054), National Science Foundation of Jiangsu Province (No. BK20151123), Fundamental Research Funds for the Central Universities (No. JUSRP51401A).
国家自然科学基金(No. 21206054),江苏省自然科学基金(No. BK20151123),中央高校基本科研业务费专项资金 (No. JUSRP51401A) 资助。
王姝婧, 陈丙友, 王玉君, 等. 内含肽在构建亲和纯化系统中的应用. 生物工程学报, 2016, 32(9): 1175–1184.
Wang SJ, Chen BY, Wang YJ, et al. Application of inteins in building protein affinity purification system. Chin J Biotech, 2016, 32(9): 1175–1184.
