酵母菌合成2-苯乙醇的研究进展
2016-11-01陈先锐王肇悦何秀萍
陈先锐,王肇悦,何秀萍
酵母菌合成2-苯乙醇的研究进展
陈先锐,王肇悦,何秀萍
中国科学院微生物研究所中国科学院微生物生理与代谢工程重点实验室,北京 100101
2-苯乙醇是一种具有令人愉悦的玫瑰风味的芳香醇,在食品、化妆品和药品等领域具有广泛的应用。本文对酵母菌合成2-苯乙醇的代谢途径及其调控过程、以及提高2-苯乙醇产量的国内外研究进展进行了综述,并对通过微生物转化法合成2-苯乙醇目前存在的不足及进一步研究方向进行了讨论。
酵母,2-苯乙醇,代谢途径,基因,调控
2-苯乙醇(2-phenylethanol,2-PE),也称β-苯乙醇、2-苯基乙醇,分子式为C8H10O,是1种具有玫瑰风味的芳香醇,存在于玫瑰、茉莉等多种植物精油中,也是葡萄酒、黄酒、啤酒和面包等多种发酵食品的天然风味物质,是决定发酵食品品质的关键因素之一。2-苯乙醇的香气颇受人们欢迎,是国际香精香料的主流风格,在食品和日化用品等领域具有非常广泛的应用。2-苯乙醇对革兰氏阴性菌、球菌、杆菌和部分真菌有抑菌作用,在医药卫生领域有重要应用;同时其对果实、鲜花具有保护作用,可以用作植物保鲜剂[1-2]。2-苯乙醇也可以作为底物合成其他高附加值的香味化合物或者药物,比如乙酸苯乙酯,既可以作为香料又可以配制神经类药物;苯乙醇苷,具有抗菌、抗病毒、抗肿瘤、强心等作用;1-异丙氨基-3-[对-(2-甲氧乙基)苯氧基]-2-丙醇,是1种β-肾上腺素阻滞剂,可治疗高血压、心绞痛和心肌梗塞等[3]。
工业上生产2-苯乙醇的方法有化学合成法和天然法。化学合成法是以苯或苯乙烯为原料通过化学反应合成2-苯乙醇,不但原料具有致癌风险,而且产物中常含有一些难以去除的副产物,严重影响了产品质量,极大限制了产品的使用范围。天然法生产2-苯乙醇包括采用物理方法从植物中直接提取和微生物合成2种途径,天然产品纯度高、无毒无害,具有很好的生物安全性,因此市场需求量越来越大[4]。从玫瑰等植物精油中提取天然 2-苯乙醇的效率很低,提取成本高,难以满足市场需求。一些真菌和酵母菌具有合成2-苯乙醇的能力,为微生物发酵法生产2-苯乙醇奠定了基础[3]。目前国内外发酵生产2-苯乙醇的菌种以酵母菌为主,如产朊假丝酵母、酿酒酵母和克鲁维酵母等。
作为模式生物的酿酒酵母既是1种国际公认的安全微生物,也是目前发现的2-苯乙醇合成能力较高的微生物之一。与其他微生物相比,酿酒酵母对很多胁迫因素具有较高耐受性,对工业化环境具有较高的适应性,以及成熟的发酵工艺控制策略,因此是通过微生物发酵法生产2-苯乙醇的理想菌种。
1 酵母菌合成2-苯乙醇的代谢途径及调控过程
1.1 莽草酸途径 (Shikimate pathway)
莽草酸途径是酿酒酵母从头合成2-苯乙醇的代谢途径 (图1)[3]。来源于糖酵解途径(Glycolysis)的磷酸烯醇式丙酮酸(Phosphoenol pyruvate) 和磷酸戊糖途径(Pentose phosphate pathway) 的4-磷酸赤藓糖(Erythrose-4-phosphate) 经4步酶促反应生成莽草酸(Shikimate),莽草酸进一步经5步酶促反应生成苯丙酮酸(Phenylpyruvate),然后在苯丙酮酸脱羧酶(Phenylpyruvate decarboxylase) 催化下生成苯乙醛(Phenyl-acetaldehyde),最后在醇脱氢酶(Alcohol dehydrogenase) 作用下脱氢生成2-苯乙醇 (2-Phenylethanol)。酿酒酵母通过莽草酸途径合成2-苯乙醇的代谢途径长、支路多,并存在多种抑制作用,因此通过莽草酸途径合成2-苯乙醇的产量很低,一般仅为400−500 mg/L[5]。
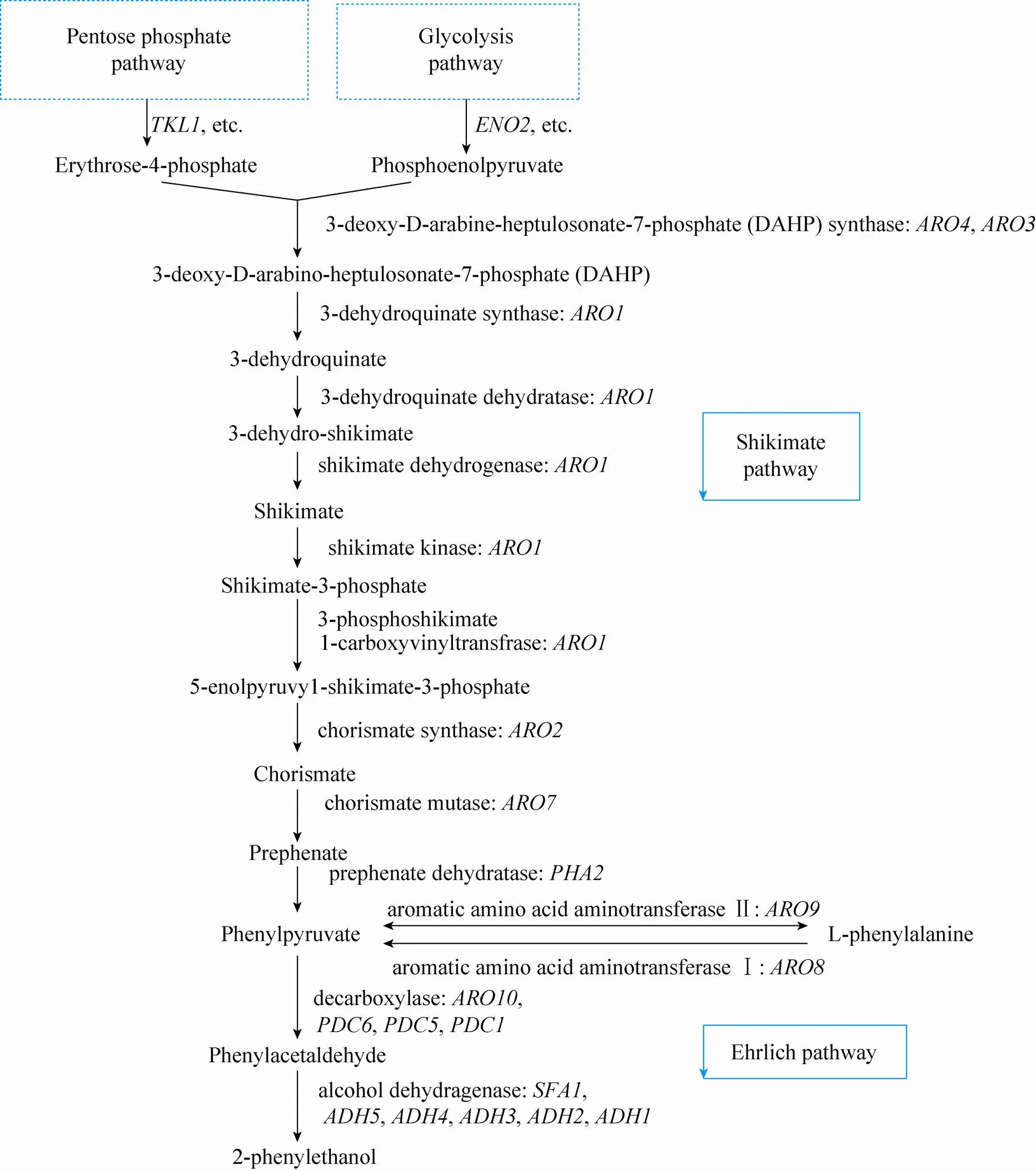
图1 酵母菌合成2-苯乙醇的代谢途径
1.2 艾氏途径 (Ehrlich pathway)
艾氏途径早在1907年就被德国生物化学家Felix Ehrlich提出,但直到20世纪90年代才通过体外实验得到确认;而胞内代谢途径直到最近几年才借助核磁共振等先进技术最终得以证实[6]。当培养基中L-苯丙氨酸 (L-Phe) 作为唯一氮源时,酵母菌主要通过艾氏途径合成2-苯乙醇:L-Phe经芳香族氨基酸氨基转移酶Ⅰ(Aromatic aminotransferaseⅠ) 或芳香族氨基酸氨基转移酶Ⅱ (Aromatic aminotransferaseⅡ) 催化生成苯丙酮酸,苯丙酮酸经苯丙酮酸脱羧酶 (Phenylpyruvate decarboxylase) 作用脱羧生成苯乙醛,苯乙醛在醇脱氢酶 (Alcohol dehydrogenase) 作用下脱氢生成2-苯乙醇 (图1和2)[3]。

图2 艾氏途径合成2-苯乙醇[3]
1.2.1 L-苯丙氨酸的转运及相关基因
酿酒酵母可以利用30多种不同的含氮化合物作为细胞生长的唯一氮源,其中能支持细胞快速生长的氮源为优质氮源,如谷氨酰胺和氨;而只能维持细胞缓慢生长的氮源为贫乏氮源,如脯氨酸、尿素和芳香族氨基酸。酿酒酵母会根据环境中氮源的含量及质量调整细胞的生理代谢过程[7]。Gap1p是转运芳香族氨基酸进入细胞的主要通透酶。培养基中存在优质氮源时,由于氮代谢物阻遏作用 (Nitrogen catabolite repression,NCR),的表达被抑制,质膜上的Gap1p失活;当培养基仅有贫乏氮源时,被诱导表达,Gap1p恢复转运活性。的诱导表达与GATA转录因子及启动子上游的激活序列有关,此外,氨基酸渗透因子Ssy1p是细胞接受胞外芳香族氨基酸信号的感应器。因此,当L-苯丙氨酸作为唯一氮源时,Ssy1p首先接受L-苯丙氨酸的信号,并诱导表达和Gap1p恢复活性,Gap1p将L-苯丙氨酸转运至胞内,参与细胞的代谢活动。
1.2.2 转氨、脱羧、还原反应及相关酶与基因
艾氏途径合成2苯乙醇的转氨反应由芳香族氨基酸氨基转移酶所催化,将L-苯丙氨酸的氨基转移到α-酮戊二酸,形成苯丙酮酸和L-谷氨酸 (图2)[3]。在酿酒酵母中存在两种同工酶,即芳香族氨基酸氨基转移酶Ⅰ和芳香族氨基酸氨基转移酶Ⅱ,两者同属于第一家族氨基转移酶类,分别由和基因编码。的表达受氨基酸生物合成的通用调控系统调节,它在细胞的各个周期都能够表达。Aro8p能够催化与芳香族氨基酸代谢相关的绝大部分转氨反应,而且对甲硫氨酸、α氨基己二酸和亮氨酸的转氨反应也有催化作用。Aro9p的N-端区域有2个反向平行的β-折叠片,是Aro9p区别于其他转氨酶的特征区域,并与Aro9p二聚体的形成有关[8]。细胞在优质氮源条件下不表达基因,在基因无法表达或者在仅含贫乏氮源的情况下,经苯丙氨酸、色氨酸、亮氨酸、甲硫氨酸等诱导进行表达,产生芳香族氨基酸氨基转移酶II。转录因子Aro80p 和基因的一段上游激活序列是参与诱导表达的两个重要因素[9]。
艾氏途径的脱羧反应为不可逆反应,转氨反应的产物——苯丙酮酸被苯丙酮酸脱羧酶催化,脱去一个羧基生成苯乙醛 (图2)[3]。酿酒酵母基因组中含有5个可能编码苯丙酮酸脱羧酶活性的基因,在不同氮源的条件下,5个基因中只有基因的转录水平有较大改变,当以L-苯丙氨酸为唯一氮源时,转录水平比其余4个基因的转录水平高出30倍,说明艾氏途径中苯丙酮酸脱羧酶主要是由基因编码[10]。Aro10p的底物范围较广,主要参与芳香族氨基酸转氨反应产物的脱羧反应[10]。与一样,细胞在优质氮源条件下不表达基因,在氮源贫乏的情况下,经苯丙氨酸、色氨酸、亮氨酸和甲硫氨酸等诱导表达,其诱导作用同样涉及转录因子Aro80p和一段上游激活序列。
艾氏途径合成2-苯乙醇的最后一步是苯乙醛在依赖于NADH的醇脱氢酶催化下发生还原反应,生成终产物2-苯乙醇 (图2)[3]。在葡萄糖限制的连续充氧恒化器中培养时,苯乙醛主要被醛脱氢酶氧化成杂醇酸,而以葡萄糖流加分批培养时,90%以上的苯乙醛会经醇脱氢酶还原生成2-苯乙醇,更进一步以不充氧方式进行分批或者恒化器培养时,苯乙醛几乎可以全部被还原生成2-苯乙醇[10]。说明醛脱氢酶与醇脱氢酶催化苯乙醛发生氧化还原反应之间的平衡是由培养条件所决定的[6,11]。在酿酒酵母中共发现6个与2-苯乙醇合成相关的脱氢酶基因,包括5个乙醇脱氢酶基因、、、和,以及一个甲醛脱氢酶基因,这6个基因至少有一个表达,细胞才能表现出长链复合醇脱氢酶活性。而Adh1p-Adh5p或者 Sfa1p中的任何一个都可以单独催化艾氏途径中最后一步由醛脱氢形成高级醇的反应[6])。
1.2.3 2-苯乙醇的外排
杂醇从细胞内外排到培养基中的详细机制目前还不清楚,但有研究表明,杂醇的外排至少需要一个细胞质膜载体的参与[6]。,编码一种依赖于ATP的与苯甲酸盐、山梨酸盐等弱有机酸外排有关的质膜载体Pdr12p。当细胞在以亮氨酸、甲硫氨酸或苯丙氨酸为唯一氮源的恒化器中培养时,的表达水平明显上升[9]。对缺失突变株的表型分析表明Pdr12p参与了酵母菌艾氏途径以亮氨酸、异亮氨酸、缬氨酸、苯丙氨酸或色氨酸为底物合成的杂醇的外排过程[12]。
1.2.4 艾氏途径合成2-苯乙醇的调控
在氮源丰富的条件下,细胞只能通过莽草酸途径合成少量的2-苯乙醇[9]。而当L-苯丙氨酸作为唯一氮源时,某些转录因子可以调控艾氏途径相关基因表达,细胞以艾氏途径合成2-苯乙醇。目前已知的调控因子主要有Aro80p以及GATA转录因子[13-14]。
1) 转录因子Aro80p
基因编码的转录因子Aro80p属于Zn2Cys6蛋白家族的一员。它对芳香族氨基酸产生应答而激活和的表达。Aro80p的N末端是与DNA结合的区域,能够与靶基因启动子序列中一段36 bp的激活序列结合。这段36 bp的激活序列由4组互相间隔7个碱基的CCG组成,最早在和的启动子序列中得到确认,同时也存在于启动子序列中(图3)[14]。在芳香族氨基酸作为唯一氮源的条件下,芳香族氨基酸通过氨基酸通透酶Gap1p进入细胞,Aro80p接受芳香族氨基酸的诱导信号后与和基因启动子上的CCG重复序列结合,激活艾氏途径关键酶基因的表达,同时Aro80p也对的表达产生自诱导作用。
2) GATA转录因子
GATA家族是一类能识别GATA基序(motif)并与之结合的转录调节因子。在酿酒酵母中,氮代谢活动相关基因的表达受4个GATA家族转录因子——Gln3p、Gzf3p、Gat1p、Dal80p的全局调控,其中Gln3p和Gat1p是转录激活因子[13]。在氮源丰富条件下,Gln3p和Gat1p被隔离在细胞质中,无法参与靶基因的转录调控;当氮源贫乏时,Gln3p和Gat1p进入细胞核,激活靶基因的表达[13-14]。是第一个被克隆和测序的氮代谢基因的调控因子基因。Gln3p的306−330区域是一个锌指结构,是Gln3p与靶基因启动子的5¢-GATAA/G-3¢序列结合的区域,这些序列称之为上游激活序列 (UASNTR)。Gat1p是酿酒酵母氮代谢途径中第二个被发现的激活因子。和有较高的同源性,310−334区域是与靶基因启动子5¢-GATAA/G-3¢序列结合的锌指结构区。与酿酒酵母艾氏途径相关的、、和的启动子中均含有GATA转录因子的结合序列5¢-GATAA/G-3¢(图3)[14];用雷帕霉素处理酵母细胞后,细胞出现类似氮源缺乏的表型,通过染色质免疫共沉淀发现此条件下GATA转录因子Gln3p和Gat1p与、、和启动子的结合明显增强[14]。而敲除GATA转录激活因子编码基因和后,、、和的表达水平明显降低[14]。可见GATA转录因子可能直接或间接参与艾氏途径合成2-苯乙醇关键酶基因的转录调控。

图3 ARO9、ARO10、ARO80和GAP1启动子上游激活序列
2 2-苯乙醇的生理功能与细胞毒性
2-苯乙醇作为一种次级代谢产物,它在酵母细胞中的生理功能目前还不很清楚。它可能作为环境敏感的信号分子,通过特定的信号途径影响细胞的形态。酵母细胞在含有杂醇,比如异戊醇的培养基中会诱导假菌丝生长,这种细胞形态的改变伴随着琥珀酸脱氢酶活性的增加以及细胞壁几丁质含量的上升。除异戊醇外,外源添加2-苯乙醇也会导致细胞形态发生改变和单倍体侵入生长[15]。生理生化研究表明,随着2-苯乙醇浓度增加(从0到4.0 g/L),酵母细胞分解代谢能力、细胞膜渗透性逐渐降低,线粒体膜电位逐渐增加,胞内ROS 浓度先增加后减少[16]。这种效应可能被一种感应环境变化而发生形态改变的群体信号通路所调控。芳香醇通过cAMP-依赖的蛋白激酶A亚基Tpk2p和转录因子Flo8p,诱导细胞表面GPI锚定蛋白——絮凝蛋白Flo11p的上调表达来刺激细胞形态发生改变[15]。在不能合成芳香醇的缺陷菌株中,细胞丝状生长的现象明显减少,而外源添加芳香醇后细胞又重新出现丝状生长的现象[15]。人类真菌病原体白色念珠菌和都柏林念珠菌在刺激菌膜形成的生长阶段也会产生2-苯乙醇和异戊醇。可见2-苯乙醇可能作为一种信号分子,诱导细胞分化以适应环境的改变[6]。
3 提高酵母菌2-苯乙醇产量的研究
艾氏途径合成2-苯乙醇只需要3步反应,代谢途径短,是提高2-苯乙醇产量的关键途径。酵母细胞在贫乏氮源中仅维持基本的生理代谢活动,因此细胞对芳香族氨基酸的吸收速度比较慢,艾氏途径转化芳香族氨基酸的效率很低。贫乏型氨基酸在细胞内累积,也会对氨基酸通透酶Gap1p基因的表达和酶活性产生反馈抑制作用,以减少细胞能量及代谢物的消耗。而当艾氏途径的产物2-苯乙醇浓度上升时,细胞生长和的表达都受到抑制,2-苯乙醇浓度超过3 g/L后,几乎完全抑制酵母细胞生长,并且的表达几乎被阻断;细胞对L-苯丙氨酸的吸收效率也随2-苯乙醇浓度的上升而逐渐降低[16]。因此,酵母细胞通过艾氏途径合成2-苯乙醇存在着底物反馈抑制、底物利用率低、产物反馈抑制和产物的细胞毒性等问题。要提高2-苯乙醇的产量,需要对酵母菌合成2-苯乙醇的各个关键环节进行综合调控。目前提高酵母菌2-苯乙醇产量的研究主要包括传统选育、代谢工程改造等育种策略以及发酵过程优化及控制。
3.1 菌株选育
3.1.1 自然筛选及诱变育种
对微生物进行筛选和诱变是获得工业高产菌株的有效方法。酵母菌是人类最早应用的工业微生物之一,通过筛选和诱变获得高产2-苯乙醇的酵母菌株已有较多的报道 (表1)。梅建凤等比较了13个酵母菌株合成2-苯乙醇的能力,筛选出一株2-苯乙醇合成能力较高的酿酒酵母BD;紫外诱变获得的突变菌株BD-25-39其2-苯乙醇产量达到5.4 g/L,比原始菌株提高了10.2%[17-18]。Eshkol等在具有多重压力抗性表型的酵母菌株中筛选首先获得耐热菌株,进而获得可以耐受2.5 g/L以上2-苯乙醇的酵母菌株Ye9-612,其2-苯乙醇产量和非耐热菌株相比提高了57%[19]。Celinska等报道了一株从英国酵母保藏中心筛选到的产2-苯乙醇的解脂耶氏酵母NCYC3825,在非优化的培养基中2-苯乙醇产量接近2g/L,这是首次筛选到的产2-苯乙醇的解脂耶氏酵母,是一株较有潜力的2-苯乙醇生产菌株[20]。
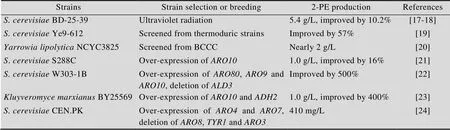
表1 产2-苯乙醇酵母菌株选育
3.1.2 代谢工程改造
运用基因工程可以对酵母菌合成2-苯乙醇的关键酶基因和调控因子基因的表达进行调控,进而调节细胞合成2-苯乙醇的能力,达到定向提高2-苯乙醇产量的目的 (表1)。梁婧如等从.S288C 中克隆脱羧酶基因并构建重组质粒,将重组质粒导入S288C,转化菌株的2-苯乙醇产量达到1.0 g/L,较对照菌提高了16%[21]。Kim等在W303-1B中高效表达转录因子基因,明显提高了Aro80p靶基因和的表达水平,使2-苯乙醇产量比对照菌株提高了58%;进一步通过同时高效表达、和,在SC培养基中2-苯乙醇产量比对照菌株提高了3.1倍;在此基础上,敲除乙醛脱氢酶基因,阻断苯乙醛生成苯乙酸酯这一竞争性途径,2-苯乙醇产量比对照菌提高了约5倍[22]。Kim等通过质粒介导的方式在马克斯克鲁维酵母BY25569中同时高效表达酿酒酵母艾氏途径的苯丙酮酸脱羧酶基因和醇脱氢酶基因,在以YNB为氮源的培养基中培养时2-苯乙醇产量为1.0 g/L,比宿主菌株提高了4倍;而当这两个基因分别在BY25569中高效表达时,细胞没有产生2-苯乙醇,说明在以YNB为氮源的培养基中,细胞启动艾氏途径合成2-苯乙醇至少需要同时具有苯丙酮酸脱羧酶和醇脱氢酶的活性;作者还筛选出1株具有对氟苯丙氨酸 (L-Phe的毒性类似物)抗性的进化菌株,并在该菌株中高效表达来源于的抗3-脱氧-D-阿拉伯庚酮糖酸-7-磷酸(DAHP) 合酶回复突变型基因aroG,减轻芳香族氨基酸特别是L-苯丙氨酸合成的反馈抑制,该菌株在不含L-苯丙氨酸的培养基中可以合成1.3 g/L的2-苯乙醇[23]。Romagnoli等应用合成基因阵列法对酿酒酵母中参与2-苯乙醇合成的基因进行筛选和鉴定,重点研究了编码苯丙酮酸脱羧酶的基因,研究发现敲除后的CEN.PK在以硫酸铵为唯一氮源的培养基中生长时,的表达量增加,2-苯乙醇的产量为180 mg/L;同时敲除、和以及高效表达和后,的表达量进一步增加,2-苯乙醇产量达到410 mg/L,该研究为利用廉价氮源合成2-苯乙醇提供了新的思路[24]。本实验室对酿酒酵母莽草酸途经和艾氏途径合成2-苯乙醇的代谢调控进行了研究,发现不仅合成途径中的关键酶对2-苯乙醇合成有直接的调节作用,而且氨基酸通透酶以及转录因子对莽草酸途径和艾氏途径合成2-苯乙醇也具有重要的调控作用,这些研究为全面阐述2-苯乙醇合成的调控机制以及进一步构建高产2-苯乙醇的酵母工程菌提供了宝贵的理论依据。
3.2 发酵过程优化与控制
3.2.1 培养基成分和培养条件优化
酵母菌合成2-苯乙醇除了受到菌株本身特性的影响,还与培养基成分和培养条件密切相关,通过对培养基成分及培养条件进行优化,可以显著提高酵母菌2-苯乙醇的产量 (表2)。梅建凤等通过单因素和正交试验、中心组合试验和响应面分析,建立了2-PE产量和培养基组分之间的二次多项式回归模型,发现碳氮源、无机盐及底物浓度等均是影响酵母菌2-PE合成的主要因素,在优化培养条件下,2-PE合成能力提高了155%[18]。王航等对酿酒酵母转化生成2-苯乙醇过程的碳氮源进行优化,2-苯乙醇终浓度达4.4 g/L,和未优化时相比提高了76%[25]。汪琨等对酿酒酵母CWY132生物转化合成2-苯乙醇的培养基组成及培养条件进行优化设计,2-苯乙醇产量达到4.1 g/L,比未优化时提高了约50%[26]。Etschmann等对CBS600的13种培养基成分以及培养温度进行优化演算,2-苯乙醇的最高产量达到5.6 g/L,比未优化时提高了87%[27]。Pan等研究在甘蔗糖蜜废水中以混合微生物共培养的方法生产2-苯乙醇,利用比较代谢组学和多元统计分析方法对细胞内102种代谢物进行了分析,发现其中17种代谢物通过6条不同的途径影响2-苯乙醇的合成,经过发酵实验对代谢物进一步分析提出了生产2-苯乙醇的整体代谢机制假说,即:细胞内丙酮酸代谢流量的分支途径,以及苯丙氨酸、酪氨酸、色氨酸、谷氨酸、脯氨酸、亮氨酸、苏氨酸和油酸的流量,与2-苯乙醇产量和细胞生长密切相关,这个结论为利用甘蔗糖蜜废水生产2-苯乙醇的菌种驯化、筛选和培养基优化提供了理论指导[28]。
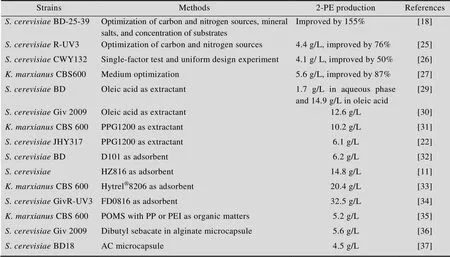
表2 产2-苯乙醇酵母菌株发酵过程优化和控制
3.2.2 原位产物分离技术
原位产物分离技术,是一种可以从发酵培养基中连续回收产物的方法,使发酵培养基中产物的浓度维持较低水平,有效降低或避免发酵产物对微生物细胞的生长抑制或毒性作用,解除产物反馈抑制,还可以简化下游的产物分离工艺。原位产物分离技术主要包括两相法萃取技术、吸附技术以及基于膜分离的渗透蒸发和渗透萃取技术等。在微生物合成2-苯乙醇的培养基中采用原位产物分离技术将2-苯乙醇与微生物细胞分离,有助于提高2-苯乙醇产量 (表2)。
1) 两相法萃取
液液萃取技术是指利用2-苯乙醇在水相和有机相中的溶解度或分配系数差异,使2-苯乙醇从水相转移到有机相中,达到产物和细胞分离的目的。梅建凤等研究了BD在水/有机溶剂两相体系中转化合成2-苯乙醇的工艺,在油酸与培养基体积比为1∶3时,有机相和水相中2-苯乙醇的浓度分别为14.9 g/L和1.7 g/L[29]。Stark等以油酸为萃取剂,将Giv 2009进行两相补料分批培养,油酸中2-苯乙醇的浓度为24.0 g/L,2-苯乙醇总产量达到12.6 g/L[30]。Etschmann等以PPG1200为萃取剂对CBS 600进行流加培养,培养过程中保持培养基中L-苯丙氨酸浓度恒定,有机相和水相中的2-苯乙醇浓度分别为26.5 g/L和0.3 g/L,2-苯乙醇总产量为10.2 g/L[31]。Kim 以PPG 1200为萃取剂,采用JHY 317进行两相发酵,2-苯乙醇总产量为6.1 g/L[22]。
2) 吸附
吸附技术是在发酵培养基中加入利用树脂等多孔材料对2-苯乙醇进行吸附,使产物实现原位转移。Mei等从几种树脂中筛选出对2-苯乙醇具有较高吸附能力的非极性大孔树脂D101,以BD作为实验菌株,将2 g水合树脂加入到30 mL发酵培养基中,2-苯乙醇的总产量为6.2 g/L[32]。Rong等在用活性干酵母发酵2-苯乙醇时以大孔吸附树脂HZ816为分离介质,通过控制葡萄糖酵解和乙醇氧化降解的速率来加强2-苯乙醇合成效率,2-苯乙醇总产量为14.8 g/L[11]。Gao和Daugulis利用固液两相分区生物反应器系统对CBS 600进行发酵培养,以Hytrel®8206作为吸附剂,2-苯乙醇总产量为13.7 g/L,而当采用半连续反应器进行培养时,2-苯乙醇总产量可达20.4 g/L[33]。Wang等提出了一个反映协同效应的动力学模型,利用GivR-UV3合成2-苯乙醇时通过控制葡萄糖流量和加入FD0816树脂作为萃取剂来降低2-苯乙醇和乙醇对细胞的毒性作用,在流加培养时加入10%的树脂,2-苯乙醇总产量为13.7 g/L,而当采用半连续培养的原位产物分离技术,在2-苯乙醇含量高于2.7 g/L时替换新的树脂,2-苯乙醇总产量可达32.5 g/L[34]。
3) 渗透蒸发和渗透萃取
膜具有选择性分离的功能,利用膜的选择透过性可以在发酵液中实现2-苯乙醇的分离和纯化。Etschmann等用聚辛基甲基硅氧烷 (POMS) 膜包裹聚丙烯 (PP) 或聚醚酰亚胺 (PEI) 组成一种亲有机质的渗透蒸发单元,将它用于CBS 600的发酵培养,2-苯乙醇产量达到5.2 g/L[35]。Stark等将癸二酸二丁酯包埋在直径2.2 mm的海藻酸钙-聚乙烯亚胺-戊二醛微胶囊中,每个微囊形成一个独立的渗透萃取系统,将这些微囊放入发酵罐中,对Giv 2009进行补料分批发酵后得到5.6 g/L的 2-苯乙醇,比原来的产量提高了47%[36]。侯丹丹等利用海藻酸钠-壳聚糖 (AC) 微胶囊作为固定化载体将酵母细胞包裹,在培养基-癸二酸二丁酯两相体系中催化合成2-苯乙醇,细胞与有机相被微胶囊隔离,有机相不影响微囊内酵母细胞的生长,且微囊内细胞活性保持良好,2-苯乙醇产量为4.5 g/L[37]。
4 总结与展望
微生物转化法生产的2-苯乙醇属于天然产品,符合国际标准对食品、化妆品和药品原材料的要求,在国际市场上具有广阔的应用前景。然而世界范围内只有少数几个企业能够运用微生物发酵生产2-苯乙醇,产量较低,远远不能满足市场需求。微生物合成2-苯乙醇的产量受到多种因素的影响和制约,目前提高2-苯乙醇产量的研究取得了一定的进展,但是这些方法都存在着一定的局限:传统方法随机性大,2-苯乙醇产量提高不明显;原位产物分离技术成本较高,不利于控制生产成本;基因工程方法的调控机制比较复杂,需要更多的深入研究。在今后的研究中,研究者们仍需在菌种改造、培养基优化、成本控制和生产工艺优化等方面继续深入研究,综合考虑这些因素对2-苯乙醇产量的影响,实现微生物生产2-苯乙醇的最优方案。同时,深入研究2-苯乙醇生物合成的关键调控因子及调控机制以及2-苯乙醇的毒性机制,将为阐明细胞内2-苯乙醇的代谢机制及调控机理提供更多理论依据,并为进一步构建高产2-苯乙醇工程菌提供理论指导。
REFERENCES
[1] Fraud S, Rees EL, Mahenthiralingam E, et al. Aromatic alcohols and their effect on gram-negative bacteria, cocci and mycobacteria. J Antimicrob Chemoth, 2003, 51(6): 1435–1438.
[2] Mo EK, Sung CK. Phenylethyl alcohol (PEA) application slows fungal growth and maintains aroma in strawberry. Postharvest Biol Tec, 2007, 45(2): 234–239.
[3] Etschmann MM, Bluemke W, Sell D, et al. Biotechnological production of 2-phenylethanol. Appl Microbiol Biotechnol, 2002, 59(1): 1–8.
[4] Hua D, Xu P. Recent advances in biotechnological production of 2-phenylethanol. Biotechnol Adv, 2011, 29(6): 654–660.
[5] Etschmann MM, Sell D, Schrader J. Microbial production of 2-phenylethanol by an integrated bioprocess//LeQuere JL, Etievant PX. Flavour research at the dawn of the twenty-first century. 2003: 385–388.
[6] Hazelwood LA, Daran JM, Vanmaris AJ, et al. The Ehrlich pathway for fusel alcohol production: a century of research onmetabolism. Appl Environ Microb, 2008, 74(8): 2259–2266.
[7] Broach JR. Nutritional control of growth and development in yeast. Genetics, 2012, 192(1): 73–105.
[8] Chen H, Huang H, Li X, et al. Crystallization and preliminary X-ray diffraction analysis of, an aromatic aminotransferase from. Protein Peptide Lett, 2009, 16(4): 450–453.
[9] Boer VM, Tai SL, Vuralhan Z, et al. Transcriptional responses ofto preferred and nonpreferred nitrogen sources in glucose-limited chemostat cultures. FEMS Yeast Res, 2007, 7(4): 604–620.
[10] Vuralhan Z, Luttik M A, Tai S L, et al. Physiological characterization of the-dependent, broad-substrate-specificity 2-oxo acid decarboxylase activity of. Appl Environ Microb, 2005, 71(6): 3276–3284.
[11] Rong S, Ding B, Zhang X, et al. Enhanced biotransformation of 2-phenylethanol with ethanol oxidation in a solid-liquid two-phase system by active dry yeast. Curr Microbiol, 2011, 63(5): 503–509.
[12] Hazelwood L A, Tai S L, Boer VM, et al. A new physiological role for Pdr12p in: export of aromatic and branched-chain organic acids produced in amino acid catabolism. FEMS Yeast Res, 2006, 6(6): 937–945.
[13] Cooper TG. Transmitting the signal of excess nitrogen infrom the Tor proteins to the GATA factors: connecting the dots. FEMS Microbiol Rev, 2002, 26(3): 223–238.
[14] Lee K, Hahn J S. Interplay of Aro80p and GATA activators in regulation of genes for catabolism of aromatic amino acids in. Mol Microbiol, 2013, 88(6): 1120–1134.
[15] Chen H, Fink GR. Feedback control of morphogenesis in fungi by aromatic alcohols. Genes Dev, 2006, 20(9): 1150–1161.
[16] Wang H, Meng C, Shi XA, et al. Effects of 2-phenylethanol on physiological and biochemical characteristics of. Microbiol China, 2012, 39(6): 749–755 (in Chinese).王航, 孟春, 石贤爱, 等. 2-苯乙醇对酿酒酵母生理生化特性影响. 微生物学通报, 2012, 39(6): 749–755.
[17] Mei JF, Hang M. Breeding of yeast strain for production of 2-phenylethanol by biotransformation. Food Fermn Ind, 2007, 33(5): 22–24 (in Chinese).梅建凤, 航闵. 生物转化法合成2-苯乙醇菌种的诱变选育. 食品与发酵工业, 2007, 33(5): 22–24.
[18] Mei JF, Hang M, Lü ZM. Biocatalytic synthesis of 2-phenythanol by yeast cells. Chinese J Catal, 2007, 28(11): 993–998 (in Chinese). 梅建凤, 闵航, 吕镇梅. 利用酵母细胞生物催化合成2-苯乙醇. 催化学报, 2007, 28(11): 993–998.
[19] Eshkol N, Sendovski M, Bahalul M, et al. Production of 2-phenylethanol from L-phenylalanine by a stress tolerantstrain. J Appl Microbiol, 2009, 106(2): 534–542.
[20] Celinska E, Kubiak P, Bialas W, et al.: the novel and promising 2-phenylethanol producer. J Ind Microbiol Biot, 2013, 40(3-4): 389–392.
[21] Liang JR, Yin S, Liu L, et al. Over-expression of the decarboxylase geneand its influence on β-phenethyl alcohol biosynthesis in. Sci Tech Food Ind, 2014, 35(3): 155–159 (In Chinese). 梁婧如, 尹胜, 刘丽, 等. 脱羧酶基因的过量表达及其对的β-苯乙醇合成代谢影响. 食品工业科技, 2014, 35(3): 155–159.
[22] Kim B, Cho BR, Hahn JS. Metabolic engineering offor the production of 2-phenylethanolEhrlich pathway. Biotechnol Bioeng, 2014, 111(1): 115–124.
[23] Kim TY, Lee SW, Oh MK. Biosynthesis of 2-phenylethanol from glucose with genetically engineered. Enzyme Microb Technol, 2014, 61–62(1): 44–47.
[24] Romagnoli G, Knijnenburg TA, Liti G, et al. Deletion of thegene, encoding an aromatic amino acid transaminase, enhances phenylethanol production from glucose. Yeast, 2015, 32(1): 29–45.
[25] Wang H, Dong QF, Meng C, et al. Optimizationand kinetics of the fed-batch bioconversion from L-phenylalanine to 2-phenylethanol. Chin J Process Eng, 2010, 10(4): 767–771 (in Chinese).王航, 董清风, 孟春, 等. 酿酒酵母转化生成2-苯乙醇分批补料工艺优化. 过程工程学报, 2010, 10(4): 767–771.
[26] Wang K, Shen QJ, Wei XY, et al. Studies on the biotransformation processes for 2-phenylethanol productionby CWY132in small fermentor test. Food Fermn Ind, 2011, 37(4): 102–106 (in Chinese).汪琨, 沈情佳, 魏秀燕, 等. 酿酒酵母CWY132发酵罐小试生产2-苯乙醇. 食品与发酵工业, 2011, 37(4): 102–106.
[27] Etschmann MMW, Sell D, Schrader J. Medium optimization for the production of the aroma compound2-phenylethanol using a genetic algorithm. J Mol CatalB-Enzym, 2004, 29: 187–193.
[28] PanXR, Qi HS, Mu L, et al. Molasses wastewater for higher 2-phenylethanol production. J Agric Food Chem, 2014, 62(40): 9927–9935.
[29] Mei JF, Chen H, Wang H, et al. Synthesis of 2-phenylethanol by bioconversion in aqueous/organic solvent two-phase system. Chem React Eng Techno, 2009, 25(1): 69–73 (in Chinese).梅建凤, 陈虹, 王鸿, 等. 水/有机溶剂两相体系中生物转化合成2-苯乙醇. 化学反应工程与工艺, 2009, 25(1): 69–73.
[30] Stark D, Munch T, Sonnleitner B, et al. Extractive bioconversion of 2-phenylethanol from L-phenylalanine by. Biotechnol Progr, 2002, 18(3): 514–523.
[31] Etschmann MM, Schrader J. An aqueous-organic two-phase bioprocess for efficient production of the natural aroma chemicals 2-phenylethanol and 2-phenylethylacetate with yeast. Appl Microbiol Biotechnol, 2006, 71(4): 440–443.
[32] Mei J, Min H, Lu Z. Enhanced biotransformation of l-phenylalanine to 2-phenylethanol using anproduct adsorption technique. Process Biochem, 2009, 44(8): 886–890.
[33] Gao F, Daugulis AJ. Bioproduction of the aroma compound 2-phenylethanol in a solid-liquid two-phase partitioning bioreactor system by. Biotechnol Bioeng, 2009, 104(2): 332–339.
[34] Wang HD, Guan QF, Meng A, et al. Synergistic inhibition effect of 2-phenylethanol and ethanol on bioproduction of natural 2-phenylethanol byand process enhancement. J Biosci Bioeng, 2011, 112(1): 26–31.
[35] Etschmann MM, Sell D, Schrader J. Production of 2-phenylethanol and 2-phenylethylacetate from L-phenylalanine by coupling whole-cell biocatalysis with organophilic pervaporation. Biotechnol Bioeng, 2005, 92(5): 624–634.
[36] Stark D, Kornmann H, Munch T, et al. Novel type ofextraction: Use of solvent containing microcapsules for the bioconversion of 2-phenylethanol from L-phenylalanine by. Biotechnol Bioeng, 2003, 83(4): 376–385.
[37] Hou DD, Li HJ, Song HY, et al. Size and strength of alginate-chitosan microcapsules in nonaqueous system. J Chem Ind Eng, 2012, 63(5): 1522–1528 (in Chinese).侯丹丹, 李会静, 宋慧一, 等. 非水相体系中海藻酸钠-壳聚糖微胶囊粒径及强度性能. 化工学报, 2012, 63(5): 1522–1528.
(本文责编 陈宏宇)
Advances in biosynthesis of 2-phenylethanol by yeasts
Xianrui Chen, Zhaoyue Wang, and Xiuping He
CAS Key Laboratory of Microbial Physiological and Metabolic Engineering, Institute of Microbiology, Chinese Academy of Sciences, Beijing 100101, China
2-Phenylethanol (2-PE) is an aromatic alcohol with a pleasant rose-like fragrance. It has been widely used in food, cosmetic, and pharmaceutical industry. Most of 2-PE is produced by chemical synthesis, but the use of chemically synthesized product is restricted in some fields. 2-PE from plant extraction is natural but its production is very low. Microbial biotransformation is a promising process to produce natural 2-PE. In this paper, we review recent research progress in the synthetic metabolic pathways and regulatory processes of 2-PE in yeast, and strategies for improving 2-PE production. Moreover, we discuss the limitation of current progress and future research directions.
yeast, 2-phenylethanol, metabolic pathway, gene, regulation
December 21, 2015; Accepted: January 28, 2016
Xiuping He. Tel/Fax: +86-10-64807427; E-mail: hexp@im.ac.cn
Supported by: National Natural Science Foundation of China (No. 31171754).
国家自然科学基金 (No. 31171754) 资助。
陈先锐, 王肇悦, 何秀萍. 酵母菌合成2-苯乙醇的研究进展. 生物工程学报, 2016, 32(9): 1151–1163.
Chen XR, Wang ZY, He XP. Advances in biosynthesis of 2-phenylethanol by yeasts. Chin J Biotech, 2016, 32(9): 1151–1163.
