产顺,顺-粘康酸细胞工厂的构建与优化
2016-11-01宋国田江小龙陈五九彭彦峰路福平王钦宏
宋国田,江小龙,陈五九,彭彦峰,路福平,王钦宏
产顺,顺-粘康酸细胞工厂的构建与优化
宋国田1,2,江小龙2,陈五九2,彭彦峰2,路福平1,王钦宏2
1 天津科技大学生物工程学院,天津 300457 2 中国科学院天津工业生物技术研究所中国科学院系统微生物工程重点实验室,天津 300308
顺,顺-粘康酸是重要的平台化学品。目前,生物合成顺,顺-粘康酸还缺乏高性能菌株,已报道的主要工程菌株不仅需要诱导表达,遗传不稳定,而且发酵培养基组分复杂,不利于大规模工业化生产。构建能利用简单无机盐培养基、遗传稳定且不需要诱导表达的新型工程菌受到人们的关注。本研究在实验室前期构建的产三脱氢莽草酸工程菌株WJ060中,整合合成顺,顺-粘康酸的3个外源基因(、、),并且利用3个不同强度的组成型启动子进行组合调控,成功构建了27株顺,顺-粘康酸工程菌,得到的最优工程菌MA30的产量达到1.7 g/L。为了进一步提高顺,顺-粘康酸工程菌的生产能力,利用基因组复制工程构建突变体库,结合高通量筛选方法,经过两轮筛选,成功筛选到了顺,顺-粘康酸产量提高超过8%的大肠杆菌MA30-G2。利用5 L发酵罐进行分批补料发酵,MA30-G2的顺,顺-粘康酸产量达到了11.5 g/L。本研究采用组合调控和高通量筛选相结合的策略不仅促进了顺,顺-粘康酸的生物合成,同时也为其他生物基化学品的生物制造提供了重要参考。
顺,顺-粘康酸,组合调控,大肠杆菌,组成型启动子,基因组复制工程,高通量筛选
顺,顺-粘康酸(,-muconic acid,MA)具有两个羧基和成对的共轭双键,在260 nm处具有很好的紫外吸收性质,可用于紫外防护剂以及军工特种用品如隐形飞机涂层,同时也是制备功能树脂、医药及农用化学品的潜在原料[1],并可用于生产大宗化工产品尼龙66的单体己二酸以及对苯二甲酸二甲酯和偏苯三酸等[2-4]。
目前,生物合成MA主要是利用含质粒的工程菌实现。2015年,Jung等[5]通过在优化的肺炎克雷伯氏菌中转入含有的质粒,MA产量达到2.1 g/L,但由于肺炎克雷伯氏菌是致病菌,不利于工业化生产;2013年,Pandeeti等[6]在酿酒酵母中通过在质粒上过表达MA合成途径的3个外源基因,首次实现了MA在酿酒酵母中的生产,产量仅为141 mg/L。自1994年Draths等[7]在莽草酸合成途径阻断的大肠杆菌AB2834中通过共转含有MA合成途径3个外源基因的2个质粒,MA产量达到2.4 g/L之后,在大肠杆菌中合成MA的研究也越来越受到人们的关注。2014年,Lin等[8]通过以水杨酸作为前体合成MA,摇瓶发酵48 h产量达到 1.5 g/L。2015年,Zhang等[9]通过构建了共生的双细胞模式将木糖与葡萄糖混合糖转化为MA的生物合成途径,MA在72 h的分批补料发酵产量最高达到4.7 g/L。虽然MA在大肠杆菌中生产取得了一定程度的成功,但由于是以遗传不稳定的基于质粒的工程菌为发酵菌株,同时使用复杂的培养基成分使生产成本增加,不利于MA工业化生产。因此,需要通过利用新的代谢工程策略将外源基因整合到大肠杆菌基因组,并通过组合调控等获得生产能力提高,并且遗传稳定的工程菌株。
为了提高MA产量,近几十年中,许多研究学者[10-12]也采用各种方法提高MA前体物3-脱氢莽草酸的产量。本研究中,以产3-脱氢莽草酸(3-hydroshikimate, DHS) 的大肠杆菌WJ060作为出发菌株,先后整合不同强度组成型启动子组合调控[13]、和突变体[14]的表达,合成途径如图1所示。我们得到了最优MA生产菌MA30。为进一步提高MA工程菌的生产能力,我们将基因组复制工程与MA高通量筛选方法[15-16]相结合,经过两轮筛选,成功筛选到了MA产量得到提高的大肠杆菌MA30-G2。利用5 L发酵罐进行分批补料发酵[17-21],进一步提高了MA的产量。

图1 大肠杆菌中顺,顺-粘康酸生物合成途径
1 材料与方法
1.1 材料
1.1.1 菌株与质粒
本试验所用菌株与质粒如表1所示。生产DHS的出发菌株大肠杆菌WJ060是实验室前期构建的菌株。
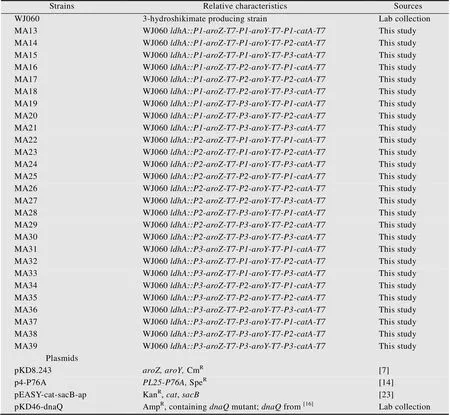
表1 本研究的菌株与质粒
1.1.2 主要试剂
氨苄青霉素(工作浓度100 μg/mL)、氯霉素(工作浓度34 μg/mL)、壮观霉素(工作浓度 50 μg/mL) 购自上海生工生物工程有限公司;质粒小量快速提取试剂盒购自美国Axygen公司;DNA 回收试剂盒购自康为世纪公司;TransStart FastDNA聚合酶购自北京全式金生物技术有限公司;2×PCR MasterMix,DNA marker购自Biomed公司;3-脱氢莽草酸(DHS) 标准品购自美国Sigma公司;原儿茶酸(PCA) 标准品购自Aldrich公司;儿茶酚(CA) 标准购自国药集团化学试剂有限公司;顺,顺-粘康酸(MA)标准品购自Aldrich公司;其他试剂均为分析纯。
1.1.3 培养基
液体LB培养基(g/L):酵母提取物5,胰蛋白胨10,氯化钠10 (固体LB加入1.5%琼脂粉) 摇瓶发酵培养基(g/L):KH2PO43.5,K2HPO4·3H2O 6.5,MgSO40.12,(NH4)2HPO43.5,CaCl20.011,硫胺素0.005。每升摇瓶发酵培养基添加1 mL的微量元素(g/L) 包括FeCl3·6H2O 0.16,CoCl2·6H2O 0.02,CuSO4·5H2O 0.015,ZnCl20.02,Na2MoO4·2H2O 0.02,H3BO30.05,每升微量元素添加10 mL浓盐酸。
发酵罐发酵种子培养基(g/L):酵母提取物5,胰蛋白胨10,氯化钠10,葡萄糖10;发酵罐发酵培养基(g/L):K2HPO4·3H2O 7.5,MgSO4·7H2O 2,(NH4)2SO41.6,FeSO4·7H2O 0.077 5,柠檬酸2,酵母抽提物1。每升发酵罐发酵培养基添加1 mL微量元素(g/L) 包括MnSO4·H2O 0.004 5,Na2SO40.02,ZnSO40.006 4,CoCl2·6H2O0.004,CuSO4·5H2O 0.000 6。
1.2 方法
1.2.1 重组片段的构建
整合到基因组中的由低强度到高强度的组成型启动子(P1: 5¢-TTATCTCTGGCGGTGTTG ACAAGAGATAACAACGTTGATATAATTGAGCCCTTTTGGTGCGTCAGTCAGTTTAAACCAGGAAACAGCT-3¢,P2: 5¢-TTATCTCTGGCGGTGT TGACAAGAGATAACAACGTTGATATAATTGAGCCTGAGGTGGCTTATTATTCGTTTAAACCAGGAAACAGCT-3',P3: 5¢-TTATCTCTGGCGG TGTTGACAAGAGATAACAACGTTGATATAATTGAGCCCGTATTGTTAGCATGTACGTTTAAACCAGGAAACAGCT-3¢)[24]与以及T7终止子串联表达重组片段构建如下:1) 第一步同源重组片段的构建:以pEASY-cat-sacB-ap为模板利用引物ldhA-cat-sacB-s/ldhA-cat-sacB-a进行扩增,获得带有40 bp同源臂的ldhA-cat-sacB- ldhA DNA片段。2) 第二步同源重组片段的构建:以pKD8.243为模板利用ldhA-P1-aroZ-s、ldhA-P2-aroZ-s、ldhA-P3-aroZ-s/ldhA-T7-aroZ-a分别进行扩增,获得带有40 bp同源臂的ldhA-P1/2/3-aroZ-T7-ldhA DNA片段,通过两步同源重组的方法实现目标片段对的无痕替换。具体构建片段与整合流程如图2A所示。

图2 重组片段的整合与组合调控示意图
用上述方法获得带有40 bp同源臂的aroZ-T7-cat-sacB-ldhA、aroZ-T7-P1/2/3-aroY-T7- ldhA以及aroY-T7-cat-sacB-ldhA、aroY-T7- P1/2/3-catA-T7-ldhA DNA片段。本研究中所用引物见表2。

表2 本研究所用的引物
The underlined is the sequence of synthetic promoter corresponding to the primer name.
1.2.2 MA细胞工厂的构建
通过在产3-脱氢莽草酸的大肠杆菌WJ060基因组上位点上依次整合3种不同强度的组成型启动子组合调控的3个外源基因(、、),成功构建了27株MA工程菌MA13-MA39,组合调控示意图如图2B所示。
1.2.3 MA高通量测定方法的建立
基于MA在260 nm处有很好的紫外吸收性质,配制浓度为0.2 g/L、0.4 g/L、0.6 g/L、0.8 g/L以及1 g/L的MA标准品,通过在酶标仪测定其260 nm的紫外吸光度值,以MA标准品浓度为横坐标,紫外吸光度值为纵坐标,绘制MA标准溶液的浓度与吸光度的标准曲线,每组实验3次平行。
1.2.4 MA细胞工厂的高通量筛选优化
基于突变的基因组复制工程构建文库[16],在MA30中转入温敏型质粒pKD46-dnaQ (由突变体替换pKD46中的、、)后于30 ℃连续传代4次,每代时12 h,从而构建了MA30突变体文库。从文库中分离单菌落,经过活化后,在无菌的96深孔板中37 ℃、 220 r/min发酵24 h,取每个文库中近千个样本的发酵液在96孔板中于酶标仪上检测其260 nm处的紫外吸光度值,并对吸光度值高于对照的最高突变工程菌进行摇瓶发酵验证,从而实现了高通量筛选的目的。
1.2.5 摇瓶发酵与发酵罐补料发酵
摇瓶发酵生产MA:将保存于−80 ℃的工程菌在加有氨苄青霉素的平板上划线,培养过夜,挑取单菌落到含有3mL LB的试管中,30 ℃、200 r/min培养12 h,测600值,保证起始600=0.4,按相应比例接种到10 mL摇瓶发酵培养基中(100 mL摇瓶),接种时添加2%葡萄糖,37 ℃、220 r/min培养24 h,收集菌液用于MA产量的测定。
发酵罐补料发酵生产MA:选取摇瓶发酵中MA产量最高的菌株进行发酵罐放大培养。将保存于−80 ℃的工程菌在加有氨苄青霉素的平板上划线,培养过夜,挑取单菌落到含有3 mLLB的试管中,30 ℃、200 r/min培养12 h,再将3 mL培养液接种于200 mL种子培养基(1 L摇瓶)中,37 ℃、250 r/min培养12 h,然后将200 mL种子全部接种于装有1.8 L发酵培养基的5 L发酵罐中,在37 ℃、pH 6.5、溶氧40%的条件下发酵,通过氨水调控pH。严格控制培养基中残糖含量低于1 g/L。从6 h开始,每隔6 h取样检测发酵液中葡萄糖、DHS、PCA、CA以及MA含量。
1.2.6 代谢产物和菌体量检测
利用高效液相色谱来确定发酵液中葡萄糖消耗量,DHS、PCA、CA以及MA积累量。发酵液稀释适当倍数后取1 mL于12 000 r/min离心10 min,取上清液制样,上液相。检测条件:VWD检测器,Innoval C18色谱柱(4.6mm× 250 mm,5 μm),流动相A为水∶磷酸=1 000∶1 (占80%),B为甲醇(占20%),流速0.8 mL/min,柱温30 ℃,检测波长分别为210 nm以及 260 nm。每个待测样品分别有3个平行样,实验结果取自3个平行的平均值。用DHS、PCA、CA以及MA等标准品构建HPLC标准曲线。以水作为空白,用分光光度计测定600值作为单位时间的菌体量。
2 结果与分析
2.1 MA细胞工厂的构建
为了构建基因组整合型的MA细胞工厂,选择实验室前期构建的产3-脱氢莽草酸大肠杆菌WJ060为出发菌株。该菌株是在野生型大肠杆菌ATCC8739中,通过弱化调控突变体替换解除反馈抑制作用、强化调控替换PTS以及弱化调控和后获得,可高效生产3-脱氢莽草酸,摇瓶产量超过3 g/L (图1)。结合理性设计原则,在产3-脱氢莽草酸的大肠杆菌WJ060基因组上,通过替代乳酸脱氢酶基因,依次整合3种不同强度的组成型启动子组合调控的3个外源基因(、、),成功构建了27株MA工程菌,实现了外源基因在WJ060基因组上的表达,结果如图3所示。对MA及其副产物产量分析表明,在MA产量前三的工程菌(MA21、MA27以及MA30) 中的表达均由高强度组成型启动子P3调控,而在MA产量最低的3株工程菌(MA13、MA22以及MA31) 中以及的表达均由弱强度组成型启动子P1调控,其副产物DHS、PCA以及CA在不同程度上均有较多积累,基因的表达强度影响MA的生产强度;MA30产量最高达到1.7 g/L,其副产物DHS因其的表达由中等强度组成型启动子P2调控,未完全转化到PCA而积累0.067 g/L,由于和的表达均受到高强度组成型启动子P3调控,PCA和CA基本上都转化成MA而没有积累;由3个最强的P3启动子分别调控3个外源基因表达的MA39产量少于MA30,与预期不一致,其原因在于MA39生长情况明显较弱,不利于MA的积累;同时结合27株工程菌的生长情况分析,MA产量较高的工程菌(MA21、MA27以及MA30) 其生长情况明显较弱,相反,MA产量较低的工程菌(MA13、MA22以及MA31)其生长情况反而较好,MA产量的积累对MA工程菌的生长有明显的抑制作用。通过构建一系列的MA细胞工厂,成功得到1株生长较好、产量较高的MA工程菌MA30。

图3 整合不同强度组成型启动子表达aroZ、aroY和catA的工程菌的MA产量
2.2 MA高通量测定方法的建立
为了提高MA细胞工厂的生产能力,期望通过基因组复制工程,筛选得到产能提高的MA突变株。然而,利用产物HPLC分析等检测方法难以进行庞大的文库筛选,需要有高通量的检测和筛选方法。由此,基于MA在260 nm处有良好的紫外吸收性质,我们测试了MA在 260 nm吸光度值与标准品浓度之间的关系,发现实验测得的吸光度值与标准MA溶液浓度之间的关系为=2.703 2+4.406 8,相关系数的平方2为0.990 5,线性关系良好 (图4)。因此,利用紫外检测的方法可以用来实现对生产MA的突变体文库快速、准确地筛选。

图4 紫外检测MA的标准曲线
2.3 MA细胞工厂的优化
2.3.1 MA细胞工厂的高通量筛选
第一轮筛选:以MA30作为出发菌株,基于突变体的基因组复制工程构建了MA突变文库后,利用MA高通量筛选方法,对文库进行酶标仪检测260 nm处的紫外吸光度值 (图5A)。在含有950个样本的MA30文库中,筛选得到紫外吸收值大于MA30共351个,占文库37%,并经过摇瓶发酵验证,得到了MA产量提高的突变体MA30-G1。
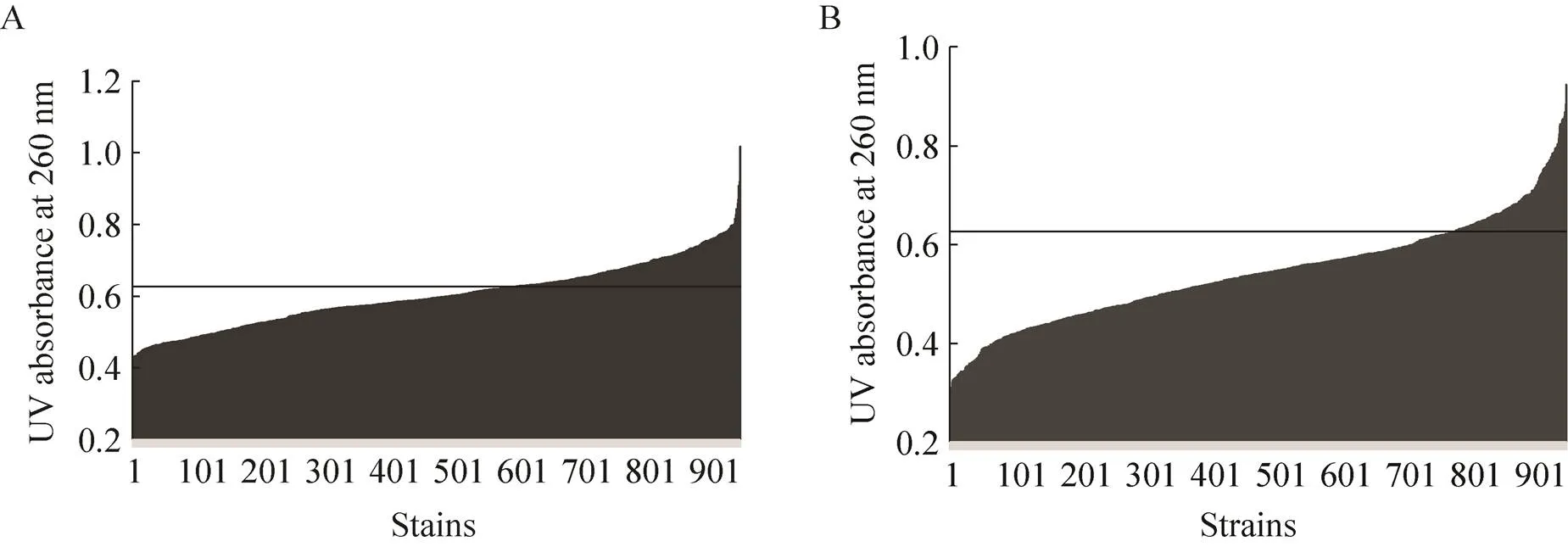
图5 MA突变体的紫外吸光度值
第二轮筛选:为了进一步提高MA30-G1的生产能力,以MA30-G1作为出发菌株,基于突变体的基因组复制工程构建文库后,利用MA高通量筛选方法,对文库进行酶标仪检测260 nm处的紫外吸光度值(图5B)。在含有950个样本的MA30-G1文库中,筛选得到紫外吸收值大于MA30-G1的突变体共171个,占文库18%,并经过摇瓶发酵验证,得到了MA产量进一步提高的突变体MA30-G2。
2.3.2 筛选得到的进化菌株摇瓶发酵评价
为了同时评价筛选得到的MA30-G1,MA30-G2以及对照MA30生产MA的情况,对其进行摇瓶发酵评价 (图6)。通过基因组复制工程与高通量筛选方法的结合,先后成功筛选得到了MA产量较MA30提高4%的MA30-G1,较MA30-G1产量进一步提高4.3%的MA30-G2,从而最终得到的MA30-G2较MA30产量提高了8.5%。因而,我们利用基因组复制辅助工程与MA高通量筛选方法,实现了快速、便捷的MA文库构建与筛选,并成功筛选到MA细胞工厂产能进一步提高的MA30-G2。
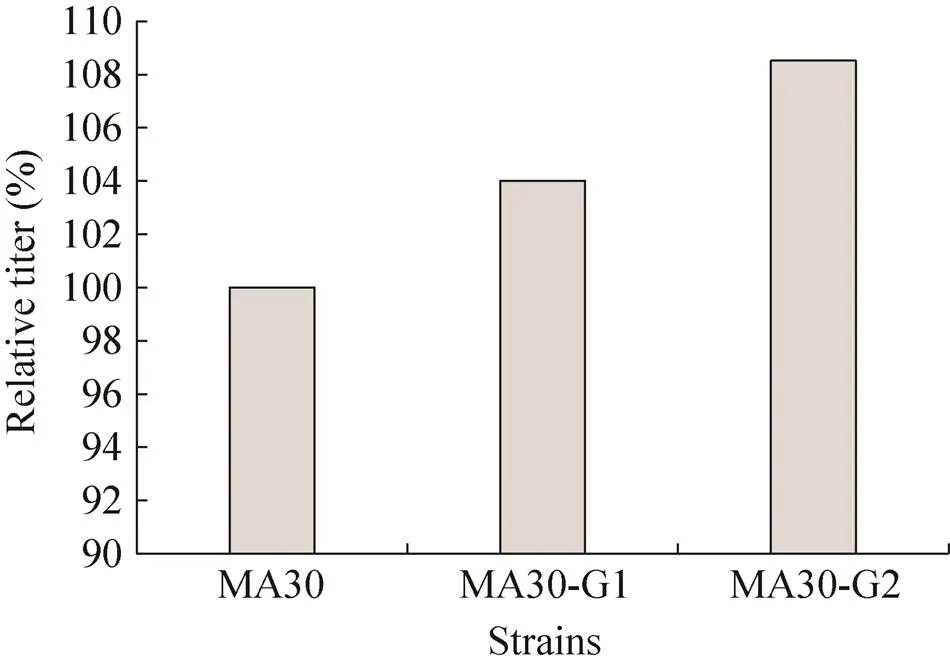
图6 大肠杆菌MA30-G1和MA30-G2相对于MA30的粘康酸产量提高率
2.3.3 MA30-G2的5 L发酵罐分批补料发酵评价
为了进一步研究工程菌生产MA的性能,选取MA30-G2作为出发菌株,进行5 L发酵罐分批补料发酵 (图7)。经过72 h的发酵,MA产量最高为11.5 g/L,PCA、CA以及其他的副产物含量几乎为0 g/L,而DHS积累了 2.7 g/L,转化率8.1% mol/mol,其原因在于在MA30-G2(P2、P3和P3分别调控3个外源基因的表达)中的由中等强度的启动子P2调控,致使DHS无法完全转化到PCA而积累了下来。通过放大发酵,MA30-G2的MA产量得到了进一步的提高,较MA30提高了6.7倍。随着MA产量的不断增加,600在30 h达到最大值为19.4之后一直在降低, 78 h时降到12.4。一方面,由于发酵后期,菌体处于衰亡期,死亡数大大超过新生数,总活菌数明显下降,生理代谢活动趋于停滞;另一方面可能由于MA的积累对MA30-G2造成了很大的生长压力,抑制其生长。后续我们可以通过对MA30-G2进行MA耐受性适应性进化,提高菌株对MA的耐受性,从而进一步提高MA工程菌的生产能力。

图7 MA30-G2的5 L发酵罐分批补料发酵
3 讨论
本研究先后采用了理性设计原则以及基因组复制工程对产3-脱氢莽草酸的大肠杆菌WJ060进行改造与优化,包括了在WJ060基因组中的位点上,依次整合3种不同强度的组成型启动子组合调控的3个外源基因(、) 的理性设计以及MA工程菌基于基因组复制工程构建文库与基于紫外检测MA方法构建的高通量筛选方法进行筛选的非理性设计,从而得到了27株MA工程菌中MA产量最高的MA30以及产量进一步提高的MA30-G2。
根据理性设计原则,在不同强度的组成型启动子组合调控3个外源基因表达而构建的27株MA工程菌中,MA30 (由P2、P3和P3组成型启动子分别调控3个外源基因的表达)在简单的无机盐摇瓶发酵培养基中经过24 h发酵,产量达到1.7 g/L,实现了MA生产过程无需添加额外的营养物质,也成功避免了质粒表达外源基因时存在的易丢失现象,极大降低了MA生产成本,为异源合成MA以及MA工业化生产提供参考。然而,基于理性设计原则的代谢工程方法虽然可以通过对宿主的代谢网络中的特定基因位点进行遗传改造,来实现微生物向着指定表型区域定向跃进,但是,很难实现基因组上多个位点的同时扰动来增强表型的目的。
于是,我们基于突变体的基因组复制工程构建了1个含有将近千个突变体的文库,实现了在MA30的基因组上多位点的同时扰动,并利用已构建的高效、便捷的MA紫外检测和筛选方法,经过两轮的筛选,成功筛选得到MA产量逐步提高的MA30-G1和MA30-G2,在摇瓶发酵中MA30-G2的MA产量较MA30提高了8.5%。对MA30-G2进行5 L发酵罐的分批补料发酵,经过72 h的发酵,MA产量达到最高为11.5 g/L较MA30产量提高了6.7倍,从而证实了基因组复制工程与MA高通量筛选方法能够高效而有效地提高MA工程菌的生产能力。
本研究中,MA30-G2在含有较高浓度的MA时生长明显受到抑制,后续可以通过对MA30-G2进行耐受性适应性进化,提高其耐受性,进一步提高MA30-G2的生产能力。借助基因组复制工程,我们筛选得到的MA30-G1和MA30-G2以及原始菌株MA30进行基因组重测序,期望通过序列对比以及功能性基因的差异性分析整个代谢网络的差异性,从而为后续反向代谢工程操作提高MA产量提供参考。
REFERENCES
[1] Xie NZ, Liang H, Huang RB, et al. Biotechnological production of muconic acid: current status and future prospects. Biotechnol Adv, 2014, 32: 615–622.
[2] Bui V, Frost JW. Process for preparing hexamethylenediamine and polyamides therefrom: WO, 141993. 2012-10-18.
[3] Coudray L, Bui V, Frost JW, et al. Process for preparing caprolactam and polyamides therefrom: US, 9073867. 2015-07-07.
[4] Tino P, Markus S, Michael B, et al. Toward biotechnological production of adipic acid and precursors from biorenewables. J Biotechnol, 2013, 167: 75–84.
[5] Jung HM, Jung MY, Oh MK, et al. Metabolic engineering offor the production of-muconic acid. Appl Microbiol Biotechnol, 2015, 99: 5217–5225.
[6] Pandeeti EV, Siddavattam D. Purification and characterization of catechol 1,2-dioxygenase fromsp. DS002 and cloning sequencing of partialgene. Indian J Microbiol, 2011, 51(3): 312–318.
[7] Draths KM, Frost JW. Environmentally compatible synthesis of adipic acid from D-glucose. J Amer Chem Soc, 1994, 116: 399–400.
[8] Lin YH, Sun XX, Yuan QP, et al. Extending shikimate pathway for the production of muconic acid and its precursor salicylic acid in. Metab Eng, 2014, 23: 62–69.
[9] Zhang HR, Pereira B, Li Z, et al. Engineeringcoculture systems for the production of biochemical products. Proc Natl Acad Sci USA, 2015, 112(27): 8266−8271.
[10] Li K, Mikola MR, Draths KM, et al. Fed-batch fermentor synthesis of 3-dehydroshikimic acid using recombinant. Biotechnol Bioeng, 1999, 64(1): 61–73.
[11] Licona-Cassani C, Lara AR, Cabrera-Valladares N, et al. Inactivation of pyruvate kinase or the phosphoenolpyruvate sugar phosphotransferase system increases shikimic and dehydroshikimic acid yields from glucose in. J Mol Microbiol Biotechnol, 2013, 24(1): 37–45.
[12] Richman JE, Chang YC, Kambourakis S, et al. Reaction of 3-dehydroshikimic acid with molecular-oxygen and hydrogen peroxide: products, mechanism, and associated antioxidant activity. J Amer Chem Soc, 1996, 118(46): 11587–11591.
[13] Datsenko KA, Wanner BL. One-step inactivation of chromosomal genes inK-12 using PCR products. Proc Natl Acad Sci USA, 2000, 97(12): 6640–6645.
[14] Han L, Liu P, Wu Y, et al. Engineering catechol 1,2-dioxygenase by design for improving the performance of the-muconic acid synthetic pathway in. Sci Rep, 2015, 5: 13435–13446.
[15] Luan GD, Cai Z, Li Y, et al. Genome replication engineering assisted continuous evolution (GREACE) to improve microbial tolerance for biofuels production. Biotechnol Biofuels, 2013, 6(1): 137–145.
[16] Luan GD, Cai Z, Gong F, et al. Developing controllable hypermutablecells through manipulating its methyl-directed mismatch repair system. Protein Cell, 2013, 11: 854–863.
[17] Vardon DR, Franden MA, Johnson CW, et al. Adipic acid production from lignin. Energy Environ Sci, 2015, 8: 617–628.
[18] Yocum RR, Gong W, Dole S, et al. Production of muconic acid from genetically engineered microorganisms: WO, 116244. 2013-01-29.
[19] Van Duuren JB, Wijte D, Karge B, et al. PH-stat fed-batch process to enhance the production of-muconate from benzoate byKT2440-JD1. Biotechnol Prog, 2012, 28: 85–92.
[20] Kaneko A, Ishii Y, Kirimura K. High-yield production of-muconic acid from catechol in aqueous solution by biocatalyst. Chem Lett, 2011, 40(4): 381–383.
[21] Bui V, Lau MK, Macrae D, et al. Methods for producing isomers of muconic acid and muconate salts: US, 8809583. 2013-08-19.
[22] Umbarger HE. Amino acid biosynthesis and its regulation. Annu Rev Biochem, 1978, 47: 533–606.
[23] Gong ZJ, Peng YF, Zhang YT, et al. Construction and optimization offor producing rhamnolipid biosurfactant. Chin J Biotech, 2015, 31(7): 1050–1062 (in Chinese).巩志金, 彭彦峰, 张煜婷, 等. 产鼠李糖脂生物表面活性剂大肠杆菌的构建与优化. 生物工程学报, 2015, 31(7): 1050–1062.
[24] Lu J, Tang JL, Liu Y, et al. Combinatorial modulation ofandgene expression for improved alternative glucose utilization. Appl Microbiol Biotechnol, 2012, 93(6):2455–2462.
(本文责编 陈宏宇)
Construction and optimization of microbial cell factories for producing-muconic acid
Guotian Song1,2, Xiaolong Jiang2, Wujiu Chen2, Yanfeng Peng2, Fuping Lu1, and Qinhong Wang2
1,,300457,CAS Key Laboratory of Systems Microbial BiotechnologyTianjin Institute of Industrial BiotechnologyChinese Academy of ScienceTianjinChina
-muconic acid (MA) is an important platform chemical. Now, majority of reported engineered strains are genetically instable, the exogenous genes are expressed under the control of expensive inducer and the components of their fermentation medium are complex, thus large-scale microbial production of MA is limited due to the lack of suitable strains. Hence, it is still necessary to construct novel high-performance strain that is genetically stable, no induction and grows in simple inorganic fermentation medium. In this study, after 3 exogenous genes (,,) for biosynthesis of MA were integrated into previously constructed 3-hydroshikimate producingWJ060 strain and combinatorially regulated with 3 constitutive promoters with different strengths, 27 engineered strains were constructed. The best engineered strain,MA30 could produce 1.7 g/L MA in the simple inorganic fermentation medium without induction. To further enhance the production capacity of MA, the mutant library ofMA30 was constructed by genome replication engineering and screenedhigh-throughput assay. After two-round screening, the new strain,MA30-G2 with improved production of MA was obtained, and the titer of MA increased more than 8%. Under the condition of 5 L fed-batch fermentation,MA30-G2 could produce about 11.5 g/L MA. Combinatorial regulation and high-throughput screening provide important reference to microbial production of other bio-based chemicals.
-muconic acid, combinatorial regulation,, constitutive promoters, genome replication engineering, high throughput screening
December 21, 2015; Accepted: January 15, 2016
Qinhong Wang. Tel/Fax: +86-22-84861950; E-mail: wang_qh@tib.cas.cn
Supported by:Key Technology R&D Programof Tianjin Municipal Science and Technology Commission (No. 14ZCZDSY00066), Research Equipment Program of Chinese Academy of Sciences (No. YZ201153).
天津市科学技术委员会科技支撑计划重点项目 (No. 14ZCZDSY00066),中国科学院科研装备项目 (No. YZ201153) 资助。
宋国田, 江小龙, 陈五九, 等. 产顺,顺-粘康酸细胞工厂的构建与优化. 生物工程学报, 2016, 32(9): 1212–1223.
Song GT, Jiang XL, Chen WJ, et al. Construction and optimization of microbial cell factories for producing-muconic acid. Chin J Biotech, 2016, 32(9): 1212–1223.
