不同类型牛GPR54基因启动子变异与其表达水平的关联性
2016-11-01王学故邓丹妹陈宏权
王学故,邓丹妹,程 晋,王 扬,李 彤,陈宏权,2*
(1.安徽农业大学动物科技学院,合肥 230036; 2.安徽畜禽遗传资源保护与生物育种省级实验室,合肥230036)
不同类型牛GPR54基因启动子变异与其表达水平的关联性
王学故1,邓丹妹1,程晋1,王扬1,李彤1,陈宏权1,2*
(1.安徽农业大学动物科技学院,合肥 230036; 2.安徽畜禽遗传资源保护与生物育种省级实验室,合肥230036)
旨在研究不同类型牛GPR54基因启动子的变异对其表达水平的影响,以揭示牛GPR54基因多态性与牛早熟性之间的关联性。提取荷斯坦牛、皖东黄牛及江淮水牛3种牛血液白细胞总RNA,通过PCR、测序、RT-PCR和双荧光素酶报告基因的方法,检测不同牛GPR54基因启动子区的多态性,启动子效率以及GPR54基因的表达水平,分析启动子变异在牛品种、年龄和性别间对GPR54基因表达的效应。结果表明,GPR54基因启动子存在多个SNP位点,3种牛的启动子型存在明显的差异,其中荷斯坦牛GPR54基因启动子效率是江淮水牛的4.44倍,是皖东黄牛的1.99倍,而皖东黄牛启动子效率是江淮水牛的2.24倍。RT-PCR显示,青年牛GPR54基因表达水平高于成年牛;荷斯坦牛高于皖东黄牛和水牛,水牛的GPR54表达水平最低;母牛的GPR54基因表达水平极显著高于公牛(P<0.01)。综上表明,不同牛的早熟性与GPR54启动子存在密切的关联性。
牛;早熟性;GPR54基因;启动子效率
初情期(Puberty)是动物性器官发育成熟度的标志,其出现的早晚作为牛的一个重要性状,与繁殖、生产寿命、经济效益等密切相关[1]。研究证实,初情期是在GnRH神经网络产生的促性腺激素脉冲分泌模式下启动[2],此后生殖器官和附属性腺发育成熟,达到性成熟(Sexual maturatity),此时机体生长发育等重要经济性状的发育已进入成熟阶段,为其经济利用奠定了基础。不同类型牛的性成熟时间存在较大差异,生产性能千差万别,很大程度上依赖于初情期的启动与调控模式[1-2]。
KISS-1/GPR54系统在哺乳动物生殖内分泌的调节中起着中枢调控作用,其对青春期启动意义引起研究者的高度关注[3-5]。研究表明,GPR54与kisspeptin结合,活化GnRH表达,打开下丘脑—垂体—性腺轴,启动青春期发育[6]。GPR54是G蛋白偶连受体,包含7个跨膜的疏水结构域和N-端的3个糖基化作用位点,kisspeptin为其内源性配体[7-8]。GPR54基因的表达水平直接决定与Kisspeptin的结合,影响性成熟。GPR54基因表达受其启动子的调控,研究表明,不同类型牛GPR54基因启动子GPR54-973区域存在3个特异SNP位点,形成不同类型牛的启动子基因型,如地方黄牛启动子型为AATTCC、荷斯坦牛和西门塔尔牛的启动子型为CCCCTT,以及地方水牛为CCTTCC[9]。但不同类型牛启动子差异与GPR54基因表达水平的关联性却鲜有报道,有关不同类型牛GPR54基因表达水平及其规律的研究也不多见。本研究基于不同类型牛GPR54基因的启动子变化,构建其表达载体,利用双报告基因检测和qPCR等方法,研究不同类型牛血液白细胞GPR54基因的表达水平以及启动子效率,探讨不同类型牛启动子与GPR54基因表达的关联性。
1 材料与方法
1.1试验牛与样品采集
依据不同类型牛GPR54-973启动子基因型,采集中国地方皖东黄牛(16头)和江淮水牛(7头)、荷斯坦牛(15头)血液样品。采集试验牛血液样品8 mL(分装2管,Trizol保护)和适量耳组织样品,置于干冰保存,带回实验室。
1.2血液白细胞收集培养和总RNA提取
取3 mL抗凝血加入3倍体积的PBS缓冲液混匀,450 g离心15 min,弃上清,留下白细胞沉淀,再用1 mL PBS缓冲液冲洗1~2次。用含有10%胎牛血清的DEME Basic(Gibco)培养基重悬白细胞沉淀,转移到25 cm2细胞培养瓶中,于37 ℃,5.0% CO2培养箱中培养。
取1 mL血样加入3 mL红细胞裂解液,4 ℃,450 g离心15 min,去除红细胞,留下白细胞沉淀,利用RNA提取试剂盒(Biomega)提取牛血液白细胞RNA。用1.2%琼脂糖凝胶电泳检测RNA的品质,并用核酸蛋白测定仪测定其浓度及纯度。
1.3白细胞GPR54基因表达量测定
利用反转录试剂盒(Qiagen公司),合成cDNA,反应体系为20 μL。另取每头牛的耳组织,用试剂盒(天根)提取耳组织DNA,1%的琼脂糖凝胶电泳检测DNA的品质。
根据牛GPR54 mRNA序列(GenBank登录号:NC-007305)和牛的β-actinmRNA序列(GenBank登录号:NM_173979.3)利用Primer Premier 5.0 软件设计引物,由上海生工生物有限公司进行合成,PAGE纯化。引物WXG-1扩增片段长度为222 bp,上游序列:5′-GGACGAAGAGGGTGGCAAT-3′,下游序列:5′-GGCAGATGACGAAGATGACC-3′;β-actin扩增片段长度167 bp,上游序列:5′-CCAACGTGTCTGTTGTGGAT-3′,下游序列:5′-CTGCTTCACCACCTTCTTGA-3′。使用Qiagen公司的SYBR Green PCR Kit 试剂盒进行定量试验,20 μL反应体系:2×SYBR Green PCR Master 10 μL,QN ROX reference dye 2 μL,cDNA 1 μL,引物(F+R) 2.8 μL,RNase-free water 4.2 μL。荧光定量反应条件为95 ℃ 5 min,95 ℃ 10 s,60 ℃ 1 min,40个循环,每个样品重复4次。
1.4启动子区扩增与SNP检测
用WXG-2引物(上游序列:5′-GGCAGGCAGATTCCTAACCACTAG-3′,下游序列:5′-TCAACCTTCCCAAGACTCTGATGC-3′)扩增GPR54基因的启动子区(GPR54-973),PCR反应体系:ddH2O 34 μL,dNTPs 4 μL,10×Easy Taq Buffer 5 μL,Taq1 μL,WXG-2(上下游)共4 μL,DNA 2 μL。反应程序:95 ℃预变性5 min,35个循环(95 ℃变性1 min,62 ℃退火1 min,72 ℃延伸1 min),72 ℃延伸10 min,4 ℃保存产物。对PCR产物用1.5%的琼脂糖凝胶,缓冲液为1×TBE电泳检测。PCR产物送华大生物有限公司进行测序,并分析其SNPs。
1.5启动子双荧光素酶报告基因分析
1.5.1重组质粒的构建与鉴定根据牛5′启动子区序列(GenBank登录号:GU289736.1),用WXG-3引物克隆下含有酶切位点的牛5′启动子区片段,与空白质粒连接,同时对阳性重组质粒测序,鉴定重组质粒。WXG-3引物序列:上游:5′-CGA-CGCGTGGCAGGCAGATTCCTAACCACTAG-3′,下游:5′-GCCTCGAGATTGCCACCCTCTTCGT-CCTGA-3′。
1.5.2重组质粒转染细胞及双荧光素酶检测用FuGENE®6 Transfection Reagent(Promega)转染试剂将鉴定正确的重组质粒导入293T细胞内,在培养24~48 h,用Dual-Glo®Luciferase Assay System(Promega)试剂检测双荧光素酶活性。
1.6数据处理
通过ABIStepOneTMSoftware V2.2 软件以及SPSS 17.0软件对定量结果和双荧光素酶报告基因检测数据进行差异分析,同时利用最小二乘法建立GPR54基因表达量与性别、年龄和种属(品种)的线性建模:Yijkl=μ+Bi+Aj+Sk+eijkl。其中Y为表达水平RQ值,μ为群体平均值,Bi为牛的类型效应值,Aj为牛年龄的效应值,Sk代表牛性别的效应值,eijkl为误差。统计分析不同牛的启动子效率与GPR54基因的关联性。
2 结 果
2.1不同类型牛GPR54基因启动子变异
预测3种牛GPR54基因启动子,结果发现在CDS上游973 bp片段(记为GPR54-973)中存在2个启动子区域Promoter 1和Promoter 2,其中皖东黄牛和荷斯坦牛的2个启动子区域均分别位于-888~-638 bp和-379~-130 bp,江淮水牛分别位于-885~-636 bp和-379~-130 bp;不同类型牛Promoter 1之间存在多处核苷酸差异,而Promoter 2中仅江淮水牛发生1处核苷酸替换。如果连接变异点作为基因型的话,则(小写字母位于启动子区域,带下划线的核苷酸是皖东黄牛样本群体内SNP位点,带*号为缺失):皖东黄牛基因型为AATTtgccgacggcgCTGACTTCGTcGACAA,荷斯坦牛基因型为ACTTcgccgatagcgCTGACTTCGTcGACAA,江淮水牛基因型为CC**ta*ttgctaaaA**TGGGACCaAGGGC。
比较牛群内部的多态性发现,皖东黄牛GPR54-973片段存在3个多态性位点,检测出3种基因型CCCCTT、AATTCC和ACTCCT,分别位于-946、-816和-754 bp,荷斯坦牛(CCCCTT)和江淮水牛(CCTTCC)均为纯合子。结果显示皖东黄牛GPR54含有西门塔尔牛的遗传背景。
2.2不同类型牛启动子的启动效率分析
根据检测出的基因型,利用皖东黄牛的3种基因型的SNP位点进行双荧光素酶检测,其结果如表1。CCT基因组合启动效率是ATC组合的3倍,是ATC/CCT型的1.39倍。杂合型的启动子表现为中间效应。该项启动子效率的测定与牛白细胞GPR54基因表达RQ值一致。
表1 皖东黄牛不同SNP型启动子对荧光素酶的启动效率
Table 1The efficiency of the promoters with different SNP genotypes to the luciferase expression in Wandong cattle
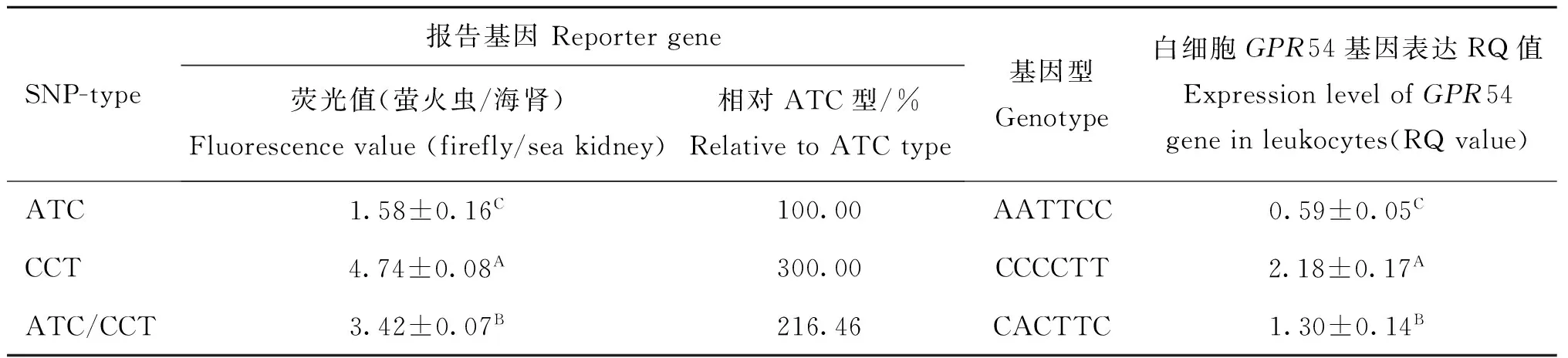
SNP-type报告基因Reportergene荧光值(萤火虫/海肾)Fluorescencevalue(firefly/seakidney)相对ATC型/%RelativetoATCtype基因型Genotype白细胞GPR54基因表达RQ值ExpressionlevelofGPR54geneinleukocytes(RQvalue)ATC1.58±0.16C100.00AATTCC0.59±0.05CCCT4.74±0.08A300.00CCCCTT2.18±0.17AATC/CCT3.42±0.07B216.46CACTTC1.30±0.14B
A、B、C表示组间差异极显著
A,B and C showed that the differences between SNP-types were very significant(P<0.01)
检测3种类型牛GPR54基因启动子的双荧光素酶检测结果见表2。表2表明,3种牛启动子的启动效率存在着极显著的差异,其中荷斯坦牛GPR54基因启动子效率是江淮水牛的4.44倍,是皖东黄牛的1.99倍;皖东黄牛启动子效率是江淮水牛的2.24倍。
表2不同类型牛GPR54基因启动子效率比较
Table 2Efficiency comparison ofGPR54 gene promoters to the luciferase expression in different types of bovines

GPR54-973荧光值(萤火虫/海肾)1Fluorescencevalue(firefly/seakidney)相对江淮水牛/%RelativetoJianghuaibuffalo荷斯坦牛Holstein6.54±0.79A444.90皖东黄牛2Wandongcattle3.29±1.18B223.81江淮水牛Jianghuaibuffalo1.47±0.10C100.00
1.字母A、B、C表示组间差异极显著;2.混合启动子型
1.A,B and C showed that the differences between types of bovines were very significant(P<0.01);2.Mixed promoter types
2.3不同类型牛白细胞GPR54基因的表达水平
利用线性模式分析荷斯坦牛、皖东黄牛和江淮水牛血液白细胞GPR54基因的表达水平,结果见图1。所有牛GPR54基因表达的群体RQ均值为1.48,荷斯坦牛、皖东黄牛和江淮水牛的遗传效应分别为0.70、0.17和-0.87。荷斯坦牛和皖东黄牛的GPR54基因的表达水平分别是江淮水牛的4.34和2.25倍(P<0.01,图1A),表明不同类型牛启动子差异对GPR54基因的表达具有显著的影响,并且与所发现的3个SNP位点存在明显的关联性。
年龄和性别对GPR54基因的表达水平也具有明显的影响。<24月龄和>24月龄年龄效应分别为0.39和-0.39;<24月龄牛表达水平比>24月龄牛高出90.84%(P<0.01,图1B),显示年轻牛GPR54基因表达水平较年长牛高。公牛和母牛的效应分别为-0.28和0.28;在不同性别牛间,母牛的表达水平是公牛的3.75倍(P<0.01,图1C)。

**.P<0.01图1 不同类型牛血液白细胞GPR54基因表达水平Fig.1 Changes of GPR54 gene expression in the blood leukocytes of different types of bovines
3 讨 论
牛的早熟性是一个重要生产性状,通过其初情期早晚来体现。初情期受到营养、年龄和遗传因素的影响,其中遗传因素决定着早熟性的一系列激素调控过程[1],环境因素的改变可能会影响初情期正常来临的具体时间,但这种生理变化只是性状变异的一种环境组分。早熟性是不同类型牛种质特性的重要组成部分,不同类型牛通过进化形成了特定的早熟性,其中乳牛早于肉牛,水牛较晚[10],基于比较基因组学研究早熟性的物种间差异对探明性状形成的原因具有重要意义。已经证实青春期启动在物种间存在相同的机制,包括KISS1、GPR54、GnRH1和GnRHR等在内的多种激素及受体是青春期启动的关键基因[11],其中GPR54的激活能触发GnRH的释放[12]。有关相同的启动机制在不同类型牛间产生青春期早晚差异问题,有研究证实与GPR54启动子多态性有关[13-14]。
GPR54基因多态性在动物中广泛存在,猪[15]和羊[16-17]等具有几乎与牛相同的启动子多态位点,这种多态性已经由选择的作用加以固定,成为物种的一个特性。如本研究GPR54启动子3个SNP位点分别在荷斯坦牛(CCCCTT)和江淮水牛(CCTTCC)表现为纯合型,而皖东黄牛存在3种基因型可能与其形成过程混杂地方纯种黄牛(AATTCC)和西门塔尔牛(CCCCTT)[14]血缘有关。调控试验证实,荷斯坦牛GPR54启动子型增加GPR54表达的效率最高,本地黄牛次之,水牛最低,显示在超越牛种属间早熟性差异仍然与GPR54基因的多态性密切相关。
本研究的结果同时也揭示GPR54的调控作用不仅仅发生在牛的初情期,与后期性状的发育存在很大的关联性。在小鼠、大鼠、猴和猪等多种动物的研究中,GPR54基因在下丘脑中的表达量在初情期是明显增加的,且体内注射Kisspeptin能促进LH的分泌[18-19];小尾寒羊母羊发情期其下丘脑GPR54基因表达量显著高于发情周期的其他阶段[20]。这表明GPR54的表达在生长发育的不同阶段虽然存在差异,但对促进GnRH、FSH和LH的释放[21]仍然具有重要意义。在本研究结果中,牛血液白细胞中GPR54基因表达水平与年龄和性别存在显著关联性,其中,2岁以下牛显著高于2岁以上牛,母牛高于公牛。
[1]PERRY G A.Factors affecting puberty in replacement beef heifers[J].Theriogenology,2016,86(1):373-378.
[2]HERBISON A E.Control of puberty onset and fertility by gonadotropin-releasing hormone neurons[J/OL].NatRevEndocrinol,2016.[2016-06-22].http://www.nature.com/nrendo/journal/vaop/ncurrent/full/nrendo.2016.70.html
[3]LUO Q,LI W,LI M,et al.Leptin/leptin R-kisspeptin/KiSS1r-GnRH pathway reacting to regulate puberty onset during negative energy balance[J].LifeSci,2016,153(15):207-212.
[4]WANG C H,QIAO C,WANG R C,et al.KiSS1 mediated suppression of the invasive ability of human pancreatic carcinoma cells is not dependent on the level of KiSS 1 receptor GPR54[J].MolMedRep,2016,13(1):123-129.
[6]HAN S K,GOTTSCH M L,LEE K J,et al.Activation of gonadotropin-releasing hormone neurons by kisspeptin as a neuroendocrine switch for the onset of puberty[J].JNeurosci,2005,25(49):11349-11356.
[7]ROBERT F.A powerful first KiSS-1[J].Science,2005,309(5734):551-552.
[8]MILLAR R P,BABWAH A V.KiSS1R:Hallmarks of an effective regulator of the neuroendocrine axis[J].Neuroendocrinology,2015,101(3):193-210.
[9]张翼鹏.牛GPR54基因5′调控区的SNPs及其启动子效率研究[D].合肥:安徽农业大学,2011.
ZHANG Y P.Studies on SNPs in 5′ regulatory region ofGPR54 gene and their promoter efficiency in cattle[D].Hefei:Anhui Agricultural University,2011.(in Chinese)
[11]HWANG J S.The genes associated with gonadotropin-releasing hormone-dependent precocious puberty[J].KoreanJPediatr,2012,55(1):6-10.
[12]DUNGAN H M,CLIFTON D K,STEINER R A.Minireview:kisspeptin neurons as central processors in the regulation of gonadotropin-releasing hormone secretion[J].Endocrinology,2006,147(3):1154-1158.
[13]周梅,王学故,陈宏权,等.牛GPR54基因C-816T/T-754C品种间分布及其与早熟性的关联[J].安徽农业大学学报,2015,42(3):413-416.
ZHOU M,WANG X G,CHEN H Q,et al.Distribution of C-816T/T-754C locus in theGPR54 gene in different cattle breeds and their association with precocity[J].JournalofAnhuiAgriculturalUniversity,2015,42(3):413-416.(in Chinese)
[14]CHEN H Q,ZHANG Y P,CHEN H,et al.Polymorphism in the 5′ regulatory region of theGPR54 gene and their association with sexual maturity in cattle[J].MolReprodDev,2011,78(12):894.
[15]LI S,REN J,YANG G,et al.Characterization of the porcine kisspeptins receptor gene and evaluation as candidate for timing of puberty in sows[J].JAnimBreedGenet,2008,125(4):219-227.
[16]FENG T,ZHAO Y Z,CHU M X,et al.Association between sexual precocity and alleles of KiSS-1 andGPR54 genes in goats[J].AnimBiotechnol,2009,20(3):172-176.
[17]CHU M,XIAO C,FENG T,et al.Polymorphisms of KiSS-1 andGPR54 genes and their relationships with litter size in sheep[J].MolBiolRep,2012,39(3):3291-3297.
[18]LENTS C A,HEIDORN N L,BARB C R,et al.Central and peripheral administration of kisspeptin activates gonadotropin but not somatotropin secretion in prepubertal gilts[J].Reproduction,2008,135(6):879-887.
[19]KADOKAWA H,MATSUI M,HAYASHI K,et al.Peripheral administration of kisspeptin-10 increases plasma concentrations of GH as well as LH in prepubertal Holstein heifers[J].JEndocrinol,2008,196(2):331-334.
[20]王军,孙蕾,吕发文,等.KiSS-1/GPR54系统在不同发情周期母羊下丘脑中的表达规律[J].西北农林科技大学学报,2011,39(12):49-52.
WANG J,SUN L,LU F W et al.Expreeion of KiSS-1/GPR54 system in the ewe hypothalamus during the estrous cycle[J].JournalofNorthwestA&FUniversity(NaturalScienceEdition),2011,39(12):49-52.(in Chinese)
[21]ESPIGARES F,ZANUY S,GMEZ A.KiSS2 as a regulator of LH and FSH secretion via paracrine/autocrine signaling in the Teleost fish European Sea Bass (Dicentrarchuslabrax)[J/OL].BiolReprod,2015.[2016-06-22].http://www.biolreprod.org/content/early/2015/09/17/biolreprod.115.131029.
(编辑 程金华)
The Relationship between the Expression Variations ofGPR54 Gene and the Polymorphisms ofGPR54 Promoters in Different Types of Bovines
WANG Xue-gu1,DENG Dan-mei1,CHENG Jin1,WANG Yang1,LI Tong1,CHEN Hong-quan1,2*
(1.CollegeofAnimalScienceandTechnology,AnhuiAgriculturalUniversity,Hefei230036,China;2.KeyLaboratoryofAnhuiLocalLivestockandPoultryGeneticResourcesConservationandBiobreedingofAnhuiProvince,Hefei230036,China)
The aim of the study is to investigate the impact of the variations ofGPR54 promoter on the expression levels ofGPR54 gene in Holstein (HT),Wandong cattle (WD) and Jianghuai buffalo (JH),therefore further unveil the association between the polymorphisms ofGPR54 gene promoter and the sexual precocity.Total RNAs in leukocytes of HT,WD and JH were extracted and the polymorphism of the promoter region were detected by PCR and sequencing.Furthermore,the efficiency of the promoters were determined via RT-PCR and luciferase expression from the fusion reporter gene.Various SNPs were detected in the promoter regions ofGPR54 genes in HT,WD and JH with significant difference.Moreover,it was shown that the promoter efficiency of HT was 4.44 times and 1.99 times higher compared to JH buffalo and WD respectively.Meanwhile the promoter efficiency of WD was 2.24 times higher than JH.Notably,the RT-PCR results showed thatGPR54 gene expression levels in youngsters were dramatically higher than that of the adults especially in HT than in WD and JH.JH showed the weakest expression level ofGPR54 while the cows exhibited the strongestGPR54 expression level compared to ox (P<0.01).These results indicated that the polymorphisms ofGPR54 promoter and the bovine sexual precocity were evidently correlated.
bovine;sexual precocity;GPR54 gene;promoter efficiency
10.11843/j.issn.0366-6964.2016.09.010
2016-03-07
国家自然科学基金项目(31272402)
王学故(1991-),男,安徽利辛人,硕士生,主要从事动物分子遗传育种研究,E-mail:1055069260@qq.com
陈宏权,教授,博导,主要从事动物分子遗传育种研究,E-mail:chqchq@ahau.edu.cn
S823.2
A
0366-6964(2016)09-1824-06
