鸡Visfatin蛋白的原核表达、纯化及其活性研究
2016-11-01张盼盼商鹏飞田方圆韩瑞丽蒋瑞瑞孙桂荣康相涛刘小军田亚东
张盼盼,商鹏飞,田方圆,韩瑞丽,蒋瑞瑞,孙桂荣,康相涛,刘小军,田亚东
(河南农业大学牧医工程学院,河南省家禽种质资源创新工程研究中心,郑州 450002)
鸡Visfatin蛋白的原核表达、纯化及其活性研究
张盼盼#,商鹏飞#,田方圆,韩瑞丽,蒋瑞瑞,孙桂荣,康相涛,刘小军,田亚东*
(河南农业大学牧医工程学院,河南省家禽种质资源创新工程研究中心,郑州 450002)
本试验旨在通过克隆Visfatin基因,将其在原核表达系统中表达并纯化,通过3T3-L1细胞的分化验证其活性,成功获得鸡重组Visfatin蛋白。以AA肉仔鸡肝组织总RNA为模板,qRT-PCR扩增Visfatin基因,转化进入pGEM®-T载体,再与原核表达载体pET-30a连接转化,获取含pET-30a-Visfatin重组质粒的E.coliBL21(DE3)表达菌株。以IPTG诱导重组菌株,优化表达条件,SDS-PAGE鉴定表达情况。采用镍离子亲和层析对Visfatin蛋白进行纯化,Western blot鉴定表达蛋白,并通过3T3-L1细胞的分化情况鉴定表达蛋白Visfatin的活性。结果,通过NcoⅠ、XhoⅠ酶切获得的结果与预期目的条带大小相符,成功构建pET-30a-Visfatin表达载体。SDS-PAGE检测结果表明,在培养基pH为8.0,IPTG终浓度为0.4 mmol·L-1,30 ℃条件下,诱导10~12 h时可溶性蛋白表达量最大。通过镍离子层析纯化Visfatin蛋白,在SDS-PAGE的60 ku处可见一条与预期一致的蛋白条带。Western blot证明纯化蛋白可与6*His标签特异性结合。油红O染色结果表明,与对照组相比Visfatin诱导的3T3-L1细胞有更多的脂滴形成。qRT-PCR结果显示,在3T3-L1细胞分化过程中,Visfatin作用下标志基因PPARγ、aP2、FAS和C/EBPα的表达量显著增加(P<0.05)。本研究成功建立了一套标准化的鸡Visfatin重组蛋白表达程序,获得了具有生物活性的鸡Visfatin,为其在家禽领域的进一步研究奠定了基础。
鸡重组Visfatin;克隆;原核表达;条件优化;3T3-L1
内脏脂肪素(Visfatin)由A.Fukuhara等在2005年发现并命名[1],其实质与前B细胞克隆增强因子(PBEF)、烟酰胺磷酸核糖转移酶(NAMPT)相同[2-3],是一种分泌蛋白,由493个氨基酸组成,其大小约为52 ku。鸡Visfatin在多个组织中均有表达[4],且与人、大鼠、猪、斑马鱼的同源性分别为94%、94%、94%、88%,说明其具有高度保守性[5]。作为一种新型细胞脂肪因子,Visfatin是家禽采食调控中潜在的一种食欲增强因子,具有广阔的研究前景。因此,获得Visfatin的体外表达纯化蛋白可为其在家禽领域的进一步研究奠定基础。目前为止,Visfatin已在人类[6]、啮齿动物[7]、猪[8]和鸡[4]等动物中均有研究报道,其在糖脂代谢、胰岛素抵抗、心血管疾病、细胞凋亡、炎症反应和癌症中都起到重要的作用[1,9-11]。2008年,M.A.Cline等研究表明,向脑室内注射人重组Visfatin可以显著增加肉仔鸡食欲[12];2011年,该结论在小鼠中再次得到了验证[13]。由此猜测,Visfatin在家禽采食量调控中可能扮演关键作用。2010年,韩瑞丽等已成功克隆出鸡Visfatin全长序列,并对其相关SNP进行了分析[5,14];此后,J.Li等对该基因的克隆、组织表达及启动子等做了更为详细的分析研究[15]。这些研究均为Visfatin在鸡上的研究奠定了基础。近年来有关Visfatin在家禽方面的研究所用试剂均为人重组Visfatin,市场上也只售有人和鼠重组内脂素,且未见有关鸡重组Visfatin的相关报道。不同物种之间的同种蛋白存在一定差异,异源蛋白可能会对试验结果产生一定程度的影响。
本研究以肉仔鸡肝总RNA为模板,克隆Visfatin序列,通过构建载体,将其转入大肠杆菌中表达并纯化,并通过3T3-L1细胞的分化情况验证其活性,从而获得具有生物活性的鸡Visfatin蛋白,为其在家禽领域的深入研究提供基础。
1 材料与方法
试验于2013年5月至2014年8月在河南省家禽种质资源创新工程研究中心完成。
1.1试验材料
1.1.1试验动物、菌株和质粒试验所用艾拔益加(AA)肉仔鸡由河南农业大学种鸡站提供。pGEM-T Easy Vector System购自Promega公司。TOP10、E.coliBL21(DE3)感受态细胞、原核表达载体pET-30a质粒由河南省家禽种质资源创新工程研究中心保存。3T3-L1细胞购自美国模式菌种收集中心(ATCC)。
1.1.2主要生化试剂与酶总RNA提取试剂Trizol、PrimeScriptTMRT-PCR Kit、IPTG、X-gal、Premixed Protein Marker(Low)购自TaKaRa 公司;One Step Western Kit HRP(mouse)、TaqDNA聚合酶购自北京康为世纪生物科技有限公司,6*His,His-Tag Monoclonal Antibody购自Proteintech公司;T4 DNA Ligase、硫酸卡那霉素、氨苄青霉素、PVDF膜、滤纸购自Promega公司;SDS、Tris、丙烯酰胺、甲叉双丙烯酰胺、 β-巯基乙醇、考马斯亮蓝 R-250、TEMED、过硫酸胺、二硫苏糖醇(DTT)等常用试剂均为国产分析纯;引物合成、基因测序由上海生工生物工程有限公司完成;DMEM、青链霉素、EDTA购自Gibco公司;细胞分化诱导剂(Dex、IBMX、Insulin)与油红O购自Simga公司;Trizol、反转录试剂盒、定量Mix等购自TaKaRa公司。
1.2试验方法
1.2.1Visfatin基因的克隆与鉴定按照PrimeScriptTMRT-PCR Kit的说明,从AA肉仔鸡肝组织中提取总RNA,反转录后获得其cDNA。根据GenBank公布的鸡VisfatinmRNA(NM_001030728)序列,应用DNAstar (Version 4.0)及Primer(Version 5.0)基因分析软件,设计鸡Visfatin编码区引物,Visfatin-F(5′-ATACCATGGCTATGGAGTGCGCGGCGG-3′),Visfatin-R(5′-CGCCTCGAGTTAGTGAGACGCCGTTTCTAG-3′),下划线部分分别为NcoⅠ和XhoⅠ的酶切位点。以cDNA为模板,进行PCR扩增,反应体系:2×PCR Master Mix 25 μL,上下游引物各2.0 μL,cDNA为2.5 μL,加ddH2O至总体积为50 μL。PCR程序:95 ℃预变性5 min;94 ℃变性30 s,63 ℃退火30 s,72 ℃延伸90 s,32个循环;72 ℃延伸10 min;4 ℃保存。PCR结束后,再在样品中加入10 μL的普通DNA Mix,混匀后72℃继续扩增30 min,进行加A尾巴,随后取5 μL反应产物于1%琼脂糖凝胶中进行电泳检测,观察并记录结果。检测合格后,对扩增产物进行胶回收,并对回收结果进行凝胶检测。
1.2.2鸡Visfatin重组表达质粒的构建与鉴定为了提高转化效率,本试验采用双载体系统来构建目的质粒,具体载体序列和技术路线如图1和图2所示。先将回收纯化的PCR产物与克隆载体pGEM®-T Easy进行连接,转化进入到感受态细胞E.coliTOP10中,筛选阳性菌落提取重组质粒,进行双酶切(NcoⅠ和XhoⅠ)检测,并测序鉴定,获得重组质粒pGEM®-T-visfatin。
将得到的pGEM®-T-Visfatin重组质粒与pET30a质粒同时用NcoⅠ和XhoⅠ进行双酶切,琼脂糖凝胶电泳检测酶切结果,并纯化回收。将酶切后的Visfatin基因片段用T4 DNA连接酶连接到pET30a载体上,再将连接产物转化进大肠杆菌BL21(DE3)感受态细胞中,挑取单菌落进行重组质粒提取,经双酶切鉴定正确后送上海生工生物工程有限公司测序,鉴定获得阳性转化子。测序鉴定正确的重组质粒命名为pET30a-Visfatin,用于诱导表达。

图1 PET-30a-c(+)载体序列图Fig.1 The sequence map of PET-30a-c(+) vector
1.2.3Visfatin重组蛋白的诱导表达及条件优化将含pET30a-Visfatin重组质粒的大肠杆菌BL21(DE3)划线,37 ℃培养过夜;次日挑单菌于LB培养基中37 ℃培养12 h;按照1%~2%的比例加入LB培养液中,再加入1‰比例的Kna,然后按照1∶100的比例接种于100 mL LB液体培养基(pH分别为6、7、8)中扩大培养至OD600 nm值为0.6~1时,菌液进行分组诱导培养。分别检测诱导温度(30 ℃、37 ℃)、IPTG终浓度(0.4、0.8、1.2 mmol·L-1)、诱导时间(2、4、6、8、10、12 h)对Visfatin重组蛋白可溶性表达量的影响。收集菌体后使用超声波细胞破碎仪将菌体裂解30 min和50 min。离心后取上清,加入Loading buffer,煮沸加热5 min后,用12%的SDS-PAGE电泳检测蛋白表达情况。1.2.4Visfatin重组蛋白的纯化按优化后条件表达出大量菌体,收集后用50 mmol·L-1的咪唑平衡缓冲液(pH7.4)重悬,于冰浴中超声破碎裂解。12 000 r·min-1,4 ℃,离心10 min,取上清。将上清经镍离子亲和层析柱进行纯化,用50 mmol·L-1咪唑洗涤杂蛋白,150 mmol·L-1咪唑洗脱目的蛋白。然后采用低温透析的方法除去蛋白溶液中的咪唑,根据该重组蛋白的消光系数测定纯化的蛋白浓度,取100 μL进行12%的SDS-PAGE电泳,鉴定Visfatin重组蛋白的纯度。

图2 原核表达技术路线图Fig.2 Construction of prokaryotic expression vector
1.2.5Western blot鉴定Visfatin蛋白通过Western blot检验纯化后的重组目的蛋白,阴性对照为未诱导的pET30a-Visfatin。SDS-PAGE电泳后100 V转膜(PVDF)1.5 h。用5%脱脂奶粉4 ℃过夜封闭PVDF;TBST漂洗后,加入1∶500稀释的抗His标签的鼠源一抗,室温孵育2 h;TBST冲洗后,加入1∶2 000稀释的辣根过氧化物酶标记的羊抗鼠IgG抗体(二抗),室温孵育1 h。采用DAB显色试剂盒显色,观察结果。
1.2.63T3-L1细胞检测Visfatin重组蛋白活性小鼠的脂肪前体细胞(3T3-L1)分化成为脂肪细胞,需要胰岛素(Insulin)等诱导剂的诱导。有活性的Visfatin具有类胰岛素作用,可通过脂肪库和葡萄糖加速三酰甘油的积累,同时促进三酰甘油酰基转移酶-1(DGAT-1)、脂肪酸合成酶(FAS)、重组人CCAT/增强子结合蛋白α(c/EBPα)、过氧化物酶体增殖因子活化受体γ(PPAR-γ)、转录因子aP2等调节脂肪分化的关键因子的表达,调节脂肪细胞分裂周期,促使前脂肪细胞分化为成熟的脂肪细胞。从而可以通过观察检测3T3-L1的分化情况来检验Visfatin重组蛋白的活性。
3T3-L1的培养与染色:3T3-L1细胞复苏于培养皿,置于37 ℃、5% CO2培养箱中常规培养,至其密度达到70%~80%时,将其传代到12孔细胞培养板中;待密度达100%后,接触抑制2 d,随后换为含0.5 mmol·L-1IBMX和0.25 μmol DEX的10%胎牛血清的高糖DMEM培养液,继续培养48 h后,换成含0.5 mmol·L-1IBMX、0.25 μmol DEX和0.1 μg·mL-1Insulin/human Visfatin/chicken Visfatin/PBS(此浓度由预试验选定)的10%胎牛血清高糖DMEM培养液,培养6 d,每2 d换一次培养液;分别在分化的第4和第8天收取细胞,用于检测脂肪细胞的分化情况。分化第8天时,采用油红O染色来观察细胞分化情况。先用PBS洗涤后,用4%多聚甲醛37 ℃固定细胞1 h,PBS洗2~3次,加入油红O染液,37 ℃静置染色1~2 h,PBS漂洗2次。倒置显微镜下观察结果,拍照。
1.2.7实时荧光定量PCR(qRT-PCR)检测相关基因表达量收集诱导分化8 d的脂肪细胞,Trizol法提取总RNA,反转录得到cDNA。本试验采用SYBR GreenⅡ染料法,以β-actin为内参。qRT-PCR的反应体系:5 μL Mix,上下游引物各0.5 μL,1 μL cDNA,加水至10 μL。反应程序:95 ℃预变性180 s;三步法95 ℃ 15 s,60 ℃ 40 s,72 ℃ 15 s,共40个循环;95 ℃ 1 min,55 ℃ 1 min熔解,55 ℃ 30 s冷却。参照2-ΔΔCt的方法计算目的基因的表达量变化,并通过SPSS分析其差异性。
试验所用引物由Primer 5.0软件设计完成,由上海生工生物工程有限公司合成,具体引物信息见表1。使用qRT-PCR技术检测PPARγ、aP2、FAS、C/EBPα等3T3-L1诱导分化标志基因的相对表达量,其表达的变化就体现了细胞分化能力的强弱,即相应诱导剂活性作用的大小。
表1扩增脂肪细胞分化标志基因的引物序列
Table 1Amplifying primers of marker genes for adipocyte differentiation
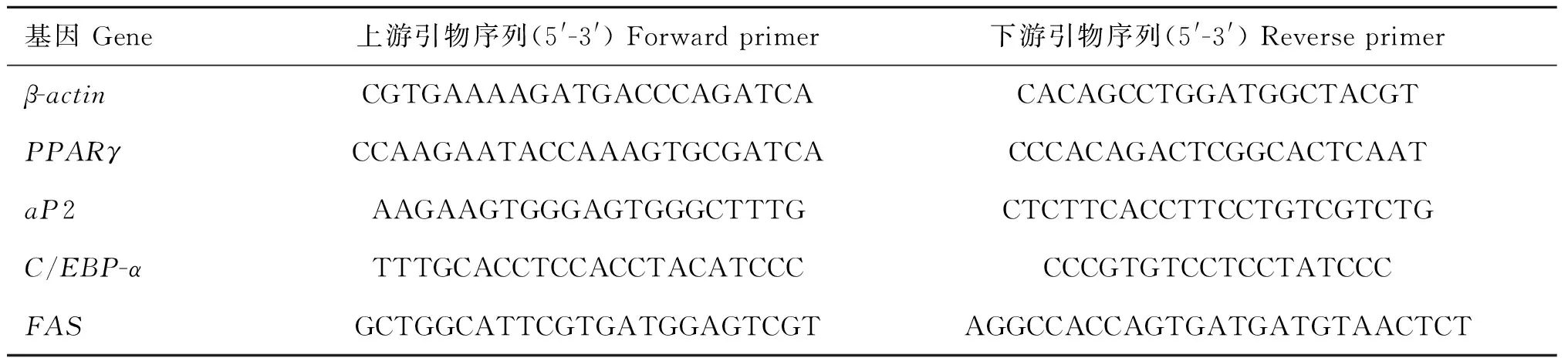
基因Gene上游引物序列(5'-3')Forwardprimer下游引物序列(5'-3')Reverseprimerβ-actinCGTGAAAAGATGACCCAGATCACACAGCCTGGATGGCTACGTPPARγCCAAGAATACCAAAGTGCGATCACCCACAGACTCGGCACTCAATaP2AAGAAGTGGGAGTGGGCTTTGCTCTTCACCTTCCTGTCGTCTGC/EBP-αTTTGCACCTCCACCTACATCCCCCCGTGTCCTCCTATCCCFASGCTGGCATTCGTGATGGAGTCGTAGGCCACCAGTGATGATGTAACTCT
2 结 果
2.1目的片段扩增产物鉴定
Visfatin基因的扩增产物经1%琼脂糖凝胶电泳检测和测序鉴定,在1 500 bp左右位置出现特异性条带(图3),设计的VisfatinDNA扩增长度为1 482 bp,从电泳图片可见扩增产物大小与预期设计结果相符,可用于后续试验。
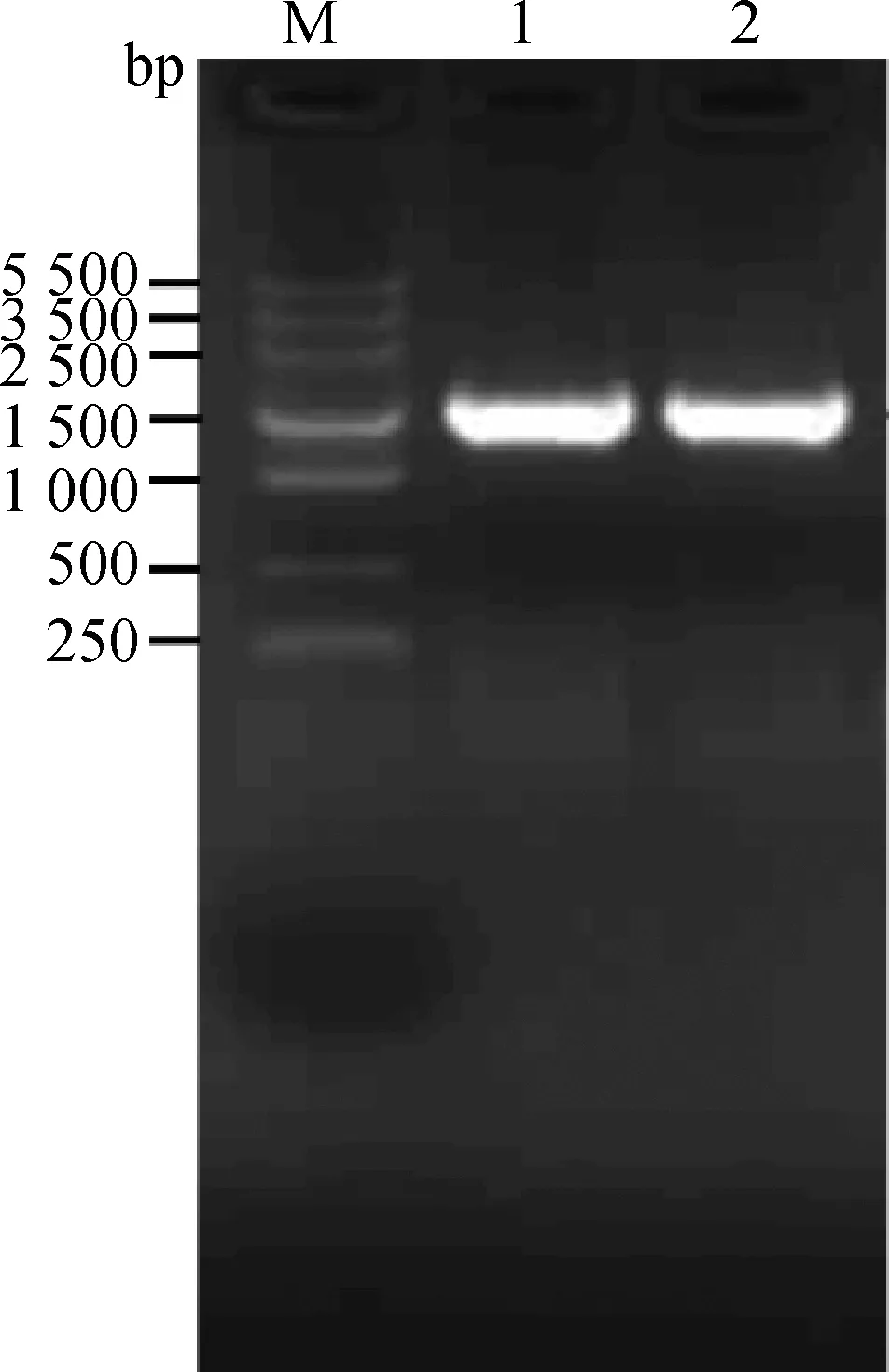
M.DNA相对分子质量标准;1、2.RT-PCR产物M.DNA markerV;1,2.Products of RT-PCR图3 qRT-PCR扩增Visfatin产物的琼脂糖凝胶电泳图Fig.3 Agarose gel electrophoresis of qRT-PCR amplification products for Visfatin
2.2鸡Visfatin重组表达质粒的构建与鉴定
2.2.1pGEM®-T-Visfatin重组质粒鉴定提取菌液PCR为阳性的菌液质粒,通过XhoⅠ和NcoⅠ双酶切后,经1%琼脂糖凝胶电泳检测(图4),出现3 015 bp和1 482 bp两个片段,分别为载体和目的片段,经测序证实序列完全正确,说明重组质粒pGEM®-T-Visfatin构建成功。
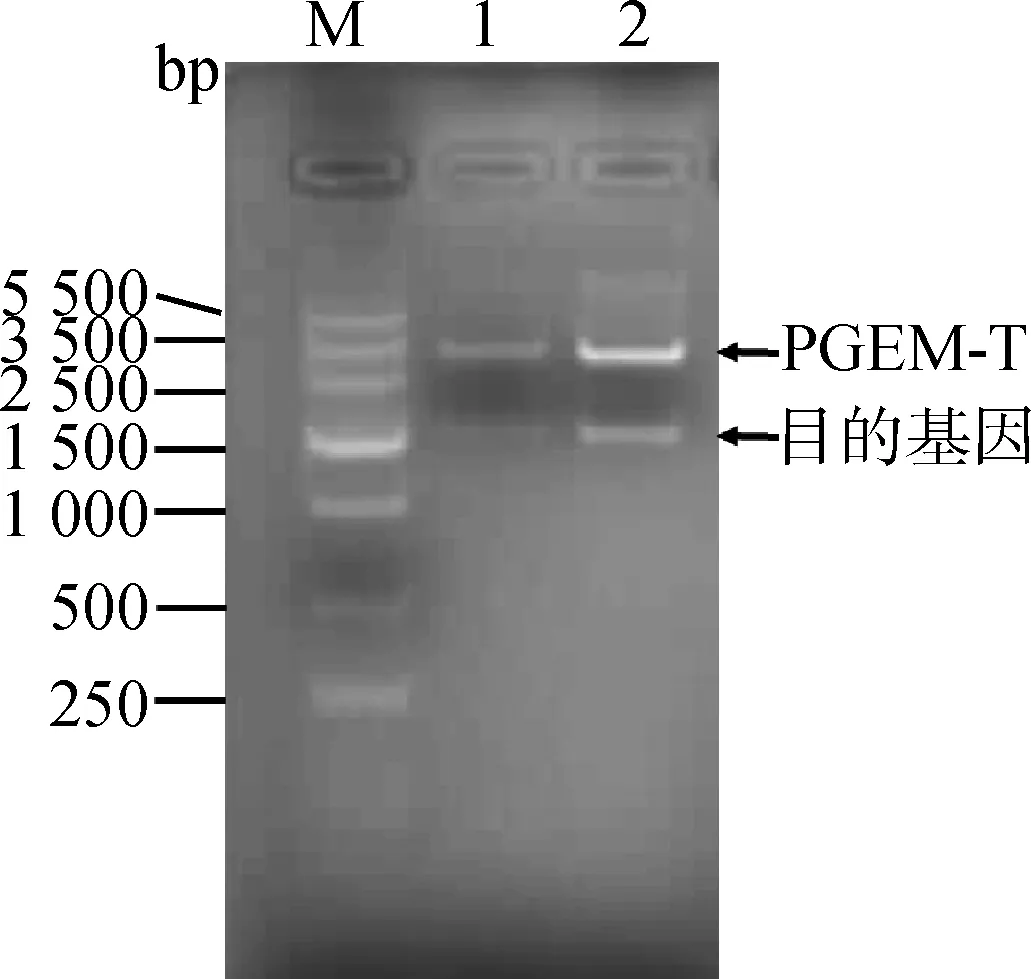
M.DNA相对分子质量标准;1、2.pGEM®-T-Visfatin质粒酶切M.DNA markerV;1,2.Digestion of pGEM®-T-Visfatin plasmid图4 重组质粒pGEM®-T-Visfatin酶切鉴定Fig.4 Identification of pGEM®-T-Visfatin digestion
2.2.2表达载体pET30a-Visfatin的构建与鉴定挑取阳性克隆质粒,通过NcoⅠ、XhoⅠ酶切后,经1%琼脂糖凝胶电泳检测(图5),分别出现载体和目的片段2条带,符合pET30a-Visfatin酶切图谱,且重组质粒测序结果与Visfatin完全一致(结果未展示)。结果表明,已成功构建表达质粒pET30a-Visfatin,可以进行后续试验。
2.3Visfatin重组蛋白的诱导表达条件优化
将构建成功的pET30a-Visfatin质粒转化到大肠杆菌BL21(DE3)中,得到含有目的基因的工程菌。利用SDS-PAGE、革兰氏染色技术对诱导表达的温度、IPTG浓度、时间、培养基pH以及超声破碎时间等条件的优化结果进行检测。由图6可确定,最优的诱导条件是培养基pH为8.0,IPTG终浓度为0.4 mmol·L-1,30 ℃下诱导10~12 h。低温下超声破碎50 min可使菌体蛋白最大程度释放(图7),且破碎上清中目的蛋白含量明显多于破碎沉淀,可确定纯化对象为破碎上清。

M.DNA相对分子质量标准;1、2.pET30a-Visfatin质粒酶切M.DNA markerⅤ;1,2.Digestion of pET30a-Visfatin plasmid图5 表达质粒pET30a-Visfatin酶切检测Fig.5 Identification of pET30a-Visfatin digestion

M.蛋白质相对分子质量标准。A.诱导温度优化:1.未诱导重组质粒;2~5.37 ℃重组质粒诱导全菌、沉淀、沉淀、上清;6~8.30 ℃重组质粒诱导全菌、上清、沉淀。B.IPTG浓度优化:1~3.IPTG浓度为1.2 mmol·L-1时的诱导全菌、上清、沉淀;4~6.IPTG浓度为0.8 mmol·L-1;7~9.IPTG浓度为0.4 mmol·L-1。C.诱导时间优化:1~3.诱导2 h时的全菌、上清、沉淀;4~6.诱导4 h;7~9.诱导6 h;10~12.诱导8 h;13~15.诱导10 h;16~18.诱导12 h。D.培养基pH优化:1~3.pH为7时的全菌、上清、沉淀;4~6.pH为6;7~9.pH为8M.Protein marker.A.Optimization of induction temperature:1.Not induced;2-5.Bacteria,sediment,sediment and supernatant of recombinant plasmid at 37 ℃;6-8.Bacteria,supernatant and sediment of recombinant plasmid at 30 ℃.B.Optimization of IPTG:1-3.Bacteria,supernatant and sediment of recombinant plasmid with 1.2 mmol·L-1 IPTG;4-6.0.8 mmol·L-1 IPTG;7-9.0.4 mmol·L-1 IPTG.C.Optimization of induction time:1-3.Bacteria,supernatant and sediment of recombinant plasmid induced for 2 h;4-6.4 h;7-9.6 h;10-12.8 h;13-15.10 h;16-18.12 h.D.Optimization of pH:1-3.Bacteria,supernatant and sediment of recombinant plasmid at pH7;4-6.pH6;7-9.pH8图6 重组蛋白诱导条件优化Fig.6 Optimization of induction condition of recombinant protein

A.超声破碎前;B.超声破碎30 min;C.超声破碎50 minA.Before ultrasonication;B.Ultrasonication for 30 min;C.Ultrasonication for 50 min图7 超声破碎条件的优化 100×Fig.7 Optimization of ultrasonication 100×
2.4Visfatin重组蛋白的纯化及鉴定
2.4.1Visfatin重组蛋白的纯化经DNAstar软件分析,pET30a-Visfatin重组蛋白大小为60 ku左右。将超声破碎所得上清经镍离子亲和层析进行纯化,经预试验洗涤、洗脱浓度梯度摸索后,最终确定洗涤液为50 mmol·L-1咪唑,采用150 mmol·L-1咪唑洗脱液洗脱目的蛋白,可得到较纯的目的蛋白。用20 mmol·L-1PB(pH7.4)进行透析,经12% SDS-PAGE分析纯化蛋白(图8),结果可见一条清晰的大小为60 ku的单一蛋白条带,与预期的蛋白大小一致。经检测,200 mL菌液可得到浓度为1 mg·mL-1的蛋白溶液约10 mL,计算可知,1 L菌液可得到10 mg Visfatin重组蛋白。
M.蛋白质相对分子质量标准;1.流出液;2.纯化前蛋白;3.纯化后洗脱的目的蛋白M.Protein marker;1.Effluent;2.Not purified protein;3.Purified protein图8 SDS-PAGE检验重组蛋白纯化结果Fig.8 SDS-PAGE analysis on expression products of Visfatin
2.4.2Visfatin重组蛋白的Western blot鉴定将纯化的Visfatin蛋白进行Western blot后,结果显示,纯化后的Visfatin蛋白能与6*His,His-Tag Monoclonal Antibody特异性结合,在约60 ku处可看到一条明显的条带,进一步证实该纯化蛋白为含6*His标签的鸡Visfatin融合蛋白,即已纯化得到目的蛋白Visfatin。
2.53T3-L1细胞检验重组Visfatin活性
2.5.1油红O染色分别将由0.1 μg·mL-1人重组Insulin/鸡重组Visfatin/对照(PBS)诱导8 d的3T3-L1细胞进行油红O染色。倒置荧光相差显微镜100倍放大拍照观察,染色结果显示,Visfatin可以促进细胞内脂质的积聚,促进细胞分化,但是作用不及胰岛素(图8)。由此可初步判断,鸡重组Visfatin具有生物学活性。
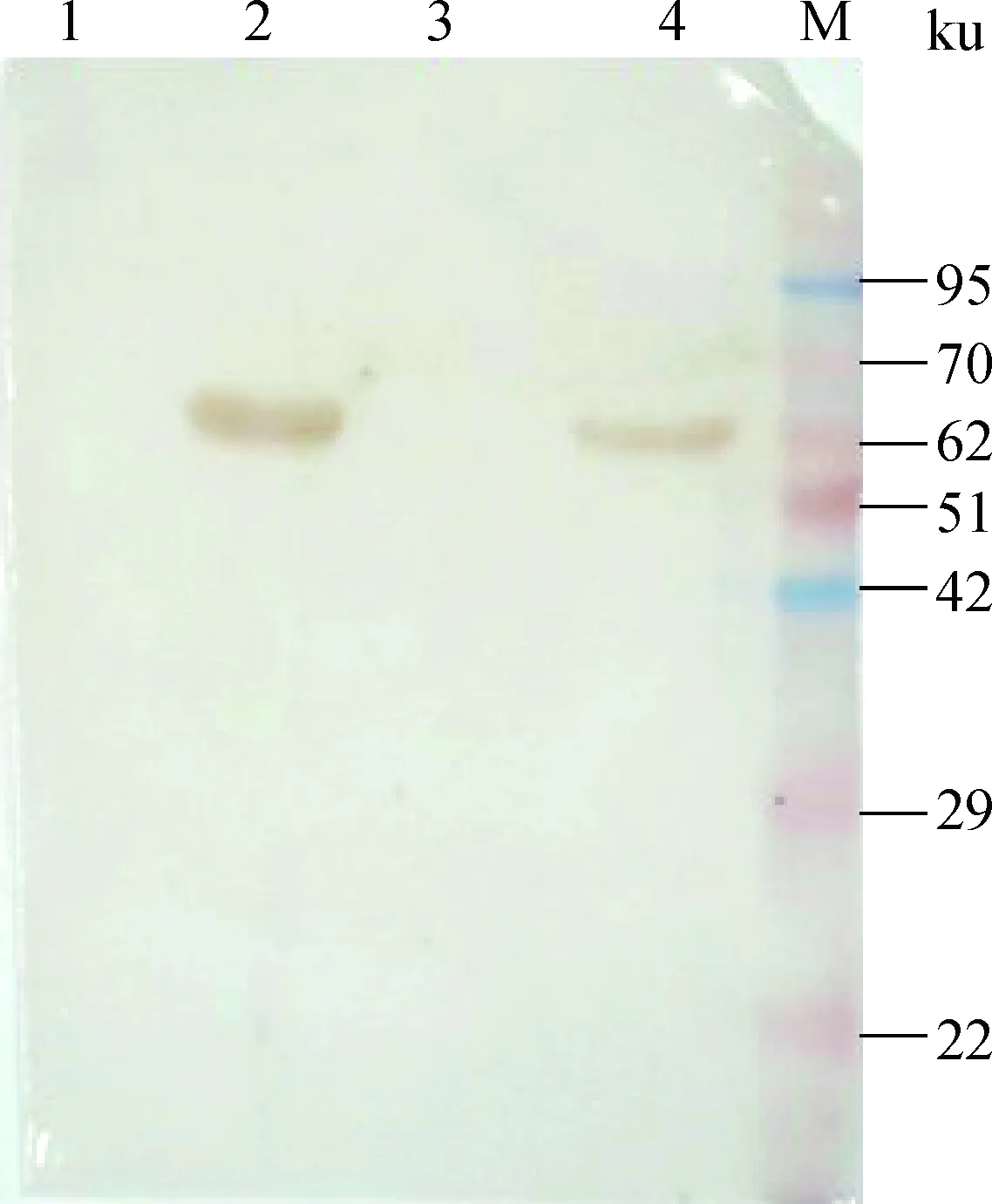
M.蛋白质相对分子质量标准;1、3.阴性对照;2、4.纯化后蛋白M.Protein marker;1,3.Control;2.Purified protein图9 Western blot鉴定纯化蛋白Fig.9 Identification results of Visfatin by Western blot
2.5.2qRT-PCR检测相关基因mRNA表达量试验处理分为4组,分别用Chicken Visfatin、Human Visfatin、Insulin和PBS诱导3T3-L1脂肪细胞分化,通过qRT-PCR方法检测3T3-L1脂肪细胞分化标志基因(PPARγ、aP2、FAS、C/EBPα)的mRNA表达量变化,进一步验证鸡Visfatin对脂肪细胞分化的影响,即鸡重组Visfatin的活性。定量结果显示,诱导分化第4天时,各基因各组间差异显著情况不尽相同,但总体表达趋势一致;分化第8天时,除FAS基因外,Human Visfatin与对照组相比表达量差异不显著(P>0.05),其余各组间各基因表达量差异均达到显著水平(P<0.05)(图11)。由此可进一步说明鸡重组Visfatin与胰岛素、人重组Visfatin作用类似,可以促进3T3-L1向脂肪细胞分化,同时表明鸡重组Visfatin具有生物学活性。

图10 3T3-L1细胞的油红O染色 100×Fig.10 Oil Red O staining of 3T3-L1 100×

图11 3T3-L1分化标志基因的mRNA相对表达量Fig.11 mRNA relative expression of marker genes
3 讨 论
Visfatin是新发现的脂肪细胞因子[10],由于其在糖尿病、肥胖、胰岛素抵抗、代谢综合征、心血管疾病、细胞凋亡、炎症反应和癌症等疾病的防治上均表现出一定的作用[11,16],在人和哺乳动物上研究众多,而作为潜在的家禽增食因子[1],也开始受到关注。虽然研究逐渐在深入,但鸡Visfatin的重组表达却仍未见报道。鸡Visfatin是一个由493个氨基酸残基组成的分子量为52 ku的多肽。韩瑞丽等人预测鸡Visfatin的氨基酸序列具有6个功能基序,26个磷酸化位点;该蛋白具有NAPRTase家族保守结构域特征,不具有信号肽序列,但存在一个疏水性区域;在第145~163位氨基酸残基处存在一个由内向外的跨膜螺旋肽段;不同物种之间该蛋白的相似性达90%以上,具有高度保守性[5]。本研究成功构建鸡Visfatin的原核表达质粒,定向转化获得高表达工程菌,通过简单的纯化步骤获得了纯度较高、活性较好的Visfatin蛋白,为其在家禽领域的进一步研究奠定了基础,并填补了鸡重组Visfatin成功表达这一科研空白。
Visfatin在家禽领域中的研究较少,其生理作用尚不明确。研究表明,鸡Visfatin在不同组织中均有表达,胸肌表达量最高,其次是肝和腿肌[4]。鉴于肝RNA较易提取,本试验选择肝组织作为克隆Visfatin基因的样本。本试验选用的大肠杆菌表达菌株遗传背景研究较为清楚且经济方便,是目前应用较为广泛的外源重组蛋白表达研究方法[17]。由于pET系统所带标签小,表达量大,不影响目的蛋白活性,且pET-30a表达载体N端含有编码6个组氨酸的标签序列,纯化、鉴定极为方便,故选其作为表达载体[18-19]。此外,为了更为高效的定向转化目的基因,我们采用了双载体系统(pGEM-T和pET-30a)构建目的质粒。
活性蛋白的产率取决于蛋白合成、折叠及聚集速率,如果新生肽链的聚集速率超过蛋白折叠的速率就会形成包涵体。外源蛋白在大肠杆菌内表达时,多以无活性的包涵体形式存在,因此需要对表达条件进一步优化进而获得可溶性目的蛋白[20]。一般情况下,蛋白的可溶性表达可以通过降低重组蛋白的合成速率(如降低培养温度)或改变培养基的成分来实现[21]。因此,一方面,本试验选择37和30 ℃进行培养温度优化,37 ℃诱导表达时蛋白的表达量很高,但90%是以包涵体的形式存在;30 ℃诱导表达时,可溶性蛋白的表达量占总表达量的80%,同时蛋白总表达量没有降低,所以30 ℃是最优诱导表达温度;另一方面,基于培养基的pH距重组蛋白等电点越远,其表达的蛋白产物就越不容易形成包涵体这一理论特点,本研究通过软件预测出Visfatin重组蛋白的等电点是6.93,因此选择培养基的pH梯度为pH6、7、8,当培养基的pH为8时,蛋白的可溶性表达量达到最大。此外,本试验还从诱导时间、IPTG浓度以及超声破碎时间等方面对其诱导表达条件进行了优化,确定了最优表达条件,获得了较为理想的表达效果。其中,超声破碎菌体易产生大量的热,容易使蛋白变性,故试验中采取低温处理措施[21]。
重组蛋白纯化时,His标签能与镍离子特异性结合,因此目的蛋白可以特异结合到镍离子柱表面,其他杂蛋白则随洗涤液流出;洗脱时,则只需提高咪唑浓度与His标签竞争镍离子结合位点,将目的蛋白从柱子上洗脱[22]。前期做了大量咪唑浓度梯度摸索(结果未展示),最终确定最佳洗涤浓度为50 mmol·L-1,洗脱浓度为150 mmol·L-1。SDS-PAGE和Western blot结果显示,纯化所得重组蛋白与预期大小一致,且纯度较高,特异性较好。
有关Visfatin活性鉴定的报道并不多,就目前来说,通过检测Visfatin对3T3-L1细胞分化的影响来间接说明Visfatin有无活性可能是唯一一种检验Visfatin活性的方法。3T3-L1细胞具有分化成为脂肪细胞的潜能,一般需要在Insulin、Dex、IBMX等试剂的诱导下分化成为成熟的脂肪细胞。该过程由多种转录因子调控完成,不但环状脂滴逐渐明显形成,可用油红O染色观察[23];同时分化相关标志基因PPARγ、aP2、FAS、C/EBPα表达量也会跟着发生改变[24-25],可通过实时荧光定量技术检测。Visfatin具有类胰岛素作用,且市面有售人重组Vistatin成品,故试验设Insulin/重组Visfatin/鸡重组Visfatin/空白(PBS)4组进行比较。试验结果很好地证明了鸡重组Visfatin具有生物学活性。
4 结 论
本试验通过克隆表达鸡重组Visfatin成功构建了pET30a-Visfatin质粒表达载体,并优化了目的基因在原核系统中的表达条件,经过纯化得到了纯度较高的鸡Visfatin蛋白,且该蛋白具有生物学活性。由此建立了一套鸡重组Visfatin的标准化表达程序,为Visfatin在家禽领域的进一步研究奠定了基础。
[1]FUKUHARA A,MATSUDA M,NISHIZAWA M,et al.Visfatin:a protein secreted by visceral fat that mimics the effects of insulin[J].Science,2005,307(5708):426-430.
[2]REVOLLO J R,KÖMER A,MILLS K F,et al.Nampt/PBEF/visfatin regulates insulin secretion in β cells as a systemic NAD biosynthetic enzyme[J].CellMetab,2007,6(5):363-375.
[3]REVOLLO J R,GRIMM A A,IMAI S.The regulation of nicotinamide adenine dinucleotide biosynthesis by Nampt/PBEF/visfatin in mammals[J].CurrOpinGastroenterol,2007,23(2):164-170.
[4]ONS E,GERTLER A,BUYSE J,et al.Visfatin gene expression in chickens is sex and tissue dependent[J].DomestAnimEndocrinol,2010,38(2):63-74.
[5]韩瑞丽.鸡 visfatin 和 PRDMl6 基因遗传变异及其效应与表达研究[D].杨凌:西北农林科技大学,2010.
HAN R L.Study on genetic variation and its effects and expression of visfatin and PRDM16 gene in chickens[D].Yangling:North West Agriculture and Forestry University,2010.(in Chinese)
[6]SAMAL B,SUN Y,STEARNS G,et al.Cloning and characterization of the cDNA encoding a novel human pre-B-cell colony-enhancing factor[J].MolCellBiol,1994,14(2):1431-1437.
[7]KLÖTING N,KLÖTING I.Visfatin:gene expression in isolated adipocytes and sequence analysis in obese WOKW rats compared with lean control rats[J].BiochemBiophysResCommun,2005,332(4):1070-1072.
[8]CHEN H,XIA T,ZHOU L,et al.Gene organization,alternate splicing and expression pattern of porcine visfatin gene[J].DomestAnimEndocrinol,2007,32(3):235-245.
[9]CHEN M P,CHUNG F M,CHANG D M,et al.Elevated plasma level of visfatin/pre-B cell colony-enhancing factor in patients with type 2 diabetes mellitus[J].JClinEndocrinolMetab,2006,91(1):295-299.
[10]OGNJANOVIC S,BRYANT-GREENWOOD G D.Pre-B-cell colony-enhancing factor,a novel cytokine of human fetal membranes[J].AmJObstetGynecol,2002,187(4):1051-1058.
[11]YE S Q,SIMON B A,MALONEY J P,et al.Pre-B-cell colony-enhancing factor as a potential novel biomarker in acute lung injury[J].AmJRespirCritCareMed,2005,171(4):361-370.
[12]CLINE M A,NANDAR W,PRALL B C,et al.Central visfatin causes orexigenic effects in chicks[J].BehavBrainRes,2008,186(2):293-297.
[13]BRUNETTI L,RECINELLA L,DI NISIO C,et al.Effects of visfatin/PBEF/NAMPT on feeding behaviour and hypothalamic neuromodulators in the rat[J].JBiolRegulHomeostAgents,2011,26(2):295-302.
[14]韩瑞丽,康相涛,魏杨,等.鸡 visfatin 基因第 9 内含子 4 个 SNPs 的关联分析[C].南京:第十二次全国畜禽遗传标记研讨会,2010.
HAN R L,KANG X T,WEI Y,et al.Association analysis of 4 SNPs in the ninth intron of visfatin gene in chicken[C].Nanjing:Conference Proceedings of the 12th National Symposium on Genetic Markers of Livestock and Poultry,2010.(in Chinese)
[15]LI J,MENG F,SONG C,et al.Characterization of chicken visfatin gene:cDNA cloning,tissue distribution,and promoter analysis[J].PoultSci,2012,91(11):2885-2894.
[16]SETHI J K,VIDAL-PUIG A.Visfatin:the missing link between intra-abdominal obesity and diabetes[J].TrendsMolMed,2005,11(8):344-347.
[17]范翠英,冯利兴,樊金玲,等.重组蛋白表达系统的研究进展[J].生物技术,2012,22(2):76-80.
FAN C Y,FENG L X,FAN J L,et al.Recent advances on the expression systems for recombinant protein production[J].Biotechnology,2012,22(2):76-80.(in Chinese)
[18]RIBAS A V,HO P L,TANIZAKI M M,et al.High-level expression of tetanus toxin fragment C-thioredoxin fusion protein inEscherichiacoli[J].BiotechnolApplBiochem,2000,31(2):91-94.
[19]ZHAO J H,XU Z,HUA Z C.Expression of human cardiac-specific homeobox protein in Escherichia coli[J].ProteinExprPurif,2000,18(3):316-319.
[20]KANE J F,HARTLEY D L.Formation of recombinant protein inclusion bodies inEscherichiacoli[J].TrendsBiotechnol,1988,6(5):95-101.
[21]叶姣,陈长华,夏杰,等.温度对重组大肠杆菌生长及外源蛋白表达的影响[J].华东理工大学学报:自然科学版,2002,28(4):364-367.
YE J,CHEN C H,XIA J,et al.Effect of temperature on the growth of recombinantE.coliand on the expression of recombiant protein[J].JournalofEastChinaUniversityofScienceandTechnology,2002,28(4):364-367.(in Chinese )
[22]PORATH J.Immobilized metal ion affinity chromatography[J].ProteinExprPurif,1992,3(4):263-281.
[23]LIN F T,LANE M D.CCAAT/enhancer binding protein alpha is sufficient to initiate the 3T3-L1 adipocyte differentiation program[J].ProcNatlAcadSci,1994,91(19):8757-8761.
[24]初明,胡志强,魏兰兰,等.白黎芦醇对垂体腺瘤GH3细胞生长及其分子机制的研究[J].中华医学杂志,2003,83(22):2004-2006.
CHU M,HU Z Q,WEI L L,et al.Studies on the effect of resveratrol on growth of GH3 cells and its molecular mechanism in pituitary adenomas[J].NationalMedicalJournalofChina,2003,83(22):2004-2006.(in Chinese )
[25]WU Z,ROSEN E D,BRUN R,et al.Cross-regulation of C/EBPα and PPARγ controls the transcriptional pathway of adipogenesis and insulin sensitivity[J].MolCell,1999,3(2):151-158.
(编辑郭云雁)
Prokaryotic Expression,Purification and Bioactivity Identification of Recombinant Chicken Visfatin Protein
ZHANG Pan-pan#,SHANG Peng-fei#,TIAN Fang-yuan,HAN Rui-li,JIANG Rui-rui,SUN Gui-rong,KANG Xiang-tao,LIU Xiao-jun,TIAN Ya-dong*
(HenanInnovativeEngineeringResearchingCenterofPoultryGermplasmResources,CollegeofAnimalScienceandVeterinaryMedicine,HenanAgriculturalUniversity,Zhengzhou450002,China)
The objective of the present study was to obtain recombinant chicken Visfatin protein with biological activity.The total RNA was extracted from livers of AA broilers.TheVisfatincDNA was first amplified by qRT-PCR and cloned into pGEM®-T vector.The cDNA was then cut out from pGEM®-T vector by digestion with endonucleaseNcoⅠ andXhoⅠand inserted into corresponding cloning sites of the plasmid pET-30a.The positive recombinant plasmid designated as pET-30a-Visfatin was transformed intoE.coliBL21 (DE3) competent cells.The cells containing pET-30a-Visfatin were identified.The conditions of IPTG induction were optimized by examining the expression level of recombinant protein using SDS-PAGE analysis.The recombinant protein was purified by Nickel ion affinity chromatography.The identification of the purified recombinant protein was checked by Western blot and the bioactivity was examined by looking into differentiation status of 3T3-L1 cells.A fragment which was the same size to prediction was observed when the recombinant plasmid pET-30a-Visfatin was digested with endonucleaseNcoⅠ andXhoⅠ.It indicated that the recombinant expression vector was constructed successfully.The SDS-PAGE analysis revealed that the optimum conditions of induction were 0.4 mmol·L-1IPTG,pH 8.0,at 30 ℃ for 10-12 h.The molecular weight of the recombinant protein was about 60 ku,which was the same to prediction.The Western blot analysis indicated that the recombinant protein could be recognized by anti-His antibody.Additionally,the Oil Red O stain assay showed that there were more lipid droplets formation in 3T3-L1 cells induced by Visfatin than that in the controls.Meanwhile,the results of qRT-PCR revealed that the expression levels of genes involved in cell differentiation such asPPARγ,aP2,FASandC/EBPαincreased significantly (P<0.05) when 3T3-L1 cells induced by Visfatin.This study successfully established a standardized expression program for recombinant chicken Visfatin protein production,and obtained the purified recombinant protein with biological activity,which laid a foundation for further research in the field of poultry.
chicken recombinant Visfatin;cloning;prokaryotic expression;condition optimization;3T3-L1
10.11843/j.issn.0366-6964.2016.09.006
2016-03-02
国家自然科学基金(31372330);教育部创新团队发展计划(IRT1236);农业部农业科研杰出人才及其创新团队;河南省重大科技专项(151100110800)
张盼盼(1989-),女,河南商丘人,硕士,主要从事家禽分子营养研究,E-mail:jqzxzpp2013@126.com;商鹏飞(1986-),女,河南济源人,硕士,主要从事家禽分子营养研究,E-mail:shangpengfei13@163.com。二者同为第一作者
田亚东,副教授,博士,研究生导师,主要从事家禽营养和家禽生产研究,E-mail:ydtian111@163.com
S831.2
A
0366-6964(2016)09-1785-10
