低频超声联合微泡输送药物治疗脑胶质瘤的研究进展
2016-10-28皮兆柯李芳芳李粤黄纬键陈依玲沈圆圆陈思平陈昕
皮兆柯, 李芳芳, 李粤, 黄纬键, 陈依玲, 沈圆圆, 2, 3, 陈思平, 2, 3, 陈昕, 2, 3
1. 深圳大学生物医学工程学院(深圳,518060) 2. 医学超声关键技术国家地方联合工程实验室(深圳,518060) 3. 广东省生物医学信息检测与超声成像重点实验室(深圳,518060)
低频超声联合微泡输送药物治疗脑胶质瘤的研究进展
皮兆柯1, 李芳芳1, 李粤1, 黄纬键1, 陈依玲1, 沈圆圆1, 2, 3, 陈思平1, 2, 3, 陈昕1, 2, 3
1. 深圳大学生物医学工程学院(深圳,518060) 2. 医学超声关键技术国家地方联合工程实验室(深圳,518060) 3. 广东省生物医学信息检测与超声成像重点实验室(深圳,518060)
血脑屏障保护大脑内环境稳定的同时, 也阻挡了大部分治疗药物进入中枢神经系统, 从而严重影响颅内疾病的治疗效果。恶性脑胶质瘤由于高复发率和致死率, 是最常见且治疗棘手的脑肿瘤之一, 给人类的生命健康带来很大的危害。目前治疗方法首选手术切除、 放疗和化疗。手术切除后病人容易复发, 化疗由于血脑屏障的存在疗效不佳, 低频聚焦超声联合微泡的方法能够可逆, 有效、 靶向地开放血脑屏障, 为脑部输送药物, 给治疗脑胶质瘤提供了很有潜力的途径。该文综述了近几年来利用低频聚焦超声联合微泡输送药物治疗脑胶质瘤的研究进展。
血脑屏障; 低频超声; 微泡; 脑胶质瘤; 化疗
0 引言
脑胶质瘤是人体中枢神经系统中最常见的原发性肿瘤[1]。在美国, 每年至少有23 000名患者被诊断为大脑或其他中枢神经系统恶性肿瘤, 而这其中有将近一半的病人为神经胶质瘤或胶质母细胞瘤[2]。脑胶质瘤相对其他癌症虽然发病率低但却有极高的死亡率, 其中胶质母细胞瘤恶性程度最高, 占胶质瘤的50%以上[3]。根据世界卫生组织分类, 胶质瘤可以分为星形胶质细胞瘤和少突胶质细胞瘤, 而根据这些肿瘤生长速度分为Ⅰ~Ⅳ四个等级, I和II级胶质瘤恶性程度较低, 如星形胶质瘤; III和IV级胶质瘤恶性程度很高, 特别如多型性神经胶质母细胞瘤(Glioblastoma multiform, GBM), 平均生存期仅一年左右, 是威胁人类生命健康最严重的恶性肿瘤之一[4]。目前, 脑胶质瘤治疗的首选方案是先在最大范围安全切除肿瘤后给予放射治疗, 并进行化学药物治疗。对III期的GBM患者进行随机调查发现,经手术切除和放疗后, 中位生存时间仅仅只有12个月[5]。大部分胶质瘤患者在接受手术切除和放疗后仍极易复发, 因此, 化学疗法是治疗脑胶质瘤的重要手段之一[6]。然而, 传统的静脉注射化疗药物会导致全身性的细胞毒性, 对病人的生存质量有很大影响, 而且, 由于血脑屏障(Blood-brain barrier, BBB)[7]和血脑肿瘤屏障(Blood-brain tumor barrier, BTB)[8]的存在, 阻挡了大部分药物进入大脑内的肿瘤区域,从而严重影响化疗效果。近年来, 低频聚焦超声(Focused ultrasound, FUS)联合微泡(Microbubbles, MB)被证明是一种无创、 短暂、 可逆、 局部地开放血脑屏障的有效方法[9]。因此, 更多的药物将会被应用到治疗脑胶质瘤上, 目前已经有很多动物实验研究通过低频聚焦超声联合微泡开放血脑屏障的方法, 成功将治疗脑胶质瘤的大分子药物靶向输送入脑[10], 为脑胶质瘤的治疗提供了新的途径。
1 脑胶质瘤的特征
脑胶质瘤病是由Nevin[11]于1938年首先提出, Jennings等[21-22]回顾的文献中数百例脑胶质瘤患者中, 临床上主要病理特征是出现精神异常, 智能减退, 颅内压升高并常伴有癫痫发作[12]。在神经影像学上, 脑胶质瘤病变呈弥漫性浸润生长, 范围广且边界模糊[13]。胶质瘤发生机制尚未完全探明, 其发生发展可能与机体因素、 外环境因素和基因变异有关, 是一个有多种癌基因或抑癌基因共同参与的、 多因素联合作用的过程[14]。相关研究证明, 脑胶质瘤绝大多数是原发性肿瘤[15], 且肿瘤细胞表现为无控性生长, 其能侵袭到周边正常组织, 并能向远处发生转移[16]。这为手术切除肿瘤区域和放疗带来了极大的困难。而且, 肿瘤细胞术后残留是胶质瘤复发的根源所在[17]。脑胶质瘤虽然发病率低, 但却有逐年上升趋势, 而且具有复发率高, 致死率高, 治愈率低的特点。近二十年来, 胶质瘤的疗效及预后无明显改善, 因此寻求有效的治疗措施已刻不容缓。尽管现在用于抑制肿瘤细胞生长的药物很多, 然而, 绝大多数药物都因血脑屏障的存在而无法到达脑部, 导致临床上对脑胶质瘤的治疗不理想[18]。
2 血脑屏障
血脑屏障是维持脑内环境稳定和避免有害物质入侵脑组织所特有的结构。BBB能阻挡病原生物和其他大分子物质由血液循环进入脑室和脑组织, 又能将脑内代谢产物排出, 从而保持脑组织内环境的基本稳定, 对维持脑内环境的动态平衡和正常生理状态具有重要生物学意义[19]。早在19世纪末, 德国细菌学家Ehrlich和其学生Goldmann等通过注射台盼蓝发现, 中枢神经系统和外周血液循环系统之间存在物理屏障, 并正式提出血脑屏障的概念[20]。直到20世纪60年代通过电子显微镜细胞化学的研究成功, 证明了血脑屏障的存在并揭示了血脑屏障的解剖学基础[21]。
血脑屏障是血液与脑组织间的一种特殊屏障, 它主要由脑内的毛细血管内皮细胞彼此紧密相连, 同时与完整的基膜以及周围的周细胞和星形胶质细胞相互作用构成的屏障系统[22]。在电镜下观察发现, 内皮细胞的紧密相连主要由跨膜蛋白、 胞质附着蛋白和细胞骨架蛋白共同作用, 而且内皮细胞缺少跨膜转运的质膜小泡以及缺乏细胞孔, 细胞膜上含有一些特殊的蛋白:碱性磷酸酶、 r-谷氨酸转肽酶、 糖转蛋白与铁转蛋白受体等[23]。这些构成了一个连续封闭的网状结构, 该网状结构是BBB的主要形态学基础, 对分子物质从血液进出脑组织具有高度选择通透性[24], 只允许气体及分子量小于400~500 Da的脂溶性小分子物质通过。正是由于BBB的存在, 才能使得物质不可以随便进入脑实质, 可以阻挡毒素、 炎症因子、 免疫细胞等的侵入, 从而避免影响中枢神经系统的正常生理活动, 保护脑组织内环境的高度稳定。但是与此同时, BBB也阻挡了大部分治疗中枢神经系统疾病所需要的药物的入脑, 这也成为治疗中枢神经系统疾病时遇到的重要瓶颈问题[25]。所以, 如何增大BBB的通透性, 实现让更多的大分子治疗药物入脑, 是当下治疗颅内疾病的一个非常有潜力的方向。
3 跨越血脑屏障输送药物的方法
为了提高BBB对药物的通透性, 传统临床上开放BBB的方法有以下几种:(1)使药物具备脂溶性。该方法通过用可溶于脂类的物质或者可与脂类载体共存的物质去修饰药物, 使药物亲脂性, 但是周边器官也会吸收亲脂性药物, 从而导致药物的利用率很低[26]。(2)静脉注射高渗溶液。该方法通过注射高渗溶液引起脑部毛细血管壁内皮细胞的收缩, 实现短暂地开放血脑屏障, 但是该方法不能实现靶向治疗, 全脑的血管通透性都会增加, 引起病变组织区域之外的周围细胞和神经细胞损伤[27]。(3)开颅或者直接脑室注射。这个方法可以通过插入一根连接导管的针头, 直接注入药物使得病灶药物达到一定浓度从而进行治疗, 但该方式容易造成脑部受损, 而且易发生术后感染, 属于一种有创的方法, 危险性较高[28]。(4)使用内源性载体运转系统。该方式通过改造载体的表面, 利用BBB内皮细胞上的转运蛋白特异性机制将特制的药物输送入脑, 但是由于细胞膜上受体的数量有限, 而且制作方法复杂, 很大程度上限制了其临床应用前景[29]。
由上可知, 传统增加BBB通透性的方法都有一定的局限性。2001年, 加拿大多伦多大学的Hynynen首次将超声和微泡联合起来, 发现可以安全、 有效、 无创、 可逆地开放兔子的BBB[30]。这一重大发现使得无创开放BBB输送大分子物质入脑的研究进程进入一个历史性的阶段。低频聚焦超声联合微泡的方法具有巨大的应用潜力, 该方法在病理结果上没有造成神经元损伤, 具有无创性; 能够通过聚焦超声实现局部区域的治疗, 具有靶向性; BBB短暂开放后依然能重新恢复, 具有可逆性。因此, 该方法克服了传统方法的局限性, 具有独特的优势。
4 低频聚焦超声联合微泡输送治疗脑胶质瘤的药物
由上述研究可以得到, 超声联合微泡对大脑靶向输送药物具有独特的优势[31], 而且大量的实验证明了这种方法用于临床上治疗脑胶质瘤的可行性。目前用于治疗恶性脑胶质母细胞瘤疾病的唯一一线药物是替莫唑胺TMZ, 其他药物有卡莫司汀BCNU等[32]。但是血脑屏障的存在使得这些药物的疗效并没有发挥出来。例如TMZ的脑脊液血液之比仅在10%~20%之间。在这过程中存在的问题是为了增加疗效, 增加药物剂量的同时也会导致药物毒性的增加。因此, 解决这一问题的关键点是如何增加中枢神经系统中的药物剂量以达到更好的疗效[33]。
由于超声联合微泡开放血脑屏障具有无创、 可逆、 局部治疗的独特优势, 研究学者们将该方法应用在动物模型上, 进行了一系列的探索。目前研究者们已经进行了超声联合微泡开放血脑屏障输送大分子物质入脑。2006年有研究显示分子量为150 kDa的抗体药物赫赛汀(Herceptin)和D4受体抗体都能够利用这一方法成功输送入小鼠脑部[34]。2008年Raymond等首次发现利用超声微泡能够往AD鼠脑部输送抗淀粉样蛋白抗体(分子量为150 kDa的抗Aβ1-40)。2012年Yang首次在脑胶质瘤动物模型中通过超声联合微泡的方法递送含硼化合物BPA, 提高中子捕获治疗的疗效[35], 2013年Ryan再次证明了BPA可以通过超声微泡成功入脑, 并且对脑胶质瘤的增长有一定的抑制效果[36]。2011年Burgess首次成功通过该方法输送干细胞入脑[37]。2013年Alkins再次证实了该方法输送干细胞的可行性。由上可见, 低频聚焦超声联合微泡这一技术在输送大分子药物入脑很有潜力。
超声联合微泡开放血脑屏障对脑部肿瘤治疗的疗效提高已经在动物实验中得到验证。目前已有的研究采用的化疗药物主要有阿霉素脂质体(Liposomal DOX)、 卡莫司汀(Carmustine, BCNU)、 替莫唑胺(Temozolomide, TMZ)和紫杉醇(Paclitaxel, PTX), 本文分别在章节4.1至4.4综述, 这些研究采用的参数总结在表1中。
4.1超声联合微泡开放血脑屏障输送阿霉素脂质体治疗脑胶质瘤
2007年研究者Treat LH成功将阿霉素脂质体药物输送至正常大鼠脑部[38], 2012年Treat在采用中心频率为1.7 MHz、 负声压为1.2 MPa的超声, 联合微泡辐照时长60~120 s, 经过单次的治疗, 输送脂质体包裹阿霉素药物。实验结果发现该方法能够有效延长种植9L脑胶质瘤大鼠的寿命, 超声联合微泡治疗组比不治疗组的中位生存周期提高24%, 且存在显著性差异(P=0.000 7), 存活天数大于40 d的比率是26.7%。而单独DOX治疗组比不治疗组的中位生存周期仅提高16%, 不存在显著性差异(P=0.17), 且存活天数均小于40 d[39]。2013年Aryal通过对 9L脑胶质瘤大鼠模型经过三周期的治疗, 超声联合微泡治疗组的8只大鼠中, 有1只大鼠存活天数为66 d, 甚至有两只大鼠存活天数超过136 d, 与不治疗组的中位生存周期相比较, 超声联合微泡治疗组增加了一倍, 而单独DOX治疗组仅提高16%, 用MRI检测FUS+MB+DOX组、 单独FUS组、 对照组和单独DOX给药组的平均肿瘤体积增倍时间分别为3.7、 2.2、 2.3和2.7 d[40]。说明超声联合微泡开放BBB输送阿霉素脂质体在治疗脑胶质瘤疾病方面具有很大的临床应用潜力。
4.2超声联合微泡开放血脑屏障输送卡莫司汀治疗脑胶质瘤
卡莫司汀一直是临床上常用于神经胶质瘤的治疗药物, 虽然BCNU是亲脂性的, 容易穿过血脑屏障, 但这也同时会导致全身性的细胞毒性, 从而限制了药物到达脑肿瘤的浓度。2012年Liu等[41]在MRI引导下使用中心频率为400 kHz、 负声压为0.62 MPa的低频聚焦超声增强输送BCNU到达小鼠的脑部, 发现脑肿瘤区域的药物浓度达到了344 μg, 是对照组的两倍多。聚焦超声联合微泡共同作用开放血脑屏障递送BCNU发挥出最大的肿瘤抑制效果, 显著延长了动物的生存时间, 使得小鼠的生存中位时间增加并且超过50 d, 而对照组、 超声微泡不给药组和单纯注射BCNU组的生存中位时间分别仅仅为26、 29和32 d。此外, BCNU还可以做成脂质体卡莫司汀、 BCNU聚合物以及纳米粒子等用于治疗脑胶质瘤[42]。
4.3超声联合微泡开放血脑屏障输送替莫唑胺治疗脑胶质瘤
替莫唑胺(TMZ)早在2005年就已经被批准当作烷化剂抗肿瘤药物用来治疗脑肿瘤[43]。TMZ的一个优势在于可以口服经吸收后达到中枢神经系统[44]。2014年Liu HL等[45]进行了超声联合微泡开放血脑屏障输送TMZ治疗脑胶质瘤的动物实验研究。在该研究中, 采用了人类U87脑胶质瘤动物模型, 利用液相色谱分析和串联质谱分析技术测量了TMZ在脑脊液和血浆中的含量。结果显示, 与单纯TMZ给药组相比, 利用FUS+MB输送TMZ的方法使得药物在脑脊液和血浆中的比例从22%增加到39%(超声中心频率:500 kHz, 负声压:0.6 MPa, 脉冲时长:10 ms, 脉冲重复频率:1 Hz, 超声辐照时间:60 s)。当TMZ剂量为2.5 mg/kg时, 对肿瘤的生长速度控制时长超过7 d; 当TMZ剂量增加到25 mg/kg时, 裸鼠脑内胶质瘤生长速度虽然得到一定的控制, 但是动物的生存时长却没有明显增加, 相比之下, FUS+MB输送TMZ的低剂量(75 mg/kg/d, 5 d)与FUS-MB输送TMZ高剂量(100 mg/kg/d, 5 d) 相比, 大大延长了动物生存时间, 中位生存时间增加了15%。该实验结果在动物实验水平证明超声微泡输送TMZ可以提高其治疗脑胶质瘤的治疗效果。
4.4超声联合微泡开放血脑屏障输送紫杉醇治疗脑胶质瘤
紫杉醇(Paclitaxel, PTX)是近几十年常用于临床上的天然抗肿瘤药物之一, 它通过促进微管蛋白聚合抑制解聚, 抑制细胞有丝分裂, 促进肿瘤细胞凋亡, 诱导肿瘤坏死因子的产生等, 被广泛用于乳腺癌、 卵巢癌、 前列腺癌、 头颈部肿瘤等疾病的治疗。但是PTX的水溶性极差, 临床上现采用无水乙醇和聚氧乙烯蓖麻油混合作为溶剂, 增大其溶解度, 然而溶剂容易引起严重过敏反应和神经毒性等不良反应[46]。2008年, Turunen等运用琥珀酸紫杉醇类药物, 发现可以减少全身的细胞毒性[47]。在同年, 付赤学对兔VX2脑肿瘤模型使用加入三醋酸甘油酯的载PTX微泡并联合聚焦超声靶向治疗(超声参数, 中心频率:1.75 MHz/3.5 MHz声压:1.0 MPa, 超声辐照时间:10 min, 微泡计量:0.5 ml/kg), 治疗效果明显, 抑瘤率达40.8%, 比单纯药物组(20.6%)明显提高; 凋亡指数达 37%, 明显高于其余各组[48]。
本文研究小组将U87 MG Red可生物发光细胞移植到裸鼠颅内, 探索低频超声联合微泡输送紫杉醇脂质体对裸鼠颅内移植的胶质母细胞瘤的治疗效果。采用了频率为1.051 MHz和负声压为0.6 MPa的超声辐照60 s。利用生物发光成像研究进行监测每个老鼠脑内的神经胶质瘤的生长情况。超声联合微泡输送紫杉醇脂质体组肿瘤的生长得到了显著的抑制, 与对照组相比, 在第20 d测得的荧光总量的值降低了三倍, 中位生存时间增加了20%。表1总结了上述研究中利用FUS联合微泡输送各种药物治疗脑肿瘤的情况。
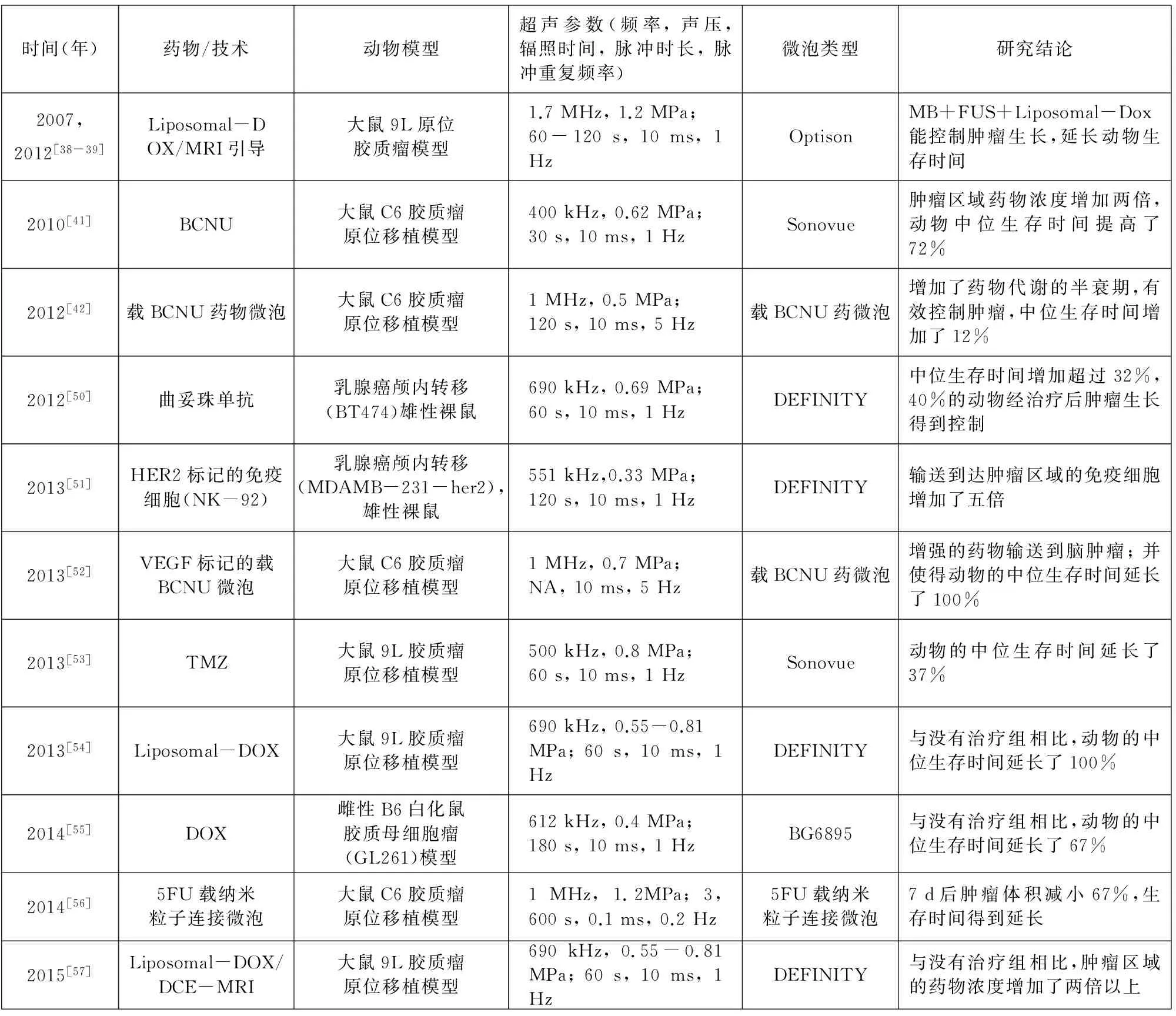
表1 超声联合微泡开放血脑屏障输送药物治疗脑肿瘤的相关实验总结
5 小结与展望
众多研究表明, 超声联合微泡开放血脑屏障介导肿瘤靶向药物治疗兼具安全、 高效、 靶向性好、 可控性强等优点, 初步显示了其潜在的应用前景, 对于临床脑胶质瘤的治疗有望成为一种新的途径和技术[58]。2015年11月Sunnybrook科学家首次在MRI引导下利用聚焦超声联合微泡开放首例恶性脑胶质瘤病人的血脑屏障。如果在接下来的长期生存研究中能够证实该治疗方法的有效性, 将为临床上治疗脑部疾病开辟一个新的技术领域, 也同时为该方法运用于治疗其他颅内疾病提供新的途径, 如阿尔茨海默病、 帕金森综合症等[59]。
相信在不久的将来, 低频超声联合微泡输送药物治疗颅内疾病的方式将会在临床上发挥出其革命性的优势。随着各种兼具诊断治疗双重作用的超声探头和稳定分布良好的载药微泡的研制, 以及对超声参数及其生物学效应的深入研究, 低频聚焦超声联合微泡开放血脑屏障介导肿瘤靶向给药治疗将为临床上脑胶质瘤的治疗带来新的希望。
[1] Ostrom QT, Gittleman H, Farah P, et al. CBTRUS statistical report: Primary brain and central nervous system tumors diagnosed in the united states in 2006-2010 [J]. J Neuro Oncol, 2014,16(4):1-13.
[2] Siegel R, Naishadham D, Jemal A. Cancer statistics, 2013 [J]. Ca-Cancer J Clin, 2013,63(1):11-30.
[3] Arko L, Katsyv I, Park GE, et al. Experimental approaches for the treatment of malignant gliomas [J]. Pharmacol Ther NLM, 2010,128(1):1-36.
[4] Stupp R, Hegi ME, Mason WP, et al. Effects of radiotherapy with concomitant and adjuvant temozolomide versus radiotherapy alone on survival in glioblastoma in a randomised phase iii study: 5-year analysis of the eortc-ncic trial [J]. Lancet Oncol, 2009,10(5):459-466.
[5] Galanis E, Buckner J. Chemotherapy for high-grade gliomas [J]. Brit J Cancer, 2000,82(8):1371-1380.
[6] Stuart A. Grossman, Julette F. Batara. Current management of glioblastoma multiforme [J]. Semin Oncol, 2004,31(5):635-644.
[7] Khil MS, Kolozsvary A, Apple M, et al. Increased tumor cures using combined radiosurgery and bcnu in the treatment of 9l glioma in the rat brain [J]. Int J Radiat Oncol, 2000,47(2):511-516.
[8] Cloughesy TF, Black KL. Pharmacological blood-brain barrier modification for selective drug delivery [J]. J Neuro Oncol, 1995,26(2):125-132.
[9] Kang J, Wu XL, Wang ZG, et al. Antitumor effect of docetaxel-loaded lipid microbubbles combined with ultrasound-targeted microbubble activation on vx2 rabbit liver tumors [J]. J Ultras Med, 2010,29(1):61-70.
[10] He X, Liu HL, Huang CY, et al. Pharmacodynamic and therapeutic investigation of focused ultrasound-induced blood-brain barrier opening for enhanced temozolomide delivery in glioma treatment [J]. Plos One, 2014,9(12):114-311.
[11] S N. Gliomatosis cerebri [J]. Brain, 1938,61:170-191.
[12] Jennings MT, Frenchman M, Shehab T, et al. Gliomatosis cerebri presenting as intractable epilepsy during early-childhood [J]. Pediatric Neurol, 1995,10(1):37-45.
[13] 谢淑萍. 脑胶质瘤病的临床和MRI研究 [J]. 中枢神经系统放射学, 2001,35(4):277-279.
[14] 续岭. 脑胶质瘤发病机制及其免疫治疗的发展和展望 [C]. 神经外科2013年年会, 2013,2(32):148-152.
[15] Fiveash JB, Spencer SA. Role of radiation therapy and radiosurgery in glioblastoma multiforme [J]. Cancer J , 2003,9(3):222-229.
[16] 师蔚. 脑胶质瘤发病机制、诊断与治疗的研究进展 [J]. 中华神经医学杂志, 2007,6(9):869-871.
[17] 朱伟.脑胶质瘤临床复发的原因分析 [J]. 中国微侵袭神经外科杂志, 2005,10(4):183-184.
[18] Bhowmik A, Khan R, Ghosh MK. Blood brain barrier: A challenge for effectual therapy of brain tumors [J]. Biomed Res Int, 2015,(1):1-21.
[19] 桑洁, 赵宝全. 血脑屏障分子组成研究进展 [J]. 国际药学研究杂志, 2011,38(3):201-205.
[20] Bentivoglio M, Kristensson K. Tryps and trips: Cell trafficking across the 100-year-old blood-brain barrier [J]. Trends Neurosci, 2014,37(6):325-333.
[21] Reese TS, Karnovsk.[M]. Fine structural localization of a blood-brain barrier to exogenous peroxidase [J]. J Cell Biol, 1967,34(1):207-217.
[22] SI R. Blood-brain barrier in physiology and medicine [J]. Amer. S, 1977,65(1):1-102.
[23] Staddon JM, Rubin LL. Cell adhesion, cell junctions and the blood brain barrier [J]. Curr Opin Neurobiol, 1996,6(5):622-627.
[24] Nagy Z, Peters H, Hüttner I. Fracture faces of cell junctions in cerebral endothelium during normal and hyperosmotic conditions [J]. Lab. Rob, 1984,50(3):313-322.
[25] Pardridge WM. Blood-brain barrier drug targeting: The future of brain drug development [J]. Mol Interv, 2003,3(2):90-105.
[26] Pardridge WM. Drug and gene delivery to the brain: The vascular route [J]. Neuron, 2002,36(4):555-558.
[27] Dietz GPH, Bähr M. Delivery of bioactive molecules into the cell: The trojan horse approach [J]. Mol Cell Neurosci, 2004,27(2):85-131.
[28] Shoichet MS, Winn SR. Cell delivery to the central nervous system [J]. Adv Drug Deliver Rev, 2000,42(1-2):81-102.
[29] Fan CH, Yeh CK. Microbubble-enhanced focused ultrasound-induced blood-brain barrier opening for local and transient drug delivery in central nervous system disease [J]. J Ultras Med, 2014,22(4):183-193.
[30] Hynynen K, McDannold N, Vykhodtseva N, et al. Noninvasive mr imaging-guided focal opening of the blood-brain barrier in rabbits 1 [J]. Radiology, 2001,220(3):640-646.
[31] Burgess A, Shah K, Hough O, et al. Focused ultrasound-mediated drug delivery through the blood-brain barrier [J]. Expert Rev Neurother 2015,15(5):477-491.
[32] Stan A, Casares S, Radu D, et al. Doxorubicin-induced cell death in highly invasive human gliomas [J]. Anticancer Res, 1998,19(2A):941-950.
[33] Grossman S, O′Neill A, Grunnet M, et al. Phase iii study comparing three cycles of infusional carmustine and cisplatin followed by radiation therapy with radiation therapy and concurrent carmustine in patients with newly diagnosed supratentorial glioblastoma multiforme: Eastern cooperative oncology group trial 2394 [J]. J Clin Oncol , 2003,21(8):1485-1491.
[34] Kinoshita M, McDannold N, Jolesz FA, et al. Noninvasive localized delivery of herceptin to the mouse brain by mri-guided focused ultrasound-induced blood-brain barrier disruption [J]. Proc Natl Acad Sci USA, 2006,103(31):11719-11723.
[35] Yang FY, Chen YW, Chou FI, et al. Boron neutron capture therapy for glioblastoma multiforme: Enhanced drug delivery and antitumor effect following blood-brain barrier disruption induced by focused ultrasound [J]. Future Oncol, 2012,8(10):1361-1369.
[36] Alkins RD, Brodersen PM, Sodhi RN, et al. Enhancing drug delivery for boron neutron capture therapy of brain tumors with focused ultrasound [J]. Neuro Onco, 2013,12(9): 1225-1235.
[37] Burgess A, Ayala-Grosso CA, Ganguly M, et al. Targeted delivery of neural stem cells to the brain using mri-guided focused ultrasound to disrupt the blood-brain barrier [J]. Plos One, 2011,6(11):e27877.
[38] Treat LH, McDannold N, Vykhodtseva N, et al. Targeted delivery of doxorubicin to the rat brain at therapeutic levels using mri-guided focused ultrasound [J]. Int J Cancer, 2007,121(4):901-907.
[39] Treat LH, McDannold N, Zhang YZ, et al. Improved anti-tumor effect of liposomal doxorubicin after targeted blood-brain barrier disruption by mri-guided focused ultrasound in rat glioma [J]. Ultrasound Med Biol, 2012,38(10):1716-1725.
[40] Aryal M, Vykhodtseva N, Zhang YZ, et al. Multiple treatments with liposomal doxorubicin and ultrasound-induced disruption of blood-tumor and blood-brain barriers improve outcomes in a rat glioma model [J]. J Contr Releas, 2013,169(1):103-111.
[41] Liu HL, Hua MY, Chen PY, et al. Blood-brain barrier disruption with focused ultrasound enhances delivery of chemotherapeutic drugs for glioblastoma treatment [J]. Radiology, 2010,255(2):415-425.
[42] Qian LL, Zheng JJ, Wang K, et al. Cationic core-shell nanoparticles with carmustine contained within o-6-benzylguanine shell for glioma therapy [J]. Biomaterials, 2013,34(35):8968-8978.
[43] Kim H, Likhari P, Parker D, et al. High-performance liquid chromatographic analysis and stability of anti-tumor agent temozolomide in human plasma [J]. J Pharmaceut Biomed, 2001,24(3):461-468.
[44] Baker SD, Wirth M, Statkevich P, et al. Absorption, metabolism, and excretion of 14C-temozolomide following oral administration to patients with advanced cancer [J]. Clin Cancer Res, 1999,5(2):309-317.
[45] Liu HL, Huang CY, Chen JY, et al. Pharmacodynamic and therapeutic investigation of focused ultrasound-induced blood-brain barrier opening for enhanced temozolomide delivery in glioma treatment [J]. Plos One, 2014,9(12): e114311.
[46] Tartis MS, McCallan J, Lum AF, et al. Therapeutic effects of paclitaxel-containing ultrasound contrast agents [J]. Ultrasound Med Biol, 2006,32(11):1771-1780.
[47] 卫凤英, 成文彩. 紫杉醇脂质体细胞毒作用和抗瘤作用的研究 [J]. 同济医科大学学报, 2001,30(1):46-49.
[48] Turunen BJ, Ge H, Oyetunji J, et al. Paclitaxel succinate analogs: Anionic and amide introduction as a strategy to impart blood-brain barrier permeability [J]. Bioorg Med Chem Lett, 2008,18(22):5971-5974.
[49] 付赤学. 超声激发载紫杉醇微泡跨血脑屏障靶向脑肿瘤的实验研究 [M]. 重庆, 2008,第三军医大学:7-68.
[50] Park EJ, Zhang YZ, Vykhodtseva N, et al. Ultrasound-mediated blood-brain/blood-tumor barrier disruption improves outcomes with trastuzumab in a breast cancer brain metastasis model [J]. J Contr Releas, 2012,163(3):277-284.
[51] Alkins R, Burgess A, Ganguly M, et al. Focused ultrasound delivers targeted immune cells to metastatic brain tumors [J]. Cancer Res, 2013,73(6):1892-1899.
[52] Fan CH, Ting CY, Liu HL, et al. Antiangiogenic-targeting drug-loaded microbubbles combined with focused ultrasound for glioma treatment [J]. Biomaterials, 2013,34(8):2142-2155.
[53] Wei KC, Chu PC, Wang HYJ, et al. Focused ultrasound-induced blood-brain barrier opening to enhance temozolomide delivery for glioblastoma treatment: A preclinical study [J]. Plos One, 2013,8(3): 1-10.
[54] Aryal M, Vykhodtseva N, Zhang YZ, et al. Multiple treatments with liposomal doxorubicin and ultrasound-induced disruption of blood-tumor and blood-brain barriers improve outcomes in a rat glioma model [J]. J Contr Releas, 2013,169(1-2):103-111.
[55] Kovacs Z, Werner B, Rassi A, et al. Prolonged survival upon ultrasound-enhanced doxorubicin delivery in two syngenic glioblastoma mouse models [J].J Contr Releas, 2014,187(192):74-82.
[56] Burke CW, Alexander E, Timbie K, et al. Ultrasound-activated agents comprised of 5fu-bearing nanoparticles bonded to microbubbles inhibit solid tumor growth and improve survival [J]. Mol Ther, 2014,22(2):321-328.
[57] Aryal M, Park J, Vykhodtseva N, et al. Enhancement in blood-tumor barrier permeability and delivery of liposomal doxorubicin using focused ultrasound and microbubbles: Evaluation during tumor progression in a rat glioma model [J]. Phys Med Biol, 2015,60(6):2511-2527.
[58] Olivier Couture JF, Neal F. Kassell, et al. Review of ultrasound mediated drug delivery for cancer treatment updates from pre-clinical studies [J]. Transl Cancer Res, 2014,3(5):494-511.
[59] 陈高舒,郭瑾璇,沈圆圆,等. 低频超声联合微泡治疗阿尔茨海默症的研究进展 [J]. 生物医学工程学进展, 2015,36(3):160-165.
Recent Progress of the Treatment of Glioma by Drug Delivery Using Low-frequency Ultrasound Combined with Microbubbles
PI Zhaoke1, LI Fangfang1, LI Yue1, HUANG Weijian1, CHEN Yiling1,SHEN Yuanyuan1, 2, 3, CHEN Siping1, 2, 3, CHEN Xin1, 2, 3
1. School of Biomedical Engineering, Shenzhen University (Shenzhen,518060)2. National-Regional Key Technology Engineering Laboratory for Medical Ultrasound (Shenzhen,518060)3. Guangdong Key Laboratory for Biomedical Measurements and Ultrasound Imaging (Shenzhen,518060)
The blood-brain barrier can protect the stability of internal environment of brain. However, it also hinders the delivery of therapeutic agents into the central nervous system, affecting the treatment efficiency of many intracranial diseases. Malignant glioma is one of the most common brain tumors and characteristic of high rates of recurrence and mortality, bringing great threat to human life. Current chemotherapy has failed to control tumor progression or improve glioma patient surviving time because of the blood-brain barrier. Low-frequency focused ultrasound combined with microbubbles has already been confirmed to enhance permeability of brain vasculature by temporally opening the blood-brain barrier and has potential capability to enhance delivery of therapeutic agents into brain tumors. This paper reviews the current progress of recent researches on the therapeutic effects of glioma using low-frequency ultrasound with microbubbles for drug delivery.
blood-brain barrier, low-frequency ultrasound, microbubbles, glioma, chemotherapy
10.3969/j.issn.1674-1242.2016.02.006
深圳市战略新兴产业发展专项资金基础研究项目(JCYJ20140828163634004)
皮兆柯,研究生,研究方向:生物医学工程,E-mail:pizhaoke@outlook.com
陈昕,副教授,硕士生导师,E-mail:chenxin@szu.edu.cn
R445.1
A
1674-1242(2016)02-0078-06
2016-04-24)