基于彗星实验的洛克沙胂对秀丽隐杆线虫胚胎细胞DNA损伤的研究
2016-10-27高上吉钟晓霞刘婉莹王勉之孙静李弘程孙永学
高上吉,钟晓霞,刘婉莹,王勉之,孙静,李弘程,孙永学
华南农业大学广东省兽药研制与安全评价重点实验室,广州510642
基于彗星实验的洛克沙胂对秀丽隐杆线虫胚胎细胞DNA损伤的研究
高上吉,钟晓霞,刘婉莹,王勉之,孙静,李弘程,孙永学*
华南农业大学广东省兽药研制与安全评价重点实验室,广州510642
为评价洛克沙胂的遗传毒性,采用单细胞凝胶电泳(彗星实验),研究了不同浓度的洛克沙胂对秀丽隐杆线虫胚胎细胞脱氧核醣核酸(DNA)的损伤作用。提取秀丽隐杆线虫的胚胎细胞,分别暴露于0(空白对照)、50、250、500 μg·L-1含洛克沙胂的溶液染毒1 h。用彗尾DNA百分比含量(TDNA%)、彗星尾长(TL)和Olive尾矩(OTM)作为DNA损伤的指标。实验结果表明,与空白对照组比较,处理组中彗尾DNA百分比含量、彗星尾长以及Olive尾矩显著增加(P<0.01)。随着洛克沙胂浓度的增加,彗尾DNA百分比含量、彗星尾长以及Olive尾矩逐渐增加,其相关系数r>0.99,说明在实验浓度范围内,存在极显著的浓度-效应关系。洛克沙胂对秀丽隐杆线虫胚胎细胞DNA具有损伤作用,彗星实验操作简便、快速、灵敏度高,能够反映出洛克沙胂的遗传毒性。因此,通过彗星实验建立实验室检测洛克沙胂遗传毒性的方法具有可行性。
洛克沙胂;秀丽隐杆线虫;彗星实验;DNA损伤;遗传毒性
高上吉,钟晓霞,刘婉莹,等.基于彗星实验的洛克沙胂对秀丽隐杆线虫胚胎细胞DNA损伤的研究[J].生态毒理学报,2016,11(3):167-172
Gao S J,Zhong X X,Liu W Y,et al.Comet assay study on DNA damage of embryonic cells inCaenorhabditis elegansinduced by roxarsone[J].Asian Journal of Ecotoxicology,2016,11(3):167-172(in Chinese)
洛克沙胂(roxarsone)是一种有机砷类饲料添加剂,具有明显的促进动物生长及抗菌、抗球虫的作用,在我国被广泛应用。畜禽饲喂洛克沙胂后吸收较少,大部分以原形随粪便和尿液直接排泄到体外,所吸收的很少部分也会经机体代谢后排泄到体外[1]。兽药随动物粪、尿等排泄物进入生态环境,污染环境土壤、表层水体等,并通过食物链影响植物、动物和微生物的正常生命活动,或在植物中富集,最终将影响人类的健康[2-3]。
然而,洛克沙胂潜在的遗传毒性尚不可知,特别是对秀丽隐杆线虫胚胎细胞脱氧核糖核酸(DNA)损伤的研究资料尚为空白。彗星实验(单细胞凝胶电泳,SCGE)是测定单个细胞DNA断裂的技术,近年来,因其快速、敏感、经济和灵敏度高等特点已在环境污染物的遗传毒性评价方面得到了广泛应用[4-5]。秀丽隐杆线虫因其个体结构简单、易于实验室培养、生活史短等许多优点,在环境毒理学等领域得到广泛应用[6]。本实验采用单细胞凝胶电泳技术探讨了洛克沙胂暴露胁迫对秀丽隐杆线虫体外培养胚胎细胞DNA的损伤作用,为评价洛克沙胂的遗传毒性提供试验依据。
1 材料与方法(Materials and methods)
1.1 主要仪器设备
水平电泳仪(Power Pac Basic,基本型电源,美国Bio-Rad公司);水平电泳槽(SPFT型,美国Bio-Rad公司);荧光显微镜(DM2500,德国Leica公司);冷冻离心机(Sorvall RC 12BP,美国Thermo公司);电子分析天平(感量0.00001 g,AE160,瑞士Mettler公司);电子分析天平(0.001 g,Sartorius BSA323S,德国赛多利斯科学仪器有限公司);超纯水机(Milli-Q,美国Millipole公司);可调微量移液器(Eppendorf Research型,0.5~2.5 μL,2~20 μL,10~100 μL,20~ 200 μL,100~1 000 μL,500~5 000 μL,德国Eppendorf公司)。
1.2 主要实验试剂
洛克沙胂原料药粉(含量98.5%,广州惠华动物保健品有限公司提供);正常熔点琼脂糖(NMA,美国Sigma公司);低熔点琼脂糖(LMA,美国Sigma公司);曲拉通X-100(Triton X-100,美国Sigma公司);二甲基亚砜(DMSO,美国Sigma公司);N-十二烷基肌氨酸钠(SLS,美国Sigma公司);溴化乙锭(EB,美国Sigma公司);Tris-Base(美国Genview公司);台酚蓝(美国Genview公司);其他试剂均为国产分析纯。
1.3 线虫和菌株
野生型秀丽隐杆线虫(N2)以及大肠杆菌OP50 (E.coliOP50)均由国际线虫遗传中心(Caenorhabditis Genetics Center,CGC)获得。线虫生长培养基(Nematode Growth Medium,NGM):氯化钠3 g,琼脂粉17 g,加双蒸水至1 L,高压灭菌40 min后,55℃水浴15 min加入1 mol·L-1无菌氯化钙溶液1 mL,1 mol· L-1无菌硫酸镁1 mL,1 mol·L-1无菌磷酸钾缓冲液(pH=6)25 mL,5 mg·mL-1无菌胆固醇乙醇溶液1 mL,混匀后倒入培养皿,待凝固后铺上大肠杆菌OP50菌液,于20℃恒温箱中过夜培养[7]。
1.4 细胞培养
当大部分秀丽隐杆线虫成虫到达产卵初期,用15 mL离心管收集洗涤后的成虫,以750×g离心1 min,弃去上清液,加入漂白液5 mL(新鲜5%次氯酸钠溶液1 mL、5 mol·L-1NaOH溶液0.5 mL、双蒸水3.5 mL,混匀,现用现配);漩涡振荡3~5 min至大部分成虫裂解,使成虫体内的虫卵释放;加入虫卵缓冲液(含118 mmol·L-1的NaCl、48 mmol·L-1的KCl、2 mmol·L-1的CaCl2、2 mmol·L-1的MgCl2,25 mmol· L-1的4-羟乙基哌嗪乙磺酸,过滤除菌),以1 500×g离心1 min,弃去上清液,相同条件洗涤3次后,弃去上清液,保留1 mL的液体;加入1 mL 60%蔗糖溶液,混匀,使虫卵悬浮于30%的蔗糖溶液,以1 500× g离心5 min,收集上清液中的虫卵。用虫卵缓冲液洗去蔗糖,收集虫卵并加入含1 U·mL-1几丁质酶的虫卵缓冲液(过滤除菌)1 mL,于室温下消化约45 min,镜下观察发现约90%的虫卵卵壳被溶解后,置于EP管中于4℃、以900×g离心4 min,弃去上清液,加入1 mL的L-15培养基将管底沉淀的细胞混匀后900×g离心4 min,弃去上清液,加入1 mL的L-15培养基,混匀;用5 μm滤器过滤悬浮液至无菌EP管,获取离散的秀丽隐杆线虫胚胎细胞。将EP管于4℃、以900×g离心4 min,弃去上清液,用预先配制好的加有双抗(50 U·mL-1青霉素、50 μg·mL-1链霉素)和10%胎牛血清的L-15完全培养基混匀胚胎细胞,调节细胞密度约1.5×106个·mL-1,备用。6孔板中预先放置一块用多聚左旋赖氨酸包被并灭菌的盖玻片,取100 μL细胞悬液滴加到盖玻片中央,于20℃孵育2 h后再加入2 mL完全培养基,于20℃静置4 h,至此胚胎细胞悬浮液制作完成[8-9]。
吸取50 μL虫卵悬浮液与50 μL台酚蓝染色液于离心管中混合均匀,取少许混合液(约15 μL)白血球计数板上方凹槽加入,盖上盖玻片,于100倍显微镜下观察,活细胞不染色,死细胞显蓝色,计数100~200个细胞,经检查所有处理组细胞成活率均大于90%,满足彗星实验细胞成活率至少大于75%的要求[10-11]。
1.5 胚胎细胞的染毒
将洛克沙胂溶解于双蒸水中,使质量浓度(以As计)分别达到100、500、1 000 μg·L-1,以双蒸水作空白对照。胚胎细胞成活率检测后,小心吸出液体培养基中的代谢产物和死细胞,取100 μL的液体培养基,加入配好洛克沙胂溶液100 μL,使染毒终浓度分别为50、250、500 μg·L-1洛克沙胂溶液,染毒1 h,并设置空白对照。以上操作均在黑暗条件下进行,且洛克沙胂溶液在使用前配制。
1.6 彗星实验
彗星实验参照Singh等[12]、王瑞国[13]的方法略加改进。每张玻片用荧光显微镜放大400倍拍照,每组至少随机选择50个不重叠的彗星影像进行拍照。每个处理组至少随机选择150个彗星图像采用CASP软件进行分析,以彗尾DNA百分比含量(TDNA%)、彗星尾长(TL)和Olive尾矩(OTM)[14-15]作为DNA损伤的评价指标。
1.7 统计分析
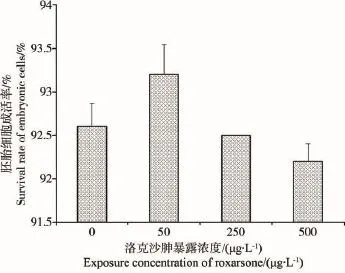
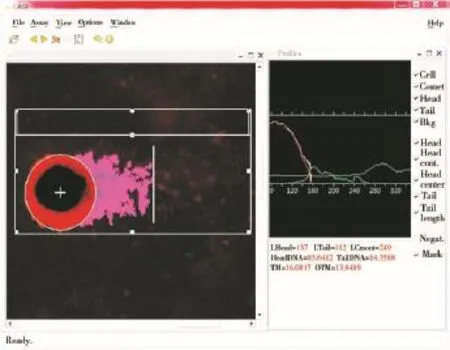
数据分析采用SPSS软件(16.0版,SPSS Inc.)。不同处理组间差异采用单因子方差分析(One-way ANOVA),不同处理组间差异显著性采用Duncan检验(0.01 2.1 洛克沙胂对秀丽隐杆线虫胚胎细胞成活率的影响 由图1可知,空白对照组和各洛克沙胂染毒组线虫胚胎细胞成活率均大于90%,说明胚胎细胞DNA损伤为洛克沙胂作用所致,而非细胞毒性。 图1 不同浓度洛克沙胂暴露1 h对秀丽隐杆线虫胚胎细胞成活率的影响 图2 不同浓度洛克沙胂暴露1 h对秀丽隐杆线虫胚胎细胞DNA损伤的彗星图像 2.2 洛克沙胂对秀丽隐杆线虫胚胎细胞DNA的损伤及彗星图像分析 空白对照组和各洛克沙胂染毒组彗星图像如图2所示。由图2可见,空白对照组的胚胎细胞DNA完整,细胞核大小均一,呈圆形荧光团,荧光强度均匀,边缘光滑,彗星细胞无拖尾现象,DNA没有明显的损伤(图2A)。50 μg·L-1洛克沙胂暴露浓度组胚胎细胞核中心呈一荧光红点,周围有一层“红晕”,说明细胞DNA开始出现解体,呈松散状态,彗星细胞开始出现拖尾现象(图2B)。250、500 μg·L-1洛克沙胂暴露浓度组胚胎细胞DNA受损比较严重,均有一个像彗星一样的拖尾,呈扫帚状,类似彗星,并且随着洛克沙胂浓度的增加,细胞核逐渐缩小,彗星尾长逐渐延长,尾部荧光强度逐渐增强,彗星头部的直径随着尾部的加长而减小(图2C、D),其损伤作用表现出显著的浓度效应。图3是经CASP彗星图象分析软件分析后,由于荧光强度的不同而显示出彗头和彗尾的清晰轮廓。 图3 CASP彗星图像分析 2.3 洛克沙胂对秀丽隐杆线虫胚胎细胞DNA损伤的影响及浓度-效应关系 不同浓度洛克沙胂对秀丽隐杆线虫胚胎细胞DNA损伤的影响效应如表1所示。各浓度组彗尾DNA百分比含量、彗星尾长以及Olive尾矩均极显著高于空白对照组(P<0.01),且各浓度组彗尾DNA百分比含量、彗星尾长以及Olive尾矩之间均有极显著性差异(P<0.01)。彗尾DNA百分比含量、彗星尾长以及Olive尾矩随着洛克沙胂暴露浓度的增加而增高,彗尾DNA百分比含量、彗星尾长以及Olive尾矩与洛克沙胂暴露浓度均具有极显著正相关关系(r= 0.991,P<0.01;r=0.993,P<0.01;r=0.991,P<0.01)。 线虫是土壤动物区系中最为丰富的无脊椎动物,它们参与土壤有机质分解、植物营养矿化和养分循环等重要生态过程,在土壤生态系统腐屑食物网中占有重要地位[16-17]。线虫因其形态特殊性、食物专一性、分离鉴定相对简单,以及对环境的各种变化包括污染胁迫效应能做出较迅速的反应等特点,可将线虫作为土壤污染效应研究的生物指标。彗星实验通过测定DNA迁移部分的光密度或迁移长度可定量测定单个细胞DNA损伤的程度[18],因其简便、快速、应用范围广、灵敏度高、所需细胞少而成为科研工作者进行环境监测、流行病学调查以及生态毒理学研究的有效工具,是检测细胞遗传毒性的常用方法。 在相同的实验条件下,受损胚胎细胞的尾部DNA百分比含量以及彗星尾长与DNA损伤程度有关,故尾部DNA百分比含量以及彗星尾长是评价DNA损伤的重要参数,而Olive尾矩指标作为复合值,较单一的尾部DNA百分比含量以及彗星尾长指标有更高的准确性。本研究采用CASP软件分析彗星图像,使实验结果更加客观准确,避免了人为误差[19];而且OTM指标分析灵敏,结合其他指标进行对比分析将进一步提高SCGE技术的准确性和灵敏度。 表1 不同浓度洛克沙胂暴露1 h对秀丽隐杆线虫胚胎细胞DNA损伤的实验结果(平均值±标准差,n=150)Table 1 Results of DNA damage of embryonic cells inCaenorhabditis elegansinduced by different concentrations of roxarsone exposure for 1 h(mean±standard deviation,n=150) 本研究发现,在不同浓度洛克沙胂暴露后,秀丽隐杆线虫胚胎细胞彗尾DNA百分比含量、彗星尾长以及Olive尾矩均极显著增加,DNA损伤均极显著增加。研究表明,洛克沙胂暴露下会使抗氧化酶活性受到抑制,导致过量活性氧自由基的产生。刘耀川等[20]发现洛克沙胂引起大鼠肝脏和肺脏抗氧化酶(超氧化物歧化酶)活性显著下降,孙永学[21]发现洛克沙胂可导致大白鼠肝匀浆和血清以及鲫鱼脑抗氧化酶(如超氧化物歧化酶、谷胱甘肽-S-转移酶、乳酸脱氢酶)活性的减弱,引起抗氧化物质(还原型谷胱甘肽)减少,而氧化产物(如丙二醛)增高。细胞在代谢过程中产生大量的自由基,可被体内抗氧化防御系统所清除同时,对活性氧自由基的清除能力减弱会导致过量活性氧自由基产生。这些自由基超过一定限度时,可分别与分子发生反应,产生氧化性损伤和生成加合物,最终导致DNA链断裂和损伤[22-23],这可能是洛克沙胂遗传毒性的机制。 洛克沙胂对核酸物质具有较强的毒性,能导致DNA链断裂。通过相关性分析得知,洛克沙胂对秀丽隐杆线虫胚胎细胞DNA的损伤效应呈很好的相关性,洛克沙胂的浓度与DNA损伤存在极显著的浓度-效应关系,其相关系数>0.99,因此,秀丽隐杆线虫胚胎细胞DNA损伤可作为洛克沙胂遗传毒性的生物学指标。 本研究结果显示,洛克沙胂的浓度与DNA损伤存在极显著的浓度-效应关系,洛克沙胂可导致秀丽隐杆线虫胚胎细胞DNA明显的断裂和迁移,诱导了秀丽隐杆线虫的遗传损伤,秀丽隐杆线虫胚胎细胞DNA损伤可作为洛克沙胂遗传毒性的生物学指标。 目前关于洛克沙胂的环境影响的研究仅仅是初步的。为评价和控制洛克沙胂对环境的影响,还有很多工作要做。彗星实验操作简便、快速、灵敏度高,能够反映出洛克沙胂的遗传毒性。因此,通过彗星实验建立实验室检测洛克沙胂遗传毒性方法具有可行性。洛克沙胂导致秀丽隐杆线虫胚胎细胞DNA损伤的损伤机制还有待进一步研究。 (References): [1] Rutherford D W,Bednar A J,Garbarino J R,et al.Environmental fate of roxarsone in poultry litter.PartⅡ. Mobility of arsenic in soil amended with poultry litter[J]. Environmental Science&Technology,2003,37(8):1515-1520 [2] 马驿,陈杖榴.恩诺沙星对土壤微生物群落代谢功能多样性的影响[J].生态毒理学报,2010,5(3):446-452 Ma Y,Chen Z L.Effects of enrofloxacin on the functional diversity of soil microbial communities[J].Asian Journal of Ecotoxicology,2010,5(3):446-452(in Chinese) [3] 王连生.环境有机化学[M].北京:化学工业出版社, 2004:228-244 [4] Singh N P,McCoy T,Tice R R,et al.A simple technique for the quantitation of low levels of DNA damage in individual cells[J].Experimental Cell Research,1988,175: 184-191 [5] United States Environmental Protection Agency(US EPA).Chemical Assessment Summary.Pentachlorophenol (CASRN 87-86-5)[R].Washington DC:National Center for Environmental Assessment,2001 [6] Leung M C,Williams P L,Benedetto A,et al.Caenorhabditis elegans:An emerging model in biomedical and environmental toxicology[J].Toxicological Sciences,2008, 106:5-28 [7] Brenner S.The genetics ofCaenorhabditis elegans[J]. Genetics,1974,77(1):71-94 [8] Shaham S.Methods in Cell Biology[M]//TheC.elegans Research Community.WormBook.2006.http://www. wormbook.org [9] 黄鸿山,胡玉,卢伟伟,等.二氯苯醌对秀丽隐杆线虫胚胎细胞DNA的损伤作用[J].环境与健康杂志,2014, 31(6):471-473 Huang H S,Hu Y,Lu W W,et al.Effects of 2,6-dichloro-1,4-benzoquinone on DNA in embryonic cells ofCaenorhabditis elegans[J].Journal of Environmental Health, 2014,31(6):471-473(in Chinese) [10] Strober W.Trypan blue exclusion test of cell viability[J]. Current Protocols in Immunology,2001,A3:18-23 [11] Miranda D D C,Arcari D P,Ladeira M S P,et al.Analysis of DNA damage induced by aflatoxin B-1 in Dunkin-Hartley guinea pigs[J].Mycopathologia,2007,163(5): 275-280 [12] Singh N P,McCoy M T,Tice R R,et al.A simple technique for quantitation of low levels of DNA damage in individual cells[J].Experimental Cell Research,1988, 175(1):184-191 [13] 王瑞国.黄曲霉毒素B1致雏鸭肝细胞DNA损伤的研究[D].北京:中国农业科学院,2009:25-40 Wang R G.Study on the DNA damage induced by Afla-toxin B1in duckling hapetic cells[D].Beijing:Chinese A-cademy of Agricultural Sciences,2009:25-40(in Chinese) [14] Olive P L,Wlodek D,Durand R E,et al.Factors influencing DNA migration from individual cells subjected to gel electrophoresis[J].Experimental Cell Research,1992, 198:259-267 [15] Ashby J,Tinwell H,Lefevre P A,et al.The single-cell gel electrophoresis assay for induced DNA damage(comet assay):Measurement of tail length and moment[J].Mutagenesis,1995,10:85-90 [16] Ingham R E,Trofymow J A,Ingham E R,et al.Interactions of bacteria,fungi,and their nematode grazers: Effects of nutrient cycling and plant growth[J].Ecological Monographs,1985,55:119-140 [17] Wardle D A.Impacts of disturbance on detritus food webs in agroecosystems of contrasting tillage and weed management practice[J].Ecological Research,1995,26:105-185 [18] 王瑞国,苏晓鸥.改良彗星实验检测黄曲霉毒素B1致雏鸭DNA损伤[J].中国畜牧兽医,2009,36(9):45-50 [19] Konca K,Lankoff A,Banasik A,et al.A cross-platform public domain PC image analysis program for the comet assay[J].Mutation Research,2003,534:15-20 [20] 刘耀川,宋淑英,张泽辉,等.洛克沙胂对大鼠SOD、GSH-Px、LDH、MDA等生化指标的影响[J].黑龙江畜牧兽医,2015,6:238-240 [21] 孙永学.有机胂添加剂的生态毒性及毒性机理研究[D].广州:华南农业大学,2003:37-63 Sun Y X.Study on ecological toxicity and mechanism of organoarsenical additives[D].Guangzhou:South China Agricultural University,2009:37-63(in Chinese) [22] Walker C H.Avian forms of cytochrome P450[J].Environmental Health Perspectives,1998,106(52):613-620 [23] Goldstone J V,Goldstone H M.Cytochrome P450 1 genes in early deuterostomes(tunicates and sea urchins) and vertebrates(chicken and frog):Origin and diversification of the CYP1 gene family[J].Molecular Biology and Evolution,2007,24(12):2619-2631◆ Comet Assay Study on DNA Damage of Embryonic Cells in Caenorhabditis elegans Induced by Roxarsone Gao Shangji,Zhong Xiaoxia,Liu Wanying,Wang Mianzhi,Sun Jing,Li Hongcheng,Sun Yongxue* Guangdong Provincial Key Laboratory of Veterinary Pharmaceutics Development and Safety Evaluation,South China Agricultural University,Guangzhou 510642,China 30 December 2015 accepted 14 March 2016 To evaluate the genotoxicity of roxarsone,the present study investigated the damage effects of different concentrations of roxarsone on deoxyribonucleic acid(DNA)of embryonic cells inCaenorhabditis elegansby using the single cell gel-electrophoresis(SCGE).The extracted embryonic cells ofCaenorhabditis eleganswere exposed to 0(blank control),50,250,500 μg·L-1roxarsone for 1 h,respectively.The percentage of comet tail DNA(TDNA%),the comet tail length(TL)and Olive tail moment(OTM)were used as the indicators of DNA damage.The results showed that,TDNA percentage,TL and OTM in all treatment groups increased significantly compared with these in the control group(P<0.01).TDNA percentage,TL and OTM increased gradually according to the increased concentrations of roxarsone.The correlation coefficient ofrgreater than 0.99,which indicated that the con-centration-effect relationship was observed in the experimental concentration range.Roxarsone had damage effect on DNA of embryonic cells inCaenorhabditis elegans.Comet assay was simple,fast,and highly-sensitive to reflect the genotoxicity of roxarsone.Thus,as a laboratory based method,it is practical to detect the genotoxicity of roxarsone by using comet assay. roxarsone;Caenorhabditis elegans;comet assay;DNA damage;genotoxicity 2015-12-30 录用日期:2016-03-14 1673-5897(2016)3-167-06 X171.5 A 10.7524/AJE.1673-5897.20151230001 简介:孙永学(1969—),男,博士,教授,研究方向为兽药安全性评价、生态毒理学。 国家自然科学基金项目(31172368) 高上吉(1989-),男,硕士研究生,研究方向为兽医药理学与毒理学,E-mail:710648618@qq.com *通讯作者(Corresponding author),E-mail:sunyx@scau.edu.cn2 结果与分析(Results and analysis)

3 讨论(Discussion)