三种益生菌菌株与PK-15细胞共培养抗TGEV作用
2016-10-26刘文娜王辉辉东北农业大学动物医学学院哈尔滨50030鄂伦春自治旗大杨树畜牧综合服务站内蒙古呼伦贝尔65456
魏 萍,刘文娜,王辉辉(.东北农业大学动物医学学院,哈尔滨50030;.鄂伦春自治旗大杨树畜牧综合服务站,内蒙古呼伦贝尔65456)
三种益生菌菌株与PK-15细胞共培养抗TGEV作用
魏萍1,刘文娜1,王辉辉2
(1.东北农业大学动物医学学院,哈尔滨150030;2.鄂伦春自治旗大杨树畜牧综合服务站,内蒙古呼伦贝尔165456)
为模拟猪肠道内环境,探究益生菌与细胞共培养抗TGEV作用,利用Transwell小室在体外建立益生菌与PK-15细胞共培养,通过台盼蓝染色,检测PK-15细胞存活率。结果表明,当益生菌菌体浓度102cfu·mL-1≤c≤1012cfu·mL-1,共培养时间为1和3 h;当共培养时间1 h≤t≤24 h,益生菌菌体浓度为102、104、106和108cfu·mL-1时,PK-15细胞存活率较高,益生菌与PK-15细胞共培养成立。采用MTT比色法检测对TGEV抑制率,结果显示,益生菌菌体浓度约为102~108cfu·mL-1,共培养时间为1~24 h时对TGEV抑制率均达90%以上。此外,益生菌与PK-15细胞共培养的TGEV平均滴度较低。
益生菌;PK-15细胞;共培养;抗TGEV
网络出版时间2016-6-17 15:21:52[URL]http://www.cnki.net/kcms/detail/23.1391.S.20160617.1521.010.htm l
魏萍,刘文娜,王辉辉.三种益生菌菌株与PK-15细胞共培养抗TGEV作用[J].东北农业大学学报,2016,47(6):60-67.
Wei Ping,Liu Wenna,Wang Huihui.Anti-TGEV effect of three probiotics strains and PK-15 cells co-culture[J].Journal of Northeast Agricultural University,2016,47(6):60-67.(in Chinese with English abstract)
猪传染性胃肠炎是危害严重的病毒性腹泻病,主要临床症状为呕吐、严重腹泻和脱水[1]。近年来,常伴有PEDV、RV等混合感染,猪传染性胃肠炎流行趋势严峻[2]。Maragkoudakis等利用动物和人肠道及非肿瘤来源巨噬细胞系模型检测乳酸菌抗病毒活性,发现乳酸菌可保护完整单层细胞而不被RV或TGEV破坏,鼠李糖乳杆菌、干酪乳杆菌抗RV和TGEV,对细胞有最佳保护效果[3]。Kumar等研究猪源肠道益生菌(植物乳杆菌和唾液乳杆菌)抗冠状病毒(TGEV)活性,发现体外ST细胞上益生菌培养上清即代谢产物抑制TGEV生长,作用72 h未引起细胞病变效应,表明益生菌培养上清显著抑制TGEV吸附ST细胞[4]。高长春等根据体外ST细胞感染TGEV模型研究益生菌抗TGEV作用,结果发现三株益生菌均能抑制TGEV感染ST细胞,但在菌株和作用方式存在差异[5]。前人研究仅单一利用益生菌菌体、某种成分或代谢产物与细胞短暂作用,无法完全反映益生菌对细胞抗病毒作用影响。另外,相对于细菌间共培养[6]、细胞间共培养[7-8],尤其是益生菌与细胞共培养鲜见报道。本试验尝试将抗病毒和共培养有机融合,诣在模拟猪肠道内环境,通过台盼蓝染色试验初步摸索益生菌与PK-15细胞共培养成立条件,通过MTT比色法和CPE探究益生菌与PK-15细胞共培养抗TGEV作用效果,为应用益生菌抗腹泻病毒提供理论依据。
1 材料与方法
1.1材料
1.1.1菌株、细胞和病毒
猪源枯草芽孢杆菌、屎肠球菌和食淀粉乳杆菌均为东北农业大学动物医学学院预防兽医学传染病实验室保存;PK-15细胞购自上海拜力生物科技有限公司;猪传染性胃肠炎病毒(TGEV)TO163株由中国农业科学院哈尔滨兽医研究所惠赠。
1.1.2试验试剂
DMEM/F-12 1ϑ1购自赛默飞世尔生物化学制品(北京)有限公司;FBS购自浙江天杭生物科技有限公司;台盼蓝、MTT、DMSO均购自Sigma公司;Transwell、96孔细胞培养板和六孔细胞培养板均购自哈尔滨赛托(赛信)生物科技有限公司。
1.2方法
1.2.1益生菌与PK-15细胞共培养建立
当六孔细胞培养板中PK-15细胞铺满单层约为2.5×106cells·mL-1时,弃液,PBS液洗涤3次后将0.4μm Transwell小室放入培养板孔中,每孔即分为上室和下室,小室内称上室,培养板孔内称下室,在下室中添加新的细胞培养基,以刚接触Transwell小室基底膜为宜,约2mL,上室加用细胞培养基稀释的益生菌菌体,其终浓度分别为102、104、106、108、1010和1012cfu·mL-1,各处理组均封盖于37℃,5%CO2无菌细胞培养箱中分别共培养1、3、6、12、18和24 h,移除Transwell小室,收集共培养上悬液,PBS液洗涤下室3次,加1m L 0.25%胰酶消化液作用5min,将贴壁细胞从培养板上消化下来,再加1mL细胞培养基终止消化,连同收集的共培养上悬液一并用移液器转移至Ep管中,1 000 r·min-1离心5min,弃上清液,加2mL PBS液并将PK-15细胞沉淀吹散成均匀单细胞混悬液,另加等体积0.4%台盼蓝染色液,混合均匀,染色2min,吸取少许液体于盖有盖玻片的血球计数板细胞计数池内,光学显微镜下观察并计录蓝染和未蓝染细胞数。
1.2.2益生菌与PK-15细胞共培养抗TGEV效果测定
1.2.2.1益生菌与PK-15细胞共培养对TGEV抑制率影响
当六孔细胞培养板中的PK-15细胞铺满单层约为2.5×106cells·mL-1时,弃液,PBS液洗涤3次后,加2mL细胞培养基,将Transwell小室放入培养板孔中,上室加用细胞培养基稀释益生菌菌体,其终浓度分别为102、104、106、108、1010和1012cfu·mL-1,封盖于37℃,5%CO2无菌细胞培养箱中共培养3 h,上室加细胞培养基稀释的终浓度为108cfu·mL-1益生菌菌体,封盖于37℃,5% CO2无菌细胞培养箱中分别共培养1、3、6、12、18和24 h后,移除Transwell小室,PBS液洗涤下室3次,加100μL 100TCID50TGEV与PK-15细胞作用,于37℃,5%CO2无菌细胞培养箱中作用1.5 h,PBS液洗涤3次,加1 m L维持液于37℃,5%CO2无菌细胞培养箱中继续培养,同时设正常细胞对照组和病毒对照组,每组处理三孔重复,改良MTT比色法测定益生菌与PK-15细胞共培养对TGEV抑制率,即当病毒对照组CPE达75%时,PBS液洗涤3次,加25μLMTT溶液(5mg·mL-1)和100μL维持液,37℃避光孵育4 h,弃液,每孔加100μL二甲基亚砜(DMSO),避光震荡10min,酶标仪测定490 nm波长处光吸收度即OD490,根据公式计算:病毒抑制率(%)=[(益生菌与细胞共培养处理组平均OD值-病毒对照组平均OD值)/(正常细胞对照组平均OD值-病毒对照组平均OD值)]× 100%。
1.2.2.2益生菌与PK-15细胞共培养对TGEV滴度影响
当六孔细胞培养板中PK-15细胞铺满单层约为2.5×106cells·mL-1时,弃液,PBS液洗涤3次后,加2mL细胞培养基,将Transwell小室放入培养板孔中,向上室加用细胞培养基稀释的终浓度为108cfu·mL-1益生菌,共培养12 h,PBS液洗涤3次后接入TGEV,于37℃,5%CO2无菌细胞培养箱中孵育1.5 h,PBS液洗涤3次,弃液,细胞维持液继续培养,分别于6、12、24、48和72 h置-20℃反复冻融3次,4 000 r·min-1离心10 min,收集各组上清即为病毒液,0.22μm滤器过滤并分装,于-80℃保存待测。
当96孔细胞培养板中PK-15细胞铺满单层约为105cells·mL-1时,将待测病毒作10个梯度连续10倍倍比稀释,每个稀释度病毒以100μL·孔-1量接种到96孔细胞微量培养板每一纵列,同时设正常细胞对照,于37℃,5%CO2无菌细胞培养箱中培养,每天显微镜观察,记录细胞产生CPE孔数,直至最低稀释度孔内细胞无病变,且对照组细胞开始衰老为止。
1.3数据处理
试验数据经Microsoft Excel 2007初步整理后,结果用平均值±标准差(Mean±SD)表示,运用SPSS 17.0软件,作单因素方差ANOVA和多重比较分析,P>0.05时,表示差异不显著;P<0.05时,表示差异显著。
2 结果与分析
2.1益生菌与PK-15细胞共培养建立
应用台盼蓝染色法计数益生菌与PK-15细胞共培养体系中蓝染及未蓝染细胞数,根据公式:细胞存活率(%)=未蓝染细胞数/(蓝染细胞数+未蓝染细胞数)×100%,计算不同益生菌菌体浓度与不同共培养时间组合处理PK-15细胞存活率(%),结果见表1~4。
由表1可知,同一共培养时间条件下,益生菌菌体浓度102、104、106、108cfu·mL-14组间PK-15细胞存活率差异不显著,但均显著高于益生菌菌体浓度为1010和1012cfu·mL-1的PK-15细胞存活率。

表1 同一共培养时间不同益生菌菌体浓度PK-15细胞存活率比较(M ean±SD)Table1 Comparison of PK-15 cells survival rate of the same time of co-culture and different concentration of probiotics (%)
当益生菌菌体浓度102cfu·mL-1≤c≤1012cfu·mL-1时,对不同共培养时间PK-15细胞存活率比较组间差异性,结果见表2。
由表2可知,当益生菌菌体浓度102cfu·mL-1≤c≤1012cfu·mL-1时,共培养1和3 h两组间PK-15细胞存活率差异不显著,但均显著高于其余各组。
综上所述,当益生菌菌体浓度102cfu·mL-1≤c≤1012cfu·mL-1时,共培养时间为1或3 h,益生菌与PK-15细胞共培养成立。

表2 不同共培养时间PK-15细胞存活率组间比较(Mean±SD)Table2 Comparison of PK-15 cells survival rate of different time of co-culture
由表3可知,当益生菌菌体浓度≤108cfu·mL-1时,同一益生菌菌体浓度条件下,不同共培养时间各组间PK-15细胞存活率差异不显著;当益生菌菌体浓度108cfu·mL-1 当共培养时间1 h≤t≤24 h时,对不同益生菌菌体浓度PK-15细胞存活率作组间差异性比较,结果见表4。 由4可知,当共培养时间1 h≤t≤24 h时,益生菌菌体浓度为102、106和108cfu·mL-1三组间PK-15细胞存活率差异不显著,但均显著高于其余各益生菌菌体浓度组PK-15细胞存活率。 综上所述,当共培养时间1 h≤t≤24 h时,益生菌菌体浓度为102、106和108cfu·mL-1,益生菌与PK-15细胞共培养成立。 表3 同一益生菌菌体浓度不同共培养时间PK-15细胞存活率比较(M ean±SD)Table3 Comparison of PK-15 cells survival rate of the same concentration of probiotics and different time of co-culture(%) 表4 不同益生菌菌体浓度PK-15细胞存活率组间比较(M ean±SD)Table 4 Comparison of PK-15 cells survival rate of different concentration of probiotics 2.2益生菌与PK-15细胞共培养对TGEV抑制率测定 不同浓度益生菌菌体与PK-15细胞共培养3 h后,加TGEV作用1.5 h,MTT比色法测OD490值,根据公式计算TGEV抑制率,并绘制TGEV抑制率随益生菌菌体浓度变化曲线,结果见图1。 图1 不同浓度益生菌与PK-15细胞共培养对TGEV抑制率变化曲线Fig.1 TGEV inhibition rate curve of different concentrations of probiotics and PK-15 cells co-culture 由图1可知,TGEV抑制率随益生菌菌体浓度增加先升后降。不同益生菌菌体与PK-15细胞共培养,对TGEV抑制率存在差异,枯草芽孢杆菌与PK-15细胞共培养体系中,当菌体浓度为1010cfu·mL-1时,对TGEV抑制率达到峰值为87.4%;屎肠球菌与PK-15细胞共培养体系中,当菌体浓度为106cfu·mL-1时,对TGEV抑制率达到峰值为80.95%;食淀粉乳杆菌与PK-15细胞共培养体系中,当菌体浓度为108cfu·mL-1时,对TGEV抑制率达到峰值为80.39%。综合比较每组对TGEV平均抑制率为:枯草芽孢杆菌组(53.97%)>屎肠球菌组(52.32%)>食淀粉乳杆菌组(41.86%)。 综上所述,当益生菌菌体浓度约为108cfu·mL-1时,对TGEV抑制率较高,因此108cfu·mL-1为益生菌最佳浓度。 浓度为108cfu·mL-1益生菌菌体与PK-15细胞共培养不同时间,加TGEV作用1.5 h,MTT比色法,测OD490,根据公式计算对TGEV抑制率,并绘制TGEV抑制率随共培养时间变化曲线,结果见图2。 图2 益生菌与PK-15细胞共培养不同时间对TGEV抑制率变化曲线Fig.2 TGEV inhibition rate curve of probiotics and PK-15 cells different time of co-culture 由图2可知,TGEV抑制率随共培养时间呈先升后降趋势。益生菌菌体与PK-15细胞共培养不同时间,对TGEV抑制率存在差异,枯草芽孢杆菌与PK-15细胞共培养体系中,当共培养时间延长至12 h时,对TGEV抑制率达到峰值为86.49%;屎肠球菌与PK-15细胞共培养体系中,当共培养时间延长至18 h时,对TGEV抑制率达到峰值为93%;食淀粉乳杆菌与PK-15细胞共培养体系中,当共培养时间延长至12 h时,对TGEV抑制率达到峰值为68.81%。综合比较,每组对TGEV平均抑制率为:枯草芽孢杆菌组(50.21%)>屎肠球菌组(48.36%)>食淀粉乳杆菌组(40.92%)。 综上所述,当共培养时间延长至12 h时,对TGEV抑制率较高,因此12 h为最佳共培养时间。 2.3益生菌与PK-15细胞共培养对TGEV滴度测定 浓度为108cfu·m L-1益生菌与PK-15细胞共培养12 h后,接种TGEV作用1.5 h,洗涤后加细胞维持液,不同时间点收集病毒液,按Reed-Muench两氏法计算TGEV滴度。以收集TGEV时间为横坐标,半数组织培养感染剂量负对数为纵坐标,绘制TGEV滴度变化曲线,结果见图3。 图3 益生菌与PK-15细胞共培养TGEV滴度变化曲线Fig.3 TGEV titer curve of probiotics and PK-15 cells co-culture 由图3可知,TGEV半数组织培养感染剂量负对数随收集病毒液时间呈先升后降趋势。益生菌与PK-15细胞共培养,不同时间点收集TGEV,其滴度差异显著。枯草芽孢杆菌与PK-15细胞共培养体系中,48 h收集TGEV,其半数组织培养感染剂量负对数达到峰值为3.87;屎肠球菌与PK-15细胞共培养体系中,24 h收集TGEV,其半数组织培养感染剂量负对数达到峰值为5.16;食淀粉乳杆菌与PK-15细胞共培养体系中,48 h收集TGEV,其半数组织培养感染剂量负对数达到峰值为4.55。综合比较,每组TGEV平均滴度为:枯草芽孢杆菌组(102.70)<屎肠球菌组(102.85)<食淀粉乳杆菌组(102.92)<正常病毒对照组(103.46)。 综上所述,益生菌与PK-15细胞共培养能降低TGEV滴度,降低程度为:枯草芽孢杆菌组>屎肠球菌组>食淀粉乳杆菌组。 3.1益生菌与PK-15细胞共培养建立 杜维霞等利用Caco-2肠上皮细胞单层屏障模型,研究四种肠道微生物对肠道屏障影响,检测细菌与细胞共培养体系中紧密连接蛋白表达和分布,结果致病菌组(大肠埃希菌、肺炎克雷伯菌)紧密连接蛋白表达明显减少;益生菌组表达与空白对照组相比无明显变化,说明致病菌降低紧密连接蛋白表达、改变蛋白分布,最终导致肠道屏障功能受损;益生菌对肠道屏障无损伤作用[9]。Georgia等利用体外Transwell共培养模型,研究细菌与鼠源肠上皮细胞、树突状细胞共培养相互作用,发现益生菌能显著增强肠上皮细胞活性,证实细胞趋化因子作用,而金黄色葡萄球菌作用效果不明显;益生菌可促进树突状细胞分化、成熟[10]。细菌穿越物理屏障诱导pro-inflammatory信号能力与其致病性和共生状态无关,依赖特殊表面“物质”即脂多糖。为模拟肠道环境,研究益生菌与细胞相互作用,尤其是益生菌对细胞有益作用,建立益生菌与细胞共培养模型十分必要。本试验以PK-15细胞为平台,建立益生菌与PK-15细胞共培养模型,探索共培养条件。结果发现当益生菌菌体浓度102cfu·mL-1≤c≤1012cfu·mL-1,共培养时间为1或3 h;当共培养时间1 h≤t≤24 h,益生菌菌体浓度为102、106和108cfu·mL-1时,PK-15细胞存活率较高,表明益生菌与PK-15细胞共培养成立。 杜维霞等研究侧重于与致病菌相比,益生菌对肠道屏障无损伤作用[9]。Georgia等研究侧重于机理方面[10]。而本试验侧重于探索益生菌与PK-15细胞共培养条件,为益生菌与细胞共培养抗病毒相关研究提供理论基础。细胞平台,应选用更加贴近肠道内环境IPEC-J2细胞,体外建立益生菌与IPEC-J2细胞共培养模型,探索益生菌与IPEC-J2细胞共培养条件。目前难以建立益生菌与肠黏膜细胞共培养模型原因:①益生菌是兼性厌氧甚至绝对厌氧,肠黏膜细胞为5%CO2,无体外共培养试验装置;②益生菌适宜培养基是MRS液体培养基,肠黏膜细胞为DMEM/F-12 1:1+10%FBS,现有培养基无法同时满足体外共培养需求;③益生菌对营养物质消耗大于肠黏膜细胞,共培养使肠黏膜细胞处于乏养状态;④益生菌代谢速度远大于肠黏膜细胞,代谢产物积累,形成过酸环境,容易损伤肠黏膜细胞;⑤肠道环境复杂,存在多种益生菌,代谢产物丰富,相互作用,血液循环能给肠黏膜细胞提供足够营养物质和稳定pH环境,肠黏膜本身分泌黏液对肠黏膜细胞形成保护层等。建议延长共培养时间为2和3 d甚至更长时间,增加更换细胞培养基频次或使用带有进出孔可使细胞培养基流动的装置。 3.2益生菌与PK-15细胞共培养抗TGEV效果评价 研究多集中在单一利用益生菌菌体(如活菌体、灭活菌体、破碎菌体等)、某些成分(如S-层蛋白)或代谢产物(如所有培养上清、提取单独胞外多糖等)与细胞短暂作用评价益生菌对细胞抗病毒作用效果。由于作用时间短且单独某一时间点,益生菌不同培养时间产生抗病毒物质不同,无法完全反映益生菌对细胞抗病毒作用影响。鉴于PK-15细胞是TGEV易感细胞,本试验在益生菌与PK-15细胞共培养基础上,模拟猪肠道内益生菌与细胞相互作用动态变化过程,进行抗TGEV效果评价,主要针对两方面检测:①通过测定PK-15细胞活性即OD490间接计算共培养对TGEV抑制率;②测定TGEV滴度即TCID50直接反映共培养对TGEV作用。结果表明,益生菌与PK-15细胞共培养具有抗TGEV作用,表现为对TGEV抑制率升高,降低TGEV滴度,不同益生菌菌株与PK-15细胞共培养具有不同抗TGEV作用效果,表现为枯草芽孢杆菌组>屎肠球菌组>食淀粉乳杆菌组,说明益生菌与PK-15细胞共培养抗TGEV作用具有菌株差异性,推测可能与益生菌菌株自身结构有直接关系。需改进之处是增设动物性试验,供试仔猪可全面评价益生菌与细胞共培养抗TGEV作用效果。目前,益生菌抗TGEV机制尚不清楚,后续将深入研究。 本试验通过Transwell小室,利用台盼蓝染色检测PK-15细胞存活率,初步摸索共培养条件,即当益生菌菌体浓度102cfu·mL-1≤c≤1012cfu·mL-1,共培养时间为1和3 h;当共培养时间为1 h≤t≤24 h,益生菌菌体浓度为102、104、106和108cfu·mL-1时,益生菌与PK-15细胞共培养成立。在此基础上,检测益生菌与PK-15细胞共培养对TGEV抑制率和滴度变化,评价益生菌与PK-15细胞共培养抗TGEV作用效果,结果发现益生菌与PK-15细胞共培养对TGEV有抑制作用,能降低TGEV滴度,组抗TGEV作用效果枯草芽孢杆菌>屎肠球菌组>食淀粉乳杆菌组。 [1]殷震,刘景华.动物病毒学[M].2版.北京:科学出版社,1997:681-688. [2]Zhang Q,Hu R,Tang X,et al.Occurrence and investigation of en⁃teric viral infections in pigswith diarrhea in China[J].Archives of virology,2013,158(8):1631-1636. [3]Maragkoudakis P A,Chingwaru W,Gradisnik L,et al.Lacticacid bacteria efficiently protect human and animal intestinal epithelial and immune cells from enteric virus infection[J].International journal of food microbiology.2010,141(1):S91-S97. [4]Kumar R,Seo B J,Mun M R,et al.Putative probiotic Lactobacillusspp.from porcine gastrointestinal tract inhibit ransmissible gastro⁃enteritis coronavirus and enteric bacterial pathogens[J].Tropical Animal Health and Production.2010,42(8):1855-1860. [5]高长春,邓玲玲,尹鑫,等.猪源益生菌体外抗猪传染性胃肠炎病毒作用的研究[J].中国预防兽医学报,2013,35(9):715-719. [6]黄兵,刘宁,黄英,等.放线菌与枯草芽孢杆菌的共培养及其对活性次生代谢产物的影响[J].生物工程学报,2009,25(6):932-940. [7]陈国忠,姜海行,陆正峰,等.骨髓间充质干细胞共培养对肝星状细胞增殖、凋亡和Roh A表达的调控[J].世界华人消化杂志,2010,18(16):1643-1649. [8]徐磊.基于共培养体系考察间充质干细胞调控关节软骨表型的研究[D].上海:华东理工大学,2012. [9]杜维霞,沈名扬,艾青,等.Zonulin介导的肠道微生物对肠上皮细胞屏障功能的调节[J].中国细胞生物学学报,2014,36(10): 1362-1367. [10]GeorgiaZ,Effie T,Joelle D,et al.Differential crosstalk between epi⁃thelial cells,dendritic cells and bacteria in a co-culture model[J]. International Journal of Food Microbiology,2009,131:40-51. Anti-TGEV effect of three probiotics strains and PK-15 cells co Agricultural University,Harbin 150030,China;2.Animal Husbandry Comprehensive Service Station of Dayangshu,Oroqen Autonomous Banner,Hulunbeir Inner Mongolia 165456,China) In order to simulate the porcine intestinal environment and explore the anti-TGEV effect of probiotics and cells co-culture,this experiment used Transwell to establish probiotics and PK-15 cells coculture in vitro.In addition,this test took advantage of trypan blue staining to detect the PK-15 cells survival rates.The results showed that the PK-15 cells survival rates were higher under the conditions of 102cfu·mL-1≤the concentration of probiotics≤1012cfu·mL-1,1,3 h of co-culture time or 1 h≤the time of co-culture≤24 h, 102,104,106and 108cfu·mL-1of probiotics concentration.On this basis,this experiment made use of MTT colorimetric assay to detect the TGEV inhibition rates.The results showed that the TGEV inhibition rates were more than 90%when the concentration of probiotics was about 102-108cfu·mL-1and the time of coculture was about 1-24 h.Furthermore,the TGEV average titer of probiotics and PK-15 cells co-culture was lower. probiotics;PK-15 cells;co-culture;anti-TGEV S858.28 A 1005-9369(2016)06-0060-08 2016-04-14 黑龙江省教育厅重点项目(12521z001);哈尔滨市科技局项目(2014RFXGJ096) 魏萍(1961-),男,教授,博士,研究方向为兽医传染病学与流行病学。E-mail:weiiping@163.com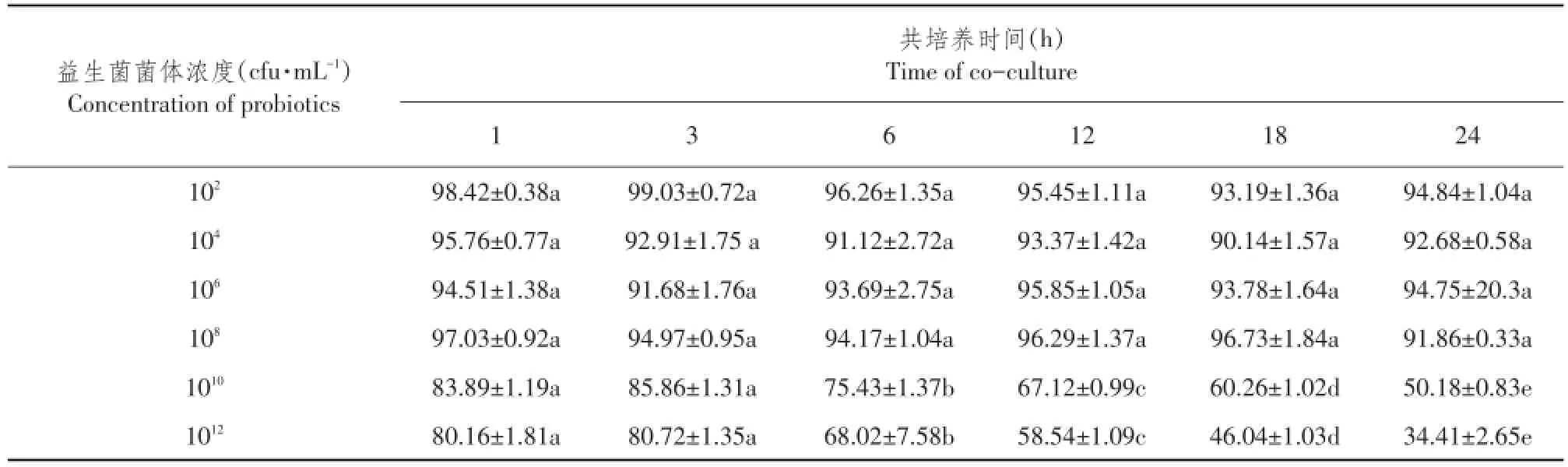

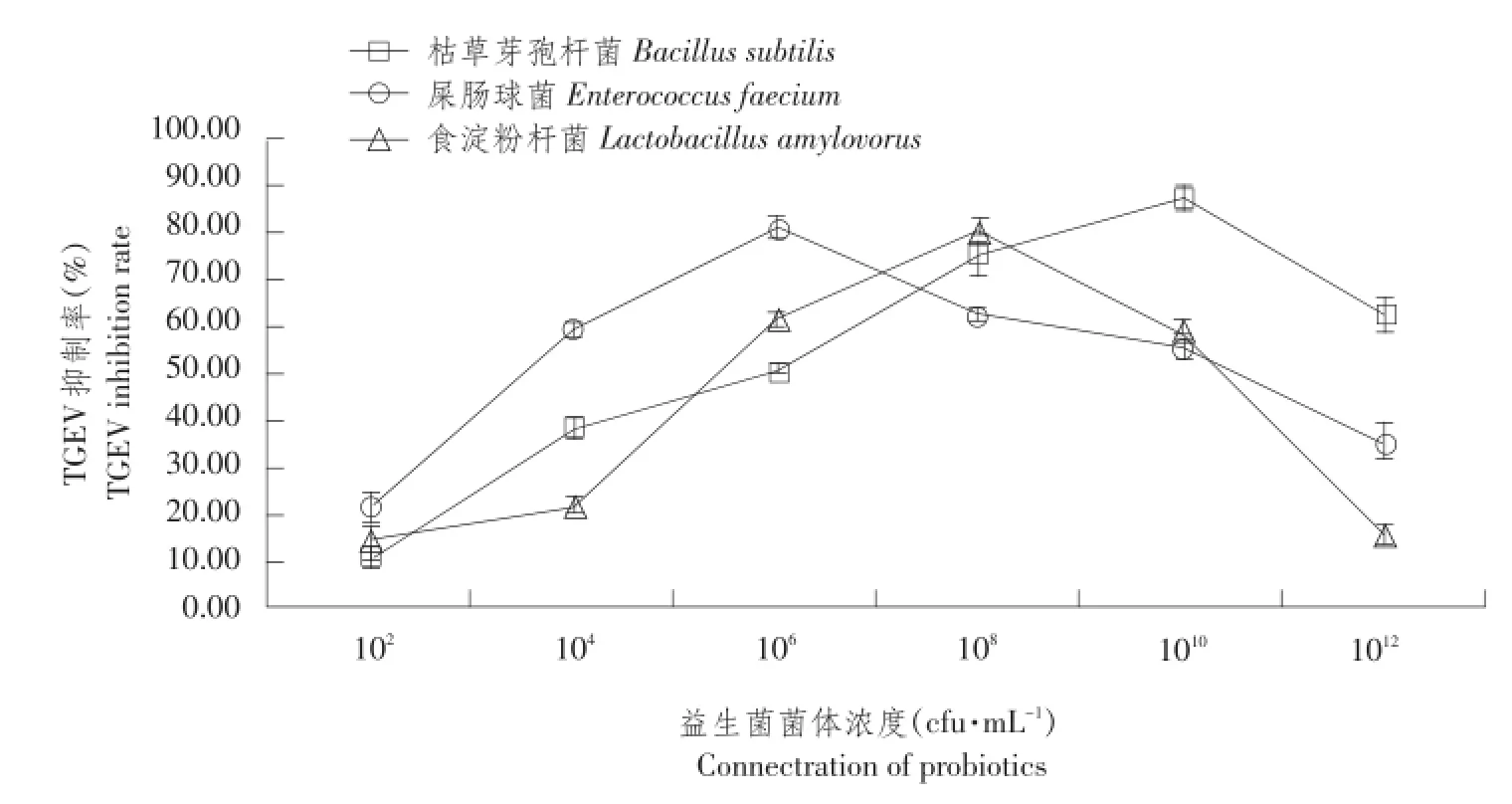
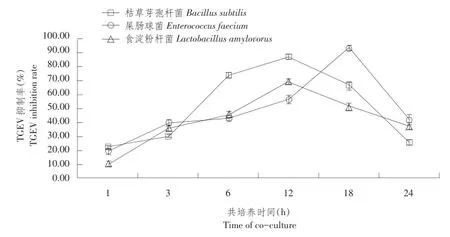
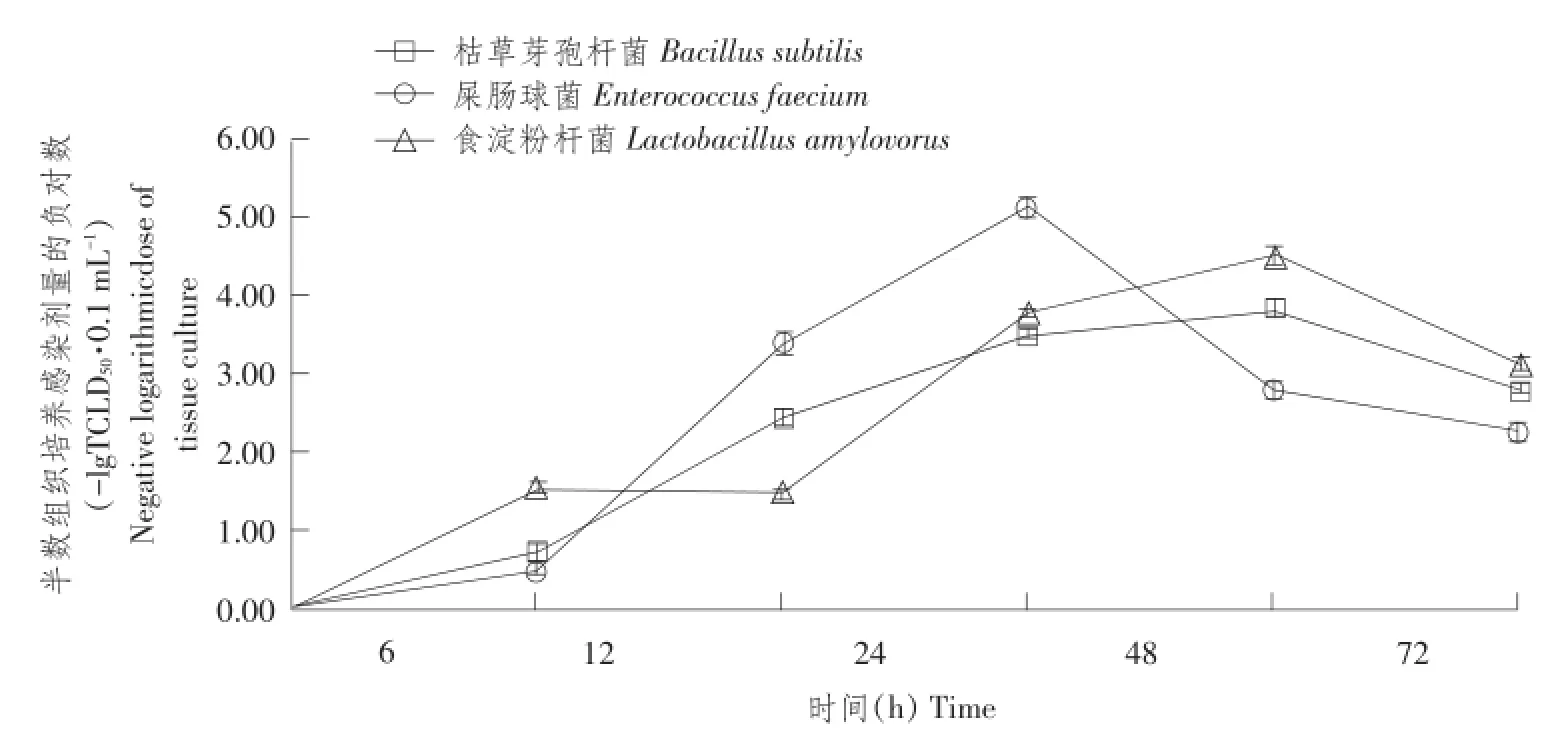
3 讨论
4 结论
culture/WEI Ping1,LIU Wenna1,WANG Huihui2
(1.School of Veterinary Medicines,Northeast
