亚热带典型森林凋落物及细根的生物量和碳储量研究
2016-10-26吴春生刘苑秋魏晓华李小东刘亮英郭晓敏欧阳勋志莫其锋
吴春生 刘苑秋 魏晓华 李小东 刘亮英 郭晓敏 欧阳勋志 莫其锋
(1. 江西农业大学林学院,江西 南昌 330045;2. 加拿大不列颠哥伦比亚大学 (Okanagan)地球与环境科学系,温哥华;3. 中国科学院华南植物园,广东 广州 510520)
亚热带典型森林凋落物及细根的生物量和碳储量研究
吴春生1刘苑秋1魏晓华2李小东1刘亮英1郭晓敏1欧阳勋志1莫其锋3
(1. 江西农业大学林学院,江西 南昌 330045;2. 加拿大不列颠哥伦比亚大学 (Okanagan)地球与环境科学系,温哥华;3. 中国科学院华南植物园,广东 广州 510520)
细根和地上凋落物分解和周转,是建模和预测土壤碳汇需要测量的2个关键生态过程,通过对亚热带典型常绿阔叶林、杉木、马尾松林和毛竹林110个样地内凋落物和细根的生物量和碳储量进行研究,分析了森林细根和地上凋落物的生物量和碳储量以及彼此之间的差异和相互关系。结果表明:杉木林凋落物生物量 (4.415 ± 0.390) t/hm2最大,毛竹林 (2.918 ± 0.310) t/hm2最小,且与其他森林差异显著;凋落物碳储量毛竹林 (1.176 ± 0.260) t/hm2最小,与其他森林碳储量差异显著,最大的是常绿阔叶林 (1.725 ± 0.16) t/hm2;4种不同森林类型细根生物量和碳储量差异显著,同一森林类型不同土层活和死细根生物量差异显著;从活/死根值中可知,常绿阔叶林细根周转要比针叶林 (杉木、马尾松) 快。
细根;凋落物;生物量;碳储量;亚热带典型森林
森林生态系统在全球碳循环过程中不断调节大气中的CO2(二氧化碳) 浓度及相关的气候变化起到重要作用[1]。虽然对我国森林碳循环的研究已经取得了很大的进展,但对森林生态系统碳储量、通量及碳沉降仍然很难精确的估计。由于快速的时空变化及细根和凋落物两者间碳通量的快速周转,因此这两者的碳输入对土壤的不确定性仍然很高。
细根是树的一个极为重要的功能性部分,因为它不仅可以从高度异质性的土壤中取得必要资源,而且还为植物碳和能量转移至土壤中提供了必要的途径[2]。研究表明,细根的生长可能占森林生态系统每年净初级生产力 (NPP) 的67%[3-4]。由于细根生命短[2,5]及高分解率[6],细根的周转对森林生态系统生物地球化学中的碳循环有直接而重要影响。一般情况下,细根动态变化由物种组成[7],养分有效性[8]和其他环境条件[9]等影响。森林生产力的大部分物质直接分配到叶,后随凋落物脱落到林地上。凋落物的积累和分解是植物营养和能量从冠层转移到土壤中的另一个主要途径,也是碳在生物地球化学循环的重要组成部分。凋落物是森林生态系统营养物质循环的主要途径,其种类、储量和数量上的变化对地表层生物和土壤有重要的影响。森林凋落物分解是在微生物作用下将复杂的有机质转化为简单的化学物质,伴随产生CO2、H2O和释放能量的生态过程。研究已经表明,细根生物量及分配到细根的碳与凋落物增多呈正相关[10]。
常绿阔叶林是中国亚热带地区最主要的原生植被类型, 是生产力高、生物多样性最丰富的地带性植被类型之一,是亚热带陆地生态系统的重要组成部分,对环境保护、维持全球碳循环和人类可持续发展均有极其重要的作用。杉木 (Cunninghamialanceolata) 和马尾松 (Pinusmassoniana) 作为江西森林的常见树种,可用于退化土壤重建的先锋树种,是典型的速生丰产林树种,在江西森林生态系统的碳循环中起到重要作用。为此有关森林植被层、土壤层的碳储量及其动态进行了较多研究,而关于凋落物与细根生物量、碳储量及彼此相互关系的研究相对较少。本研究以地处中亚热带的江西省为代表区域,通过常绿阔叶林、杉木林、马尾松林的凋落物、细根生物量与碳储量的调查研究,旨在探索中亚热带典型森林的碳储规律, 揭示不同森林生态系统凋落物、细根生物量及碳储变化,为进一步研究全球气候变化背景下凋落物对森林生态系统的响应及在碳循环和碳平衡中的重要作用提供基础数据,为提高森林碳汇功能提供参考。
1 研究区自然概况
以整个江西地区常绿阔叶林为研究对象,江西省位于长江中下游南岸,与浙江、福建、广东、湖南、湖北、安徽等省毗邻,地处北纬24°29′~30°05′, 东经113°34′~118°29′,属中亚热带温暖湿润气候,常年光照充足,雨量充沛,年平均气温16.2~19.7 ℃, 无霜期长达240~300 d,全年平均降水量为1 340~1 930 mm,地形复杂多样,东、南、西三面环山, 北部为湖区平原,中部间隔丘陵盆地,这种阶梯状地形的分布,也使土壤类型具有相应的分布规律。即以盆底为中心,向盆壁和盆沿上升,土壤类型出现从低到高,由平原区潮土、水稻土,到丘陵区的红壤及各种岩成土和红壤旱地,再经山地的黄红壤亚类,而垂直向上为黄壤、黄棕壤和山地草甸土。森林植被属亚热带常绿阔叶林区域,按主要优势树种划分森林植被类型,并参照 《中国植被》 的分类原则,大体分为9个基本类型, 即杉木林、马尾松林、国外松林、针阔混交林、硬阔林、软阔林、毛竹林、经济林和灌木林。
2 研究方法
2.1调查方法
2011年7月到2013年7月对整个江西地区常绿阔叶林,杉木林,马尾森林等森林类型、345个样地进行调查,其中有凋落物且无人为清理的样地数有176个。调查样地面积为800 m2,同时记录样地的海拔、坡度、坡向等基本信息。在样地内设5个1 m × 1 m的小样方,对样方内凋落物分未分解和半分解取样,带回实验室进行物理、化学含量测定。细根调查采用土钻法 (内径 > 5 cm),即在样地的上、中、下部位分别设置若干采样点,采集0~20、20~40 cm 的土芯8~10个,分层混合装袋,带回住地。将样品用流动水浸泡、漂洗、过筛,拣出根系 (< 2 mm)。
2.2测定及分析方法
2.2.1凋落物生物量
野外调查时对凋落物进行装袋直接称量测鲜质量,对取回试验样品烘干处理计算干质量,求得凋落物生物量。
2.2.2细根生物量
根据外形、颜色和弹性区分死根和活根,风干后称质量,并取一定数量的根样在65 ℃烘箱中烘干至恒质量,得干质量率,换算出单位面积细根现存量。
2.2.3凋落物碳含量测定
按不同分解等级每个试验样品重复2次,采用高锰酸钾浓硫酸氧化法测定每个样品碳含量。
2.2.4细根碳含量测定
采用高锰酸钾浓硫酸氧化法测定每个样品碳含量。
2.2.5凋落物碳储量
按照凋落物的形态和腐烂等级 (未分解、半分解) 进行分类,分别计算不同分解等级凋落物的干质量,结合相应分解等级样本的碳含量计算凋落物的碳储量。
2.2.6细根碳储量
根据外形、颜色和弹性区分死根和活根,风干后称质量,结合相应细根样本碳含量计算细根的碳储量。
2.2.7数据处理
用Excel 2007、SPSS 17.0进行数据处理和图表制作,统计不同森林类型凋落物、细根的生物量和碳含量,计算凋落物、细根的碳储量及其误差。并统计和比较凋落物不同分解等级和细根组分 (死根和活根) 生物量和碳储量。
3 结果与分析
3.1凋落物的生物量和碳储量
3.1.1凋落物总生物量和碳储量
从图1可知,杉木林凋落物生物量 (4.415 ± 0.39) t/hm2最大,毛竹林 (2.918 ± 0.31) t/hm2最小,且毛竹林凋落物生物量与其他3种森林类型差异显著,可能原因是杉木林、马尾松林凋落物量较常绿阔叶林少,但常绿阔叶林凋落物分解速率大于两者,而毛竹林凋落物量虽多,但其生物量较轻。凋落物碳储量毛竹林 (1.176 ± 0.26) t/hm2最小,与其他3种森林类型凋落物碳储量差异显著,最大的是常绿阔叶林 (1.725 ± 0.16) t/hm2,原因是常绿阔叶林凋落物碳含量高于杉木林,故在生物量小于杉木林下时碳储量更大。

图1凋落物生物量和碳储量
Fig.1Biomass and carbon storage of litter
3.1.2不同分解等级凋落物生物量和碳储量
从图2 (a) 中可知,除了毛竹林外,其他3种森林类型不同分解等级凋落物生物量差异显著,可能原因是毛竹林在新掉落的凋落物加入和已经存在凋落物分解两者之间存在一定的平衡,而其他3种森林类型凋落物在新掉落的凋落物加入和已有凋落物分解上存在一定的差异。常绿阔叶林未分解凋落物生物量 (2.191 ± 0.19) t/hm2大于半分解 (1.782 ± 0.16) t/hm2,杉木林和马尾松林未分解凋落物生物量小于半分解,毛竹林不同分解等级凋落物生物量相近,可能原因是常绿阔叶林新掉落的凋落物较多,结果使得未分解生物量大于半分解;杉木林和马尾松森林由于其凋落物相对较难分解,一定年份后结果是半分解生物量大于未分解;毛竹林如上述原因可能是凋落物的加入和已有凋落物分解速度相近。
从图2 (b) 可知,不同森林类型凋落物碳储量存在一定差异,毛竹林凋落物碳储量未分解层 (0.715 ± 0.12) t/hm2与半分解 (0.461 ± 0.11) t/hm2差异显著,其他3种森林类型凋落物碳储量差异不显著。可能原因是毛竹林不同分解等级层次凋落物生物量相近,而碳储量差异显著,结果说明在分解之后未分解和半分解凋落物碳含量相差较大,同样的原理可以解释其他3种森林类型凋落物碳储量差异。不同森林类型凋落物碳储量均是未分解层大于半分解层。
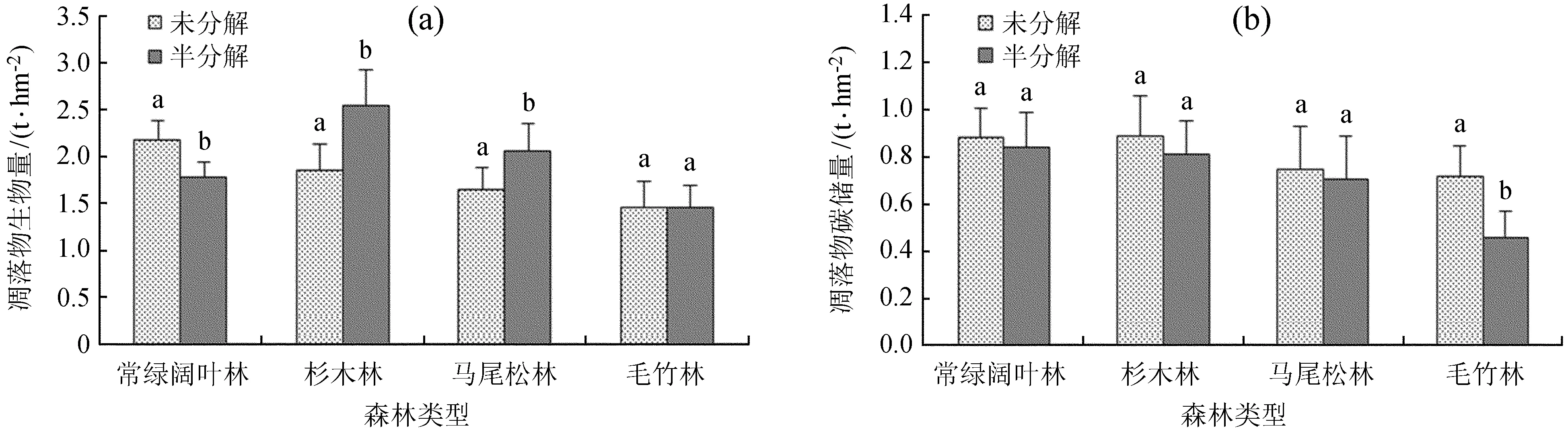
图2不同分解等级凋落物生物量和碳储量
Fig.2Biomass and carbon storage of litter in different decay classes
3.2细根的生物量和碳储量
3.2.1细根总生物量和碳储量
从图3 (a)、(b) 中可知,不同森林类型细根生物量和碳储量差异显著,毛竹林细根生物量 (0.807 2 ± 0.049) t/hm2和碳储量 (0.410 8 ± 0.040)t/hm2极显著大于其他3种森林类型。可能原因是:1) 毛竹的竹根较大,细根一样较多;2) 毛竹凋落物在地表基本覆盖,其分解和养分周转较快,结果就是养分转移到细根速率较快,细根生长加速,生物量和碳含量较高。其次杉木林细根生物量和碳储量均大于常绿阔叶林,马尾松林最小,可能原因是与上述凋落物结构相呼应,杉木林凋落物生物量最大,其分解养分输入对细根生长有相应的促进作用;常绿阔叶林林地环境条件和土壤养分相对其他森林类型更好,且凋落物碳含量较高,分解养分进入细根同样会增加;马尾松林由于其凋落物相对较少,凋落物碳含量也较低,再加上马尾松林土壤一般较贫瘠,故细根生物量和碳储量最低。从图3 (c) 中可以看出,不同森林类型不同土层细根生物量差异均显著,与上述凋落物结果相对应,凋落物生物量大、半分解凋落物生物量大,结果就是0~20 cm细根生物量相应变大。
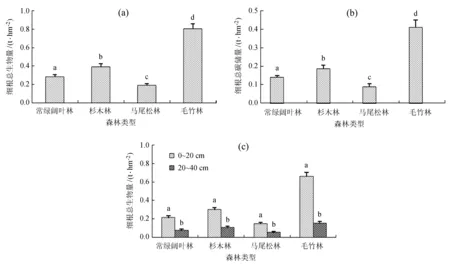
图3细根生物量和碳储量
Fig.3Biomass and carbon storage of fine root
3.2.2不同土层活细根和死细根生物量
从图4 (a) 中可知,不同森林类型活细根生物量差异显著,毛竹林0~20 cm土层活细根生物量 (0.561 4 ± 0.041) t/hm2极显著大于其他3种森林类型0~20 cm土层,马尾松林 (0.081 3 ± 0.005) t/hm2最小;20~40 cm土层活细根生物量毛竹林最大 (0.118 5 ± 0.013) t/hm2,马尾松林 (0.020 6 ± 0.007) t/hm2最小,不同森林类型之间差异显著,可能原因是毛竹林根系较多,凋落物分解对细根生长有促进作用,马尾松林凋落物较少,土壤物理结构较差异、养分转化速率较慢,对细根生长有抑制作用。不同森林类型其自身0~20 cm与20~40 cm活细根生物量差异均显著,可能原因是常绿阔叶林和杉木林凋落物对上层土壤的影响较大,半分解凋落物现存量较多,其具有保水、保肥的作用,同时在养分转化方面相对于其他森林类型更快、更多;由于毛竹根系生长较浅,故上层土壤细根含量会明显大于下层;马尾松林由于土壤保水、保肥能力较差异,养分流失速率也较快,虽然2层土壤活细根生物量差异显著,但相差值在4种森林类型中是最小的。死细根生物量不同森林类型两层差异显著 (图4 (b)),杉木林0~20 cm死细根生物量 (0.083 9 ± 0.015) t/hm2最大,常绿阔叶林 (0.044 6 ± 0.007) t/hm2最小;20~40 cm死细根生物量常绿阔叶林 (0.014 7 ± 0.003) t/hm2最小,其他3种森林类型相近,可能原因是细根的周转在常绿阔叶林是最快的,故死细根生物量是最小的;杉木和马尾松的细根是含油脂的,当细根死了以后,其周转的周期相对常绿林和毛竹林来说应该更长;故死细根生物量较大。从表1中可以看出,常绿阔叶林比针叶林 (杉木和马尾松) 细根周转速率快。
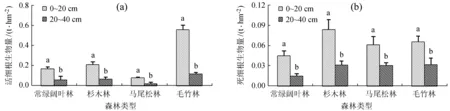
图4不同土层活、死细根生物量

Fig.4 Dead and live biomass of fine root in different layers
4 结论与讨论
1) 常绿阔叶林土壤平均含水率 (17.37 ± 3.20) %最高,马尾松林土壤平均含水率 (5.92 ± 1.29) %最低,毛竹林土壤平均含水率 (12.80 ± 2.67) %比杉木林 (12.01 ± 2.50) %高,结果说明凋落物层对地面水的阻力大小,吸水、保水能力强弱,土壤层养分状况和物理组成情况都会对土壤不同层次含水率产生较大的影响。2) 杉木林凋落物生物量 (4.415 ± 0.39) t/hm2最大,毛竹林 (2.918 ± 0.31) t/hm2最小,而碳储量最大的是常绿阔叶林 (1.725 ± 0.16) t/hm2,结果说明凋落物分解碳释放速率及碳含量多少对凋落物碳储量影响是有差异的。3) 不同森林类型细根生物量和碳储量差异显著,不同森林类型活细根和死细根生物量差异显著,结果说明细根生物量和碳储量的差异取决于树种固有生根的特点、养分状况 (土壤养分和凋落物及细根的周转速率等)、土壤物理条件等。
细根生物量经常被用来作为细根活力、生长指示;不同土壤层活根和死根细根生物量可以用来指示细根的分解周转状况[11-12]。在本研究中,细根生物量随土壤深度而降低,且彼此之间差异显著,这与以前的研究结果相同[11,13]。死细根在适宜的土壤温度、水分条件下,可以保持养分的有效性,确保更高比例的细根生物量更迅速分解。此外,4种森林类型更深的土壤层 (20~40 cm),细根生物量与上层 (0~20 cm) 差异显著,这可能归因于以下3个原因:1) 树种固有生根的特点,毛竹林和针叶树种 (杉木和马尾松) 根系相比于常绿阔叶林更浅;2) 养分,不同森林类型养分分布的不均匀性,枯落物养分周转速率不一样;3) 土壤物理条件。如常绿阔叶林和杉木林土壤要比马尾松林松弛一点,马尾松林由于立地条件影响其土壤更加板结。本研究中细根生物量范围0.194~0.807 t/hm2;低于曾凡荣等[14]研究浙江宁波天童国家森林公园常绿阔叶林细根生物量1.066~3.286 t/hm2和刘波等[15]研究安徽池州老山自然保护区的肖坑常绿阔叶林细根生物量4.889~8.956 t/hm2;低于高祥等[16]研究贵州马尾松人工林细根生物量1.29~1.37 t/hm2,张治军等[17]研究重庆市江北区铁山坪林场马尾松细根平均生物量0.485 t/hm2和张艳杰等[18]研究贵州省龙里林场马尾松人工林细根平均生物量0.664 t/hm2;亦低于匡冬姣等[19]研究湖南会同杉木人工林细根生物量1.92~2.40 t/hm2,李树战等[20]研究长沙天际岭国家森林公园杉木、马尾松细根生物量0.893、1.123 t/hm2和范少辉等[21]研究湖南会同毛竹林和杉木林细根生物量7.735、0.848 t/hm2。相比于之前的类似研究,本研究细根生物量处于较低水平。
地上凋落物加上细根的分解周转,提供的有机碳主要输入土壤[22]。凋落物数量时空尺度上差别,并主要取决于物种的密度,气候,地形,土壤母质[22-24]。本研究的凋落物生物量范围2.918~4.415 t/hm2类似于其他先前的研究[25-27];本研究结果略高于郭婧等对湖南省森林公园杉木林 (4.14 t/hm2) 的研究、略低于其对常绿阔叶林 (7.24 t/hm2) 和马尾松林 (5.71 t/hm2) 的研究[28];同时高于宋庆妮等对大岗山毛竹林 (2.77 t/hm2) 和常绿阔叶林 (2.16 t/hm2)凋落物生物量的研究[29]。相比于之前类型研究,本研究处于中等水平。
细根和地上凋落物分解和周转,这两者作为森林生态系统中最显著的通量元素,是建模和预测土壤碳汇需要测量的两个关键生态过程。在全球范围内,细根的碳估计占世界总大气碳的2.0%[30]、枯落物碳占土壤有机质5%以上[31]。在本研究中,虽然常绿阔叶林凋落物现存量不是最大的,但其碳储量最高。这符合了凋落物分解速率阔叶林通常是比针叶林更快[32]。类似的现象发生在细根现存量和细根碳储量上,常绿阔叶林细根周转要比针叶林 (杉木、马尾松) 快。
最后,本研究的数据表明,森林细根和地上凋落物生物量和碳储量彼此之间的差异和相互关系,并且还提供了4种森林类型细根和森林地面凋落物现存量和碳储量的第一手资料,这将对估计的亚热带森林生态系统的碳收支有重要的借鉴作用。但是,要指出的是不同森林类型细根的生长方式,特别是细根碳分配模式和凋落物分解养分转移机制还需要进一步调查。
[1]Pan Y, Birdsey R A, Fang J, et al. A large and persistent carbon sink in the world′s forests[J]. Science, 2011, 333: 988-993.
[2]Matamala R, Gonzalez-Meler M A, Jastrow J D, et al. Impacts of fine root turnover on forest NPP and soil C sequestration potential[J]. Science, 2003, 302: 1385-
1387.
[3]Jackson R B, Mooney H, Schulze E D. A global budget for fine root biomass, surface area, and nutrient contents[J]. Proceedings of the National Academy of Science of the United States of America, 1997, 94: 7362-7366.
[4]Janssens I, Sampson D, Curiel-Yuste J, et al. The carbon cost of fine root turnover in a Scots pine forest[J]. Forest Ecology Management, 2002, 168: 231-240.
[5]Brunner I, Bakker M R, Björk R G, et al. Fine-root turnover rates of European forests revisited: an analysis of data from sequential coring and ingrowth cores[J]. Plant Soil, 2013, 362: 357-372.
[6]Silver W L, Miya R K. Global patterns in root decomposition: comparisons of climate and litter quality effects[J]. Oecologia, 2001, 129: 407-419.
[7]Lei P, Scherer-Lorenzen M, Bauhus J. The effect of tree species diversity on fine-root production in a young temperate forest[J]. Oecologia, 2012, 169: 1105-1115.
[8]Vogt K A, Vogt D J, Palmiotto P A, et al. Review of root dynamics in forest ecosystems grouped by climate, climatic forest type and species[J]. Plant Soil, 1996, 187: 159-219.
[9]Finér L, Ohashi M, Noguchi K, et al.Fine root production and turnover in forest ecosystems in relation to stand and environmental characteristics[J]. Forest Ecology Management, 2011, 262: 2008-2023.
[10]Davis J P, Haines B, Coleman D, et al. Fine root dynamics along an elevational gradient in the southern Appalachian Mountains, USA[J]. Forest Ecology Management, 2004, 187: 19-33.
[11]Persson H Å, Stadenberg I. Spatial distribution of fine-roots in boreal forests in eastern Sweden[J]. Plant Soil, 2009, 318: 1-14.
[12]Persson H Å, Stadenberg I. Fine root dynamics in a Norway spruce forest (Piceaabies(L.) Karst) in eastern Sweden[J]. Plant Soil, 2010, 330: 329-344.
[13]Persson H Å. The high input of soil organic matter from dead tree fine roots into the forest soil[J]. International Journal of Forestry Research, 2012: doi: 10.1155/2012/217402.
[14]曾凡荣, 施家月, 阎恩荣, 等. 天童常绿阔叶林次生演替过程中细根的生物量动态[J]. 华东师范大学学报, 2008(6): 56-62.
[15]刘波, 余艳峰, 张贇齐, 等. 亚热带常绿阔叶林不同林龄细根生物量及其养分[J]. 南京林业大学学报 (自然科学版), 2008, 32(5): 81-84.
[16]高祥, 丁贵杰, 翟帅帅, 等. 不同林分密度马尾松人工林根系生物量及空间分布研究[J]. 中南林业科技大学学报, 2014, 34(6): 71-75.
[17]张治军, 王彦辉, 于澎涛, 等. 不同优势度马尾松的生物量及根系分布特征[J]. 南京林业大学学报 (自然科学版), 2008, 32(4): 71-75.
[18]张艳杰, 温佐吾. 不同造林密度马尾松人工林的细根生物量[J]. 林业科学, 2011, 47(3): 75-81.
[19]匡冬姣, 雷丕锋. 不同林龄杉木人工林细根生物量及分布特征[J]. 中南林业科技大学学报, 2015, 35(6): 70-74, 79.
[20]李树战, 田大伦, 王光军, 等. 湖南4种主要人工林群落的细根生物量及时空动态[J]. 中南林业科技大学学报, 2011, 31(5): 63-68, 80.
[21]范少辉, 肖复明, 汪思龙, 等. 毛竹林细根生物量及其周转[J]. 林业科学, 2009, 45(7): 1-5.
[22]Sayer E J. Using experimental manipulation to assess the roles of leaf litter in the functioning of forest ecosystems[J]. Biological Reviews of the Cambridge Philosophical Society, 2006, 81: 1-31.
[23]刘萍, 邓鉴峰, 魏安世, 等. 广州市森林生物量及碳储量评估[J]. 西南林业大学学报, 2015, 35(4): 62-65.
[24] Berg B, Meentemeyer V. Litter fall in some European coniferous forests as dependent on climate: a synthesis[J].Canadian Journal of Forest Research, 2001, 31: 292-301.
[25]Blanco J A, Imbert J B, Castillo F J. Influence of site characteristics and thinning intensity on litterfall production in twoPinussylvestrisL. forests in the western Pyrenees[J]. Forest Ecology Management, 2006, 237: 342-352.
[26]Liu Y, Han S J, Lin L. Dynamic characteristics of litterfalls in four forest types of Changbai Mountains, China[J]. Chinese Journal of Ecology, 2009, 28: 7-11.
[27]Li X, Hu Y, Han S, et al. Litterfall and litter chemistry change over time in an old-growth temperate forest, northeastern China[J]. Annals of Forest Science, 2010, 67: 206-213.
[28]Yuan Z, Chen H Y H. Fine root biomass, production, turnover rates, and nutrient contents in boreal forest ecosystems in relation to species, climate, fertility, and stand age: literature review and meta-analyses[J]. Critical Reviews in Plant Sciences, 2010, 29: 204-221.
[29]郭婧, 喻林华, 方晰, 等. 中亚热带4种森林凋落物量、组成、动态及其周转期[J]. 生态学报, 2015, 35(14): 4668-4677.
[30]宋庆妮, 杨清培, 欧阳明, 等. 毛竹扩张的生态后效: 凋落物水文功能评价[J]. 生态学杂志, 2015, 34(8): 2281-2287.
[31]Pregitzer K S. Fine roots of trees-a new perspective[J]. New Phytologist, 2002,154: 267-270.
[32]Meentemeyer V, Box E O, Thompson R. World patterns and amounts of terrestrial plant litter production[J]. BioScience, 1982, 32: 125-128.
(责任编辑张坤)
Relationships Between Biomass and Carbon Storage of Litter and Fine Root in Subtropical Typical Forests
Wu Chunsheng1, Liu Yuanqiu1, Wei Xiaohua2, Li Xiaodong1, Liu Liangying1, Guo Xiaoming1, Ouyang Xunzhi1, Mo Qifeng3
(1. College of Forestry, Jiangxi Agricultural University, Nanchang Jiangxi 330045, China; 2. Earth and Environmental Science Department, University of British Columbia Okanagan, Vancouver, Canada; 3. South China Botanical Garden, Chinese Academy of Sciences, Guangzhou Guangdong 510520, China)
The decomposition and turnover of fine root and litter, which were the two key processes for modeling and forecasting soil carbon sequestration in forest ecosystem. In order to understand the differences and interactions between biomass and carbon storage of fine root and litter, a field-based study in 110 plots of evergreen broad-leaf forest, includingCunninghamialanceolataplantation,Pinusmassonianaplantation andPhyllostachysedulisplantation was conducted. The results showed that the highest litter biomass was inCunninghamialanceolataplantation, at (4.415 ± 0.39) t/hm2, while the lowest was inPhyllostachysedulisplantation, at (2.918 ± 0.31) t/hm2, and the significant difference was found betweenPhyllostachysedulisplantation and other three forests; the litter carbon storage ofPhyllostachysedulisplantation was the lowest, at (1.176 ± 0.260) t/hm2, and it was significantly lower than other forests, while the highest carbon storage of litter was found in evergreen broad-leaf forest at (1.725 ± 0.16) t/hm2; the biomass and carbon storage of fine root among the four types of forests were significantly different. Moreover, the dead and alive fine root biomass had obvious dissimilarity in different layers of same type of forest or plantation; according to the fine root ratios of dead/alive, the turnover rates of fine root in evergreen broad-leaf forests was faster than that in coniferous forests (CunninghamialanceolataandPinusmassonianaplantation).
fine root, litter, biomass, carbon storage, subtropical typical forest

10. 11929/j. issn. 2095-1914. 2016. 05. 008
2015-10-08
中国科学院战略性先导科技专项项目 (XDA05050205) 资助。
刘苑秋 (1963—),女,博士,教授。研究方向:森林生态、恢复生态。Email: liuyq404@163.com。
S718.56
A
2095-1914(2016)05-0045-07
第1作者:吴春生 (1989—),男,博士生。研究方向:森林培育。Email: 1013259834@qq.com。
