基于针叶性状云南松天然群体表型分化研究
2016-10-26许玉兰蔡年辉王大玮段安安康向阳
许玉兰 蔡年辉 陈 诗 王大玮 段安安 康向阳
(1. 西南林业大学云南省高校林木遗传改良与繁育重点实验室,云南 昆明 650224;2. 北京林业大学林木育种国家工程实验室,北京 100083)
基于针叶性状云南松天然群体表型分化研究
许玉兰1蔡年辉1陈诗1王大玮1段安安1康向阳2
(1. 西南林业大学云南省高校林木遗传改良与繁育重点实验室,云南 昆明 650224;2. 北京林业大学林木育种国家工程实验室,北京 100083)
在云南松主要分布区内,采集不同区域的18个天然群体540株单株的针叶,通过对各单株的10束针叶7个性状进行测定分析。结果表明:不同表型性状在各群体间和群体内单株间均存在极显著差异,表明变异存在的广泛性;不同性状的变异规律有所差异,大多数性状的变异主要来自于群体内,表型分化系数低于50%;基于各性状两两群体间的表型分化均很低,甚至没有分化。不同表型性状对揭示群体间的遗传距离关系贡献不同,综合多个性状能反映群体间的遗传关系。经各性状遗传距离与地理距离、生态距离间的相关检测,由地理距离、生态距离等引起针叶性状变异的趋势不明显,但由生态距离引起的作用大于地理距离的作用,表明地理、气候和土壤因子对云南松群体间的分化有一定的影响作用。经聚类分析,各群体的聚类并不完全按地理分布进行聚类。
云南松;群体;针叶性状;表型分化;遗传变异
种质资源变异的研究是开展遗传改良的前提与重要环节[1-2],了解变异的分布及其模式可对资源的保护与可持续利用提供遗传信息[3-4]。表型多样性是遗传多样性与环境多样性的综合体现,主要研究群体在其分布区内各种环境下的表型变异,是遗传多样性和生物系统学研究的重要内容[5-6],同时通过表型来检测群体的变异和分化又是一种快捷、有效的方法[6]。已有研究表明,叶子形态及其解剖可反映植物对其生境的适应[7-8],是分析表型遗传变异的一个重要指标[9-10]。因此,以针叶为材料,开展云南松天然群体表型多样性的研究是云南松天然群体遗传变异研究的一部分内容。
云南松 (Pinusyunnanensis) 分布范围广,其中云南省是云南松的集中分布区[11-12],目前云南松林占云南省林分总面积的19.63%、占木材蓄积量的14.28%,在区域经济发展和生态环境建设中占有重要的地位[11,13]。云南松生境复杂多样[14],可能存在不同的生态类型,以适应不同的环境条件[15-16]。而有关云南松群体遗传多样性的研究报道较少,局限于部分地区的有限群体。鉴于此,本研究在云南松主要分布区内确定18个天然群体,测定针叶性状,分析云南松群体间和群体内针叶性状的遗传变异规律;结合群体间生长环境的差异,与对这些形态性状间进行相关分析,以了解环境因子对该物种形态作用的程度及方式,揭示不同群体针叶表型性状的地理变异模式及空间格局的地理趋势,其研究结果对于认识云南松不同群体的遗传多样性有着重要的意义,并可为探讨云南松群体的遗传结构与表型分化提供形态学的依据,也可揭示环境因素在物种的生态适应和分化过程中的作用,同时有利于进一步开展云南松种质资源的收集、保存、评价与利用研究,为云南松基因资源的遗传改良、种质资源的保护与利用提供一定的参考。
1 材料与方法
1.1研究材料的采集
在云南松天然分布区内按不同区域确定有代表性的天然群体18个 (图1),涉及云南松主要分布区的群体,包括滇中、滇南、滇东、滇东南、滇西、滇西南等,每个群体选取30株以上作为采样母树,参考文献 [9] 的方法,样株的年龄均在25年生以上,各样株间间隔5倍树高以上,从生长健康旺盛的3~5个枝条上采集2年生针叶,所有采集的枝条均在树冠的中上部位,单株编号。此外,每个群体按梅花状采集10~20 cm土层的5个土样,等量均匀混合,带回实验室,自然风干,作为该群体的土壤样品用于后续测定。
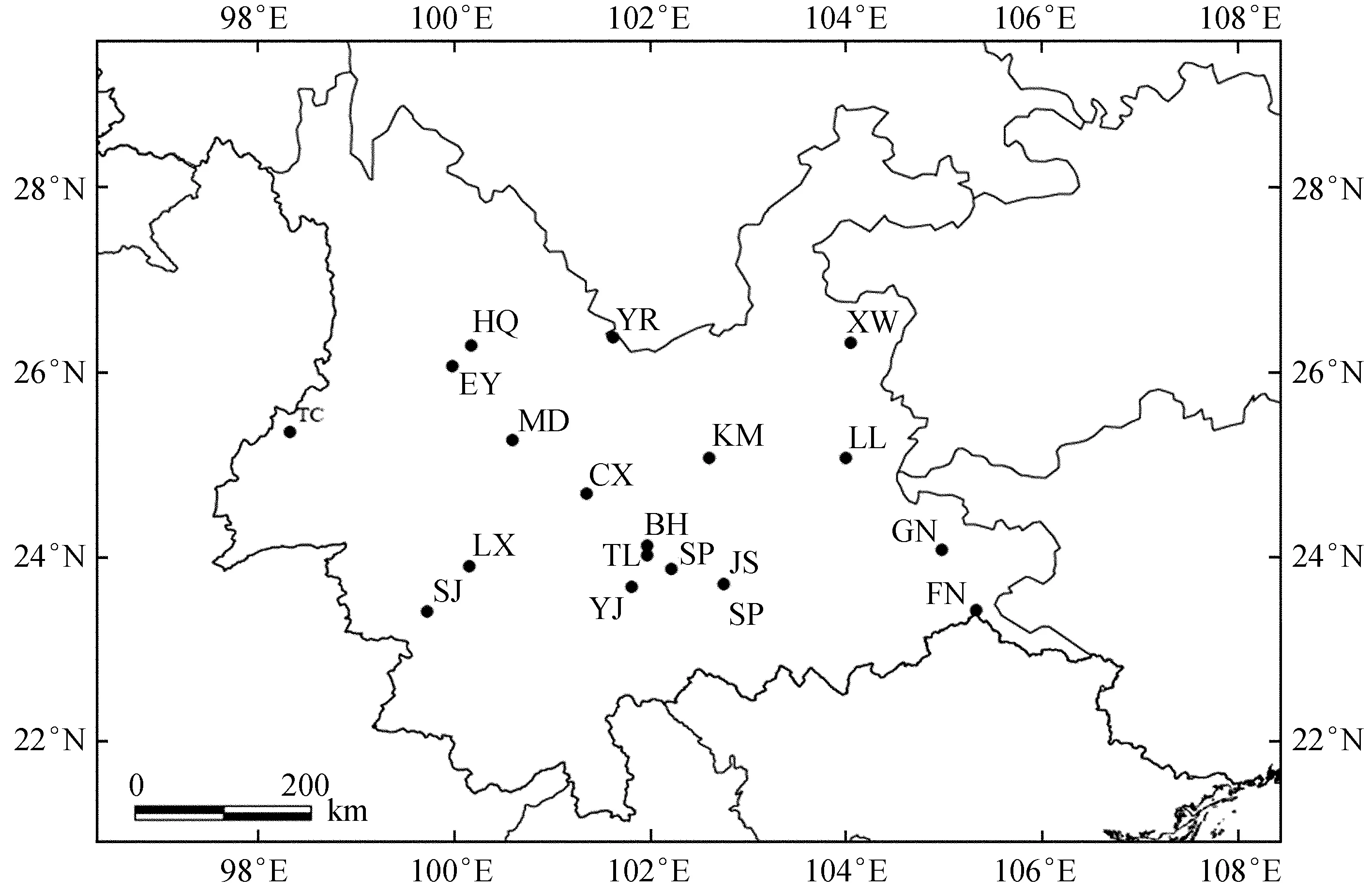
图1云南松18个采样群体分布
Fig.1Distribution of 18 sample populations ofP.yunnanensis
1.2针叶性状的测定
测定内容包括针叶长 (NL)、针叶粗 (NW)、叶鞘长 (FSL)、针叶束粗 (FW)、针叶长/针叶粗 (NL/NW)、针叶长/叶鞘长 (NL/FSL)、针叶束粗/针叶粗 (FW/NW) 7个性状。用直尺测量针叶长和叶鞘长,精确到0.01 cm;用游标卡尺测量针叶粗 (测定中央宽度) 和针叶束粗,精确到0.01 mm;计算针叶长/针叶粗、针叶长/叶鞘长、针叶束粗/针叶粗,精确到0.01。每株测量10束针叶[17-18],其中针叶长、粗分别反映了针叶在纵向和横向生长的情况,即在空间水平上的生长情况[19]。
1.3土壤样品的测定
对所采集18个群体的土壤样品,分别测定含水量、pH值、有机质、水解氮、速效磷、速效钾、全氮、全磷、全钾及质地共10个指标,其中质地采用定性描述,未用于后续的分析中,各指标的测定方法及标准分别为:含水量采用105 ℃烘箱法 (GB 7172—1987)、pH值采用电位法 (NY/T 1377—2007)、有机质采用油浴加热重铬酸钾氧化·容量法 (NY/T 1121.6—2006)、水解氮采用碱解扩散法 (LY/T 1229—1999)、有效磷采用碳酸氢钠浸提·钼锑抗比色法 (NY/T 149—1990)、速效钾采用乙酸铵浸提·原子吸收分光光度法 (NY/T 889—2004)、全氮采用凯氏蒸馏法 (NY/T 53—1987)、全磷采用NaOH熔融·钼锑抗比色法 (NY/T 88—1988)、全钾采用NaOH熔融·原子吸收分光光度法 (NY/T 87—1988)。土壤样品经风干后,去除粗枝、石块等,送由云南同川农业分析测试技术有限公司检测,每个群体送检3个样品 (即3次重复),最后的分析采用3次重复的平均值。
1.4数据分析
对针叶性状采用巢式设计方差分析[5,20-21],计算群体间和群体内的方差分量。线性模型为:Yijk=μ+
τi+δj(i)+εk(ij),其中,Yijk为第i个群体第j个单株第k个观测值,μ为总平均值,τi为群体间效应值,δj(i) 为群体内单株效应值,εk(ij) 为随机误差,在SAS v 9.3统计软件 (ANOVA, PROC MIXED Version 9.3, SAS Institute Inc., Cary, NC, USA) 上完成。
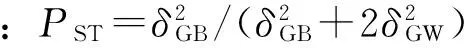
为探讨表型分化与环境因子间的关系,从Berkeley大学Global Climate Data的Worldclim下载中心 (http://www.worldclim.org/) 获得气候因子,Worldclim数据库对1950—2000年来自世界各地气象站的气候信息采用插值法生成全球气候数据,基本的数据包括每月的最高气温、最低气温、平均气温、降水量,并根据这些指标求得19个生物气候因子 (BI01-BI019)[25],共67个指标。以实测各群体的经度、纬度和海拔,选用空间分辨率为30″ 的栅格数据,数据基准面为WGS84,利用ArcGIS 9.3软件提取18个群体的67个气候因子,与经度、纬度和海拔3个地理位置因子一共70个指标。分析各针叶性状与地理、气候因子间的Spearman′s相关性,针叶性状采用各群体的均值[18],基于针叶性状各群体间的欧氏距离来代表群体间的遗传距离。由于每个性状的量纲不一样,计算各群体间的遗传距离前对各平均值进行标准化转换[2],数据标准化直接采用SPSS软件 (SPSS version 21, IBM Corporation, North Castle Drive, Armonk, NY, USA),然后按组间连接法,计算各群体间的欧氏距离,使用NTsys[26]构建群体的非加权配对算术平均法 (unweighted pair group method with arithmetic average, UPGMA) 聚类图。同样采用NTsys进行Mantel检测[27]各类距离矩阵间的相关性,包括基于各个针叶性状欧氏距离 (即遗传距离)、地理距离、基于地理-气候-土壤因子间的欧氏距离 (即生态距离) 等,以进一步探讨云南松表型分化与环境因子间的相关性。
2 结果与分析
2.1云南松群体间和群体内针叶性状的变异特征
对所测定和计算的针叶长、针叶粗、针叶束粗、叶鞘长、针叶长/针叶粗、针叶长/叶鞘长、针叶束粗/针叶粗等7个表型性状进行巢式方差分析,各性状的变异均方及F值见表1。
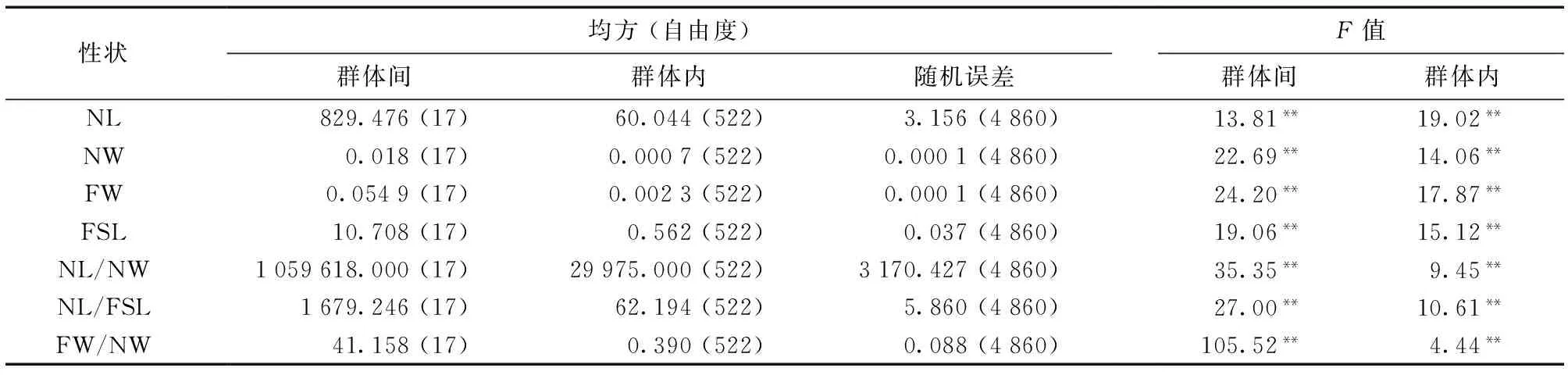
表1 云南松群体间和群体内针叶性状的方差分析
由表1可知,云南松7个针叶性状在群体间和群体内都呈极显著差异 (P< 0.01),表明云南松的针叶表型性状在群体间和群体内存在广泛的变异,这种多层次的变异不但为选择提供源泉,同时也为多样性保护奠定基础。
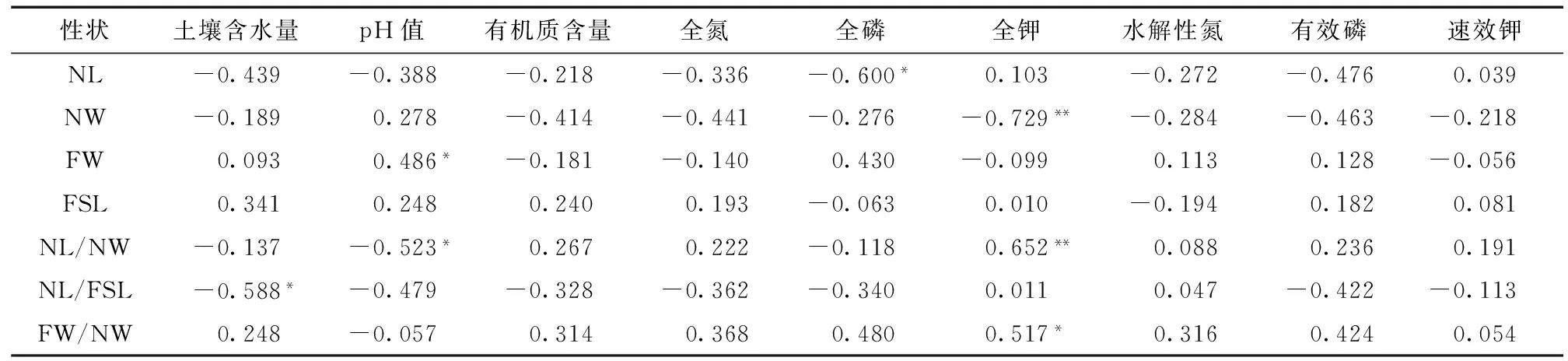
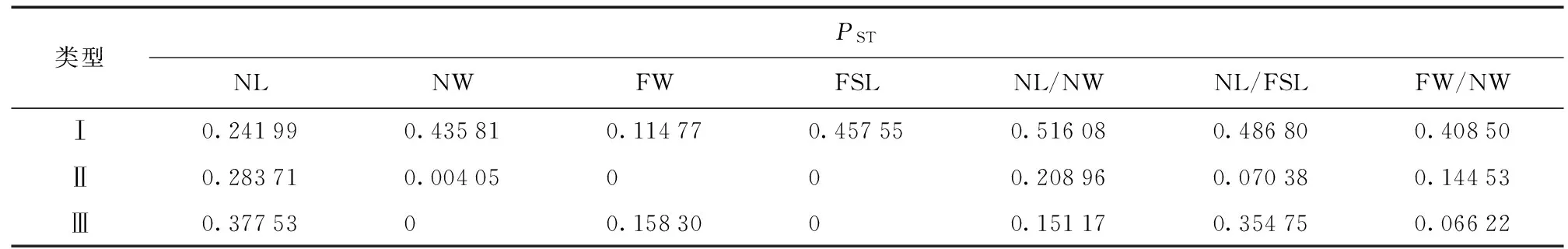
2.2云南松天然群体间针叶性状的表型分化
按照巢式方差分析,将各性状的表型变异分解为群体间变异、群体内变异和个体内变异 (机误),按方差分量比组成,进一步分析各性状两两群体间的表型分化PST,结果见表2和图2。
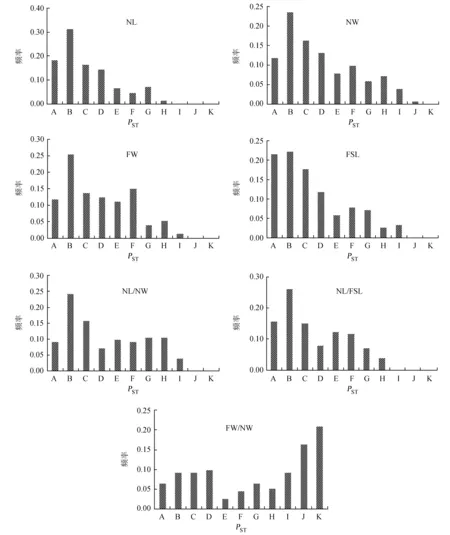
A:PST=0;B: 0 G: 0.5 图2 云南松针叶性状成对群体间表型分化PST的分布 由图2可知,针叶长、针叶粗、针叶束粗、叶鞘长、针叶长/针叶粗、针叶长/叶鞘长和针叶束粗/针叶粗7个性状在各群体的表型分化分别波动于0.000 0~0.622 8、0.000 0~0.840 0、0.000 0~0.703 0、0.000 0~0.744 6、0.000 0~0.785 8、0.000 0~0.674 3和0.000 0~0.970 1,其中针叶长、叶鞘长和针叶长/叶鞘长等性状有20%左右的成对群体间未表现出分化 (PST=0.000 0),其他4个性状有近10%的成对群体间未表现出分化。除针叶束粗/针叶粗外,其余6个性状均不足1/4的成对群体间分化系数在0.5以上。总体来看,以针叶束粗/针叶粗在各群体间的表型分化较高,而针叶长、针叶长和叶鞘长在各群体间的表型分化相对较低。从各群体间的表型分化来看,以SJ与其他群体间的表型分化比较明显,在7个性状中有3个性状两两群体表型分化最明显的均出现在SJ群体中。此外,也有2个性状 (针叶长和针叶长/针叶粗) 分化明显的群体分别出现在东部群体GN与西部群体EY、东部群体FN和中部群体KM之间。 2.3云南松天然群体针叶性状与土壤因子间的相关性 利用所测定的土壤因子与针叶性状进行相关分析,结果见表3。 表3 云南松天然群体针叶性状与土壤因子间的相关分析 由表3可知,针叶长与全磷含量呈显著负相关,针叶粗与全钾含量呈显著负相关,针叶束粗与PH值呈显著正相关,针叶长/针叶粗与pH值呈显著负相关、与全钾含量呈极显著正相关,针叶长/叶鞘长与土壤含水量呈显著负相关,针叶束粗/针叶粗与全钾含量呈显著正相关。其他针叶性状与土壤因子间的相关性不显著。由表3也可以看出,不同土壤性状指标与针叶性状间的相关性大小不同,表明不同因子对云南松群体各表型性状影响是不同的。 2.4基于针叶性状云南松天然群体的聚类 基于针叶性状在两两群体间的欧氏距离,聚类获得UPGMA聚类图 (图3)。由图3可知,LX和TC群体最为相似,其次为SP和JS、CX和YR,说明上述群体的遗传关系可能比较近。当以欧氏距离3.5为阈值时,18个群体被分为4大类:第1类 (I) 为:为SP、JS、YJ、CX、YR、TL、GN和BH;第2类 (II) 为:XW、LL、MD、HQ、EY和KM;第3类 (III) 为:LX、TC和FN;而SJ群体单独形成一类 (Ⅳ)。当以欧氏距离2.5为阈值时,可将第1大类 (I) 再分为3个亚类,其中BH独自形成一个亚类 (I-1),最先与SP、JS、YJ等3个群体形成的亚类 (I-3) 分开,其次为CX、YR、TL、GN等4个群体构成的第2亚类 (I-2)。同样地,第2大类也可以进一步分为两个亚类,其中KM单独形成1个亚类 (II-2),其余的5个群体形成另一亚类 (II-1)。 图3基于针叶性状云南松天然群体聚类 Fig.3UPGMA cluster based on the needle traits ofPinusyunnanensispopulations 2.5针叶性状表型分化与地理和生态距离间的关系 为检测针叶性状各群体间的欧氏距离与其他环境因子间的相关性,把地理距离、基于土壤因子距离 (9个指标)、基于地理-气候因子距离 (70个指标)、基于地理-气候-土壤因子距离 (79个指标) 求算的各群体间的生态距离,分别与基于针叶性状求算各群体间的遗传距离进行Mantel检测[27]。获得的相关系数分别为:基于针叶性状群体间的遗传距离与地理距离间相关系数r=0.229 62,基于针叶性状群体间的遗传距离与基于土壤因子 (9个指标) 各群体间的生态距离相关系数r=0.043 80,基于针叶性状群体间的遗传距离与基于地理-气候因子(70个指标)各群体间的生态距离相关系数r=0.462 64,基于针叶性状群体间的遗传距离与基于地理-气候-土壤因子(79个指标) 各群体间的生态距离相关系数r=0.441 92。它们之间的相关性均大于0,说明这些地理因子、土壤因子、地理-气候因子以及与地理-气候因子与土壤因子的综合可能对群体间针叶性状的表型分化有影响,即随着地理、气候、土壤等因子在各个群体间的差异增大,群体间的针叶性状表现出的相异性也增大,但它们之间的相关性均未达到显著或极显著水平 (P> 0.05),说明这些地理、气候、土壤因子不是决定群体间针叶性状表型分化的决定性因子。此外,从相关系数的大小来看,最低的是基于针叶性状群体间的遗传距离与基于土壤因子 (9个指标) 群体间的生态距离之间的相关性 (r=0.043 80),表明土壤因子的分化与其针叶性状的分化相关性较弱,这从相关性分析也可以看出 (表3),多数指标与土壤因子间的相关性不显著。最高的是基于针叶性状群体间的遗传距离与基于地理-气候因子 (70个指标) 各群体间的生态距离之间的相关性 (r=0.462 64),表明地理位置、气候因子对其针叶性状差异的影响大些,而单独的地理距离对针叶性状的影响相对较小些 (r=0.229 62)。 针对不同性状各两两群体间的PST,采用基于针叶性状各群体间的遗传距离、地理距离以及基于地理-气候因子 (70个指标) 各群体间的生态距离进行Mantel检测[27],因上述分析针叶性状群体间的分化与土壤因子群体间的分化相关性较小,暂不分析涉及土壤因子的生态距离,结果如表4。 由表4可知,不同性状在各个群体间的表型分化 (PST) 与相应的基于针叶性状各群体间的遗传距离Mantel检测[27]的相关系数波动于0.115~0.516之间,以NL/NW最大,而以FW为最小。但是,它们之间的相关性均未达到显著或极显著水平 (P> 0.05)。因此,用单一针叶性状来描述群体间的针叶性状综合差异时信息量均有损失,而不同的单一针叶性状对基于所有针叶性状群体间遗传距离的信息量也不一样,其顺序分别为:NL/NW > NL/FSL > FSL > NW > FW/NW > NL > FW。同样地,从相关系数的大小来比较,不同群体间各个针叶性状的分化与地理距离或基于地理-气候因子群体间分化的相关大小也不一样,从地理距离的分布来看,相关性较大的是NL和NL/NW。从地理-气候因子来看,相关系数较高的是NL,其次是NL/FSL。 表4 群体间针叶性状表型分化与地理距离、生态距离间的Mantel检测 注: Ⅰ: 基于7个针叶性状群体间的分化; Ⅱ: 地理距离; Ⅲ基于地理-气候因子群体间的生态距离。 3.1表型性状遗传变异的广泛性 云南松天然群体的针叶性状研究表明,云南松针叶性状在群体间和群体内均存在极显著差异,这种变异为遗传变异奠定丰富的物质基础,在很多的林木中都有类似报道,如川西云杉 (Piceabalfouriana)[28]、土耳其松 (Pinusbrutia)[29]、青海云杉 (Piceacrassifolia)[30]、油松 (Pinustabuliformis)[21]等研究报道表明针叶等表型性状呈现出变异的广泛性。这种多层次的变异一方面成为优异种质选择的源泉,同时给多样性保护提供了物质基础[30-31],其遗传改良工作可获得较大的增益[32],同时也表明生物多样性保护任务的艰巨性[30-31]。在云南松前期研究报道中也提到表型性状的广泛性,如虞泓等[33]揭示了云南松居群内雄球花多态性显著,居群间多型性也较明显。表型是遗传型和环境型共同作用的结果,表型变异越大,可能存在的遗传变异越大,一般认为表型变异往往具有适应意义,自然群体中保持大的变异贮存对群体是有利的,群体内多种基因型所对应的表型范围越广,群体在整体上适应环境的能力越强[30-31]。邹春静等[34]也提到,长白松种群在对不同环境及气候条件长期的适应过程中,其针叶性状发生了比较大的变异,形成了不同的变异类型,这些类型的形成为长白松扩大营林面积及分布区,推广引种驯化和迁地保护提供了可能性。因此,云南松丰富的表型变异是云南松适应性广、抗逆性强的基础。表型是遗传型和环境型共同作用的结果,表型多样性是在形态水平上对遗传多样性进行的阐述,表型变异可能蕴藏着丰富的遗传变异。 3.2群体间针叶性状表型分化 不同性状在群体间存在极显著差异,说明群体间的环境差异可能会导致群体表型性状的变异。在18个群体的7个针叶性状中,以针叶束粗/针叶粗的表型分化最高,为0.547 5,其次是针叶长/针叶粗,为0.280 8,最低是针叶长,为0.161 8。辜云杰等[28]通过对川西云杉分析表明性状表型分化系数为31.93%,罗建勋和顾万春[35]以云杉全分布区10个有代表性天然群体300个个体为试材,分析针叶表型分化系数为10.70%,群体间的变异远小于群体内的变异;在青海云杉的研究中表明针叶形状指数即针叶长/针叶宽的表型分化系数为54.20%[30-31],和本研究相似。此外针叶长、针叶宽的表型分化系数分别为49.45%和27.66%[30-31];在红松 (Pinuskoraiensis) 的研究报道中,不同种群表型分化系数不一样,以针叶长性状来看,种群内和种群间的相差不大,分别为23.72%和26.83%,另49.45%的变异来自个体内[36]。云南松7个针叶性状平均表型变异呈现出群体内大于群体间,即群体内的变异是云南松针叶性状表型变异的主要来源。与前期研究报道的形态分化系数 (VST=36%) 相似,而大大高于基因位点的分化系数 (GST=11%)[37],也高于SSR标记揭示的遗传分化系数Fst[38-39]。松树在这方面的研究报道较多,均表现群体内的变异占大多数,如在红松针叶、球果、种子和树皮等7个性状研究表明有大约23%是来自群体间,其余大部分变异 (大约77%来自群体内的个体间[36];Calamassi等[29]对针叶形态及其解剖特征的研究,结果表明所研究的全部性状均表现为群体间的变异小于群体内的变异。由此可知,多数树种的表型分化系数低于50%,群体间的多样性程度小于群体内的多样性,性状变异以群体内变异为主。一般来说,群体内的变异体现群体的稳定性,而分布在群体间的变异反映在不同环境中的适应能力,群体间变异越大,该生物适应的环境越广,也与地理、生殖隔离有关;分布在群体间的变异占的比例小,并不能说明群体间不存在显著性差异,当然不同基因群体间差异的分布可能是不同的[40]。 3.3针叶性状变异的趋势 针叶性状与单个的土壤因子间存在一定的相关性,其中与全钾含量之间的相关性表现较为明显,其次是全氮含量、土壤含水量和pH值,不同土壤因子对针叶性状的影响不一样,但总体来看,土壤因子与针叶性状间的相关性比较低。前期研究表明,温度对针叶长的影响最大,是云南松群体变异的主要选择因子,随着海拔的升高,针叶有变短的趋势,这可能是一种适应性变化,在高海拔地区,风力大、土层薄、土壤水分养分含量低,针叶变短有利于减少资源消耗量,从而提高云南松生长、生殖或其它适应所需的资源量,进而提高对高海拔环境的适应能力[41]。综合多个性状,分析群体间针叶性状表型分化与地理距离、生态距离间的相关性,结果表明,云南松天然群体针叶表型性状的地理变异不明显,相比较而言,生态因子的综合影响较地理分布对针叶性状的影响大。但不同性状与地理距离、生态距离间的相关性大小不一,云南松天然群体针叶性状的变异以多个因子共同分析为宜。早期王昌命等[15]从滇东南-滇中-滇西北采样的研究表明,从低海拔到高海拔,针叶变短,从北到南随着纬度降低,温度升高,针叶有变长的趋势,这可能是云南松适应周围环境,对地理、气候的变化长期选择的结果。针叶是松属植物体进行光合作用、蒸腾作用和呼吸作用的重要器官,环境条件对针叶的生长、形态有一定的影响。辜云杰等[28]在研究表型性状时,通过各性状间的相关分析表明,针叶长与温度变化有关;罗建勋和顾万春[35]对17个性状与采样地的地理生态因子分析揭示了云杉种内群体表型变异在空间分布上呈现以纬度为主的单向变异模式;王娅丽等[30-31]在青海云杉表型性状变异的分析可知,17个表型性状呈现出以经度变异为主的梯度规律性。本研究表明,针叶性状与生态距离间的相关性较单一性状、地理距离表现明显。总体来看,云南松针叶性状的地理变异趋势不明显,如Maley和Parker[42]对Pinusbanksiana64个天然林分针叶及其球果性状的分析,对针叶变异模式的无规律性分析认为可能是源于东、西两个不同迁移路线或两个不同的避难所。云南松不明显的地理变异趋势可能与其连续分布有关。 [1]Takuathung C N, Pipatwattanakul D, Bhumibhamon S. Provenance variation in seed morphometric traits and growth performance ofSennasiamea(Lam.) Erwin et Barneby at Lad Krating plantation, Chachoengsao Province, Thailand[J]. Kasetsart Journal (Natural Science), 2012,46: 394-407. 7272. [3]Turna I, Güney D. Altitudinal variation of some morphological characters of Scots pine (PinussylvestrisL.) in Turkey[J]. African Journal of Biotechnology, 2009, 8(2): 202-208. [4]Turna I, Yahyaoglu Z, Yüksek F, et al. Morphometric and electrophoretic analysis of 13 populations of Anatolian black pine in Turkey[J]. Journal of Environmental Biology, 2006, 27(3): 491-497. [5]李斌, 顾万春, 卢宝明. 白皮松天然群体种实性状表型多样性研究[J]. 生物多样性, 2002, 10(2): 181-188. [6]贾子瑞, 张守攻, 王军辉. 林芝云杉天然群体针叶与种实的变异及其地理趋势[J]. 林业科学研究, 2011, 24(4): 428-436. [7]Ali M A, Jabran K, Awan S I, et al. Morpho-physiological diversity and its implications for improving drought tolerance in grain sorghum at different growth stages[J]. Australian Journal of Crop Science, 2011, 5(3): 311-320. [8]Pham T D, Nguyen T D T, Carlsson A S, et al. Morphological evaluation of sesame (SesamumindicumL.) varieties from different origins[J]. Australian Journal of Crop Science, 2010, 4(7): 498-504. [9]Dangasuk O G, Panetsos K P. Altitudinal and longitudinal variations inPinusbrutia(Ten.) of Crete Island, Greece: some needle, cone and seed traits under natural habitats[J]. New Forest, 2004, 27: 269-284. [10]Wahid N, González-Martínez S C, Hadrami I E, et al. Variation of morphological traits in natural populations of maritime pine (PinuspinasterAit.) in Morocco[J]. Annals of forest Science, 2006, 63: 83-92. [11]金振洲, 彭鉴. 云南松[M]. 昆明: 云南科技出版社, 2004: 1-66. [12]陈飞, 王健敏, 孙宝刚, 等. 云南松的地理分布与气候关系[J]. 林业科学研究, 2012, 25(2): 163- 168. [13]邓喜庆, 皇宝林, 温庆忠, 等. 云南松林资源动态研究[J]. 自然资源学报, 2014, 29(8): 1411-1419. [14]李本德, 刘中天. 云南松 (Pinusyunnanensis) 林的分布及其分区[J]. 云南大学学报 (自然科学版), 1984, 6(1): 33-46. [15]王昌命, 王锦, 姜汉侨. 云南松针叶的比较形态学研究[J]. 西南林学院学报, 2003, 23(4): 4-7. [16]周丽, 陈诗, 徐杨, 蔡年辉, 等. 云南松不同种源苗木光合特性比较[J]. 西南林业大学学报, 2015, 35(5): 8-13. [17]Boratyńska K, Jasińska A K, Ciepuch E. Effect of tree age on needle morphology and anatomy ofPinusuliginosaandPinussilvestris-species-specific character separation during ontogenesis[J]. Flora, 2008, 203(8): 617-626. [18]Urbaniak L, Karliński L, Popielarz R. Variation of morphological needle characters of Scots pine (PinussilvestrisL.) populations in different habitats[J]. Acta Societatis Botanicorum Poloniae, 2003, 72(1): 37-44. [19]刘永良. 油松地理种群针叶性状指标的变异与趋势[D]. 北京: 北京林业大学, 2011. [20]葛颂, 王明麻, 陈岳武. 用同工酶研究马尾松群体的遗传结构[J]. 林业科学, 1998, 24(11): 399-409. [21]刘永红, 高桂琴, 崔嵬, 等. 油松天然群体种实性状表型多样性分析[J]. 种子, 2010, 29(9): 44-49. [22]Raeymaekers J A M, Van Houdt J K J, Larmuseau M H D, et al. Divergent selection as revealed byPSTand QTL-basedFSTin three-spined stickleback (Gasterosteusaculeatus) populations along a coastal-inland gradient[J]. Molecular Ecology, 2007, 16: 891-905. [23]Leinonen T, O′hara R B, Cano J M, et al. Comparative studies of quantitative trait and neutral marker divergence: a meta-analysis[J]. Journal of Evolutionary Biology, 2008, 21: 1-17. [24]Spitze K. Population-structure inDaphniaobtusa: quantitative genetic and allozymic variation[J]. Genetics, 135: 367-374. [25]Hijmans R J, Cameron S E, Parra J L, et al. Very high resolution interpolated climate surfaces for global land areas[J]. International Journal of Climatology, 2005, 25: 1965-1978. [26]Rohlf F J. NTSYS-PC: Numerical Taxonomy and Multivariate Analysis System Version 1.80[M]. Setauket New York: Distribution by Exeter SoftWare, 1994. [27]Mantel N. The detection of disease clustering and generalized regression approach[J]. Cancer Research, 1967, 27: 209-220. [28]辜云杰, 罗建勋, 吴远传, 等. 川西云杉天然种群表型多样性[J]. 植物生态学报, 2009, 33(2): 291-301. [29]Calamassi R, Puglisi S R, Vendramin G G. Genetic variation in morphological and anatomical needle characteristics inPinusbrutiaTen[J]. Silvae Genetica, 1988, 37: 199-206. [30]王娅丽, 李毅, 陈晓阳. 祁连山青海云杉天然群体表型性状遗传多样性分析[J]. 林业科学, 2008, 44(2): 70-77. [31]王娅丽, 李毅. 祁连山青海云杉天然群体的种实性状表型多样性[J]. 植物生态学报, 2008, 32(2): 355-362. [32]柳新红, 李因刚, 赵勋, 等. 白花树天然群体表型多样性研究[J]. 林业科学研究, 2011, 24(6): 694-700. [33]虞泓, 杨彩云, 徐正尧. 云南松居群花粉形态多态性[J]. 云南大学学报 (自然科学版), 1999, 21(2): 86-89. [34]邹春静, 卜军, 徐文铎. 长白松种群针叶性状及其变异的研究[J]. 生态学杂志, 1995, 14(2): 18-22.[35]罗建勋, 顾万春. 云杉天然群体表型多样性研究[J]. 林业科学, 2005, 41(2): 66-83. [36]张恒庆, 安利佳, 祖元刚. 天然红松种群形态特征地理变异的研究[J]. 生态学报, 1999, 19(6): 932-938. [37]虞泓, 黄瑞复. 云南松居群核型变异及其分化研究[J]. 植物分类学报, 1998, 36(3): 222-231. [38]Xu Y, Cai N, Woeste K, et al. Genetic diversity and population strulture ofPinusyunnanensisby simple sequence repeat marker[J]. Forest Science, 2016, 62(1): 38-47. [39]许玉兰. 云南松天然群体遗传变异研究[D]. 北京: 北京林业大学, 2015. [40]庞广昌, 姜冬梅. 群体遗传多样性和数据分析[J]. 林业科学, 1995, 31(6): 543-550. [41]Xu Y, Woeste K, Cai N, et al. Variation in needle and cone traits in natural populations ofPinusyunnanensis[J]. Journal of Forestry Research, 2016, 27(1): 41- 49. [42]Maley M L, Parker W H. Phenotypic variation in cone and needle characters ofPinusbanksiana(jack pine) in northwestern Ontario[J]. Canadian Journal of Botany, 1993, 71(1): 43-51. (责任编辑张坤) Study on the Phenotypic Differentiation of Needle Traits Among Populations ofPinusyunnanensis Xu Yulan1, Cai Nianhui1, Chen Shi1, Wang Dawei1, Duan Anan1, Kang Xiangyang2 (1. Key Laboratory for Forest Genetic and Tree Improvement & Propagation in Universities of Yunnan Province, Southwest Forestry University,Kunming Yunnan 650224, China; 2. National Engineering Laboratory for Tree Breeding, Beijing Forestry University, Beijing 100083, China) In this study, seven traits of ten bundle needles of each trees collected from 18 populations ofPinusyunnanensisin main distribution regions were measured. The results showed that there were significant differences both among populations and within populations in each needle trait, which suggested that there existed wide and abundant genetic variation inP.yunnanensispopulations. There were different variation tendency of each needle trait among populations. The phenotypic variation was more abundant within population than among populations. The coefficients of variation (CV) were lower than 50%. There were weak phenotypic differentiation or no phenotypic differentiation for each pair-wise population based on individual needle trait. Different needle traits revealed the genetic relationship among populations in varying degrees. The complex of the measured needle traits could reflect the genetic relationship among populations. The test on geographical and ecological distance with relations of genetic distance of each trait indicated that was no obvious effect of isolation by distance (IBD) and isolation of ecology (IBE) in needle trait, but the effect of IBE was more obvious than IBD. The phenotypic differentiation among populations may be influenced by the complex of the geographical, climatic and soil factors. Cluster analysis indicated that each popolation was not clustered entirely based on geographical distribution. Pinusyunnanensis, population, needle traits, phenotypic differentiation, genetic variation 10. 11929/j. issn. 2095-1914. 2016. 05. 001 2015-12-25 国家自然科学基金项目 (31260191) 资助;云南省林学一流学科建设经费资助;云南省高校林木遗传改良与繁育重点实验室开放基金资助。 S718.54 A 2095-1914(2016)05-0001-09 第1作者:许玉兰 (1979—),女,博士,副教授。研究方向:林木遗传改良。Email: xvyulan@163.com。

3 结论与讨论

