氮杂香豆雌酚衍生物的合成及其抗肿瘤活性
2016-10-25董见生袁静梅何国学潘成学苏桂发
董见生, 袁静梅, 何国学, 潘成学, 苏桂发
(广西师范大学 省部共建药用资源化学与药物分子工程国家重点实验室, 广西 桂林 541004)
氮杂香豆雌酚衍生物的合成及其抗肿瘤活性
董见生, 袁静梅, 何国学, 潘成学*, 苏桂发*
(广西师范大学 省部共建药用资源化学与药物分子工程国家重点实验室, 广西 桂林541004)
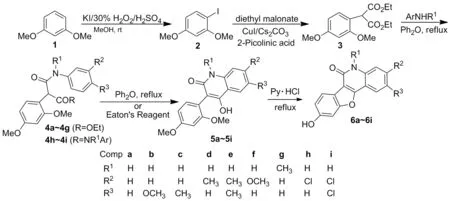
以间苯二甲醚为原料, 经碘代、偶联、胺解、分子内环化及脱甲醚环化共5步反应,合成9个氮杂香豆雌酚衍生物(6a~6i), 其结构经1H NMR,13C NMR 和APCI-MS表征。采用MTT法研究了6对Hela、 SKOV3、 BEL-7404、 HepG2及A-549等癌细胞的体外生长抑制活性。结果表明:6h对SKOV3细胞的生长抑制活性最高,其IC50值为81.58 μmol·L-1。
香豆雌酚; 天然产物结构改造; 合成; 抗肿瘤活性
雌激素受体(ER)是雌激素的效应器,主要有ERα和ERβ两种亚型结构,它们有着不同的靶器官及功能特异性,即同一配体不仅对两种亚型具有不同的效应,对不同靶组织中的同种亚型还表现出不同的作用。目前的研究成果证实:ER的过表达, 往往与乳腺、卵巢、直肠或子宫等器官的癌变有关;而ER的低表达,则往往会引起骨质疏松、心血管系统疾病、大脑认知能力下降及糖脂代谢疾病等[1]。选择性雌激素受体调节剂(SERMs),就是一类能够对不同靶组织的雌激素受体而表现出选择性调节功能的化合物,理想的SERMs是在骨骼、心血管、中枢神经系统等组织细胞中具有激动剂的作用,而在乳腺、子宫及卵巢等其他组织器官中起到拮抗剂的作用[2]。

Chart 1
Scheme 1
香豆雌酚(Coumestrol),又名考迈斯托醇、拟雌内酯等,兼具有香豆素和异黄酮骨架,与大豆苷元(Daidzein)、金雀异黄素(Genistein)及雌马酚(Equol)等在结构上具有同源性。 由于它们的骨架结构与内源性雌激素雌二醇(Estradiol)具有相似性(Chart 1),因而其对雌激素受体也表现出良好的调控作用[3],可抑制许多雌激素依赖的癌细胞的增殖[4],防止骨质疏松症[5]、缓解β-淀粉样蛋白引发的毒副作用等功效[6],因此香豆雌酚及其衍生物的合成一直受到关注[7]。
生物电子等排替换是设计各种新药及新活性分子的常用方法,特别是将某些活性化合物骨架中特定部位的O替换成N, 往往会获得活性或理化性质更好,或者得到比原化合物具有更广泛生物活性的新化合物[8-9]。Genisson课题组报道的具有抗肿瘤活性的Jaspine B[8],他们将母体中特定O变成N后,所得化合物的活性均比母体化合物好。杨春皓、王明伟研究员等[9]报道的雌马酚的结构改造,将其中的O变成N,合成出了N-杂Equol及其系列衍生物,活性研究发现它们对不同亚型雌激素受体也显示出较好的选择性。我们曾经将这一方法运用于天然产物苏木素(Brazilin)衍生物的合成和活性研究,也获得了抗肿瘤活性比母体化合物更佳的新化合物[10-11]。
本文以间苯二甲醚(1)为原料,经碘代、偶联、胺解、分子内环化及脱甲醚环化共5步反应,合成了9个氮杂香豆雌酚衍生物(Scheme 1),其结构经1H NMR,13C NMR 和APCI-MS表征。并测试了其对Hela, SKOV3, HepG2, BEL-7404及A-549等5种癌细胞的体外生长抑制活性。
1 实验部分
1.1仪器与试剂
X-4型数字显示显微熔点仪; Bruker Avance 500型超导核磁共振仪(DMSO-d6为溶剂, TMS为内标); BRUKER HCT型电喷雾质谱仪。
所有试剂均为分析纯。
1.2合成
(1) 2-碘-1,5-苯二甲醚(2)的合成
搅拌下将98%浓硫酸0.59 mL(10.86 mmol)滴加到溶有碘化钾1.2 g(7.24 mmol)和1 1.0 g(7.24 mmol)的无水甲醇(30 mL)溶液中,滴毕,加入30%的双氧水1.45 mL(14.48 mmol),于室温反应4 h。减压浓缩,用乙酸乙酯萃取,有机相依次用饱和亚硫酸氢钠溶液和饱和食盐水洗涤,无水硫酸钠干燥,减压浓缩,残留物经硅胶柱层析(洗脱剂:A=V石油醚∶V乙酸乙酯=45 ∶1)纯化得无色油状液体2 1.70 g,产率89%;1H NMRδ: 7.60(d,J=8.6 Hz, 1H, ArH), 6.42(d,J=2.4 Hz, 1H, ArH), 6.31(dd,J=8.6 Hz, 2.4 Hz, 1H, ArH), 3.84(s, 3H, OCH3), 3.78(s, 3H, OCH3)。
(2) 2-(2,4-二甲氧基苯基)丙二酸二乙酯(3)的合成
搅拌下依次向圆底烧瓶中加入碳酸铯3.13 g(9.6 mmol)、丙二酸二乙酯2.05 g(12.8 mmol)和1,4-二氧六环(6 mL),氮气保护,升温至50 ℃,反应30 min;依次加入 2 1.70 g(6.4 mmol)、碘化亚酮60.9 mg(0.032 mmol)和2-吡啶甲酸78.79 mg(0.64 mmol),加毕,反应1 h; 升温至90 ℃,反应24 h。减压浓缩,加入乙酸乙酯和蒸馏水,分液,水层用乙酸乙酯萃取,合并有机相,用饱和食盐水洗涤,无水硫酸钠干燥,减压浓缩,经硅胶柱层析(洗脱剂:A=12 ∶1)纯化得白色固体3 1.30 g,产率69%, m.p.48~49 ℃;1H NMRδ: 7.28(d,J=8.5 Hz, 1H, ArH), 6.52(dd,J=8.5 Hz, 2.4 Hz, 1H, ArH), 6.48(d,J=2.4 Hz, 1H, ArH), 5.04(s, 1H, CH), 4.36~4.11(m, 4H, CH2), 3.82(s, 3H, OCH3), 3.82(s, 3H, OCH3), 1.30~1.28(m, 6H, CH3)。
(3) 4h, 4i和5a~5g的合成通法
搅拌下,依次向50 mL双颈圆底烧瓶中加入3 1.48 g(5.0 mmol),芳胺(11.0 mmol )和二苯醚(10 mL),氮气保护下升温至230 ℃,反应15 h。冷却至室温,加入乙醚10 mL,于室温搅拌30 min(析出沉淀),抽滤,滤饼用乙醚洗涤,用乙醇重结晶或硅胶柱层析纯化得4h, 4i和5a~5g。
N,N′-双(3-氯苯基)-2-(2,4-二甲氧苯基)-丙二酰胺(4h,洗脱剂:A=1 ∶1): 白色固体1.05 g, 产率 42%, m.p.189~190 ℃;1H NMRδ: 10.31(s, 2H, NH), 7.84(s, 2H, ArH), 7.46(s, 2H, ArH), 7.33(s, 2H, ArH), 7.10(s, 2H, ArH), 7.04(d,J=8.5 Hz, 1H, ArH), 6.60(d,J=2.4 Hz, 1H, ArH), 6.54(dd,J=8.5 Hz, 2.4 Hz, 1H, ArH), 5.05(s, 1H, CH), 3.78(s, 3H, OCH3), 3.76(s, 3H, OCH3)。
N,N′-双(3,4-二氯苯基)-2-(2,4-二甲氧苯基)-丙二酰胺(4i,洗脱剂:A=1 ∶1): 白色固体1.19 g, 产率43%, m.p.236~237 ℃;1H NMRδ: 10.44(s, 2H, NH), 8.01(s, 2H, ArH), 7.56(s, 2H, ArH), 7.50(s, 2H, ArH), 7.03(d,J=8.5 Hz, 1H, ArH), 6.60(d,J=2.4 Hz, 1H, ArH), 6.54(dd,J=8.5 Hz, 2.4 Hz, 1H, ArH), 5.05(s, 1H, CH), 3.78(s, 3H, OCH3), 3.76(s, 3H, OCH3)。
3-(2,4-二甲氧苯基)-4-羟基-1H-喹啉-2-酮(5a): 土黄色固体1.30 g, 产率34%, m.p.292~293 ℃; APCI-MSm/z: 296.1{[M-H]-}。
3-(2,4-二甲氧苯基)-4-羟基-6-甲氧基-1H-喹啉-2-酮(5b): 灰色固体1.47 g,产率33%, m.p.>300 ℃;1H NMRδ: 11.06(s, 1H, NH), 9.59(s, 1H, OH), 8.01(s, 1H, ArH), 7.94(1H, d,J=8.6 Hz, ArH), 7.21(1 H, d,J=8.6 Hz, ArH), 7.03~6.56(m, 3H, ArH), 3.95(s, 3H, OCH3), 3.85(s, 3H, OCH3), 3.83(s, 3H, OCH3)。
3-(2,4-二甲氧苯基)-4-羟基-6-甲基-1H-喹啉-2-酮(5c): 灰白色固体2.46 g, 产率60%, m.p.286~287 ℃;1H NMRδ: 11.22(s, 1H, NH), 9.49(s, 1H, OH), 7.66(s, 1H, ArH), 7.30(d,J=8.4 Hz, 1H, ArH), 7.17(d,J=8.4 Hz, 1H, ArH), 7.02(d,J=8.3 Hz, 1H, ArH), 6.65~6.52(m, 2H, ArH), 3.80(s, 3H, OCH3), 3.68(s, 3H, OCH3), 2.35(s, 3H, CH3)。
3-(2,4-二甲氧苯基)-4-羟基-7-甲基-1H-喹啉-2-酮(5d): 白色固体2.09 g, 产率51%, m.p.>300 ℃;1H NMRδ: 11.06(s, 1H, NH), 9.42(s, 1H,OH), 7.30~7.22(m, 2H, ArH), 7.12(d,J=8.1 Hz, 1H, ArH), 6.81(d,J=2.3 Hz, 1H, ArH), 6.78(dd,J=8.1 Hz, 2.3 Hz, 1H, ArH), 3.87(s, 3H, OCH3), 3.73(s, 3H,OCH3), 2.43(s, 3H, CH3)。
3-(2,4-二甲氧苯基)-4-羟基-6,7-二甲基-1H-喹啉-2-酮(5e): 白色固体2.49 g,产率58%, m.p.289~290 ℃;1H NMRδ: 11.13(s, 1H, NH), 9.40(s, 1H,OH), 7.61(s, 1H, ArH), 7.05~6.98(m, 2H, ArH), 6.60(d,J=2.3 Hz, 1H, ArH), 6.56(dd,J=8.3 Hz, 2.3 Hz, 1H, ArH), 3.80(s, 3H, OCH3), 3.67(s, 3H, OCH3), 2.29(s, 3H, CH3), 2.27(s, 3H,CH3)。
3-(2,4-二甲氧苯基)-4-羟基-7-甲氧基-1H-喹啉-2-酮(5f): 白色固体2.4 g,产率56%, m.p.>300 ℃;1H NMRδ: 11.29(s, 1H, NH), 9.53(s, 1H, OH), 7.96(1H, d,J=8.8 Hz, ArH), 7.11(1 H, d,J=8.8 Hz, ArH), 7.04~6.52(m, 4H, ArH), 3.94(s, 3H, OCH3), 3.85(s, 3H,OCH3), 3.81(s, 3H, OH3)。
3-(2,4-二甲氧苯基)-4-羟基-1-甲基-1H-喹啉-2-酮(5g): 白色固体1.52 g, 产率37%, m.p.175~176 ℃;1H NMRδ: 8.05(s, 1H,OH), 7.58(ddd,J=8.6 Hz, 7.2 Hz, 1.6 Hz, 1H, ArH), 7.35(d,J=8.4 Hz, 1H, ArH), 7.30(d,J=8.4 Hz, 1H, ArH), 7.27~7.22(m, 1H, ArH), 6.64~6.56(m, 2H, ArH), 6.52(s, 1H, ArH), 3.81(s, 3H, OCH3), 3.70(s, 3H, OCH3), 3.31(s, 3H,CH3)
(4) 5h和5i的合成
搅拌下依次向圆底烧瓶中加入甲磺酸(5 mL)和五氧化二磷(m甲磺酸∶m五氧化二磷=10 ∶1),将新配制的伊顿试剂[20]升温至80 ℃,反应15 min;加入4h(或4i, 1.0 mmol),升温至130 ℃,反应3 h;冷却至室温,加入冰水10 g,搅拌30 min,抽滤,滤饼用蒸馏水洗涤,乙醇重结晶得5h和5i。
3-(2,4-二甲氧苯基)-4-羟基-7-氯-1H-喹啉-2-酮(5h): 灰色固体0.21 g, 产率61%, m.p.218~220 ℃;1H NMRδ: 11.62(s, 1H, NH), 10.21(s, 1H, OH), 7.87(d,J=8.5 Hz, 1H, ArH), 7.49~7.46(m, 1H, ArH), 7.34~7.15(m, 3H, ArH), 7.05~6.87(m, 1H, ArH), 3.94(s, 3H, OCH3), 3.82(s, 3H, OCH3)。
3-(2,4-二甲氧苯基)-4-羟基-6,7-二氯-1H-喹啉-2-酮(5i): 灰色固体0.19 g, 产率52%, m.p.>300 ℃;1H NMRδ:11.74(s, 1H, NH), 10.04(s, 1H, OH), 7.72(d,J=8.9 Hz, 1H, ArH), 7.46~7.43(m, 2H, ArH), 7.29(d,J=8.9 Hz, 1H, ArH), 6.89(s, 1H, ArH), 4.04(s, 3H, OCH3), 3.84(s, 3H, OCH3)。
(5) 6a~6i的合成通法
在50 mL圆底烧瓶中加入5(5.0 mmol)和吡啶盐酸盐20 g,搅拌下于210 ℃(浴温)反应2 h。冷却至室温,加入冷水(20 mL),于室温搅拌30 min,有沉淀生成,抽滤,滤饼用蒸馏水洗涤,乙醇重结晶得6a~6i。
9-羟基-5H-11-氧-5-氮-苯并[a]芴-6-酮(6a): 灰色固体0.42 g,产率28%, m.p.>300 ℃;1H NMRδ: 13.10(s, 1H, NH), 9.87(s, 1H, OH), 8.33(d,J=7.7 Hz, 1H, ArH), 7.90(d,J=7.7 Hz, 1H, ArH), 7.70(d,J=6.3 Hz, 2H, ArH), 7.42(t,J=6.3 Hz, 1H, ArH), 7.05(d,J=1.4 Hz, 1H, ArH), 6.87(dd,J=8.3 Hz, 1.6 Hz, 1H, ArH);13C NMRδ: 160.2, 158.5, 157.2, 156.1, 139.7, 139.4, 122.0, 119.0, 115.9, 112.5, 112.3, 107.3, 105.2, 101.8, 99.4; APCI-MSm/z: 252.0{[M+H]+}。
2-甲氧基-9-羟基-5H-11-氧-5-氮-苯并[a]芴-6-酮(6b): 灰色固体0.54 g,产率33%, m. p.>300 ℃;1H NMRδ: 13.13(s, 1H, NH), 9.21(s, 1H, OH), 7.73(d,J=8.1 Hz, 1H, ArH), 7.57(d,J=2.9 Hz, 1H, ArH), 7.34(d,J=8.8 Hz, 1H, ArH), 6.92(dd,J=8.8 Hz, 3.0 Hz, 1H, ArH), 6.77(d,J=2.1 Hz, 1H, ArH), 6.61(dd,J=8.1 Hz, 2.1 Hz, 1H, ArH);13C NMRδ: 169.4, 165.7, 154.1, 152.5, 150.6, 141.6, 127.2, 119.9, 118.7, 118.5, 109.5, 107.2, 98.8, 97.46; APCI-MSm/z: 265.9{[M-H]-}。
3-甲基-9-羟基-5H-11-氧-5-氮-苯并[a]芴-6-酮(6c): 灰色固体1.02 g, 产率63%, m.p.>300 ℃;1H NMRδ: 13.25(s, 1H, NH), 9.74(s, 1H, OH), 8.09(s, 1H, ArH), 7.86(s, 1H, ArH), 7.52(d,J=6.8 Hz, 2H, ArH), 7.04(s, 1H, ArH), 6.86(dd,J=8.2 Hz, 1.5 Hz, 1H, ArH), 2.46(s, 3H, CH3); APCI-MSm/z: 263.9{[M-H]-}。
2-甲基-9-羟基-5H-11-氧-5-氮-苯并[a]芴-6-酮(6d): 灰白色固体0.86 g, 产率53%, m.p.>300 ℃;1H NMRδ: 13.22(s, 1H, NH), 9.84(s, 1H, OH), 8.24(s, 1H, OH), 7.91(s, 1H, ArH), 7.48(s, 1H, ArH), 7.27(s, 1H, ArH), 7.08(s, 1H, ArH), 6.90(s, 1H, ArH), 2.47(s, 3H, CH3); APCI-MSm/z: 263.9{[M-H]-}。
2,3-二甲基-9-羟基-5H-11-氧-5-氮-苯并[a]芴-6-酮(6e): 灰白色固体1.06 g, 产率62%, m.p.>300 ℃;1H NMRδ: 9.85(s, 1H, NH), 8.05(s, 1H, ArH), 7.87(d,J=8.2 Hz, 1H, ArH), 7.46(s, 1H, ArH), 7.03(s, 1H, ArH), 6.85(d,J=8.1 Hz, 1H, ArH), 2.35(s, 6H, CH3);13C NMRδ: 159.41, 156.14, 152.97, 140.47, 138.35, 131.99, 123.81, 121.49, 120.74, 114.92, 112.10, 100.92, 98.34, 19.89, 19.40; APCI- MSm/z: 280.0{[M+H]+}。
3,9-二羟基-5H-11-氧-5-氮-苯并[a]芴-6-酮(6f): 灰白色固体0.83 g, 产率51%, m.p.>300 ℃;1H NMRδ: 11.68(s, 1H, NH), 10.26(s, 1H, OH), 9.88(s, 1H, OH), 7.81(dd,J=8.5 Hz, 6.1 Hz, 2H, ArH), 7.79(d,J=1.8 Hz, 1H, ArH), 7.12(d,J=1.8 Hz, 1H, ArH), 6.90(ddd,J=5.8 Hz, 2.8 Hz, 1.8 Hz, 2H, ArH), 6.79(dd,J=8.7 Hz, 2.2 Hz, 1H, ArH);13C NMRδ: 159.6, 159.5, 157.70, 156.49, 155.88, 139.84, 122.31, 121.03, 115.89, 113.21, 112.35, 107.33, 104.00, 100.98, 98.43; APCI-MSm/z: 265.9{[M-H]-}。
9-羟基-5-甲基-5H-11-氧-5-氮-苯并[a]芴-6-酮(6g): 灰色固体0.79 g, 产率: 49%, m.p.>300 ℃;1H NMRδ: 9.85(s, 1H, OH), 8.33(s, 1H, ArH), 7.90(d,J=8.2 Hz, 1H, ArH), 7.70(t,J=6.9 Hz, 2H, ArH), 7.43(s, 1H, ArH), 7.06(d,J=1.8 Hz, 1H, ArH), 6.87(dd,J=8.3 Hz, 1.9 Hz, 1H, ArH), 3.39(s, 3H, CH3); APCI-MSm/z: 263.9{[M-H]-}。
3-氯-9-羟基-5H-11-氧-5-氮-苯并[a]芴-6-酮(6h): 灰色固体0.17 g, 产率22%, m.p.>300 ℃;1H NMRδ:12.28(s, 1H, CONH), 11.69(s, 1H, OH), 8.46(s, 1H, ArH), 7.55~7.41(m, 3H, ArH), 7.36~7.35(m, 2H, ArH);13C NMRδ: 158.22, 156.27, 155.55, 139.83, 130.63, 127.47, 125.55, 124.15, 121.63, 115.35, 114.70, 109.38; APCI-MSm/z: 285.9{[M+H]+}。
2,3-二氯-9-羟基-5H-11-氧-5-氮-苯并[a]芴-6-酮(6i): 灰色固体0.15 g,产率19%, m.p.>300 ℃;1H NMRδ: 12.37(s, 1H, CONH), 11.77(s, 1H, OH), 8.46(s, 1H, ArH), 7.91(s, 1H, ArH), 7.71(t,J=8.0 Hz, 1H, ArH), 7.42(t,J=8.0 Hz, 1H, ArH), 7.35(s, 1H, ArH); APCI-MSm/z: 319.9{[M+H]+}。
1.3MTT法体外抗肿瘤活性测试
取对数生长期细胞(密度为5×104个/mL)接种于96孔细胞板中, 二氧化碳培养箱中培养24 h, 使细胞贴壁。向96孔细胞板中每孔加入2 μL浓度梯度的药物, 阴性和阳性对照分别加入DMSO和5-Fu, 每种药物的浓度设0.5, 1.0, 5.0, 10, 20 μmol·L-15个梯度, 每个梯度设3个平行孔, 培养箱中孵育48 h。向细胞板中的每孔加入5 mg·mL-1MTT(20 μL)后, 放入培养箱继续孵育4 h。弃去96孔细胞板中的培养液, 每孔加入100 μL二甲基亚砜, 置于摇床上低速振荡10~15 min 使甲瓒充分溶解。在酶联免疫检测仪OD 490 nm处检测各孔的吸光值。用以下公式计算化合物对肿瘤细胞的增殖抑制: 抑制率=(1-样品组OD值/对照组OD值)×100%,用Bliss法分别计算化合物对肿瘤细胞株的IC50值, 所有实验重复3次后取平均值。
2 结果与讨论
2.1合成
在3与芳胺的胺解反应中, 如果芳胺上没连有钝化基团, 则胺解后随即发生环化反应得到喹啉酮化合物4a~4g; 如果芳胺上连有弱的钝化基如卤原子等, 则反应产物为双胺解产物4h(4i), 进一步增加反应时间或提高反应温度, 环化反应也难以进行。我们经过许多尝试, 最后采用伊顿试剂[12]顺利实现了环化, 得到了目标产物5h(5i); 而当芳环上连有强吸电子基团如硝基时, 胺解反应则很难进行。
在5的脱甲醚保护反应中, 我们以吡啶盐酸盐作为脱甲醚试剂. 产物的1H NMR和APCI-MS证实脱甲醚反应完成后, 生成的脱甲醚产物会进一步发生脱水环化直生成6。 5和6在常见有机溶剂中溶解性均比较差, 使得我们很难用13C NMR对其结构进行表征。
2.2抗肿瘤活性
采用MTT法测试了6对Hela, SKOV3, BEL-7404, HepG2及A-549等癌细胞的体外生长抑制活性,结果见表1。由表1可见,6对常见的雌激激素依赖还是非雌激素依赖的癌细胞, 其抑制作用均比较弱。其中6h对SKOV3细胞的抑制活性最高,IC50值为81.58 μmol·L-1。6a对Hela, SKOV3, HepG2细胞,6c对SKOV3, BEL-7404细胞及6d对 BEL-7404, A-549细胞也显示了一定的生长抑制作用。

表1 6的体外抗肿瘤活性
3 结论
以间苯二甲醚为原料, 经5步反应合成了9个氮杂香豆雌酚衍生物, 用MTT法研究了6对Hela、 SKOV3、 BEL-7404, HepG2及A-549等癌细胞的体外生长抑制活性。结果表明: 6a、 6c、 6d及6h对5种受试癌细胞中的个别细胞株显示了一定的生长抑制作用。其中6h对SKOV3细胞的生长抑制活性最高,其IC50值为81.58 μmol·L-1。化合物在调节骨类代谢、心血管系统及神经系统等方面的活性,将是我们后续研究的重点。
[1]Sirop S J, Ingle J N, Goetz M P. Clinical use of selective estrogen receptor modulators and aromatase inhibitors in prevention and adjuvant treatment of breast cancer[J].Transl Endocrinology Metab,2012,3:139-167.
[2]郑阳钒,周海兵. 金属有机类选择性雌激素受体调节剂(SERMs)研究进展[J].中国药物化学杂志,2012,22:236-245.
[3]Ndebele K, Graham B, Tchounwou P. Estrogenic activity and molecular mechanisms of coumestrol-induced biological effects[J].Food Nutr Comp Focus,2013,5:518-528.
[4]梁占超,钟燕,刘靖,等. 雌激素药物中间体6-酮雌二醇的合成[J].合成化学,2011,19:428-429.
[5]Ye S F, Saga I, Ichimura K,etal. Coumestrol as well as isoflavones in soybean extract prevent bone resorption in ovariectomized rats[J].Endocrine Regulations,2003,37:145-152.
[6]Liu M H, Tsuang F Y, Sheu S Y,etal. The protective effects of coumestrol against amyloid-beta peptide- and lipopolysaccharide-induced toxicity on mice astrocytes[J].Neurological research,2011,33:663-672.
[7]Yao T L, Yue D W, Larock R C. An efficient synthesis of coumestrol and coumestans by iodocyclization and Pd-catalyzed intramolecular lactonization[J].J Org Chem,2005,70:9985-9989.
[8]Rives A, Ladeira S, Levade T,etal. Synthesis of Cytotoxic Aza Analogues of Jaspine B[J].J Org Chem,2010,75:7920-7923.
[9]Chen W, Lin Z, Ning M,etal. Aza analogues of equol:Novel ligands for estrogen receptorβ[J].Bioorg Med Chem,2007,15:5828-5836.
[10]Pan C X, Zeng X H, Guan Y F,etal. Design and synthesis of brazilin-like compounds [J].Synlett,2011,19,4250-4256.
[11]潘成学,关一富,张洪彬. 氮杂Brazilin/二芳基茚杂合物的合成研究[J].有机化学,2012,32:1116-1120.
[12]Eaton P E, Carlson G R, Lee J T. Phosphorus pentoxide-methanesulfonic acid.Convenient alternative to polyphosphoric acid[J].J Org Chem,1973,38:4071-4073.
Synthesis and Preliminary Antitumor Activities of Aza-coumestrol Derivatives
DONG Jian-sheng,YUAN Jing-mei,HE Guo-xue,PAN Cheng-xue*,SU Gui-fa*
(State Key Laboratory for Chemistry and Molecular Engineering of Medicinal Resources, Guangxi Normal University, Guilin 541004, China)
Nine aza-coumestrol derivatives (6a~6i)were obtained by 5 steps including iodination, coupled reaction, aminolysis, intramolecular cyclization and the demethyl-cyclization using 1,3-dimethoxy-benzene as starting material. The structures were characterized by1H NMR,13C NMR and APCI-MS. Theinvitroanti-tumor activities of 6 against Hela, SKOV3, BEL-7404, HepG2 and A-549 were investigated by MTT method. The results demonstrated that 6h exhibited better inhibition activity against SKOV3 with IC50of 81.58 μmol·L-1.
coumestrol; structural modification of natural products; synthesis; antitumor activity
2015-11-26;
2016-06-21
国家自然科学基金资助项目(21162002, 21462008); 广西自然科学基金资助项目(2014GXNSFAA118053, 2015GXNSFDA139009); 药用资源化学与药物分子工程教育部重点实验室基金资助项目(CMEMR2012-A014, CMEMR2014-A01); 广西医药产业人才小高地基金资助项目(1308)
董见生(1984-) ,男,汉族,山东曹县人,硕士研究生,主要从事药物化学研究。
潘成学,博士,教授, E-mail: chengxuepan@163.com; 苏桂发,博士,教授, E-mail: edward_su75@163.com
O625.5; O621.3
ADOI: 10.15952/j.cnki.cjsc.1005-1511.2016.09.15390
