四种抗凝方法对连续静脉-静脉血液滤过术中滤器寿命的影响及安全性
2016-10-24洪欢彭松张琳
洪欢,彭松,张琳
(安徽医科大学第三附属医院,合肥230000)
四种抗凝方法对连续静脉-静脉血液滤过术中滤器寿命的影响及安全性
洪欢,彭松,张琳
(安徽医科大学第三附属医院,合肥230000)
目的 探讨低分子肝素(LMWH)、局部枸橼酸盐、肝素以及无肝素抗凝法对连续静脉-静脉血液滤过(CVVH)中滤器寿命的影响及安全性。方法 选择肾功能衰竭患者56例,进行床旁CVVH治疗75例次,按抗凝方式分为无肝素抗凝组(A组11例次)、低分子肝素组(B组16例次)、局部枸橼酸盐组(C组24例次)、肝素组(D组24例次),比较各组滤器寿命、治疗停止原因、相关的代谢异常和出血并发症。结果 四组中,C组滤器使用寿命45.7 h明显长于A组的21.7 h、B组的34.7 h、D组的40.2 h(P均<0.01)。Kaplan-Meier生存曲线显示四组抗凝方法的滤器寿命比较,P<0.01;C、D组长于A、B组(P均<0.01)。四组治疗中均未出现严重酸碱平衡电解质紊乱,新发出血事件差异无统计学意义(P均>0.05)。结论 局部枸橼酸盐抗凝与低分子肝素抗凝、肝素抗凝、无肝素抗凝法相比能明显延长滤器使用寿命,并且不增加严重代谢紊乱及出血风险。
连续静脉-静脉血液滤过;抗凝方法;肝素;低分子肝素;枸橼酸盐
近年来,连续性肾脏替代治疗(CRRT)发展迅速,因其血流动力学稳定、溶质清除率高及能清除炎性因子等特点,在重症监护室(ICU)、肾内科等得到了广泛应用[1]。有效抗凝可提高连续静脉-静脉血液滤过(CVVH)的连续性。本研究对低分子肝素(LMWH)、局部枸橼酸盐、肝素以及无肝素抗凝法对CVVH术中滤器寿命的影响及安全性进行了探讨。
1 资料与方法
1.1临床资料 收集本院ICU 2014年12月~2015年10月因肾功能衰竭在床旁行CVVH 患者56例,共行CVVH 75例次,男43例、女13例,年龄(66.18±2.07)岁,急性生理和慢性健康评分(23.84±0.88)分;有创机械通气34例;肾脏疾病25例,重症胰腺炎6例,感染13例,外科术后等其他疾病12例。纳入标准:年龄>18岁。排除严重肝脏疾病患者。根据抗凝方式,随机将患者分为A组(8例,11例次)、B组(11例,16例次)、C组(20例,24例次)、D组(17例,24例次)。各组患者临床基本资料比较差异无统计学意义。
1.2CVVH及抗凝方法 采用德国金宝Prismaflex血滤系统,血滤器为PrismaflexM100set。CVVH血流速度为150~200 mL/min,均采用前稀释模式,置换液流量为(2~4)L/h,血管通路采用颈内静脉或股静脉双腔管路。A组予以5 000~20 000 U肝素预冲管路,治疗过程中给予生理盐水100 mL/h,每小时冲洗1次;维持血流量200~300 mL/min。B组予以LMWH,首次剂量为15~20 U/kg,追加剂量为每小时5~10 U/kg,每4~6 h监测APTT。C组予以枸橼酸钠溶液,以40~60 mmol/h泵入,由血滤管静脉端补充10%葡萄糖酸钙,每2~4 h监测iCa2+浓度,维持全身Ca2+浓度1.0~1.3 mmol/L。D组给予肝素,首剂2 500~5 000 U,或负荷剂量25~30 U/kg,后以10~50 U/kg静脉维持,每2~4 h监测APTT,根据患者出血高危、中危、低危风险,分别维持APTT为30、45、60 s。

2 结果
2.1滤器寿命 A、B、C、D组滤器使用时间分别为21.7(18~25)、34.7(30~39)、45.7(41~50)、40.2(36~45)h;四组比较,P<0.01,C、D组长于A、B组(P均<0.01),C、D组比较,P<0.05。四组滤器寿命Kaplan-Meier生存曲线结果显示四组中位使用时间分别为20、32、47、45 h;四组比较,P<0.01,C、D组长于A、B组(P均<0.01)。见图1。四组滤器使用停止原因均主要由于跨膜压高,四组因死亡、好转、检查等人为停止分别为A组2例,B组3例,C组7例,D组8例。
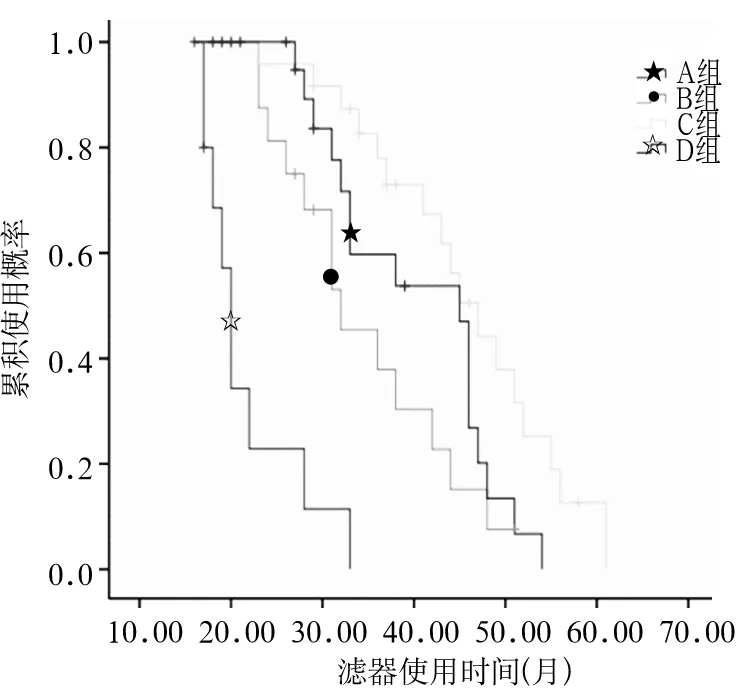
图1 四组滤器使用寿命生存曲线(Kaplan-Meier法)
2.2不良事件A、B、C、D组治疗后pH值分别为7.42±0.46、7.41±0.45、7.40±0.38、7.37±0.12,四组比较,P>0.05;乳酸分别为(1.40±0.40)、(1.35±0.40)、(1.24±0.33)、(1.20±0.35)mmol/L,四组比较,P>0.05;血清Ca2+浓度分别为(2.41±0.22)、(2.51±1.94)、(2.42±1.47)、(2.45±1.34)mmol/L,四组比较,P>0.05;HCO3-的浓度分别为(24.91±2.30)、(24.69±2.24)、(24.58±2.22)、(24.14±2.19)mmol/L,四组比较,P>0.05;治疗后血小板下降>30%分别为1、0、0、2例,四组比较,P>0.05;血红蛋白下降>30%分别为0、3、4、4例,四组比较,P>0.05;新发出血事件分别为2、3、1、1例,四组比较,P>0.05。
3 讨论
CVVH可以纠正电解质酸碱平衡紊乱,维持机体容量平衡和清除致病物质[2,3],近年在危重病患者治疗中应用广泛。安全有效的抗凝方式是CVVH持续有效进行的保障。
本研究对具有高危出血风险同时有抗凝剂禁忌的患者,选择无肝素抗凝剂法,得出A组相对于B、C、D组滤器使用寿命短,易造成管路、滤器凝血,影响疗效,增加医疗成本的结论。Bellomo等[4]报道的高出血风险患者进行无抗凝的CVVH中,无抗凝剂平均滤器寿命可达40.9 h,与本研究21.7 h存在一定差异。考虑导致差异原因为不同中心人员操作熟悉程度、CVVH模式、CVVH治疗剂量、生物膜的选用等方面存在差异。
普通肝素在体内外均具有强大的抗凝作用,主要机制是与抗凝血酶Ⅲ结合,可影响凝血的多个环节。活化部分凝血活酶时间(APTT)是反映普通肝素抗凝效果及安全性的有效指标。本研究D组相对于A、B组滤器使用寿命较长,与肝素抗凝可监测APTT、可及时调整剂量有一定相关性。LMWH可迅速灭活凝血因子Ⅹa,对凝血酶Ⅱa作用减弱,出血风险相对普通肝素低,可用于高危出血患者,但其抗凝作用相对较弱,相对于C、D组滤器使用寿命短。如果增加抗凝剂量将增加出血风险,但抗凝剂量不足又易导致凝血,造成管路、滤器凝血以及影响滤器使用寿命和疗效[5,6]。本研究中四组出血事件差异无统计学意义,与B组患者病情相对较轻、定期监测凝血功能有一定关系。但对于出血高危患者,LMWH和普通肝素均已不能满足CVVH治疗的需求,而无抗凝剂又容易造成管路凝血,严重影响滤器使用寿命,影响疗效及安全性,增加医疗成本。
枸橼酸钠可络合血液中的Ca2+,阻止凝血酶原转化为凝血酶从而起到抗凝作用,此反应为可逆反应,在外周静脉血中补充足够钙离子即可恢复凝血功能,可以达到体外循环抗凝而无全身抗凝作用[7]。此外,与普通肝素相比,枸橼酸钠生物相容性好,可避免肝素引起的血白细胞、血小板下降,抑制黏附分子表达等[8]。Liu等[9]的前瞻性研究中纳入了30例无出血高危倾向的ICU患者,发现枸橼酸钠抗凝是肝素抗凝滤器寿命的4倍,并且COX风险比例模型分析发现枸橼酸钠是滤器寿命延长的独立预测因子。而最近更多的研究发现枸橼酸钠比全身肝素抗凝的滤器寿命延长上更具优势[10,11]。本研究中C组滤器使用寿命明显优于A、B、D组,而血清pH值、乳酸、Ca2+、HCO3-、血小板下降及血红蛋白下降患者所占百分比和出血风险差异无统计学意义。与本研究具备血气分析仪,可以及时有效监测床旁血气,血清Ca2+、HCO3-浓度有一定相关性。
本研究为单中心、回顾性研究,四组患者在抗凝方法选择上并非随机性选择,对于高危出血风险患者倾向选择无抗凝剂及枸橼酸钠抗凝,造成治疗前及治疗后凝血功能指标差异具有统计学意义,也可能低估LMWH及肝素出血风险。总之,CVVH治疗在选择合理抗凝方法同时,应兼顾能延长滤器使用时间、减少生物不良反应等方面。枸橼酸盐作为抗凝剂,无论是应用范围、抗凝作用、滤器使用时间、出血风险等方面有一定优势,具有较好前景。
[1] Honore PM, Jacobs R, Joannes-Boyau O, et al. Septic AKI in ICU patients. diagnosis, pathophysiology, and treatment type, dosing, and timing: a comprehensive review of recent and future developments[J]. Ann Intensive Care, 2011,1(1):32.
[2] Kellum JA, Mehta RL, Angus DC, et al. The first international consensus conference on continuous renal replacement therapy[J]. Kidney Int, 2002,62(5):1855-1863.
[3] Ronco C, Bellomo R, Homel P, et al. Effects of different does in continuous veno-venous haemo-filtration on outcome of acute renal failure: a prospective randomised trial[J]. Lancet, 2000,356 (9223):26-30.
[4] Bellomo R, Teede H, Boyce N. Anticoagulant regimens in acute continuous hemodiafiltration:a comparative study[J].Intensive Care Med, 1993,19(6):329-332.
[5] Uchino S, Fealy N, Baldwin I, et al. Continuous is not continuous: the incidence and impact of circuit "down time" on uraemic control during continuous veno-venous haemofiltration[J]. Intensive Care Med, 2003,29(4):575-578.
[6] Schiffl H, Lang SM, Fisher R, et al. Daily hemodialysis and the outcome of acute renal failure[J]. N Engl J Med, 2002,346(5):305-310.
[7] 张凯悦,季大玺,徐斌.局部枸橼酸联合小剂量低分子肝素抗凝在连续肾脏替代治疗中的应用[J].肾脏病与透析肾移植杂志,2012,21(4):311-316.
[8] Dhondt A, Vanholder R, Tielemans C, et al. Effect of regional citrate anticoagulation on leuko- penia, of leukocyte surface molecules complement activation, and expression during hemodialysis with unmodified cellulose membrane[J]. Nephron, 2000,85(4):334-342.
[9] Liu C, Mao Z, Kang H, et al. Regional citrate versus heparin anticoagulation for continuous renal replacement therapy in critically illpatients: a meta-analysis with trial sequential analysis of randomized controlled trials[J]. Crit Care, 2016,20(1):144.
[10] Tovey L, Dickie H, Gangi S, et al. Beyond the randomized clinical trial: citrate for continuous renal replacement therapy in clinical practice[J]. Nephron Clin Pract, 2013,124(1-2):l19-123.
[11] Kalb R, Kram R, Morgera S, et al. Regional citrate an ticoagulation for high volume continuous venovenous hemodialysis in surgical patients with high bleeding risk[J]. Ther Apher Dial, 2013,17(2):202-212.
10.3969/j.issn.1002-266X.2016.29.032
R969.4
B
1002-266X(2016)29-0088-03
2016-01-26)
