艾芬地尔预处理对七氟醚致幼年大鼠学习记忆能力损伤的保护作用及机制
2016-10-24刘真真金延武冯颢王晓雷赵鑫
刘真真,金延武,冯颢,王晓雷,赵鑫
(山东大学第二医院,济南 250100)
艾芬地尔预处理对七氟醚致幼年大鼠学习记忆能力损伤的保护作用及机制
刘真真,金延武,冯颢,王晓雷,赵鑫
(山东大学第二医院,济南 250100)
目的探讨N-甲基-D-天冬氨酸受体亚型(NR2B受体)拮抗剂艾芬地尔对七氟醚导致的幼年大鼠学习记忆能力损伤的保护作用及机制。方法 出生后7 d的雄性SD大鼠随机分为四组:对照组(Con组)给予腹腔注射双蒸水10 mg/kg后暴露在30%氧气下4 h;艾芬地尔组(Ifen组)给予腹腔注射艾芬地尔(10 mg/kg)后暴露在30%氧气下4 h;七氟醚组(Sev组)腹腔注射双蒸水后暴露在2%七氟醚4 h;七氟醚+艾芬地尔组(Sev+Ifen组)给予腹腔注射艾芬地尔后暴露在2%七氟醚下4 h。用Western blotting、免疫荧光法检测大鼠海马区NR2B及凋亡相关蛋白半胱氨酸蛋白酶3(Caspase-3)、聚腺苷二磷酸核糖聚合酶(PARP)的表达。大鼠于出生后40 d行Morris 水迷宫和避暗实验评估其学习记忆能力。结果 与Con组及Sev+ Ifen组比较,Sev、Ifen组NR2B、Caspase-3、PARP、Caspase-3阳性细胞百分比均升高(P<0.05或<0.01),Con组及Sev+ Ifen组比较,P均>0.05。在定位航行实验中,Sev组的潜伏期于第2、3天长于Con组(P均<0.05)。空间探索实验中,各组目标象限的时间百分比比较差异无统计学意义(P均>0.05)。避暗实验结果表明,与Con组比较,Ifen、Sev组记忆潜伏期缩短(P均 <0.05),Sev+ Ifen组差异无统计学意义(P>0.05)。结论 预先给予艾芬地尔可减少七氟醚对幼鼠学习记忆能力的损伤,其机制可能与抑制NR2B表达及其所诱导的细胞凋亡有关。
记忆能力损伤;七氟醚;艾芬地尔;N-甲基-D-天冬氨酸受体;幼鼠
七氟醚对啮齿类动物中枢神经系统的损伤作用已被多次报道[1~3]。然而,其作用机制尚未明确。以往研究发现,N-甲基-D-天冬氨酸(NMDA)受体在学习、记忆、认知等环节中起重要作用[4]。在发育期海马神经元中,NMDA 受体2B亚型(NR2B受体)可以传导神经元存活、死亡,以及突触强化的信号[5]。因此,七氟醚对幼鼠产生的学习认知能力的损伤可能与NR2B受体有关。NR2B受体的选择性拮抗剂艾芬地尔的神经保护作用已被多项研究验证,而作为神经保护剂,艾芬地尔是否可以减轻麻醉药所造成的神经系统损伤,这在以往的研究中尚未见报道。2013年9月~2015年7月我们探讨了艾芬地尔在七氟醚所致中枢神经系统损伤中的保护作用及其机制。
1 材料与方法
1.1材料动物:18只清洁级Sprague-Dawley孕鼠,饲以实验室平衡饲料,自由进食饮水,12 h光照,12 h黑暗,室温维持在22~25 ℃,空气湿度维持在55%~60%,饲养环境保持安静。试剂及仪器:七氟醚(百特,美国),NR2B抗体(Millipore,美国),半胱氨酸蛋白酶3(Caspase-3)抗体(Sigma,美国)、聚腺苷二磷酸核糖聚合酶(PARP)抗体(Sigma,美国),甘油醛-3-磷酸脱氢酶(GAPDH)抗体(康成公司),艾芬地尔(Sigma,美国),麻醉气体监测仪(Detex- Ohmeda, Louisville, CO),Morris水迷宫及其处理软件(上海吉量软件科技有限公司),避暗实验装置(天津生物医学工程研究中心)。
1.2分组及处理待幼鼠出生后7 d,选取雄性幼鼠156只,给予麻醉或假麻醉处理。行为学检测在大鼠出生后40 d开始进行。出生后7 d的雄性SD大鼠随机分为四组:对照组(Con组)给予腹腔注射10 mg/kg双蒸水后暴露在30%氧气下4 h;艾芬地尔组(Ifen组)给予腹腔注射10 mg/kg艾芬地尔后暴露在30%氧气下4 h;七氟醚组(Sev组)腹腔注射双蒸水后暴露在2%七氟醚4 h;七氟醚+艾芬地尔组(Sev+Ifen组)麻醉前15 min给予艾芬地尔(5 mg/mL, 2 mL/kg)腹腔注射后暴露在2%七氟醚下4 h。在麻醉过程中监测呼吸、心率和体温。麻醉后6 h取材。
1.3海马区NR2B、凋亡相关蛋白的检测 采用Western blotting法。幼鼠腹腔注射100 mg/kg 苯妥英钠后,断头取脑,分离海马组织放于液氮中待用。初步测定总蛋白浓度后,以蛋白30 μg在10%或12% SDS-PAGE胶上电泳分离,之后转印至硝酸纤维素膜上,用5%脱脂奶粉封闭1 h,4 ℃下一抗(NR2B:1/1 000;Caspase-3:1/1 000,PARP:1/1 000;GAPDH:1/5 000)孵育过夜后,在辣根过氧化物酶标记的二抗溶液中孵育2 h(1∶5 000)。最后用 ECL 发光试剂盒(Pierce)显像,用灰度扫描仪检测出相应条带的平均灰度值。其中,GAPDH 作为内参。
1.4海马区Caspase-3表达的检测采用免疫荧光法。幼鼠在实验处理结束后6 h,用4 ℃、4%甲醛灌注后固定过夜,然后在30%蔗糖溶液中放置48 h。用冰冻切片机切片,厚度为15 μm。用Caspase-3(1/400)室温下孵育12 h,磷酸盐缓冲液冲洗后,避光与FICT耦连的羊抗兔二抗(1/200)室温孵育2 h,封片后避光4 ℃保存。一抗和二抗均使用封闭液稀释。使用 IP lab 7.0和Olympus IX70荧光显微镜在40×物镜下观察,每只动物选6张切片,每张切片取海马CA1区4个视野,统计Caspase-3阳性细胞数。
1.5大鼠学习、记忆能力的检测采用Morris水迷宫实验。部分大鼠于出生后第40天行Morris水迷宫实验。迷宫由一个直径为180 cm,高为60 cm的圆水池构成。池中放入一个直径为10.3 cm的平台,池内水深高于平台1.5 cm,水温(24±1)℃。实验过程中水池及周围环境保持不变,供幼鼠空间定位。由摄像系统及水迷宫软件记录幼鼠游泳的时间及路径。实验分三个阶段:训练阶段,定位航行阶段和空间探索阶段,均于上午9:00~11:00 进行。水迷宫实验自大鼠出生后第40天开始,至第47天结束。训练阶段:将出生后第40天的大鼠分别从两个不同象限面向池壁放入水中游90 s,每天训练两次,两次间间隔20 s,持续两天。该阶段不放置平台。定位航行阶段:检测大鼠的空间学习能力。训练阶段结束后,将平台固定于某一象限,大鼠放置于平台上20 s后分别从四个象限面向池壁放入水中。若大鼠不能在给定的时间内(90 s)找到隐匿在水中的平台,则将其牵引至平台停留20 s,潜伏期记为90 s;若大鼠找到平台,则同样停留20 s后进入下一象限。大鼠每天行4次实验,共持续5 d。空间探索阶段:检测大鼠的短期空间记忆能力。取走平台,将大鼠分别从目标象限(原平台所在象限)的对角象限及目标象限的左侧象限放入水池,各游90 s,记录其游泳的路径和时间。
1.6大鼠对恐惧的记忆能力检测 采用避暗实验(IA)。将大鼠放入IA装置的明箱中安静30 s,打开明暗箱之间的门,待大鼠四足全部进入暗箱时将门关闭,给予大鼠一0.3 mA持续2 s的足部刺激。24 h后,将大鼠再次放入明箱,30 s后将门打开,记录大鼠进入暗箱的时间[6]。
2 结果
2.1各组NR2B、Caspase-3、PARP相对表达量及Caspase-3阳性细胞百分比比较见表1。

表1 各组NR2B、Caspase-3、PARP相对表达量及Caspase-3阳性细胞百分比比较
注:与Con组相比,*P<0.05,**P<0.01。
2.2各组学习记忆能力比较在定位航行实验中,Sev组的潜伏期于第2天和第3天长于Con组(表2)。空间探索实验结果显示,各组大鼠找到平台的潜伏期比较差异无统计学意义(P均>0.05)。
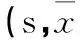
表2 定位航行实验中各组大鼠找到平台的潜伏期比较±s)
注:与Con组相比,*P<0.05。
2.3各组大鼠对恐惧的记忆能力Con、Ifen、Sev、Sev+ Ifen组的24 h记忆潜伏期分别为(40.13±7.88)、(20.08±7.08)、(19.45±6.64)、(35.22±6.48)s,与Con组比较,Ifen、Sev组记忆潜伏期缩短(P均<0.05),Sev+ Ifen组差异无统计学意义。
3 讨论
以往研究认为,NMDA受体在学习和记忆中扮演十分重要的角色,而NR2B则对神经元的可塑性起关键作用[4,7]。本研究结果显示,麻醉药可以导致幼鼠大脑海马区NR2B表达量增加,而其所诱导的凋亡也相应增加,同时伴有学习记忆能力损伤。这可能是由于NR2B不但介导了发育期海马神经元的存活和突触强化的信号,同时也介导了神经元死亡的信号,其表达量过高或过低均可诱导细胞凋亡[8]。过量的NMDA受体的激活可导致大量Ca2+内流,从而造成线粒体膜电位的降低和细胞死亡[9]。因此,NMDA受体的下调可减少这种神经元兴奋毒性。
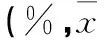
表3 各组目标象限的时间百分比比较±s)
注:Target=目标象限,CW=与目标象限顺时针方向相邻的象限;Opposite=目标象限的对角象限,CCW=与目标象限逆时针方向相邻的象限。
Caspase-3在介导细胞凋亡的过程中起着非常重要的作用。在凋亡的早期阶段,Caspase-3被激活,活化的Caspase-3可裂解相应的胞质胞核底物,最终导致细胞凋亡。PARP是存在于多数真核细胞中的一个多功能蛋白质翻译后修饰酶。它通过识别结构损伤的DNA片段而被激活,被认为是DNA损伤的感受器。同时,PARP又是Caspase的切割底物。它在DNA损伤修复与细胞凋亡中也发挥着重要作用。因此,本研究通过检测这两种蛋白的表达来评估神经元的凋亡。结果显示,单独使用艾芬地尔和七氟醚均可导致Caspase-3、PARP表达量的升高。而预先使用艾芬地尔则可减少七氟醚所致的神经元的凋亡。这与NR2B表达量的变化是一致的。
艾芬地尔作为NR2B受体的选择性拮抗剂,在很多体内体外的神经病理性模型和脑损伤模型中起神经保护作用[10,11]。本研究也发现,预先使用艾芬地尔不仅可减少吸入麻醉药诱导的凋亡,而且还减轻了其所致的学习记忆能力的损伤。但单独给予艾芬地尔时,NR2B及凋亡相关蛋白的表达量是增加的。也有研究表明,训练前预先给予艾芬地尔可以导致幼鼠认知功能的损伤。其实这并不矛盾,在正常情况下,艾芬地尔可以和NR2B受体结合,并使NR2B受体反应性增多,而此时,增多的NR2B受体并没有正常的活性和功能。这样就影响了正常水平的NR2B受体对神经元的促存活作用,最终诱导细胞凋亡。而当大脑受到一定程度的损伤或刺激时,大量的谷氨酸释放到突触间隙,NR2B 受体过度激活,细胞内Ca2+的瞬间变化会触发兴奋性毒性,导致蛋白酶、核酸内切酶的激活,促进一氧化氮和自由基的产生,引起线粒体膜渗透性改变,从而导致神经元损伤乃至死亡[12,13]。作为NR2B受体的拮抗剂,艾芬地尔可以选择性地与NR2B受体相结合,从而减少谷氨酸的兴奋毒性作用,发挥神经保护作用。
[1] Ju LS, Jia M, Sun J, et al. Hypermethylation of hippocampal synaptic plasticity-related genes is involved in neonatal sevoflurane exposure-induced cognitive impairments in rats[J]. Neurotox Res, 2016,29(2):243-255.
[2] Zhang MQ, Ji MH, Zhao QS, et al. Neurobehavioural abnormalities induced by repeated exposure of neonatal rats to sevoflurane can be aggravated by social isolation and enrichment deprivation initiated after exposure to the anaesthetic[J]. Br J Anaesth, 2015,115(5):752-760.
[3] Satomoto M, Satoh Y, Terui K, et al. Neonatal exposure to sevoflurane induces abnormal social behaviors and deficits in fear conditioning in mice[J]. Anesthesiology, 2009,110(3):628-637.
[4] Lipton SA, Nakanishi N. Shakespeare in love--with NMDA receptors[J]. Nat Med, 1999,5(3):270-271.
[5] Martel MA, Wyllie DJ, Hardingham GE. In developing hippocampal neurons, NR2B-containing N-methyl-D-aspartate receptors (NMDARs) can mediate signaling to neuronal survival and synaptic potentiation, as well as neuronal death[J]. Neuroscience, 2009,158(1):334-343.
[6] Ren Y, Zhang FJ, Xue QS, et al. Bilateral inhibition of gamma-aminobutyric acid type A receptor function within the basolateral amygdala blocked propofol-induced amnesia and activity-regulated cytoskeletal protein expression inhibition in the hippocampus[J]. Anesthesiology, 2008,109(5):775-781.
[7] Tang YP, Shimizu E, Dube GR, et al. Genetic enhancement of learning and memory in mice[J]. Nature, 1999,401(6748):63-69.
[8] Dave JR, Williams AJ, Moffett JR, et al. Studies on neuronal apoptosis in primary forebrain cultures: neuroprotective/anti-apoptotic action of NR2B NMDA antagonists[J]. Neurotox Res, 2003,5(4):255-264.
[9] Liu Y, Wong TP, Aarts M, et al. NMDA receptor subunits have differential roles in mediating excitotoxic neuronal death both in vitro and in vivo[J]. J Neurosci, 2007,27(11):2846-2857.
[10] Hrncic D, Rasic-Markovic A, Susic V, et al. Influence of NR2B-selective NMDA antagonist on lindane-induced seizures in rats[J]. Pharmacology, 2009,84(4):234-239.
[11] Xiao F, Pardue S, Arnold T, et al. Effect of ifenprodil, a polyamine site NMDA receptor antagonist, on brain edema formation following asphyxial cardiac arrest in rats[J]. Resuscitation, 2004,61(2):209-219.
[12] Liu Y, Wong TP, Aarts M, et al. NMDA receptor subunits have differential roles in mediating excitotoxic neuronal death both in vitro and in vivo[J]. J Neurosci, 2007,27(11):2846-2857.
[13] Hardingham GE, Bading H. Coupling of extrasynaptic NMDA receptors to a CREB shut-off pathway is developmentally regulated[J]. Biochim Biophys Acta, 2002,1600(1-2):148-153.
赵鑫(E-mail:lujnzx@sohu.com)
10.3969/j.issn.1002-266X.2016.29.009
R749.1
A
1002-266X(2016)29-0028-03
2016-05-06)
