菲律宾蛤仔血细胞抗凝剂的初步筛选
2018-03-10刘静
刘 静
( 青岛农业大学 中心实验室,山东 青岛 266109 )
双壳贝类免疫系统属于非特异性免疫,由细胞免疫和体液免疫两部分组成,血细胞可通过吞噬、包裹、形成结节等作用清除外源入侵物和病原生物,同时血细胞通过分泌一些抗菌肽、溶酶体酶等体液因子进入血淋巴来完成体液免疫[1],所以说双壳贝类的血细胞既是细胞免疫的承担者,也是体液免疫的提供者,在贝类免疫防御体系中占很重要的地位。体外研究血细胞的形态、功能是了解其免疫活性的重要途径,但双壳贝类血细胞离体后往往会出现凝集、甚至破裂,严重影响后续血细胞形态和功能的研究,因此适宜抗凝剂的筛选是研究双壳贝类血细胞免疫学的必要保障。
菲律宾蛤仔(Ruditapesphilippinarum)广泛分布于我国南北沿海,且是较为重要的滩涂贝类,目前关于菲律宾蛤仔血细胞的研究较少,已有文献中各学者在获取菲律宾蛤仔血细胞的描述中未提到使用抗凝剂[2-5],但笔者在试验中发现菲律宾蛤仔血细胞离体后凝集严重,而目前尚无关于菲律宾蛤仔血淋巴抗凝剂的报道。理想的抗凝剂不仅能使血细胞不产生凝集现象, 而且能较好地保持细胞的形态完整和良好的功能[6],笔者选取了10种不同抗凝剂配方,以菲律宾蛤仔血细胞的细胞形态、凝集程度作为衡量抗凝剂抗凝效果的评价指标,初步找出抗凝效果好的抗凝剂,之后进一步研究这些抗凝效果好的抗凝剂对菲律宾蛤仔血细胞存活率、血细胞组成、细胞凋亡率以及超微结构的影响,进而筛选出适合菲律宾蛤仔血细胞的抗凝剂,为今后开展菲律宾蛤仔血细胞的相关研究提供基础数据。
1 材料与方法
1.1 材料
1.1.1 试验动物
菲律宾蛤仔购自青岛城阳水产品批发市场,壳长(3.52±1.97) cm,体质量(8.23±0.197) g。买回的试验蛤仔暂养于塑料水箱中,水温约16 ℃,每日早晚各换新鲜海水1次,暂养3 d后进行试验。
1.1.2 血淋巴抗凝剂的种类
根据现有文献,笔者选取了贝类常用的几种抗凝剂来筛选适合菲律宾蛤仔血细胞的抗凝剂,配方见表1。
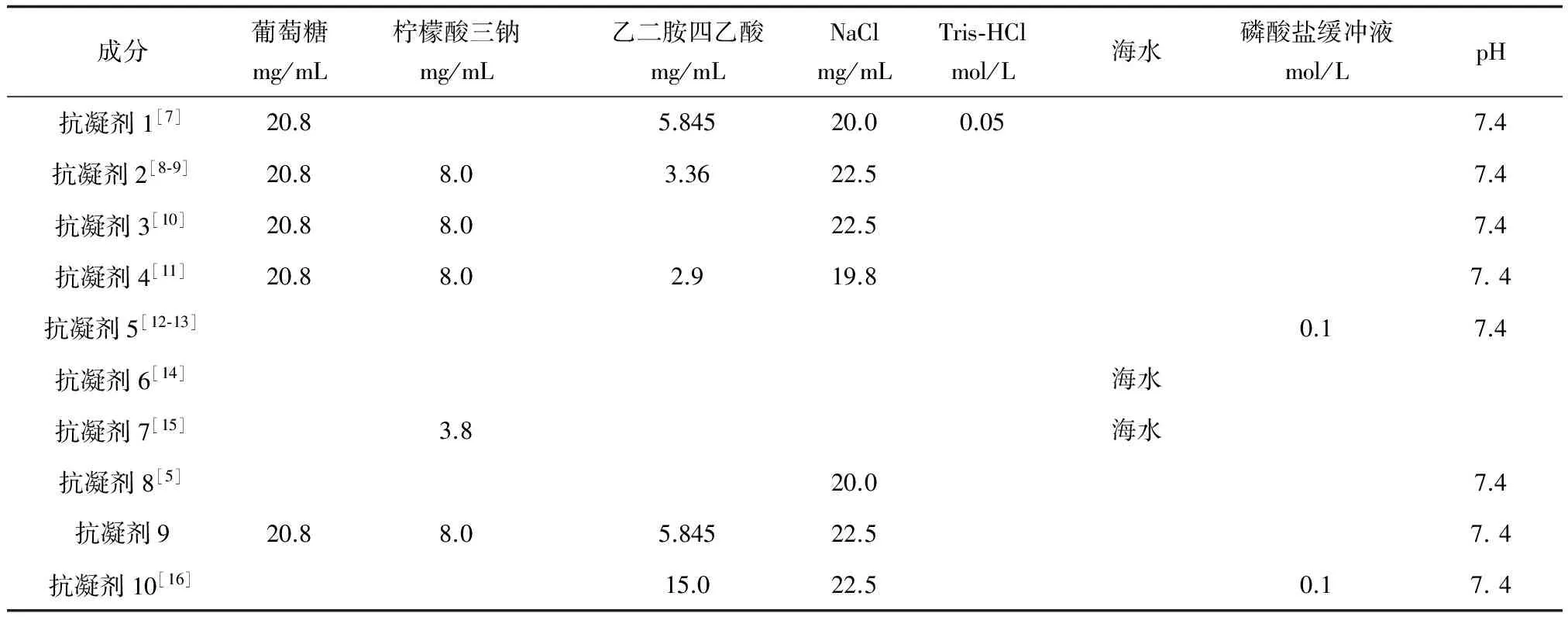
表1 10种不同抗凝剂的配方
注:以上缓冲液均使用超纯水配置, 并用0.22 μm醋酸纤维素膜过滤除菌, 于4 ℃冰箱保存备用, 所有溶液均新鲜配制, 且低温保存.0.1 mol/L磷酸盐缓冲液: NaCl 28 g/L, KH2PO4 0.2 g/L,KCl 0.2 g/L,Na2HPO4·12H2O 2.9 g/L,pH 7.4.
1.2 试验方法
1.2.1 血淋巴的抽取
用无菌海水冲洗菲律宾蛤仔,用1 mL的无菌注射器先吸取0.3 mL上述不同的抗凝剂, 再从菲律宾蛤仔闭壳肌处抽取0.3 mL血淋巴, 混合均匀后, 注入离心管中, 同时以不加抗凝剂的血淋巴为对照组,抽取的血淋巴放在冰上保存备用。
1.2.2 抗凝剂作用下血细胞凝集团个数及凝集细胞数的统计
获取血淋巴后,分别于0、2、6 h在光镜下观察血细胞形态及凝集状况,并随机记录0 h时有血细胞的40个视野中血细胞团数和每团的血细胞数量,每组抗凝剂重复3次试验。
1.2.3 抗凝剂对血细胞存活率的影响
选取抗凝效果较好的抗凝剂,检测血细胞在各抗凝剂中6 h后细胞存活率。参照司徒镇强等[17]的方法,取9滴血细胞悬液,加1滴0.4%台盼蓝染料,混匀,取10 μL血淋巴,滴在载玻片上,盖上盖玻片,在3 min内显微镜下随机记录100个细胞中活细胞和死细胞数(蓝色细胞为死亡细胞,成团的细胞不计死亡率),并根据下列公式求出细胞存活率。
血细胞存活率/%=活细胞数量/(活细胞数量+死细胞数量)×100%
1.2.4 抗凝剂对血细胞组成影响
根据细胞中颗粒的有无,可将菲律宾蛤仔血细胞分为颗粒细胞和透明细胞,在比较不同抗凝剂对血细胞组成影响时,以固定液(4%甲醛,2%NaCl,1%CaCl2)抽取的血细胞为对照组,光学显微镜下(Lecia DM500)随机计数每个样品中100个血细胞,计算出颗粒细胞和透明细胞所占比例。
颗粒细胞占比/%=颗粒细胞数/计数血细胞总数×100%
透明细胞占比/%=透明细胞数/计数血细胞总数×100%
1.2.5 抗凝剂对血细胞凋亡率的影响
采用吖啶橙/溴化乙啶法观察血细胞凋亡,取50 μL细胞悬液,加入6 μL吖啶橙/溴化乙啶(100 μg/mL)荧光染色,混匀后,将细胞悬液滴加到载玻片上,加盖玻片后于荧光显微镜下观察。正常细胞的核质着绿色,荧光深浅不一;凋亡早期血细胞,核内染色质发生不规则凝集、固缩和周边化,可形成绿色致密浓染的颗粒状、团块状或半月状;凋亡后期细胞,染色质块固缩或碎裂形成凋亡小体,呈橘红色;坏死的细胞核染色质正常,被E·B染成橘红色。每个样品随机计数100个细胞。
血细胞凋亡率/%=凋亡细胞数/计数的总血细胞数×100%
1.2.6 透射电镜样品制备[11-12]
用抗凝效果较好的抗凝剂抽取血细胞,6 h后用醛类固定液(2%多聚甲醛-2.5%戊二醛,2%NaCl,2 mmol/L CaCl2,pH 7.4)4 ℃固定过夜,3000 r/min离心10 min,血细胞沉淀用2.5%的琼脂预包埋后,0.1 mol/L二甲胂酸钠缓冲液清洗血细胞,再用1%锇酸后固定血细胞2 h,0.1 mol/L二甲胂酸钠缓冲液清洗血细胞后,进行丙酮梯度脱水,Spi-pon812环氧树脂树脂浸透包埋以及聚合,Leica UC7超薄切片机切片,切片厚70 nm,超薄切片经醋酸铀和柠檬酸铅染液双染色,日立HT7700型透射电镜观察并拍照,加速电压80 kV。
1.2.7 扫描电镜样品制备
用抗凝效果较好的抗凝剂抽取血细胞,6 h时用醛类固定液(2%多聚甲醛-2.5%戊二醛,2% NaCl,2 mmol/L CaCl2,pH 7.4)4 ℃固定过夜,取20 μL血细胞平铺于盖玻片上,之后锇酸固定2 h,0.1 mol/L二甲胂酸钠缓冲液清洗血细胞后,进行丙酮梯度脱水,醋酸异戊酯置换、临界点干燥(EmitechK850)、喷金处理,最后用JEOL 7500F扫描电镜观察并拍照。
1.2.8 数据的处理和分析
所有数据均以3个平行组数据的平均值±标准差表示,并采用单因素方差分析和Duncan检验法统计分析。
2 试验结果
2.1 无抗凝剂条件下菲律宾蛤仔血细胞形态及凝集状况
菲律宾蛤仔血细胞在无抗凝剂条件下伸出的微丝较多(图1a),细胞凝集严重(图1b);细胞贴壁能力强,20 min内细胞快速贴壁,贴壁细胞微丝减少,逐渐形成伪足,细胞变大、成不规则状(图1c)。在无抗凝剂条件下,2 h后细胞均凝集加重,形成30~100 μm的较大凝集团,6 h时细胞凝集越发严重,最大可形成270 μm的细胞团(图1d)。
2.2 不同抗凝剂对菲律宾蛤仔血细胞形态和凝集状况的影响
抗凝剂1对菲律宾蛤仔血细胞具有较强的抗凝效果,血细胞分散较好,伸出的微丝较少(图2a),细胞凝集较轻,团聚的血细胞松散而不紧密(图2b),但血细胞的贴壁能力变差;2 h内凝集程度变化不是很大,但6 h后细胞凝集稍加重,形成少量30~60 μm的细胞凝集团。
抗凝剂2中的血细胞凝集程度亦相对较低,但血细胞伸出的微丝较多(图2c),2 h后即形成30~90 μm不等的细胞团,6 h即形成大至280 μm的细胞团,并且100 μm以上的细胞团占多数。
抗凝剂3对血细胞的抗凝效果稍差,多数细胞凝集成紧密的立体团状 (图2d),抗凝剂4抗凝效果稍好于抗凝剂3,但与抗凝剂3类似,散在血细胞变形大,呈现出长条形、多边形、8字型等不规则形态(图2e)。
抗凝剂5中血细胞伸出的微丝亦较多;抗凝剂6、7中的血细胞凝集成团紧密,散在的细胞能快速贴壁,伸出伪足(图2f),2 h后细胞凝集形成30~200 μm的细胞团,6 h后最大凝集团直径约达340 μm;抗凝剂8中血细胞凝集团较多,最大的细胞凝集团约105 μm,随时间的延长,凝集程度增加,2 h后最大的凝集团的长轴直径约达255 μm。
抗凝剂9和抗凝剂10对菲律宾蛤仔血细胞的抗凝作用较好,6 h内血细胞细胞分散,无凝集。抗凝剂9中的血细胞呈圆形,基本无微丝伸出,抗凝剂10中的血细胞周边有泡状结构伸出。

图1 无抗凝剂条件下菲律宾蛤仔血细胞形态及凝集状况的观察a、b放大倍数为40倍;c放大倍数为100倍;d放大倍数为10倍.
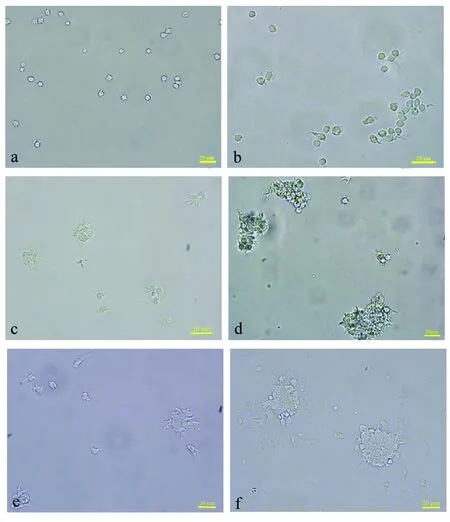
图2 不同抗凝剂对菲律宾蛤仔血细胞形态及凝集程度的影响a~f放大倍数为40倍.
对无抗凝剂组与抗凝剂组中血细胞凝集团个数进行统计,抗凝剂1、抗凝剂2、抗凝剂9及抗凝剂10处理组血细胞成团的数目显著低于无抗凝剂组(P<0.05)(图3);从各抗凝剂组细胞团中凝集细胞个数来看,抗凝剂1、抗凝剂9与抗凝剂10中凝集团中含2~5个细胞的凝集团占90%以上,表现出较好的抗凝效果(表2)。综合凝集团个数、凝集团中血细胞的个数、凝集细胞间的紧密度及细胞形态,笔者选取的10种抗凝剂抗凝效果表现为抗凝剂9>抗凝剂10>抗凝剂1>抗凝剂2>抗凝4>抗凝剂7>抗凝剂3>抗凝剂8>抗凝剂6>抗凝剂5。
2.3 菲律宾蛤仔血细胞在抗凝剂1、抗凝剂9和抗凝剂10中6 h后成活率的研究
台盼蓝排斥法研究了菲律宾蛤仔血细胞在抗凝剂1、抗凝剂9以及抗凝剂10中6 h时的存活率,菲律宾蛤仔血细胞在3种抗凝剂中6 h内存活率均在94.5%以上,并且各组之间无显著性差异(P>0.05)(图4)。
2.4 抗凝剂1、抗凝剂9、抗凝剂10对菲律宾蛤仔血细胞颗粒细胞和透明细胞数量的影响
为比较不同抗凝剂对血细胞组成的影响,选择固定液组为对照组,试验结果见图5,2 h内抗凝剂1、抗凝剂9和抗凝剂10中颗粒细胞与透明细胞占比与对照组均无显著差异(P>0.05);6 h时抗凝剂1中颗粒细胞占比显著增高(P<0.05),而抗凝剂9和抗凝剂10中血细胞的颗粒细胞显著下降(P<0.05),相对应抗凝剂1中透明细胞占比显著降低,抗凝剂9与抗凝剂10中透明细胞占比显著上升(P<0.05)。
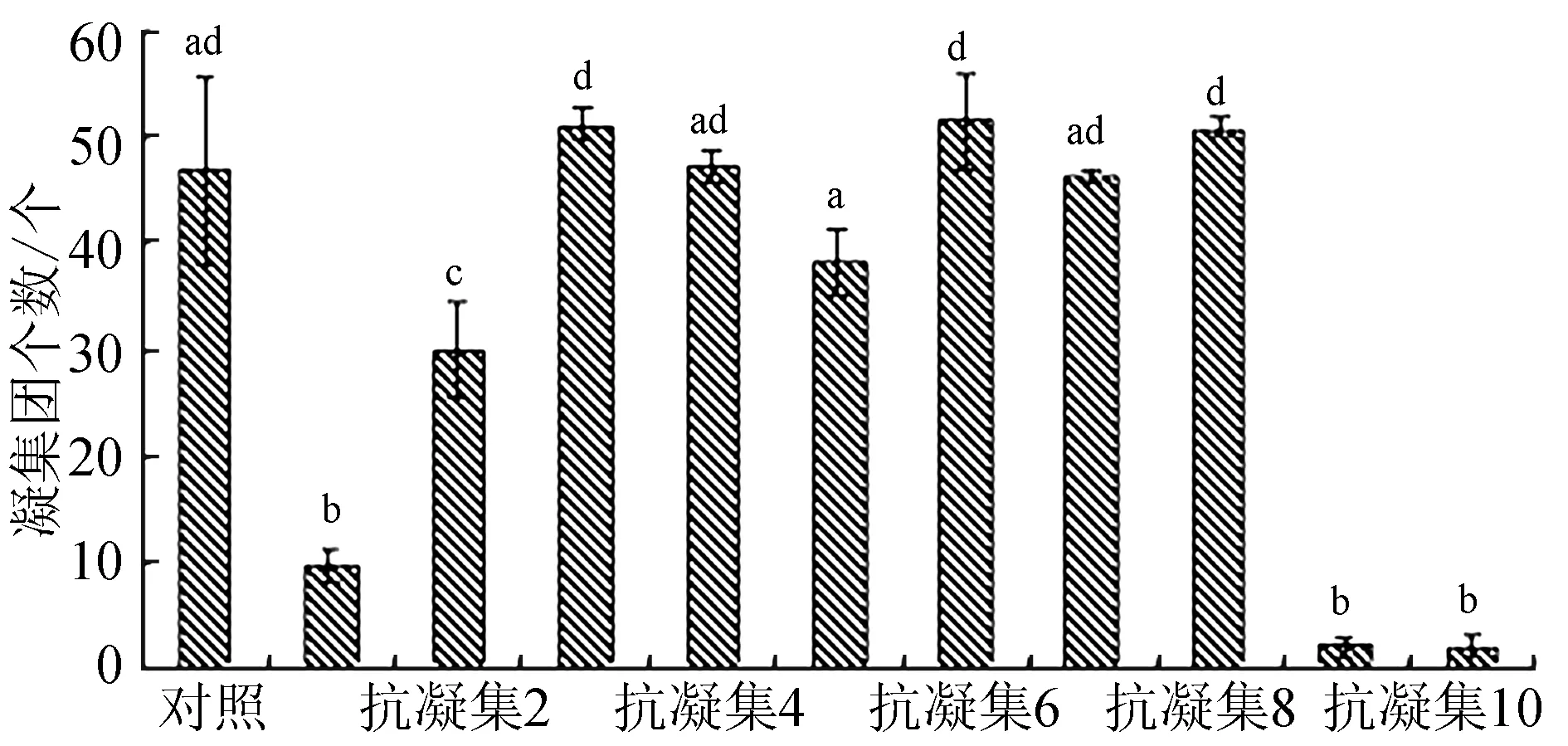
图3 无抗凝剂组和抗凝剂组中血细胞凝集团个数的比较
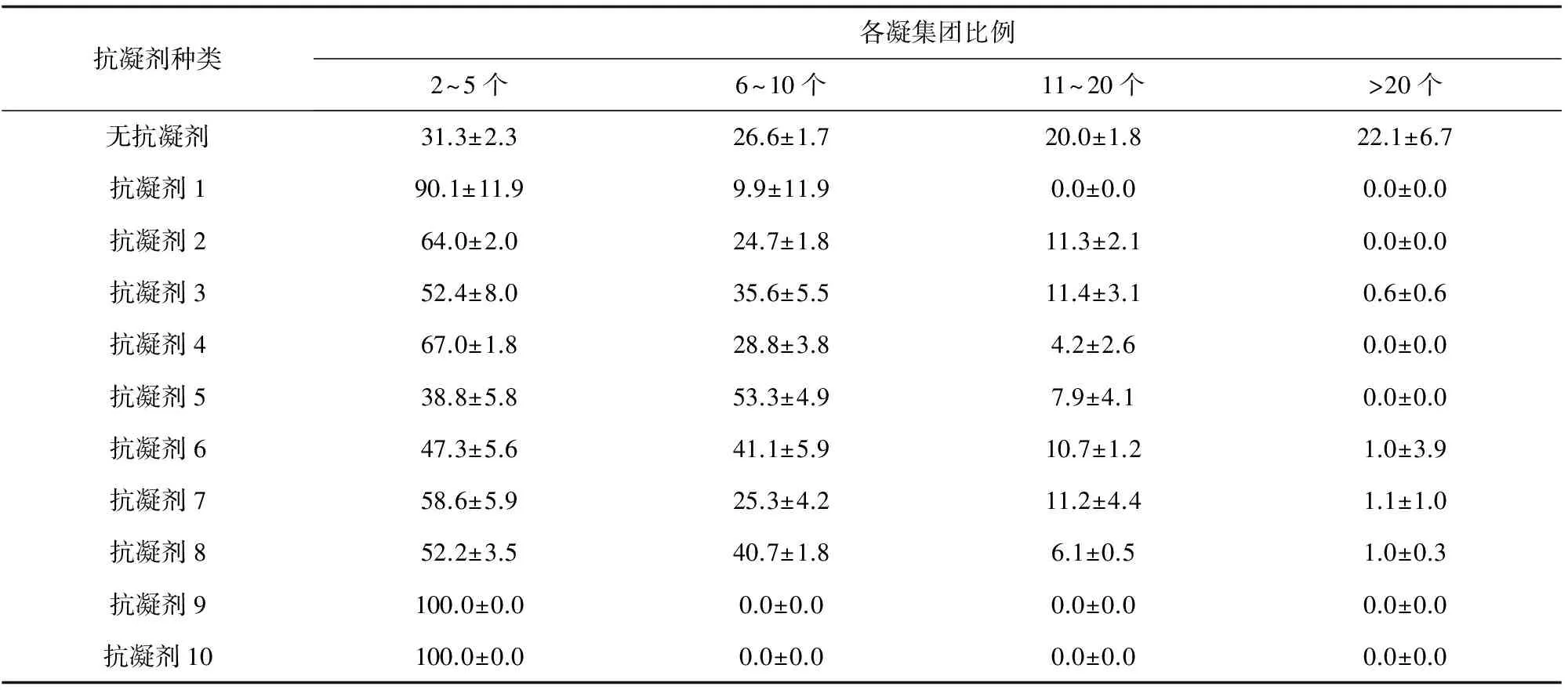

图4 菲律宾蛤仔血细胞在抗凝剂1、抗凝剂9与抗凝剂10中6 h时的存活率
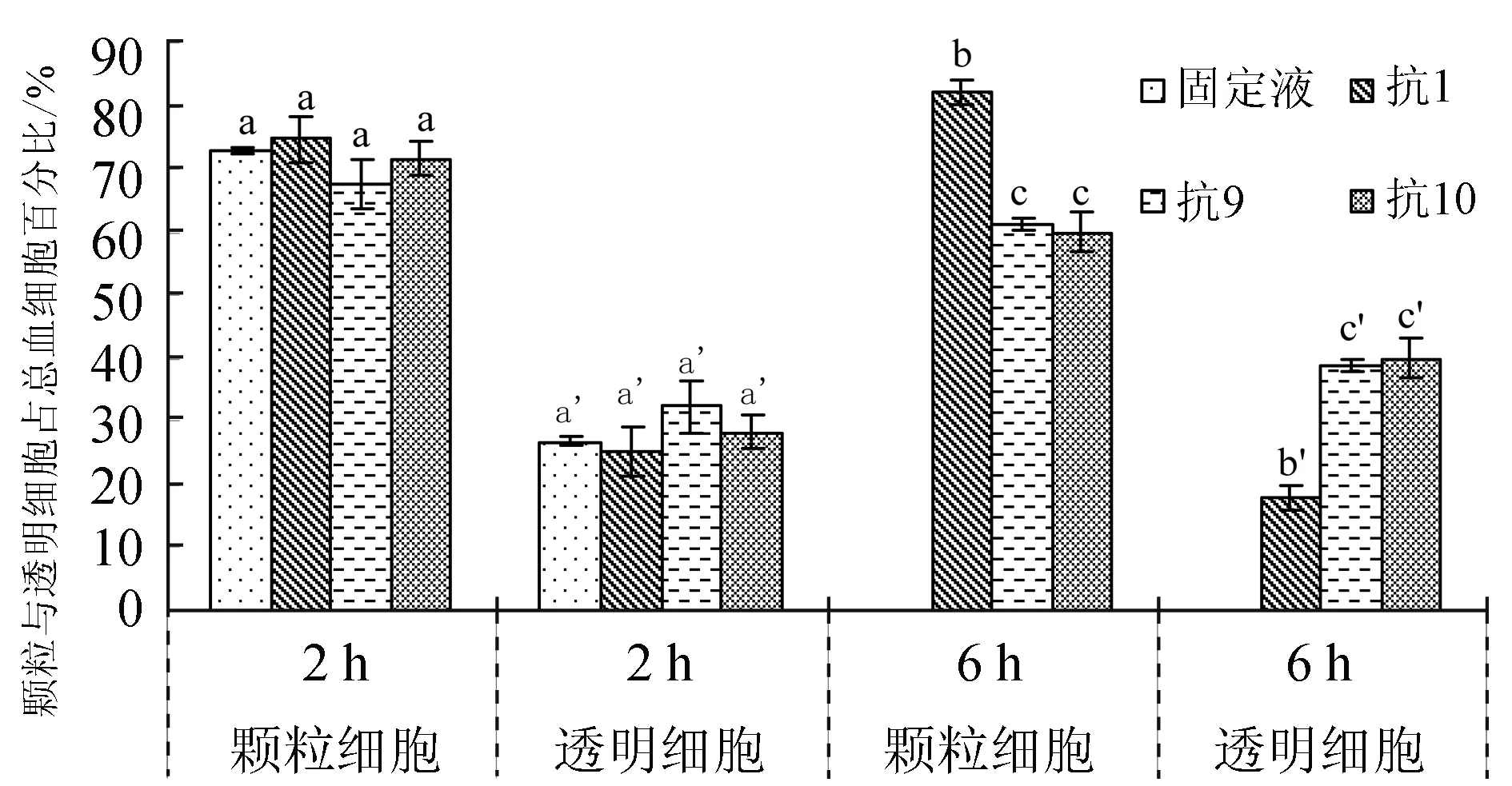
图5 抗凝剂1、抗凝剂9、抗凝剂10对菲律宾蛤仔血细胞颗粒细胞和透明细胞数量的影响
2.5 抗凝剂1、抗凝剂9、抗凝剂10对菲律宾蛤仔血细胞凋亡率的影响
用3种抗凝剂刚抽出的血细胞凋亡率无显著差异(P>0.05);2 h时抗凝剂1、抗凝剂9中血细胞凋亡率无明显变化,而抗凝剂10中的血细胞凋亡率显著上升(P<0.05);6 h时抗凝剂1中血细胞凋亡率无显著变化(P>0.05),而抗凝剂9和抗凝剂10中的凋亡率显著增加(P<0.05),并且抗凝剂10中血细胞凋亡率显著高于抗凝剂9中的凋亡率(P<0.05)(图6)。
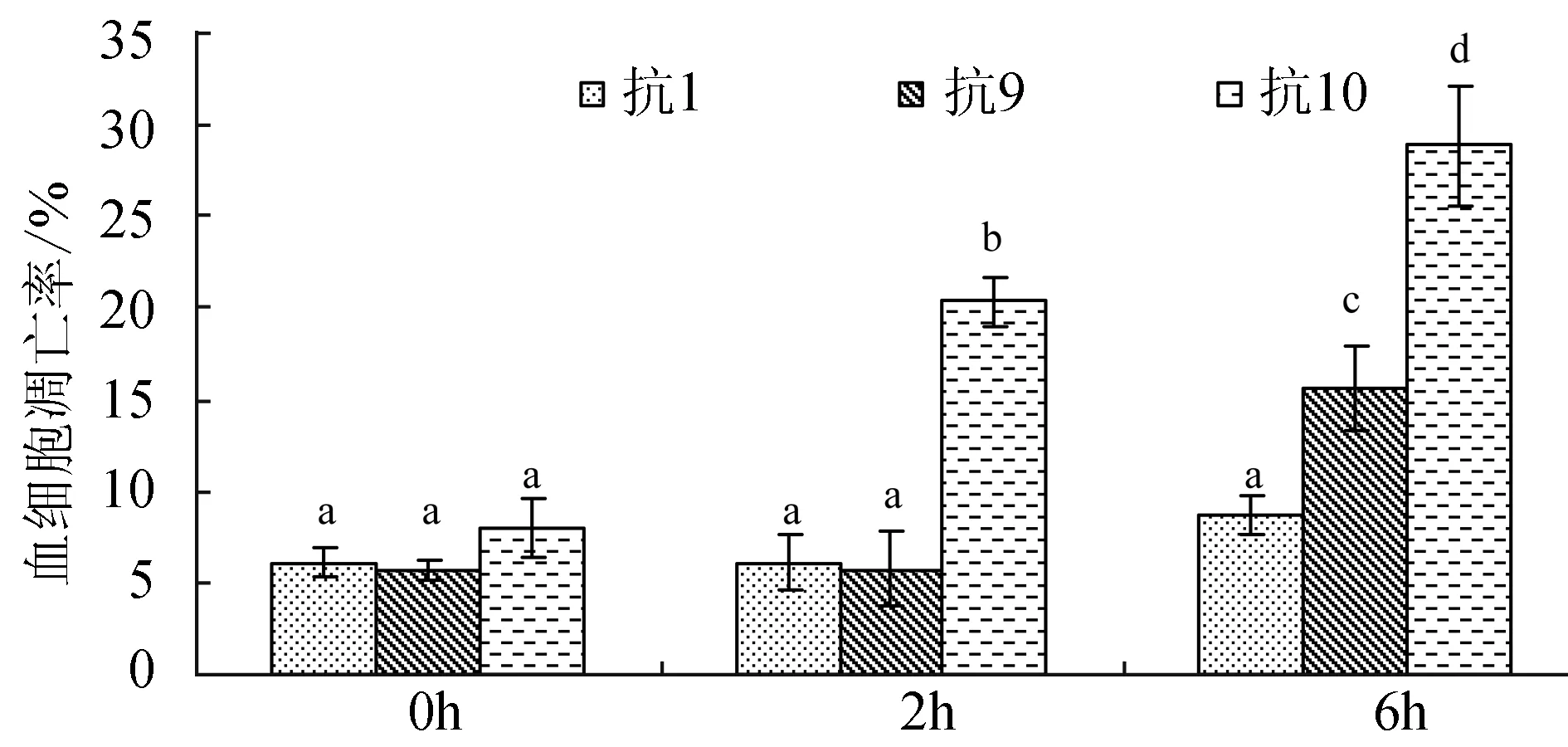
图6 抗凝剂1、抗凝剂9、抗凝剂10对菲律宾蛤仔血细胞凋亡率的影响
2.6 透射电镜和扫描电镜下观察血细胞形态结构
扫描电镜显示无抗凝剂组菲律宾蛤仔血细胞易伸出大量微丝(图7a)和伪足(图7b),而抗凝剂1中的血细胞表面结构完整,伸出的微丝和伪足显著减少(图7c、7d)。透射电镜显示抗凝剂1中的血细胞整体结构完好(图7e),线粒体、高尔基体等细胞器超微结构保存较好(图7f)。
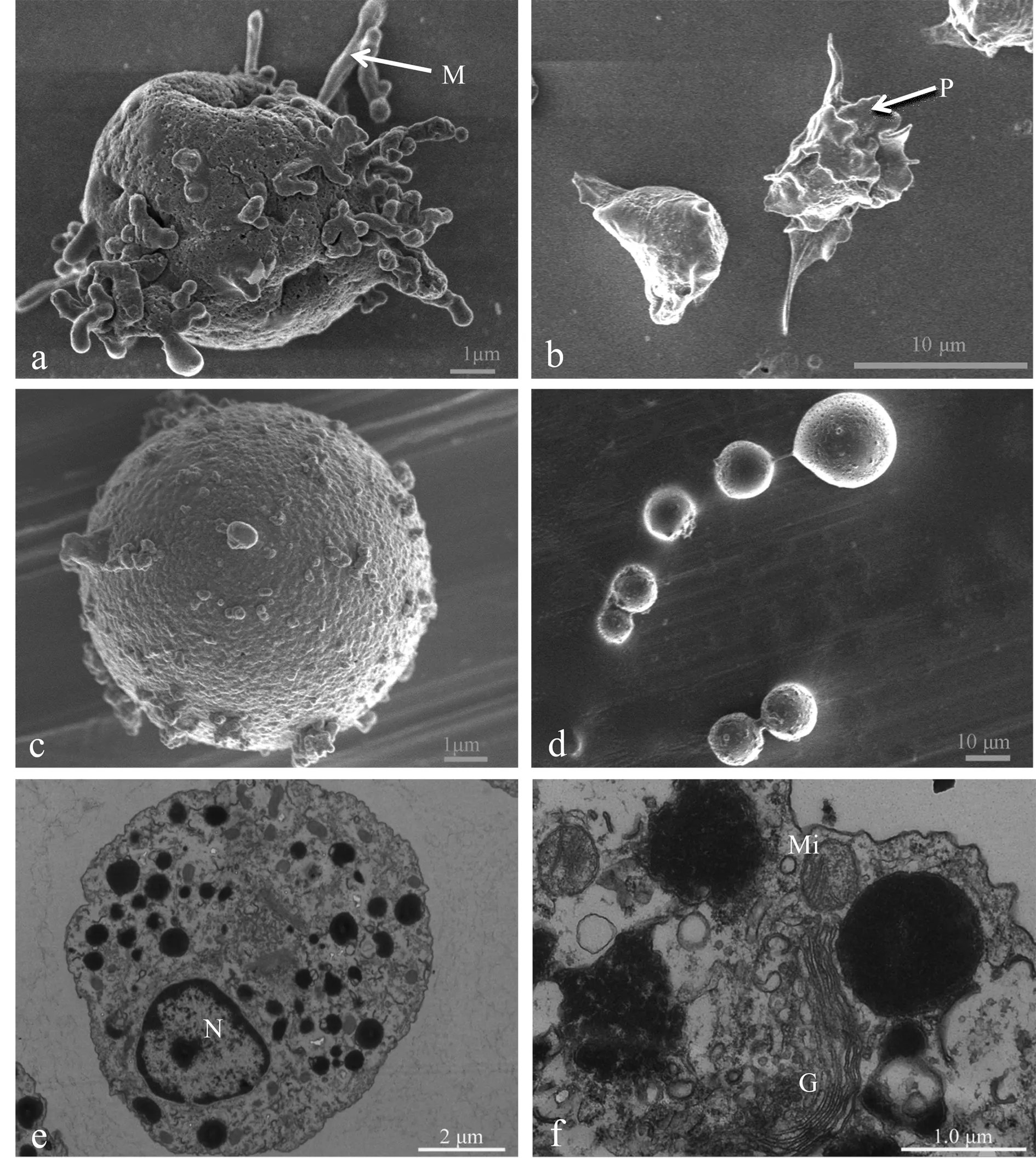
图7 扫描电镜和透射电镜下观察血细胞形态结构a、b:无抗凝剂组血细胞扫描电镜图;M:微丝;P:伪足;c、d:抗凝剂1中的血细胞的扫描电镜图;e、f:抗凝剂1中血细胞透射电镜图;N:细胞核;Mi:线粒体;G:高尔基体.
3 讨 论
无脊椎动物血液中的凝集素是免疫防御的重要体液因子之一,其在血细胞凝集、调理细胞吞噬、宿主与病原相互识别等方面发挥着重大的作用[18]。血细胞的凝集素已在多种贝类血淋巴中提取,其中包括菲律宾蛤仔[19]。由于凝集素的凝集作用,菲律宾蛤仔血细胞在体外易发生凝集反应, 即使是低温状态也会在短时间内形成凝集团,类似的现象在其他贝类中已有报道[20], 故在抽取菲律宾蛤仔血淋巴时要立即加入抗凝剂。本试验选取的抗凝剂1~8以及抗凝剂10是目前有文献报道的用于贝类血细胞的抗凝剂,抗凝剂9是笔者根据其他抗凝剂的抗凝效果调整后的配方。试验结果表明,本试验所选10种抗凝剂对菲律宾蛤仔血细胞均具有一定的抗凝作用,其中抗凝效果较好的为抗凝剂1、抗凝剂9和抗凝剂10,这些抗凝剂在栉孔扇贝(Chlamysfarreri)[7]、文蛤(Meretrixmeretrix)[21]和近江牡蛎(Crassostreaariakensis)[16]血细胞上也表现出理想的抗凝效果。
抗凝剂中柠檬酸盐和乙二胺四乙酸均能与血液中的钙离子结合,前者形成可溶性复合物,后者形成稳定的螯合物,从而阻止血液凝固。比较抗凝剂6和抗凝剂7,抗凝剂7配方是抗凝剂6的基础上加入了0.38%的柠檬酸钠,而抗凝剂7的抗凝效果好于抗凝剂6,说明柠檬酸钠在一定程度上能抑制菲律宾蛤仔血细胞的凝集,但抗凝效果不显著;抗凝剂2中柠檬酸钠质量浓度升至8.0 mg/mL时,抗凝效果显著提高,但达不到完全抗凝的作用,这与张峰[6]发现低质量浓度的柠檬酸钠(3.8~5.4 mg/mL)对仿刺参(Apostichopusjaponicus)体腔细胞的抗凝效果不显著,高质量浓度柠檬酸钠(7.6~11.4 mg/mL)则对体腔细胞的抗凝效果明显的的结果相类似。
比较抗凝剂2、抗凝剂3、抗凝剂4和抗凝剂9,其配方的差异主要在于乙二胺四乙酸含量的不同,其抗凝效果表现为抗凝剂9>抗凝剂2>抗凝剂4>抗凝剂3,说明在柠檬酸钠含量相同的条件下,乙二胺四乙酸含量升高,抗凝效果会提高。有学者发现当乙二胺四乙酸的质量浓度为2.0~3.0 mg/mL时, 会减轻刺参体腔细胞凝集程度, 但细胞形态保持较差, 存活率降低[6],而本试验选取抗凝剂1和抗凝剂9中乙二胺四乙酸的质量浓度达到了5.845 mg/mL,6 h内对菲律宾蛤仔血细胞的形态以及血细胞存活率均无影响,这可能跟物种差异有关。比较抗凝剂1、抗凝剂2与抗凝剂9的配方,抗凝剂1中不含有柠檬酸钠,但乙二胺四乙酸的含量高于抗凝剂2,抗凝剂9是在抗凝剂2的基础上,提高了乙二胺四乙酸的含量达到抗凝剂1的水平,抗凝效果表现为抗凝剂9>抗凝剂1>抗凝剂2,此结果说明乙二胺四乙酸在菲律宾蛤仔血细胞抗凝作用中起着重要的作用,但乙二胺四乙酸含量也不是越高越好,抗凝剂10中乙二胺四乙酸的质量浓度达到了15 mg/mL,虽然6 h内细胞存活率无变化,但是2 h时就导致血细胞凋亡显著升高,6 h时血细胞中颗粒细胞占比严重下降,说明乙二胺四乙酸含量要控制在合适的范围内。
笔者通过比较血细胞在不同抗凝剂中的形态以及凝集程度,发现抗凝剂1、抗凝剂9和抗凝剂10的抗凝效果比其他抗凝剂好,比较这3种抗凝剂中血细胞在6 h内的存活率、细胞组成比例以及凋亡率,结果表明,6 h内3种抗凝剂对血细胞存活率均无显著影响,但抗凝剂9、抗凝剂10在6 h时显著降低了颗粒细胞的数量,并且显著提高了血细胞的凋亡率,而抗凝剂1中血细胞除6 h颗粒细胞占比稍升高外,其余指标6 h内均无明显变化。笔者发现6 h时抗凝剂1中血细胞有轻微凝集现象,并且凝集团中透明细胞较多,故可认为这是导致6 h时抗凝剂1中颗粒细胞占比升高的原因。利用扫描和透射电镜对无抗凝剂组和抗凝剂1中6 h时的血细胞进行表面和内部超微结构观察,结果显示无抗凝剂组的菲律宾蛤仔血细胞表面会放射出大量微丝,继而变形形成伪足,这与孙虎山[22]利用扫面电镜观察栉孔扇贝血细胞的表面结构时得到的结果相类似,而用抗凝剂1抽取的血细胞,细胞圆形,伸出的微丝和伪足显著降低,并且血细胞内部的超微结构保存完好。
综上所述,虽然抗凝剂1不是抗凝效果最好的抗凝剂,但综合抗凝剂中血细胞形态、血细胞组成比例、细胞凋亡率以及血细胞的超微结构等指标,笔者认为在选取的10种抗凝剂中,抗凝剂1是最适合作为菲律宾蛤仔血细胞的抗凝剂。此研究结果为今后利用菲律宾蛤仔血细胞开展免疫学、毒理学等研究提供基本的技术支持和理论依据。
[1] Fisher W S, Oliver L M, Winstead J T, et al. A survey of oystersCrassostreavirginicafrom Tampa Bay, Florida: associations of internal defense measurements with contaminant burdens[J]. Aquatic Toxicology, 2000,51(1):115-138.
[2] Ford S E, Paillard C. Repeated sampling of individual bivalve mollusks I: intraindividual variability and consequences for haemolymph constituents of the Manila clam,Ruditapesphilippinarum[J]. Fish and Shellfish Immunology, 2007, 23(2):280-291.
[3] Jeffroy F, Paillard C. Involvement of nitric oxide in the in vitro interaction between Manila clam,Ruditapesphilippinarum, hemocytes and the bacteriumVibriotapetis[J]. Fish and Shellfish Immunology, 2011, 31(6):1137-1141.
[4] 王文琪,徐申波,张玉娜,等. 菲律宾蛤仔(Ruditapesphilippinarum)血细胞分类及其功能初探[J]. 莱阳农学院学报:自然科学版, 2006, 23(3):165-169.
[5] 刘东武,王宜艳,孙虎山. 菲律宾蛤仔、中国蛤蜊、文蛤和紫石房蛤血细胞的分类研究[J]. 水产科学, 2005, 24(10):5-7.
[6] 张峰,宋志东,刘洪伟,等. 4种抗凝剂对刺参体腔细胞的抗凝效果[J]. 大连水产学院学报, 2006, 21(1):87-89.
[7] Chen M Y,Yang H S, Delaporte M, et al. Immune condition ofChlamysfarreriin response to acute temperature challenge[J]. Aquaculture, 2007, 271(1/4)479-487.
[8] Xue Q G, Renault T, Chilmonczyk S. Flow cytometric assessment of haemocyte sub-populations in the European flat oyster,Ostreaedulis, haemolymph[J]. Fish and Shellfish Immunology, 2001, 11(7):557-567.
[9] 娄绘芳,朱泽闻,徐立蒲,等. 泥蚶血细胞的形态结构特征及部分免疫功能[J]. 水产学报, 2011, 35(10):1494-1504.
[10] Xie Y H, Hu B C, Wen C G, et al. Morphology and phagocytic ability of hemocytes fromCristariaplicata[J]. Aquaculture, 2011, 310(3/4):245-251.
[11] 杨淞,赵柳兰,张爽,等. 不同壳色福寿螺血细胞的比较研究[J]. 四川动物, 2013, 32(5):722-728.
[12] Cheng W, Hsiao I S, Chen J C. Effect of ammonia on the immune response of Taiwan abaloneHaliotisdiversicolorsupertextaand its susceptibility toVibrioparahaemolyticus[J]. Fish and Shellfish Immunology, 2004, 17(3):193-202.
[13] 李俊辉,刘亮明,杜晓东,等. 文蛤Meretrixmeretrix血细胞形态与分类[J]. 广东海洋大学学报, 2009, 29(4):75-78.
[14] 张峰,李光友. 几种重金属对皱纹盘鲍血细胞活性氧产生的影响[J]. 海洋环境科学, 2005, 24(1):32-34.
[15] Marisa I, Marin M G, Caicci F, et al. In vitro exposure of haemocytes of the clamRuditapesphilippinarumto titanium dioxide (TiO2) nanoparticles: nanoparticle characterisation, effects on phagocytic activity and internalisation of nanoparticles into haemocytes[J]. Marine Environmental Research, 2015(103):11-17.
[16] Donaghy L, Kim B K, Hong H K, et al. Flow cytometry studies on the populations and immune parameters of the hemocytes of the Suminoe oyster,Crassostreaariakensis[J]. Fish and Shellfish Immunology, 2009, 27(2):296-301.
[17] 司徒镇强,吴军正. 细胞培养[M]. 西安: 世界图书出版社,1996:40-182.
[18] 张朝霞,王军, 丁少雄, 等. 贝类免疫学研究新进展[J]. 厦门大学学报: 自然科学版, 2006,45(增刊2):90-96.
[19] 张鹭,陈寅山, 许友勤. 福建11种软体动物凝集素的凝集性能[J]. 福建师范大学学报:自然科学版, 2002, 18(3):69-73.
[20] 李进寿,陈军,唐艳霞,等. 利用流式细胞仪技术研究杂色鲍血细胞的吞噬率[J]. 台湾海峡, 2010, 29(4):460-466.
[21] 王清,杨红生,王晓宇. 镉和苯并芘胁迫对文蛤血细胞功能的影响[J]. 海洋科学, 2010, 34(9):82-86.
[22] 孙虎山. 栉孔扇贝血细胞的吞噬作用及扫描电镜研究[J]. 高技术通讯, 2001, 11(4):16-19.
